表现为家族性偏头痛的CADASIL家系的影像学特点☆
程虹金庆文牛琦沈飞飞姚娟丁新生
表现为家族性偏头痛的CADASIL家系的影像学特点☆
程虹*金庆文*牛琦*沈飞飞*姚娟*丁新生*
目的探讨伴皮层下梗死和白质脑病的常染色体显性遗传性脑病(CADASIL)家系的核磁共振(MRI)特点,提高对本病脑内MRI表现的认识。方法记录该CADASIL家系先证者及其亲属的临床表现及影像学检查,并行NOTCH3基因检测。结果本组6例中5例检出NOTCH3基因第14外显子C2182T突变,其中3例与MRI初诊结果一致。头颅核磁共振显示双侧额叶皮层下与侧脑室旁白质内广泛融合的病灶,基本对称性分布的稍长T1T2信号,T2FLAIR呈高信号者4例;外囊T2WI呈高信号3例;基底节区、丘脑腔隙性梗死4例;脑干T2WI呈高信号2例;脑内微出血3例;未见双侧颞极白质病灶(O’Sullivin征)。结论 CADASIL病例MRI存在特征性的病变,MRI对该病的诊断有重要作用。
CADASIL基因诊断 突变磁共振成像
伴皮层下梗死和白质脑病的常染色体显性遗传性脑病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL)是一种非淀粉样变性、非动脉硬化性的常染色体显性遗传的脑小动脉病[1],主要由人类染色体19p13的NOTCH3基因突变所致,主要的临床特征包括有先兆的偏头痛、脑卒中、情感障碍和认知功能减退[2-3],头颅磁共振成像(magnetic resonance imaging,MRI)对诊断CADASIL有较高的敏感性[4-6]。已发现NOTCH3基因突变包括内含子和外显子突变[2],其中外显子突变,尤其是第3、4、5、6、11、18和19外显子突变最为常见[7]。本研究报道新发现的第14外显子C2182T突变的CADASIL家系1例,探讨该家系的磁共振成像特征,为临床诊断提供参考依据。
1 对象与方法
1.1研究对象 收集我院2013年6月收治住院的1例拟诊CADASIL患者及其5例直系家系成员的临床资料和MRI图像。其中男2例,女4例;年龄41~67岁,平均(55.5±9.9)岁;除4例有高血压病史外,无其他脑血管危险因素。6例全部进行神经内科专科体检、神经心理学量表测评、头颅MRI和NOTCH3基因检测,1例进行皮肤组织活检。家系图见图1。

图1 CADASIL家系图 ↗为先证者,■为临床患者,□正常,/已死亡
1.2方法
1.2.1基因检测采集先证者及亲属静脉血各3 mL,EDTA抗凝-20℃保存。对NOTCH3基因2-33所有外显子突变热点区进行筛查。采用目的条带聚合酶链反应(polymerase chain reaction,PCR)结合基因测序法定位突变位点。标准法从外周血白细胞中抽提DNA,应用PCR方法扩增受试者NOTCH3基因第2-33外显子序列,Qiagen PCR purification kit纯化DNA后,使用Applied Biosystems的BigDye Terminator循环测序包,由ABI 3100自动测序仪完成测序。以上实验在江苏省人民医院生殖遗传检测中心完成。
1.2.2头颅MRI采用Siemens Trio 3.0 T超导型MRI扫描仪,8通道头部相控阵线圈,上述观察对象行头颅MRI检查。检查序列:横轴位T1WI;TR 250 ms,TE 2.46 ms,矩阵256×256,层厚5 mm,层间距1 mm,层数20;横轴位T2WI,TR 6000 ms,TE93 ms,矩阵256×256,层厚5 mm,层间距1 mm,层20;液体衰减反转恢复(fluid attenuated inversion recovery,Flair)T2WI序列:TR 8000 ms,TE 97 ms,TI 2370 ms,层厚、层间距及层数同前,视野22 cm×22 cm,矩阵275×226,激励次数1;扩散加权成像(DWI);SE-EPI序列,轴位扫描,TR 3000 ms,TE最小值,b值取1000 mm2/s,层数20(均复制常规MRI的扫描线,使扫描层面与前相同);采用常规三维时间飞跃法MRA序列进行颅脑血管成像,TR 24 ms,TF 4.5 ms,激励次数1。图像分析由2名主治医师以上诊断医师对MRI颅内病变分布和信号特点进行分析。
1.2.3家系相关临床资料 该家系有遗传性脑梗死和偏头痛家族史,本研究调查的3代家族成员中有6例患脑梗死,10例有偏头痛发作,但未发现明显痴呆症状者;此次受检的6例受试者中,5例均自年轻时(20岁左右)出现剧烈的不伴有视觉先兆的偏头痛发作,疼痛剧烈均需服用止痛片方能缓解。认知功能障碍的检测主要依据简易智能状态检测量表(mini-mental state examination,MMSE)和画钟试验(clock drawing test,CDT),抑郁焦虑状态的评估依据汉密尔顿抑郁量表(HAMD)和焦虑量表(HAMA)。
2 结果
2.1临床资料先证者男性,67岁,汉族,江苏人。因“头痛40余年,反复头晕发作2年,进行性加重半年”于2013年6月来我院就诊。患者自20岁起频繁出现偏头痛发作,近2年来反复有头晕发作,伴站立不稳和双下肢乏力,半年来症状进行性加重,并逐渐有口齿不清和行走不稳,2013年6月来我院住院治疗。头颅CT示颅内多发缺血梗死灶;住院期间发现有失眠、情绪低落、兴趣减退、不愿与外界交流等情感障碍表现。有高血压病史15年,无糖尿病、高脂血症等病史。入院查体:神志清,精神萎,双侧眼球活动自如,右侧鼻唇沟稍浅,伸舌尚居中,双侧咽反射迟钝,颈软,四肢肌力肌张力正常,双侧Babinski征(±),直线行走不稳,昂白试验(+);认知功能评估:MMSE评分28/30,CDT正常,HAMA 30,HAMD 25,表明先证者无痴呆的临床表现,但有明显的抑郁和焦虑症状。5例亲属中,4例有偏头痛发作,3例有情感障碍表现,3例有头昏或肢体无力等脑梗死表现,1例无脑梗死的临床表现,仅有偏头痛发作,上述5名亲属均没有痴呆相应的临床表现。
2.2基因检测及皮肤组织活检结果本组共有5例(先证者1例及4例亲属)检出NOTCH3基因第14外显子C2182T突变,仅一妹妹未见上述改变(见图2)。先证者皮肤组织活检证实嗜锇颗粒物质(ganular osmiophilic material,GOM)存在(见图3)。

图2CADASIL家系NOTCH3基因检测结果 上图为CADASIL患者14外显子发生C>T突变;下图为正常对照者(先证者无症状的妹妹,Ⅱ10)在相同检测位点未见该突变

图3 皮肤活检电镜检查结果 病理检查结果:电镜显示真皮小血管基底膜明显增厚,大量胶原纤维沉积,并可见嗜锇颗粒物质(GOM)存在
2.3头颅核磁共振(MRI)检查本组中4例可见双侧额叶皮质下与侧脑室旁白质内大致对称分布的病灶,呈稍长T1长T2信号,T2FLAIR表现为高信号。MRA检查颅内大动脉未见明显异常。本组有3例MRI表现为外囊T2WI高信号、皮层下腔隙性梗死灶(subcortical lacunar lesions,SLLs)、丘脑高信号,2例见脑干T2WI高信号。3例磁敏感成像(SWI)可见颅内多发低信号影,主要位于皮质下白质、深部白质、基底节和丘脑,脑干偶有发现,表现为圆点状低信号,考虑为微出血病灶(microbleeds,MBs),6例中均未见到典型的双侧颞极白质病灶(O’Sullivin征)。本组中3例MRI初诊为CADASIL(见图4)。
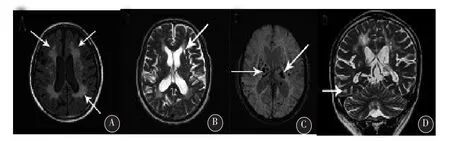
图4 CADASIL的影像学特点先证者MR表现:双侧脑室旁白质内基本对称性分布、稍长T1T2信号,T2FLAIR呈高信号(A图);外囊T2WI呈高信号(B图);SWI见基底节、丘脑及颞叶多发微出血灶(C图);皮层下腔隙性病灶(SLLs)(D图)
2.4诊断根据上述相关临床资料和相关检查结果,本家系的患者符合CADASIL的诊断标准[8]。除基因检测证实NOTCH3突变外,先证者的皮肤活检电镜检查同样支持CADASIL的诊断。虽未出现明显的智能障碍,但先证者及其亲属的其他临床表现:偏头痛发作、情感障碍及卒中样发作均与CADASIL一致,也与国外相同位点(C2182T)突变的个案报道一致[9]。该家系中未发现智能障碍及痴呆患者,可能与该家系脑血管疾病发病较晚,病情较轻有关。

表1 5例CADASIL的MRI特点
3 讨论
3.1CADASIL的临床表现及流行病学特征CADASIL是一种基因突变所致的遗传性全身小动脉病,其主要发病机制为与NOTCH3基因突变引发的血管平滑肌发生退变。与已往报道[7]的NOTCH3突变热点不同,本例报道的突变为第14外显子C2182T突变,为中国CADASIL家系首次发现。
国外的家系(法国)研究表明[1,10],CADASIL平均发病年龄为45岁,无明显性别差异;病程10~30年,平均死亡年龄65岁。其自然病程分以下3个阶段[5]:①20~40岁,频发偏头痛发作和明确的影像学病灶;②40~60岁,卒中样发作、有明确的神经功能障碍以及基底节多发梗死灶、大脑半球白质片状病灶;③60岁以后,近半数出现皮层下痴呆及假性延髓麻痹。本家系调查的6例家族成员中,5例(5/6)出现偏头痛发作,4例(4/6)出现情感障碍和脑梗死表现,临床表现符合疾病演变的趋势。
3.2CADASIL的MRI表现MRI是诊断CADASIL的重要手段[4-5],尤其在无法进行基因检测的基层医院是拟诊该病最重要的方法。即使是无明显临床症状的患者,也可以出现MR特征性的改变。CADASIL的MRI表现主要包括脑白质病变、皮层下和脑深部灰质及脑干多发腔隙性脑梗死和脑萎缩。典型的病变大致对称分布于双侧脑室周围白质、颞极、基底节、丘脑、外囊和脑干等部位[4-5]。
3.2.1脑白质CADASIL的脑白质病变主要分布于皮层下及侧脑室旁白质、半卵圆区、外囊和胼胝体,表现为基本对称的、稍长T1、长T2高信号,其严重程度随年龄增大而加重,可逐渐融合成片状病灶。晚期随病变范围扩大,累计包括弓状纤维在内的整个白质区域以及脑干[11]。既往报道的CADASIL患者外囊(93%)和颞叶前部(89%)白质常较早受累,特别是典型的颞极白质受累(O’Sullivin征)因有较高敏感性(89%)和特异性(86%),具有较高的临床诊断价值[12];皮层下腔隙性病灶(SLLs)也是本病表现之一,早期常见于颞极,也可见于颞叶后部及额叶深部。本家系5例患者中3例可见外囊受累,3例可见SLLs征,但未能观察到典型的颞极O’Sullivin征,这可能是本例C2182T突变不同于其他突变的影像学特征。
3.2.2脑灰质CADASIL的脑深部灰质病灶以腔隙性脑梗死为主,陈旧性病灶表现为长T1T2信号的软化灶,T2FLAIR呈低信号。临床新发病灶则呈DWI高信号。本家系4例可见基底节及丘脑陈旧性腔梗病灶,临床表现为头晕、行走不稳、言语不清和肢体麻木等症状。
3.2.3脑干CADASIL的幕下病变主要见于脑桥(100%)、中脑(69%)和延髓(35%),小脑一般不受累[13],但本组仅2例脑干见可疑异常信号。
3.2.4微出血(MBs)CADASIL患者常伴有脑内微出血,文献报道其发生率为(31%~69%)[14],远高于正常老年人群(6.4%)的比率,主要位于皮质下白质、丘脑和脑干,其出现的原因可能与CADASIL本身病变、年龄、高血压及抗血小板聚集药物的使用有关[15-16]。,此外本家系观察的6例携带致病基因突变的家族成员中,3例可见MBs,先证者在基底节和丘脑等部位可见数十个大小不一的MBs病灶,其密集程度之高均远超既往的研究报道[6],密集出现的MBs可能是本型突变区别于其他位点突变的影像学特征。
有文献[17]认为,MBs与情感障碍密切相关,如抑郁性情感障碍的患者在丘脑和/或皮层下会有一定数量的MBs。虽然目前对情感障碍的确切机制仍不了解,但推测可能与额叶-皮层下环路受损有关[17]。以上研究与我们的观察相一致,有明显的抑郁焦虑等情感障碍者(如先证者),其MR显示在丘脑和皮层下深部有大量的MBs;反之亦然。大多数CADASIL患者MBs位于基底节、丘脑和脑干,与高血压性脑出血的位置基本一致,较多数目的MBs可能会增加颅内出血的风险[10],因而抗血小板聚集药物的使用应非常谨慎。
与既往报道的CADASIL家系不同,本例由第14外显子突变引发的CADASIL影像学表现有一定的特点:颅内MRI表现除传统的外囊受累外,MBs征阳性率高,数目较密集,对本病有较强的提示作用,典型的颞极O’Sullivin征反而不常见。提示CADASIL的影像学表现也有一定的异质性。中青年起病的脑血管病患者,尤其是有阳性家族史、无明显脑血管病危险因素者,头颅MRI有相关征象时应考虑本病的可能。随着技术的发展和生活水平的提高,MRI有望成为CADASIL初诊筛查的重要方法和手段。
[1]Chabriat H,Joutel A,Dichgans M,et al.CADASIL[J].Lancet Neurol,2009,8(7):643-653.
[2]Bianchi S,Dotti MT,Gallus GN,et al.First deep intronic mutation in the NOTCH3 gene in a family with late-onset CADASIL[J].Neurobiol Aging,2013,34(9):2234.
[3]Bianchi S,Rufa A,Ragno M,et al.High frequency of exon 10 mutations in the NOTCH3 gene in Italian CADASIL families: phenotypic peculiarities[J].J Neurol,2010,257(6):1039-1042.
[4]Kanekar S,Poot JD.Neuroimaging of vascular dementia[J].Radiol Clin North Am,2014,52(2):383-401.
[5]金得辛,陈秀芸,张旭.伴皮层下梗死和白质脑病的常染色体显性遗传性脑动脉病家系研究[J].中华内科杂志,2004,43(12):924-927.
[6]刘明霞,刘梦雨,娄昕,等.常染色体显性遗传性脑动脉病伴皮层下梗死和白质脑病的MR特征[J].中国医学影像学杂志,2014,22(4):305-309.
[7]Wang Z,Yuan Y,Zhang W,et al.NOTCH3 mutations and clinical features in 33 mainland Chinese families with CADASIL[J]. J Neurol Neurosurg Psychiatry,2011,82(5):534-539.
[8]袁云.CADASIL的诊断与鉴别诊断[J].中国神经精神疾病杂志,2007,33(1):641-643.
[9]Rinnoci V,Nannucci S,Valenti R,et al.Cerebral hemorrhages in CADASIL:report of four cases and a brief review[J].J Neurol Sci,2013,330(1-2):45-51.
[10]Chabriat H,Joutel A,Vahedi K,et al.CADASIL(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy):clinical features and neuroimaging[J].Bull Acad Natl Med,2000,184(7):1523-1531
[11]Van Den Boom R,Lesnik Oberstein SA,van Duinen SG,et al. Subcortical lacunar lesions:an MR imaging finding in patients with cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy[J].Radiology,2002,224(3): 791-796.
[12]O'Sullivan M,Jarosz JM,Martin RJ,et al.MRI hyperintensities of the temporal lobe and external capsule in patients with CADASIL[J].Neurology,2001,56(5):628-634.
[13]Chabriat H,Mrissa R,Levy C,et al.Brain stem MRI signal abnormalities in CADASIL[J].Stroke,1999,30(3):457-459.
[14]Dichgans M,Holtmannspötter M,Herzog J,et al.Cerebral microbleeds in CADASIL:a gradient-echo magnetic resonance imaging and autopsy study[J].Stroke,2002,33(1):67-71.
[15]王本国,林棉,杨楠,等.不同脑血管病患者脑微出血的患病率及其危险因素分析[J].中国神经精神疾病杂志,2011,37(5):303-306.
[16]Choi JC,Kang SY,Kang JH,et al.Intracerebral hemorrhages in CADASIL[J].Neurology,2006,67(11):2042-2044.
[17]Noh SM,Chung SJ,Kim KK,et al.Emotional disturbance in CADASIL:its impact on quality of life and caregiver burden[J]. Cerebrovasc Dis,2014,37(3):188-194.
Neuroimaging study of CADASIL pedigree with performance of familial migraine.
CHENG Hong,JIN Qin-gwen,NIU Qi,SHEN Feifei,YAO Juan,Ding Xinsheng.Department of Neurology,the First Affiliated Hospital of Nanjing Medical University,No.300,Guangzhou Street,Nanjing 210029,Jiangsu Province,China.Tel:025-68136681.
Objective To analysis the MRI features of cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy(CADASIL),to improve the understanding of MRI manifestations of this disease.Methods The clinical manifestations,neuroimaging analysis and genetic analysis were performed in the CADASIL pedigree proband and his families.Results Five of six cases were confirmed with C2182T mutation on exon 14 of the NOTCH3,of which three cases were diagnosed by MRI.Brain MRI findings included bilateral symmetric distributed confluent lesions in the subcortical and periventricular white matter in the frontal lobe,hypointensity on T1WI and hyperintensity on both T2WI and T2FLAIR imaging in four cases.The external capsule was involved in three cases,with hyperintensity on T2WI. Subcortical lacunar lesions(SLLs)were shown in three cases.Lacunar infarction in the basal ganglia and thalamus were presented in four cases.T2WI hyperintensity at the brain stem was found in two cases.Cerebral microbleeds were revealed in three cases.There was no O’Sullivan sign in all the six cases.Conclusions There is characteristic change of MRI in CADASIL patients,which may play a very important role in screening these cases.
Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy(CADASIL)Genetic diagnosis Mutation Magnetic resonance imaging
R743
A
2015-01-15)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2015.09.006
☆南京市科技计划项目资助(编号:201201083)
*南京医科大学第一附属医院神经内科(南京210029)

