茜草精油抗氧化及DNA损伤保护效果
权美平,田呈瑞
(1.陕西师范大学生命科学学院,陕西西安710119;2.陕西省多河流重点实验室,陕西渭南714000;3.渭南师范学院化学与生命科学学院,陕西渭南714000)
茜草精油抗氧化及DNA损伤保护效果
权美平1,2,3,田呈瑞*1
(1.陕西师范大学生命科学学院,陕西西安710119;2.陕西省多河流重点实验室,陕西渭南714000;3.渭南师范学院化学与生命科学学院,陕西渭南714000)
以水蒸气蒸馏法提取茜草精油,以天然和合成的抗氧化剂为对照,用5种不同的抗氧化体系(DPPH、·OH和O2-·自由基,还原力和总抗氧化能力)检测评价茜草精油的抗氧化活性;并以·OH自由基介导的pBR322质粒损伤模型进行了精油的DNA损伤保护效果的评价。结果表明:精油表现出在不同体系中以剂量依赖方式的不同程度的功效,并且对清除DPPH和·OH自由基活性较强。精油对·OH自由基介导的pBR322质粒损伤的保护效果可能源于精油对·OH自由基较好的清除作用。
茜草;精油;抗氧化活性;DNA损伤;保护效果
研究发现许多草本及药用植物具有抗氧化属性,主要源于其中大量的活性抗氧化剂,包括黄酮类、多酚、生物碱、花青素、萜类、类胡萝卜素及维生素类。植物资源中的天然抗氧化剂备受关注,是因为其对人体健康的众多益处;正常摄入的天然抗氧化剂可减少氧化应激为机体带来的系列损伤,继而可降低癌症、心脑血管、糖尿病等其它与衰老先关的疾病等风险。作为人类天然抗氧化剂的主要资源,植物提取物和精油的抗氧化效果逐渐被人们所接受和认可。精油是芳香植物各组织中提取出的有香味的挥发性次级代谢产物,在民间医药、食品以及香料化妆品工业有着广泛的应用。近来,关于多种精油及其组分的多功能生物活性研究成为研究热点[1]。
中药茜草为茜草科多年生攀援草本植物茜草(Rubia cordifolia L.)的干燥根及根茎,主根及支根长圆柱形,弯曲,外皮红褐色,粗壮。茎生倒刺。喜生于山坡、田边及林缘处,主产于陕西、河南、安徽、河北、山东、广西和四川等地,其中以陕西、河南产量大而且品质优良。由于茜草干根及茎自古代就作为天然染料、食品的着色剂和药用植物使用,它的化学成分、药理和临床作用已被深入系统地研究[2]。其味苦,性寒,归肝、心经,具有凉血、止血、祛瘀、通经之功效,主治吐血、衄血、崩漏、外伤出血、经闭瘀阻、关节痹痛、跌扑肿痛等;亦具抗菌、抗癌、增强免疫、护肝、抑制人体表皮细胞增殖等生物活性。作为一种民族药材,它有着悠久的历史,但到目前为止还未见茜草精油的研究报道。作者以水蒸气蒸馏法提取的精油进行抗氧化活性研究,并对·OH自由基介导的pBR322质粒损伤模型进行了精油的DNA损伤保护活性作出评价,为茜草这一天然植物资源进一步开发利用提供参考。
1 材料与方法
1.1主要材料和试剂
pBR322质粒、6×loading buffer:购于西安海宁生物有限公司;茜草:采自渭南市黄河湿地保护区;主要试剂DPPH、琼脂糖、没食子酸标品:均为Sigma公司产品;其余所用试剂均为分析纯。
1.2主要仪器与设备
挥发油提取装置:西安晶博生物有限公司;722型可见分光光度计:上海光谱仪器有限公司;离心机:上海安亭科学仪器厂;KQ-200KDE型超声波清洗器:昆山仪器厂;DYY-8B型稳压稳流电泳仪及JY-SPCT电泳槽:北京君意东方电泳设备有限公司;FluorChem(5500)System凝胶图像分析系统:伯乐太平洋公司。
1.3试验方法
1.3.1茜草精油的提取采用挥发油提取器用常规水蒸气蒸馏法提取挥发油。具体操作如下:粉碎至40目的茜草干粉40 g,浸泡4 h,置于1 000 mL圆底烧瓶中,加水500 mL,加热回流提取挥发油,回流至挥发油量不再增加,停止加热;正己烷萃取收集,合并挥发油,以无水硫酸钠干燥,得黄色片状固态精油,-40℃保存备用。
1.3.2抗氧化试验精确称取20mg固态精油,加入10 mL DMSO配制成初始质量浓度2 mg/mL,然后用倍半法稀释为系列浓度,精油的质量浓度范围0.062 5~2mg/mL。
1)清除DPPH能力的测定:参照Larrauri[3]等的方法并稍作修改。分别取不同质量浓度样品液0.5 mL与3.5 mL DPPH甲醇溶液(60μmol/L)混合,于暗室室温放置30min后,在517 nm下测定吸光值;样品对DPPH清除率用下式计算:
DPPH清除率(%)=[1-(A2-A1)/A0]×100
式中:A0为溶剂对照的吸光度值;A1为样品对照吸光度值,以消除不同样品的颜色误差;A2为样品溶液的吸光度值。
2)清除·OH自由基能力的测定:参照贾之慎[4]等的方法,稍作修改。吸取0.5 mL不同稀释度的精油样品,分别加入0.5 mL、2 mmol/L二氯化铁溶液、0.5mL、2mmol/L过氧化氢溶液和0.5mL、6 mmol/L水杨酸溶液,再加入2.5 mL蒸馏水,混合均匀,将混合液在37℃水浴30min。设置空白对照,在510 nm处测定吸光度。·OH清除率(%)按下式计算:
·OH清除率(%)=[1-(Ai-Aj)/A0]×100
式中:Ai表示样品和反应体系反应后吸光度;Aj表示未加过氧化氢时样品体系的吸光度以消除样品本色对反应体系的影响;A0表示未加样品的反应体系的吸光度。
3)清除O2-·自由基能力的测定:按照Marklund等[5]的方法,取4.5mL Tris-HCl缓冲液(0.05mol/L、pH 8.2),25℃预热20 min,加入不同稀释度的样品1.0 mL和0.4mL、0.025mol/L邻苯三酚溶液,混匀,25℃水浴反应4min。立即加入1 mL、8 mmol/L盐酸溶液使反应结束。并设置空白和样品对照,于320 nm波长处测定混合液的吸光值。清除率I(%)按下式计算:
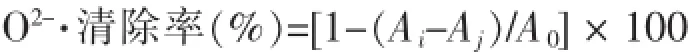
式中:Ai表示样品和反应体系的吸光度;Aj表示未加邻苯三酚样品反应体系的吸光度以消除样品本色对反应体系的影响;A0表示未加样品的反应体系的吸光度。
4)还原力的测定:样品提取液还原力的测定依照稍作修改的Vaquero等[6]的方法进行。取2.5 mL不同稀释度的样品提取液加入到装有2.5 mL、0.2 mol/L、pH 6.6磷酸缓冲液的试管中,再加入2.5 m L 1%铁氰化钾溶液混合均匀。50℃反应20min后,加入2.5 mL 10%三氯乙酸,3 000 r/min离心10 min,取上清液5mL与4mL蒸馏水和0.5mL 0.1%三氯化铁溶液混合。反应10min后,在700 nm处测吸光度。混合液的吸光度越高表示样品提取液的还原能力越强。
5)总抗氧化能力测定(磷钼络合法):参考Prieto等[7]的方法。分别取不同浓度0.4 mL样品溶液和试剂液(0.6 mol/L硫酸,28mmol/L磷酸钠和4 mmol/L钼酸铵,三种试剂以1∶1∶1混合)4 mL,混匀后放置于95℃水浴锅中恒温90min。在695 nm下测其吸光度,并用溶剂做空白对照,抗氧化活性的高低以695 nm吸光值表示,抗氧化物质活性越强,测定的吸光度值越大。
1.3.3DNA损伤保护试验精油对羟基自由基(·OH)介导的DNA损伤的保护作用按照文献[8]的方法进行测定,并略作修改。在0.25 m L的离心管中分别加入1μL(0.5μg)pBR 322质粒DNA,10μL PBS缓冲液(10mmol/L,pH7.4)和5μL精油溶液,充分混匀,然后加入2μL、1mmol/L FeSO4和2μL、1 mmol/L H2O2反应结束后,取出4μL反应液与2 μL 6×上样缓冲液混匀。然后吸取4μL置于1.0 g/dL琼脂糖凝胶(含0.5μg/m L溴化乙啶)中于电泳缓冲液(TAE,Tris/acetate/EDTA)中电泳50 min。电泳结束,用凝胶成像仪成像,并进行半定量分析。空白对照管用PBS代替多酚提取液,正常对照管用PBS代替多酚提取液、FeSO4和H2O2。按下式计算保护率:
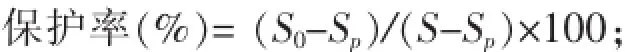
式中:S为完整pBR322质粒DNA双螺旋构象的灰度值;Sp为FeSO4+H2O2+pBR322质粒DNA体系中双螺旋构象的灰度值;S0为精油+FeSO4+H2O2+ pBR322质粒DNA体系中双螺旋构象的灰度值。
1.4总酚含量测定
精油总酚含量的测定以福林酚法进行,将0.3 mL精油(1 mg/m L)、2.5 m L去离子水和0.3 mL 1.0 mol/L Foloin-Ciocalteu试剂混合均匀。静置8 min后,加入1.5 m L、7.5 g/dL Na2CO3溶液,摇匀,密封,室温下避光反应60min后,于760 nm处测定吸光值。精油总酚含量以标准品没食子酸质量浓度(mg/mL)表示。
1.5统计学处理
实验数据以平均值±标准差表示,数据处理应用EXCEL进行;保护率采用化学发光仪凝胶成像系统自带软件的灰度进行分析。
2 结果与分析
2.1茜草精油的得率与形态
以水蒸气蒸馏法可得茜草精油(REO)的提取率0.12%,密度测定为0.896 g/mL。由图1可知室温条件下茜草精油的颜色及状态。左为黄色、薄片状结晶固态精油,具有特殊的刺激性芳香气味;中为从精油提取器收集,干燥后的精油样品,颜色黄中略红;右为茜草精油在DMSO溶解条件下的状态。茜草精油为精油中为数不多的固态精油种类,Huaiqiong Chen等[9]从健康的沉香木中所提取的精油即为固态精油,但目前大多数的研究报告证明芳香植物精油以液态精油占绝大多数。
2.2茜草精油的抗氧化活性
2.2.1清除DPPH自由基活性DPPH是一种非常稳定的自由基体系,现在被广泛用作衡量抗氧化剂自由基清除活力的有效工具。不同质量浓度的精油和阳性对照清除DPPH自由基能力见图2所示。精油、VC和BHT清除DPPH能力与所试质量浓度呈剂量依赖效应,在低质量浓度范围内量效关系增加明显;精油在低质量浓度范围(<0.125 mg/mL)内,对DPPH自由基清除力明显低于VC和BHT,以VC的清除活力最强;但在高质量浓度范围内(>0.125 mg/ mL),精油对DPPH自由基清除活力高于BHT,而低于VC,表现出强的DPPH自由基清除活力,在质量浓度为0.25 mg/mL时,精油的清除率高达(85.75± 1.13)%,VC为(95.73±2.07)%,BHT为(80.43± 1.29)%,综上可知,精油具有较强的DPPH自由基清除活力。

图1 茜草精油在室温下的色泽和状态Fig.1 Coulor and state of Rubia cordifolia essential oil(REO)at room tem perature

图2 茜草精油、VC和BHT对DPPH自由基的清除效果Fig.2 Scavenging effects on DPPH radical by REO,VC and BHT
2.2.2清除·OH自由基活性羟基自由基(·OH)是目前已知化学性质最活泼的活性氧自由基,它可以攻击生物细胞内的多糖、蛋白质、核酸等生物大分子,使其产生过氧化变性、交联或断裂,从而导致机体出现多种疾病[10]。不同质量浓度的精油和阳性对照清除·OH能力见图3。在测试质量浓度范围内,精油、VC、BHT清除羟基自由基的能力随样品质量浓度增大而逐渐增强,在质量浓度>0.25mg/mL时,VC对羟基自由基的清除能力明显大于其它二者;而质量浓度<0.25 mg/mL时,三者的清除能力相当甚至精油效果更好,在质量浓度为0.062 5 mg/mL是,精油的清除率为(42.73±2.14)%,VC的清除率为(33.52±1.56)%,BHT的清除率为(27.13±1.07)%;精油在所试浓度范围内清除率在(42.73±2.14)%~(87.76±2.24)%。
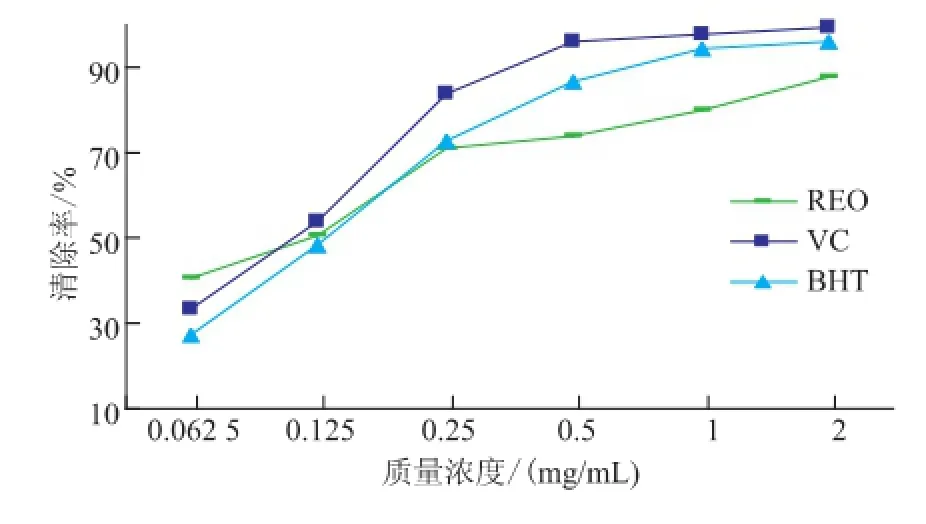
图3 茜草精油、VC和BHT对·OH自由基的清除效果Fig.3 Scavenging effects on hyd roxyl radical by REO,VC and BHT
2.2.3清除O2-·自由基活性超氧自由基(O2-·)作为众多活性氧前体物质,会促进组织的损伤和多种疾病的发生,是目前所知对细胞和组织是非常有害的一类自由基。不同质量浓度的精油和阳性对照清除O2-·自由基能力见图4。在所试质量浓度范围内,VC、BHT清除O2-·自由基的能力随质量浓度增大而逐渐增强,而样品精油的剂量依赖效应不明显;三者清除O2-·的强弱顺序依次为BHT>VC>精油;VC、BHT和精油的清除率变化范围分别是:(7.16± 1.02)%~(95.46±0.51)%,(13.77±1.40)%~(97.87± 0.95)%和(2.59±0.50)~(9.89±0.95)%。
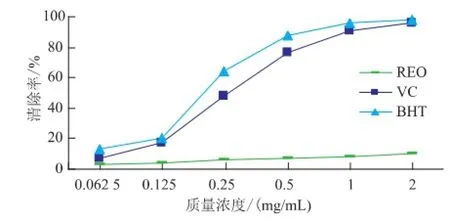
图4 茜草精油、VC和BHT对O2-·自由基的清除效果Fig.4 Scavenging effects on superoxide radical by REO,VC and BHT
2.2.4还原性Fe(III)的还原用于表示捐献电子活性强弱的指标,此活性是酚类抗氧化剂作用的重要机制之一,而且此指标可以衡量其抗氧化活性的强弱[10]。不同质量浓度的精油和阳性对照的还原能力见图5。精油、VC和BHT的还原能力与所试质量浓度呈剂量依赖效应,但精油的剂量效应性关系不明显,其在所试质量浓度范围内吸光值仅从0.277升高至0.369,而VC(0.299~0.603)和BHT(0.198~0.705)的变化要更明显。同质量浓度范围下(<1mg/mL),还原能力的大小顺序为VC>BHT>精油。
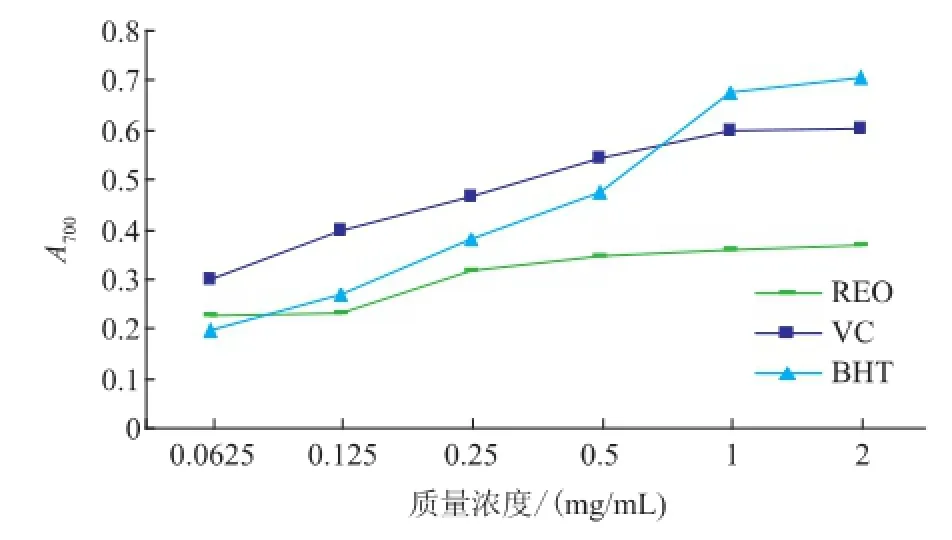
图5 茜草精油、VC和BHT的还原能力Fig.5 Reducing power of REO,VC and BHT
2.2.5总抗氧化能力(磷钼络合法)磷钼络合物法的测定原理是Mo(Ⅵ)被抗氧化物质还原生成绿色的Mo(Ⅴ)络合物,其最大吸收波长为695 nm。此方法操作简单,所用试剂低廉、方法重现性好且适合多种溶剂提取试液抗氧化活性的测定。不同质量浓度的精油和阳性对照的总抗氧化能力见图6。精油、VC和BHT总抗氧化能力与所试质量浓度呈剂量依赖效应;三者的总抗氧化活性顺序为:VC>精油>BHT。精油在所试质量浓度范围内的A695的变化范围0.225~0.953。

图6 茜草精油、VC和BHT的总抗氧化力Fig.6 Total antioxidant capacity of REO,VC and BHT
2.3精油对羟基自由基(OH·)介导的DNA损伤的保护作用
由图7可以看出,正常pBR322质粒DNA主要以双螺旋形态为主(Lane 1),被·OH氧化损伤后,双螺旋转变成了开环和线型的DNA分子,表明铁离子介导的H2O2分解后产生的·OH使pBR322质粒DNA的单链和双链都发生了断裂。然而,添加了精油后,未观察到双链断裂后的线型DNA分子,表明精油可以保护·OH介导的DNA双链的损伤。
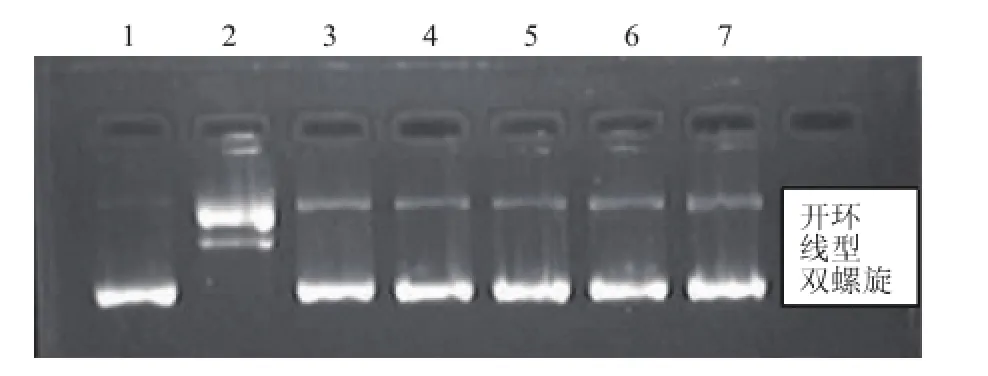
图7 茜草精油对羟基自由基(·OH)介导的DNA损伤的保护作用Fig.7·OH med iated DNA dam age protective effect of REO
为进一步研究精油对·OH介导的DNA损伤的保护作用,采用凝胶成像系统对试验结果进行了半定量分析,结果见图8。精油对·OH介导的DNA损伤的保护作用以保护率表征,保护率越高,表明其对DNA损伤的保护作用越强。由图8可以看出,在测试质量浓度范围内,精油对·OH介导的DNA损伤都具有不同程度的保护作用,但是与剂量依赖性作用不明显,保护率范围在(70.2±0.85)%~(79.5± 1.06)%,表明精油具有较好的对·OH介导的DNA损伤保护作用。对于抗氧化的研究已经表明,精油具有清除羟基自由基能力。在该体系中,精油可能通过提供氢原子或电子直接清除羟基自由基来保护DNA的损伤[11]。
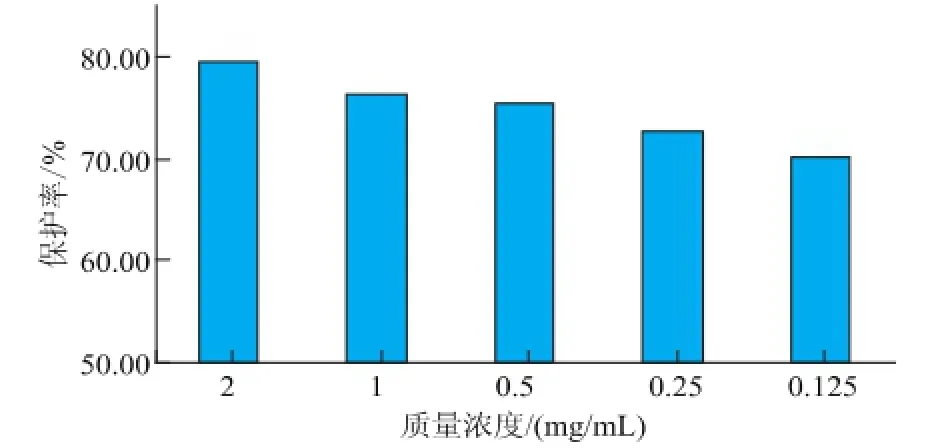
图8 茜草精油对羟基自由基(·OH)介导的DNA损伤保护作用的半定量分析Fig.8 Sem i-quan titative analysis of·OH med iated DNA damage protective effect of REO
2.4精油总酚含量
按照上述福林酚法测定没食子酸的标准曲线方程为:y=8.481 7x+0.088 2(R2=0.996 7);试验所测定的精油总酚含量为:1 g精油=0.22 mg/mL没食子酸当量。研究表明[12]:总酚含量是主要的天然抗氧化活性成分。植物提取物中总酚含量的高低常可以解释其抗氧化活性及生物活性的强弱,总酚含量与生物活性间有很强的正相关性。
3 结语
抗氧化活性的测定虽有多种方法,但对同一种抗氧化剂,选择不同的底物(或基质)体系,采用不同的测定方法,有时获得的结果也不尽相同[13]。因此,采取多种不同的抗氧化体系客观全面地反映和衡量所测定抗氧化剂的抗氧化活性非常重要。作者用5种不同的抗氧化体系评价精油的抗氧化活性,并与人工合成的抗氧化剂2,6-二叔丁基-4-甲基苯酚(BHT)和天然抗氧化剂VC进行对比,结果证明茜草精油具有较好的清除DPPH自由基和羟基自由基的生物活性,但清除超氧阴离子的能力较差,总抗氧化能力和还原能力相对阳性对照活性一般。大量研究分析表明[1,14]:精油中化合物多为抗氧化剂,且植物提取物中存在的天然抗氧化剂与该药用植物的有益属性密切相关,所以抗氧化活性被广泛作为衡量食品及药用植物生物有效性的有用参数。作者继而对·OH介导的DNA损伤的保护作用进行评价的结果说明:精油具有较好的对·OH介导的DNA损伤保护作用的机理可能在于精油具有较好的清除羟基自由基能力。
大量的植物活性物质成分研究分析表明:植物界的酚类化合物是植物发挥抗氧化潜力的主要源泉,是发挥抗氧化活性的主要贡献和参与者[10],抗氧化活性的强弱与酚类含量紧密相关;其余的生物活性如不同自由基介导的DNA损伤保护作用的发挥也与多酚含量息息相关,如gao等[8]证明了黄参籽多酚提取物不同的多酚浓度对两种自由基介导的DNA损伤保护效果研究证明:酚类物质对DNA损伤的保护具有一定程度的贡献作用。本研究测定出茜草精油的多酚含量为1 g精油=0.22 mg/mL没食子酸当量,或许精油中的多酚含量可以解释和支撑茜草精油的抗氧化和DNA损伤保护的活性效果。本研究的结果是关于茜草精油抗氧化及DNA损伤活性的首次报道,此精油表现出一定程度的抗氧化活性,表明此植物精油或许有作为食品、药品和化妆品添加剂的可能性。
[1]Mohamed Hajji,OnsMasmoudi,Nabil Souissi,etal.Chem ical composition,angiotensin I-converting enzyme(ACE)inhibitory,antioxidantand antim icrobial activities of the essential oil from Periploca laevigata rootbarks[J].Food Chem istry,2010,121(3):724-731.
[2]Yizhong Cai,Mei Sun,Jie Xing,et al.Antioxidant phenolic constituents in roots of Rheum officinale and Rubia cordifolia:structure-radicalscavenging activity relationships[J].Agricultral Food Chem istry,2004,52:7884-7890.
[3]Larrauri JA,Sánchez-Moreno C,Saura-Calixto F.Effectof temperatureon the free radicalscavenging capacity of extracts from red and white grape pomace peels[J].Journal of Agricu ltural and Food Chem istry,1998,46(7):2694-2697.
[4]贾之慎,邬建敏,唐孟成.比色法测定Fenton反应产生的羟自由基[J].生物化学与生物物理进展,1996,23(2):184-186. JIA Zhishen,WU Jianm in,TANG M engcheng.Colorimetric determ ination of hydroxyl radicals from fenton reaction[J].Prog Biochem Biophys,1996,23(2):184-186.(in Chinese)
[5]Marklund S,Marklund G.Involvementof the superoxideanion radical in theautoxidation of pyrogalloland a convenientassay for superoxide dismutase[J].European Journal of Biochem istry,1974,47(3):469-474.
[6]Vaquero M JR,Serravvalie L R T,de Nadra M CM,etal.Antioxidant capacity and antibacterialactivity of phenolic compounds from argentinean herbs infusions[J].Food Control,2010,21(5):779-785.
[7]Prieto P,Pineda M,Aguilar M.Spectrophotometric quanttation of antioxidant capacity through the formation of a phosphomolybdenum complex:specific application to the determ ination of Vitamin E[J].Anal Biochem,1999,269(2):337-341.
[8]Chun-yan Gao,Cheng-rui Tian,Rui Zhou,et al.Phenolic composition,DNA damage protective activity and hepatoprotective effect of free phenolic extract from Sphallerocarpus gracilis seeds[J].International Immuno-Pharmacology,2014(20):238-247.
[9]Huaiqiong Chen,Yun Yang,Jian Xue,et al.Comparison of compositions and antimicrobial activities of essential oils from chem ically stimulated agarwood,w ild agarwood and healthy Aquilaria sinensis(Lour.)Gilg Trees[J].M olecules,2011(16):4884-4896.
[10]N Ozsoy,A Can,RYanardag.Antioxidantactivity of Sm ilax excelsa L.leaf extracts[J].Food Chem istry,2008,110:571-583.
[11]Singh B N,Singh B R,Singh R L,etal.Oxidative DNA damage protective activity,antioxidantand antiquorum sensing potentials of Moringa oleifera[J].Food and Chem ical Toxicology,2009,47:1109-1116.
[12]Yu-Ling Lee,Gi-Wei Huang,Zeng-Chin Liang,etal.Antioxidant properties of three extracts from Pleurotus citrinopileatus[J]. LWT,2007(40):823-833.
[13]翁新楚,吴侯.抗氧化剂的抗氧化活性的测定方法及其评价[J].中国油脂,2000,25(6):119-122. WONG X inchu,WU Hou.Determ inationmethodsand the evaluation of antioxidantacticity[J].China Oil,2000,25(6):119-122.(in Chinese)
[14]F Bakkali,SAverbeck,D Averbeck,et al.Biological effects of essential oils-A review[J].Food and Chem ical Toxicology,2008,46:446-475.
会议信息
韩国拟实施食品原材料肯定列表制度
10月15日,韩国KFDA发布了《食品规格及基准部分修改》相关行政预告,其主要内容如下:
1.食品原材料的管理由以往的逐个审批变更为肯定列表方式。目前食品原材料分为可使用原材料、暂定可使用原材料、不允许使用原材料3个类别,计划整合可使用原材料、暂定可使用原材料做成可用于食品的原材料肯定列表。该肯定列表将收载可使用原材料4461种和暂定可食用原材料183种,共4644种。
2.具体步骤是把目前建设当中的食品原材料数据库整合到食品法典中,作为食品原材料使用的法律依据,也便于企业和消费者迅速查询和确认是否允许使用。
3.未收载在肯定列表中的食材,按照《食品等的暂定基准及规格认证基准》规定程序,向KFDA提交证明安全性等材料进行审批。
此外该行政预告案还包括,新设了冬季、雨季用糖饲养蜂蜜等食品类型;修改了农药残留限量;葡萄酒生产加工中为了增香允许使用橡木片(棒)等内容。
[信息来源]食品伙伴网.韩国拟实施食品原材料肯定列表制度[EB/OL].(2015-10-15).http://news.foodmate.net/ 2015/10/333872.htm l
欧盟批准二甘醇乙醚用于所有产肉动物
10月10日欧盟发布委员会实施条例(EU)2015/1820,修订(EU)No37/2010关于二甘醇乙醚(Diethylene glycol monoethyl ether)的残留限量规定。
目前欧盟已批准二甘醇乙醚用于反刍动物与猪。欧盟委员会认为,无需制定相应的残留限量规定。
欧洲药品管理局收到要求将二甘醇乙醚用于家禽的申请。欧洲药品管理局经评估认为,扩大其使用范围至家禽仍安全,由此判断二甘醇乙醚用于所有产肉动物合理。
本法规自发布20日起生效。
[信息来源]食品伙伴网.欧盟批准二甘醇乙醚用于所有产肉动物[EB/OL].(2015-10-13).http://news.foodmate.net/ 2015/10/333442.htm l
Antioxidant Activity and DNA Dam age Protective Effect of Essential Oil from Rubia cordifolia
QUAN Meiping1,2,3,TIAN Chengrui*1
(1.College of Life Science,Shanxi Normal University,Xi'an 710062,China;2.Key Lab ofWet Land Ecology and Environment of Duoheliu of Shanxi Province,W einan 714000,China;3.College of Chem istry and Life Science,Weinan NormalUniversity,Weinan 714000,China)
The antioxidantactivity and DNA damage protective effect of the essential oil from the roots of Rubia cordifolia(REO)by hydrodistillation were studied.Five different antioxidant systems,evaluated by DPPH radical method,·OH and O2-·scavenging activity,reducing power assay and the FRAP assay were employed in order to evaluate the antioxidant activities of the essential oil as compared with natural and synthetic antioxidants.The DNA damage protective activity of essential oil was evaluated by pBR322 plasm id induced by·OH radicals.The results revealed that the oil exhibited varying degrees of efficacy in each assay and a dose-dependent free-radical-scavenging activity against DPPH radical,superoxide anions and hydroxyl radical,as well as the oil exerted more potent radical scavenging activity against DPPH and·OH radicals than thatagainstO2-·radical.The essentialoilexhibited significantprotectiveactivity against·OH radical induced DNA damage.Themechanism may be originated from the superior ability of essential oil toscavenge·OH radicals.
Rubia cordifolia L.,essentialoil,antioxidantactivity,DNA damage,protectiveeffect
R 284
A
1673—1689(2015)11—1225—07
2015-07-09
渭南市科技创新扶持项目(2013JCYJ-14);渭南师范学院教育教学改革项目(JG201515)。
权美平(1978—),女,陕西咸阳人,副教授,植物资源开发与利用博士研究生。
田呈瑞(1955—),男,陕西周至人,教授,博士研究生导师,主要从事食品新资源的开发利用方面的研究。E-mail:327311912@qq.com

