通过融合双亲短肽改善L-天冬酰胺酶酶学特性
杨套伟,饶志明,贾明媚,张显,徐美娟
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
通过融合双亲短肽改善L-天冬酰胺酶酶学特性
杨套伟,饶志明*,贾明媚,张显,徐美娟
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
L-天冬酰胺酶可以将L-天冬酰胺水解成L-天冬氨酸与氨,主要应用在医药与食品行业。作者尝试在L-天冬酰胺酶N-末端融合不同的自组双亲短肽,改善该酶的酶学特性。首先,利用分子克隆技术将6条分别具有不同特征的短肽与L-天冬酰胺酶的N-端融合,并在Escherichia coli BL21中进行表达,最后,利用Ni2+-NTA纯化获得纯的重组L-天冬酰胺酶酶液。结果表明,融合SAP4对L-天冬酰氨酶(ansZ酶)动力学特征影响较大,融合蛋白SAP4-ansZ的比活力较融合前提高约30%,其中重组蛋白Km值较原始酶下降了7.5%,而Vmax值得提升了10%,说明融合SAP4可以改善ansZ酶对L-天冬酰胺的水解效率。
L-天冬酰胺酶;双亲短肽;融合;酶学特征
L-天冬酰胺酶(L-asparaginase amidohydrolase,E.C.3.5.1.1)能够将L-天冬酰胺水解脱氨基形成L-天冬氨酸和氨[1]。1961年,Broome证明豚鼠血清可以有效抑制白血病细胞6C3HED[2]。目前,L-天冬酰胺酶已经被制成药剂,成为抗癌以及治疗急性淋巴细胞白血病新药之一,在日本以及欧美等国家均已有该商品酶出售[3]。另外,在食品加工前加入天冬酰胺酶可以有效降低丙烯酰胺含量。Kukurova等研究发现,在面粉高温处理之前加入不同剂量的天冬酰胺酶,油炸食品中丙烯酰胺的含量较对照减少达90%,面粉中谷氨酸比未处理的样品增加37%,而加工产品的颜色没有明显的变化[4]。国内学者刘凌等发现油炸膨化产生的丙烯酰胺含量比微波膨化多,加入一定剂量的L-天冬酰胺酶后,食品中95%以上的L-Asn都可以转化成L-Asp,油炸膨化中丙烯酰胺含量可以减少45%,表明添加L-天冬酰胺酶可以从源头上有效地抑制食品加工过程中丙烯酰胺的生成[5]。
从豚鼠血清中提取L-天冬酰胺酶,不但含量少,且提取工艺复杂;微生物发酵法生产L-天冬酰胺酶具有周期短,提取成本低等优点,具有广泛的应用前景。目前,利用微生物法生产L-天冬酰胺酶研究较多的主要包括E.coli、E.carotovora以及E.chrysanthemi等,但是这些野生菌株酶活力较低,通过分子改造构建高效合成L-天冬酰胺酶的重组菌是一个有效的手段之一。Sidoruk等通过将来源于Y.pseudotuberculosis Q66CJ2(YpA)的L-天冬酰胺酶在E.coli中异源表达,重组菌酶活可达到20 U/mL[6]。孙茂盛等将E.coli L-天冬酰胺酶II的β-转角位置Asp178换成Pro,重组酶的热稳定性得到提高,半衰期温度(T16/02min)由原58℃提高至63℃,而对酶催化活力以及米氏常数Km和Kcat无影响[7]。
通过化学或分子修饰能够有效改善酶的特征[8-9]。自组双亲短肽(Self-assemblingamphipathic peptides,SAP)是由相互交替的亲水性和疏水性氨基酸形成,能够聚集形成有序的纳米结构[10]。因此,SAP主要应用于纳米技术领域。近年来研究发现,SAP可以用于改善酶学特性:例如利用这些短肽形成的氢化作用来固定化酶以提高酶活和稳定性[10],通过融合双亲短肽提高脂肪氧合酶的热稳定性和比酶活[11],融合双亲短肽同样可以提高碱性淀粉酶的催化效率、热稳定性以及抗氧化性[12],而融合双亲短肽对于对L-天冬酰胺酶还未见报道。
1 材料与方法
1.1多肽序列
连有6种不同的自组双亲短肽(SAP)的重组质粒pET-22b(+)/SAPs由江南大学刘龙教授惠赠,6个不同序列的多肽特征见表1[13]。位于短肽SAP的C端和ansZ N端之间有一段序列为PTPPTTPTPPTTPTPT的连接臂(PT linker),SAP、PT linker和ansZ基因连接至表达载体pET-22b(+)。

表1 多肽序列及特征Table 1 Sequences and characterisitics of the peptides
1.2N端融合多肽菌株的构建
重组质粒pET-22b(+)/SAP-ansZ的构建过程如下:首先以实验室保藏pMD18-T-ansZ[14]为模板扩增ansZ基因。引物设计如下:
上游引物:GACCCATGGATATGAAAAAACA ACGAATGC(Nco I)
下游引物:GACCTCGAGTTAATACTCATTGAA ATAAG(Xho I)
PCR产物经纯化后分别连接于同样酶切的pET-22b(+)/SAP质粒上,构建重组质粒pET-22b(+)/SAP-ansZ,重组表达载体通过CaCl2法转化E.coli,获得重组菌E.coli/pET-22b(+)/SAP-ansZ,提取质粒并酶切验证,验证正确的转化子,采用甘油法保藏。
1.3重组酶的纯化
按照E.coli培养方法,发酵结束后,4℃、8 000 g离心10 min,弃上清液,收集菌体并用PBS缓冲液洗涤2次,超声波破碎菌体,4℃、10 000 g离心30 min,收集上清液并用0.45μm无机滤膜过滤。过滤液采用Ni2+-NTA纯化,上样至已用McAc-0溶液平衡的Ni2+亲和吸附柱,用McAc-0洗去杂蛋白,目的蛋白采用0~1.0 mol/L的咪唑溶液进行线性梯度洗脱洗脱,收集最大吸收峰处的洗脱液,用于SDSPAGE分析和酶学性质研究。
1.4酶学性质研究
1.4.1重组酶的分离纯化
1)硫酸铵分级沉淀:重组菌B.subtilis 168/ pMA5-ansZ于最优条件下发酵培养24 h,于4℃、8 000 g离心10 min,收集上清液,低温条件下向上清液中添加研碎的(NH4)2SO4粉末至6个不同饱和度(30%~80%),0℃静置,4℃、10 000 g离心30 min,收集上清液,沉淀用含有1.5 mol/L(NH4)2SO4的Tris-HCl缓冲液(pH 7.5)溶解,分别测定上清液与沉淀的酶活。
2)疏水层析:重新溶解的沉淀采用0.45μm无机滤膜过滤,过滤液上样至Butyl Sepharose HP层析柱,用含1.5 mol/L(NH4)2SO4的Tris-HCl缓冲液清洗杂蛋白至基线平衡,目的蛋白用0~1.5mol/L的(NH4)2SO4缓冲液线性梯度洗脱,流速为1.0mL/min,收集目标蛋白,透析袋透析去除盐离子,透析后的蛋白用于SDS-PAGE分析和酶学性质研究。
1.4.2重组酶的酶学性质研究
1)Asn的最适反应pH和反应温度:将纯酶液分别加入到不同pH缓冲液中(pH 3.0~6.5,0.05 mol/L citrate-sodium citrate buffer;pH 6.5~9.0,0.05 mol/L Tris-HCl buffer;pH 9.0~10.0,0.05 mol/L borax-sodium hydroxide buffer),于37℃反应15 min,氨气敏电极测定酶活,考察不同pH缓冲液对天冬酰胺酶催化反应的影响,获得重组酶的最适反应pH。在最优pH条件下,将纯酶液添加到反应体系中,将反应体系分别置于20~70℃(每隔5℃为一个梯度)反应15min,反应结束后测定酶活,分析不同反应温度对天冬酰胺酶催化反应的影响,获得此酶的最适反应温度。
2)Asn的pH稳定性和热稳定性:将该酶放置于不同pH缓冲液中,0℃保温24 h,每隔一段时间取样,测定酶活,考察ansZ在不同pH缓冲液中的稳定性。将纯酶液分别在-20、0、20、30、40、50、60℃放置10 h,每隔一段时间取样,于最适反应pH和温度下反应15 min,测定酶活,考察ansZ在不同温度下的稳定性。
3)Asn反应动力学常数Km值和Vmax:配制不同浓度的L-Asn和L-Gln缓冲液,加入过量的纯酶液,反应体系置于最适条件下反应,通过氨气敏电极测定产物氨的增加量,通过Lineweaver-Burk作图法计算获得Km值和Vmax。
1.5Asn的结构模拟和分析
Asn的结构采用EasyModeller2.0软件模拟,以L-天冬酰胺酶1hg0B为模板,模拟出的3-D结构采用Discovery studio 2.5软件进行分析。
1.6Asn酶活测定
酶活测定采用氨电极法,氨电极可以测定溶液中的溶解氨[15-16]。检测设备包括连接至数显pH计的氨气敏电极和磁力搅拌器。25 mL反应体系:10 mL、0.05 mol/L Tris-HCl缓冲液,10 mL、0.05 mol/L L-Asn,加入0.5~1.0 mL的酶液,37℃水浴反应15 min,加入5 mL、15%三氯乙酸终止反应,对照管在水浴反应之前加入5 mL、15%三氯乙酸。氨电极采用不同浓度的NH4Cl溶液校正并获得铵离子标准曲线。酶活单位:按照以上条件,单位体积酶催化L-天冬酰胺产生1μmol/L的氨所消耗的酶量为1个酶活单位。蛋白质浓度采用Bradford法测定[17]。
1.7Asn酶纯化指标的计算
总活力=活力单位数/mL酶液×总体积(mL)
比活力(U/mg蛋白质)=活力单位数/mg蛋白质=总活力单位数/mg总蛋白质
纯化倍数=第一次的比活力/每次的比活力
回收率(%)=第一次总活力/每次总活力×100%
2 结果与讨论
2.1重组菌E.coli BL21/pET-22b(+)-SAP-ansZ的构建
将表1所述的6条SAP分别与ansZ的N端接,多肽与ansZ之间采用PT linker连接。重组载体转化E.coli BL21,通过Amp抗性筛选阳性转化子,酶切验证结果见图1。由图1可知,6条多肽菌连接至载体pET-22b(+),经过Xho I和Nco I双酶切后获得1.1 kb和5.7 kb左右大小的线性化基因片段。

图1 多肽融合重组质粒酶切验证图Fig.1 Identification of the recombinant plasm ids by enzyme d igestion
2.2重组蛋白的表达与纯化
按照2.3方法,采用Ni2+-NTA进行纯化,获得纯酶液,对纯酶液进行酶活测定及SDS-PAGE分析,融合蛋白的纯化结果见表2。以不融合多肽的重组蛋白Asn作为对照,融合SAP5和SAP6,重组酶的比活力较对照有所下降,SAP6下降最明显。融合SAP1对比酶活基本没有影响,融合SAP2、SAP3和SAP4,重组蛋白的比酶活菌有所提高,其中SAP4-ansZ比酶活是对照的1.3倍。
纯化蛋白的SDS-PAGE分析结果见图2,由电泳结果可知,经过Ni2+-NTA纯化后,获得单一的条带,相对分子质量大小约为38 000左右。

图2 融合蛋白纯化后SDS-PAGE分析Fig.2 SDS-PAGE analysis of the purified fusion proteins

表2 融合蛋白的纯化结果Table 2 Purification of the fusion proteins
2.3重组蛋白酶学性质研究
2.3.1重组蛋白的最适反应pH及pH稳定性从图3(a)可知,融合SAP1、SAP2、SAP5和SAP6的重组酶的最适pH没有产生变化,最适pH值7.5,与不融合多肽的重组蛋白Asn相似,融合SAP3和SAP4的重组蛋白最适pH由7.5上升至8.0。由3(b)可知,融合多肽后,重组酶的pH稳定性改变不明显,融合蛋白稳定性范围与Asn较一致。

图3 融合蛋白的最适pH(a)及pH稳定性(b)Fig.3 Effects of pH(a)and pH stability on the fusion p roteins(b)
2.3.2重组蛋白的最适反应温度及热稳定性由图4(a)可知,融合蛋白的最适反应温度为37~40℃。融合SAP4和SAP5的重组酶最适反应温度与对照ansZ一致,均为40℃,融合SAP1、SAP2、SAP3和SAP6最适反应温度稍微下降,由40℃变为37℃。图4(b)为融合蛋白的热稳定性结果。融合多肽后,重组酶的热稳定性较对照仅发生细微的变化,热稳定性范围与对照较相似。

图4 融合蛋白的最适温度(a)及热稳定性(b)Fig.4 Effects of tem perature(a)and thermal stability on the fusion proteins(b)
2.3.3重组蛋白的动力学常数按照米氏方程,采用Lineweaver-Burk作图法求得融合蛋白的动力学常数,结果见表3。从表3可知,融合SAP1、SAP2、SAP3、SAP4和SAP6重组蛋白的米氏常数Km均下降,其中融合SAP1变化最大,Km值由0.68mmol/L下降为0.49 mmol/L,而融合SAP5酶的Km值有所上升,其Km值为0.75 mmol/L。只有融合SAP2和SAP4的重组蛋白最大反应速率Vmax较对照有所增大,其中融合SAP4 Vmax由60.24μmol/(L·min)上升至66.22μmol/(L·min),其他多肽的融合均导致Vmax不同程度下降,SAP3下降最明显,Vmax值仅为25.25 μmol/(L·min)。因此,融合SAP4对Asn酶动力学特征影响较大,其中重组蛋白Km值较原始酶下降了7.5%,而Vmax值得提升了10%,说明融合SAP4可以改善ansZ酶对L-天冬酰胺的水解效率。

表3 融合蛋白的动力学常数Table 3 Kinetic parameters of the fusion proteins
2.4重组蛋白结构模拟与分析
由酶学性质研究结果发现,融合SAP4的重组酶比活力较对照获得提高,酶的催化效率获得一定程度提高,底物亲和力也有所提高。采用计算机模拟获得了原始酶Asn和重组酶SAP4-ansZ的结构,和其他已报道结构的L-天冬酰胺酶一样,该酶是一个四聚体复合物,含有四个亚基[18],每个亚基含有14个β折叠和8个α螺旋结构。为了便于观察,我们将连接多肽的亚基结构单独显示出来,见图5,并探讨短肽的加入对其活性位点结构的影响。L-天冬酰胺酶N端的活性位点包括Thr 36、Ser 84、Glu 87、Thr 109、Asp 112和Ala 148,除了Ser 84和Glu 87位点外,其它氨基酸残基都是非常保守的[18-19]。在催化反应过程中亲核试剂主要为Thr残基,酶活性中心的Thr残基上的羟基亲核攻击底物β-羰基上的C原子,形成四面体中间构型[18]。
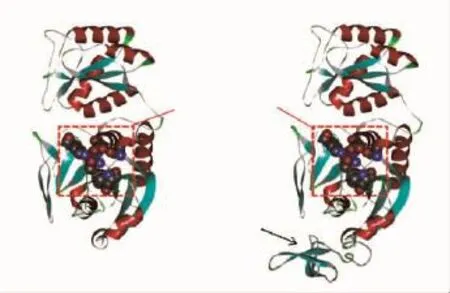
图5 Asn(a)和SAP4-ansZ(b)的3-D结构Fig.5 3-D structure of Asn(a)and SAP4-ansZ(b)
图6为酶的活性位点分析结果,SAP4-ansZ的活性位点与Asn相比较,构象有细微的改变,而且融合后活性位点周围的氢键数及盐离子键也减少,氢键和离子键的减少会使活性位点之间的催化残基变得更灵活。因此,氢键和离子键的改变可能会使酶的催化效率及对底物亲和力提高[20]。

图6 Asn(a)和SAP4-ansZ(b)的活性位点分析Fig.6 Analysis of the active site of Asn(a)and SAP4-ansZ(b)
3 结语
作者通过融合SAP4双系短肽改善L-天冬酰氨酶对L-天冬酰胺的水解效率,而对该酶其它特征影响并不明显。另外,该方法对于改善其它酶的特征提供了借鉴。
[1]Ferrara M A,Severino N M B,Mansure J J,et al.Asparaginase production by a recombinant Pichia pastoris strain harbouring Saccharomyces cerevisiae ASP3 gene[J].Enzyme and M icrobial Technology,2006,39(7):1457-1463.
[2]Broome JD.Evidence that the L-asparaginase activity of guinea pig serum is responsible for itsantilymphoma effects[J].Nature,1961,191(4793):1114-1115.
[3]Pieters R,Hunger SP,Boos J,etal.L-asparaginase treatment in acute lymphoblastic leukem ia:a focus on Erwinia asparaginase[J].Cancer,2011,117(2):238-249.
[4]Kukurova K,Morales FJ,Bednarikova A,etal.Effectof L-asparaginase on acrylamidem itigation in a fried-dough pastrymodel[J].Molecular Nutrition&Food Research,2009,53(12):1532-1539.
[5]刘凌,王文艳,薛毅,等.膨化板栗片中丙烯酰胺的形成与其前体物质的酶法控制[J].食品科技,2012(9):77-81. LIU Ling,WANG Wenyan,XUE Yi,et al.Acrylamide formation in preparing puffed chestnut chips and controlling the precursorsby asparaginase[J].Food Science and Technology,2012(9):77-81.(in Chinese)
[6]Sidoruk K V,Pokrovsky V S,Borisova A A.Creation of a producent,optim ization of expression,and purification of recombinant yersinia pseudotuberculosis L-asparaginase.[J].Bu lletin of Experimental Biology and M edicine,2011,152(2):219-223.
[7]Li L Z,X ie T H,Li H J,et al.Enhancing the thermostability of Escherichia coli L-asparaginase II by substitution w ith pro in predicted hydrogen-bonded turn structures[J].Enzym e and M icrobial Technology,2007,41(4):523-527.
[8]张静,田亚平.丁二酸酐修饰对枯草芽孢杆菌氨肽酶结构及酶学特性的影响[J].食品与生物技术学报,2013,32(6):622-627. ZHANG Jing,TIAN Yaping.Chem icalmodification of the bacillus subtilisam inopeptidase by succinic anhydride and itsenzyme properties[J].Journal of Food Science and Biotechnology,2013,32(6):622-627.(in Chinese)
[9]吴丹,郑贤良,吴敬.不同宿主来源的α-环糊精葡萄糖基转移酶分离纯化及化学修饰提高其热稳定性[J].食品与生物技术学报,2013,32(3):287-292. WU Dan,ZHENG Xianliang,WU Jing.Purification ofα-cyclodextrin glycosyltransferase and study of thermal stability improvementby chemicalmodification[J].Journal of Food Science and Biotechnology,2013,32(3):287-292.(in Chinese)
[10]Wang Q,Yang Z,Gao Y,etal.Enzymatic hydrogelation to immobilize an enzyme for high activity and stability[J].Soft M atter,2008,4(3):550-553.
[11]Lu X,Liu S,Zhang D,etal.Enhanced thermal stability and specific activity of Pseudomonas aeruginosa lipoxygenase by fusing w ith self-assembling am phipathic peptides[J].App lied M icrobiology and Biotechnology,2013,97(21):9419-9427.
[12]Yang H,Lu X,Liu L,etal.Fusion of an oligopeptide to the N terminus of an alkalineα-amylase from Alkalimonas amylolytica smultaneously improves the enzyme's catalytic efficiency,thermal stability,and resistance to oxidation[J].App lied and Environm ental M icrobiology,2013,79(9):3049-3058.
[13]Yang H,Lu X,Liu L,etal.Fusion of an oligopeptide to the N terminus of an alkalineα-amylase from alkalimonas amylolytica simultaneously improves the enzyme's catalytic efficiency,thermal stability,and resistance to oxidation[J].App lied and Environmental M icrobiology,2013,79(9):3049-3058.
[14]Jia M,Xu M,He B,et al.Cloning,expression,and characterization of L-asparaginase from a new ly isolated Bacillus subtilis B11-06[J].Journal of Agricultural and Food Chem istry,2013,61(39):9428-9434.
[15]Karmali M A,Roscoe M,Flem ing P C.Modified ammonia electrode method to investigate D-asparagine breakdow n by Campylobacter strains[J].Journal of ClinicalM icrobilolgy,1986,23(4):743-747.
[16]KarmaliM A,Williams A,Fleming PC,etal.Use of an ammonia electrode to study bacterial deam ination of amino acidswith special reference to D-asparagine breakdown by Campylobacters[J].The Journal of Hygiene,1984,93:189-196.
[17]Walker JM.Basic protein and peptide protocols[M].Totowa:Humana Press,1994.
[18]K islitsyn Y A,K ravchenko O V,Nikonov S V,et al.Three-dimensional structure of Erwinia carotovora L-asparaginase[J]. Crystallography Reports,2006,51(5):811-816.
[19]Kravchenko O V,Kislitsin Y A,Popov A N,et al.Three-dimensional structures of L-asparaginase from Erwinia carotovora complexedwith aspartateand glutamate[J].Acta Crystallographica Section D,2008,64(3):248-256.
[20]杨海泉.碱性淀粉酶的异源表达及分子改造[D].无锡:江南大学,2013.
Improvement of Characteristic of L-Asparaginase through Fusing Six Self-Assembling Amphipathic Peptides to Its N-Terminal
YANG Taowei,RAO Zhiming*,JIA Mingmei,ZHANG Xian,XU Meijuan
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi214122,China)
L-asparaginase(Asn)can catalyzes the hydrolysisof L-asparagine to L-aspartic acid and ammonia.It ismainly applied in pharmaceutical and food industry.In this study,to improve the characteristic of Asn,we fused six self-assembling amphipathic peptides(SAPs)to its N-term inal and expressed the recombinant Asns in E.coli,respectively.Compared to w ide-type Asn,the SAP4-Asn activity increased by 30%,the value of Kmdecreased by 7.5%and the Vmaxincreased by 10%.The reaction kinetics analysis showed that the affinity ability and catalytic efficiency of the fusion enzyme towards L-asparagine improved compared to wide-type Asn.
L-asparaginase,self-assembling amphipathic peptides,fusion,characterization
Q 55
A
1673—1689(2015)11—1178—07
2014-05-20
国家863计划项目(2015AA021004);国家自然科学基金项目(31400082);中央高校基本科研业务费专项资金项目(JUSRP11545);江苏高校优势学科建设工程资助项目;111引智计划(111-2-06)项目;江苏省现代发酵工业协同创新中心项目。
杨套伟(1983—),男,河南漯河人,工学博士,讲师,主要从事代谢工程、酶工程方面的研究。E-mail:ytw1228@163.com
饶志明(1975—),男,江西临川人,农学博士,教授,博士研究生导师,主要从事代谢工程、发酵工程方面的研究。
E-mail:raozhm@jiangnan.edu.cn

