海洋细菌Pseudoalteromonas sp.NJ631胶原蛋白酶的克隆与表达
薛春旭,陈威,周宇芳,朱鹏*
(1.宁波大学海洋学院,浙江宁波315211;2.平阳县海洋与渔业局,浙江温州325400;3.浙江省海洋开发研究院,浙江舟山316100)
海洋细菌Pseudoalteromonas sp.NJ631胶原蛋白酶的克隆与表达
薛春旭1,陈威2,周宇芳3,朱鹏*1
(1.宁波大学海洋学院,浙江宁波315211;2.平阳县海洋与渔业局,浙江温州325400;3.浙江省海洋开发研究院,浙江舟山316100)
对交替假单胞菌Pseudoalteromonas sp.NJ631基因组中潜在的胶原蛋白酶基因进行克隆与表达,并鉴定重组蛋白PNJC的酶活力。根据NJ631基因组序列草图,利用基因组信息发掘方法获得胶原蛋白酶功能提示的编码基因,进而利用高效表达质粒pET28a构建重组表达系统。经IPTG诱导表达、亲和层析纯化获得重组蛋白纯化产物。以不溶性Ⅰ型胶原蛋白为底物,测定胶原蛋白酶酶活力。对Pseudoalteromonas sp.NJ631基因组信息挖掘,从中发现一条疑似编码胶原蛋白酶的基因序列,命名为Pnjc。该基因全长1 359 BP,GC含量45.62%,编码由452个氨基酸残基组成的约51 000大小的胶原蛋白酶。SDS-PAGE检测表明胶原蛋白酶PNJC在0.2 mmol/L的IPTG诱导下得到高效表达。经过亲和层析获得纯化重组蛋白PNJC,蛋白质质量浓度约为1 mg/mL。酶活检测表明,PNJC的酶活力为160.34 U/mg,为标准品的70.48%。PNJC高酶活力表明Pseudoalteromonas sp.NJ631来源的胶原蛋白酶具有重要的研究价值与工业开发潜力。
交替假单胞菌;胶原蛋白酶;基因组发掘;酶活检测
胶原蛋白酶是一类特异性作用于胶原蛋白或其它变性明胶的酶类。它在医学[1-2]、基础研究[3]、环境保护[4]等方面有着重要的研究价值和应用潜力。胶原蛋白酶来源丰富,除动物中发现的胶原蛋白酶外,梭菌、弧菌等微生物也能产生胶原蛋白酶[5-6]。微生物种类多,特异性强,基因资源丰富,具有动物无法比拟的天然优势。微生物来源的胶原蛋白酶的研究开发将为我们筛选酶活更高、特异性更强的潜在工业化的胶原蛋白酶。
基因组测序技术的快速更替带来了基因组数据的爆炸性增长,利用基因组发掘(Genome Mining)方法为胶原蛋白酶编码基因的快速发掘及其功能研究提供了高效平台。Janwitthayanan等[7]基于全基因组序列获得细菌胶原蛋白酶基因,利用RT-PCR方法体外检测其表达量,验证了胶原蛋白酶在肺出血致病菌的存活与致病性方面起重要的作用。交替假单胞菌属因作为海洋特有菌属而备受关注,其基因组数据库不断得到扩充[8-9]。目前,交替假单胞菌属基因组中多有胶原蛋白酶这一功能基因的提示,但是相关基因编码的蛋白是否具有胶原蛋白酶活性未见报道。作者从Pseudoalteromonas sp.NJ631基因组草图出发[10],利用基因组发掘方法获得胶原蛋白酶基因,通过原核表达系统获得纯化蛋白并检测其功能活性,以期验证交替假单胞菌属中胶原蛋白酶的活性,为该菌属来源的胶原蛋白酶的深入研究与潜在工业应用价值奠定基础。
1 材料与方法
1.1菌株和质粒
海洋细菌交替假单胞菌(Pseudoalteromonas)NJ631:分离于珍珠膜海绵(Hymeniacidon perleve),由宁波大学浙江省海洋生物工程重点实验室保藏;大肠杆菌(Escherichia coli)Rosseta(DE3)、质粒pET28:购自Novagen公司;大肠杆菌(E scherichia coli)Top10:购自Invitrogen公司。
1.2主要试剂和仪器
细菌基因组DNA抽提试剂盒(K1071)、质粒小量提取试剂盒(GK2004):购自上海捷瑞生物工程有限公司;琼脂糖胶DNA回收纯化试剂盒(D6492):购自Omega公司;DNA Marker、rTaq聚合酶、DNA连接酶:购自TaKaRa公司;蛋白Marker:购自碧云天生物技术研究所;限制性内切酶BamHI和Hind III:购自NEB公司;Ni-NTA agarose购自北京康为世纪生物科技有限公司;不溶性Ⅰ型胶原与Ⅰ型胶原蛋白酶标准品:购自生工生物工程(上海)有限公司;Bio-Rad DC Protein ASSAY试剂盒:购自Bio-Rad公司;其他试剂均为分析纯试剂;超滤离心管Amicon Ultra-10:购自Millipore公司;;纯水制备系统:购自美国Pall公司;台式高速冷冻离心机:购自Sigma公司;酶标仪:购自Thermo公司;匀浆仪Precellys 24:购自Bertin公司;PCR仪:购自杭州博日科技有限公司;凝胶成像系统:购自上海欧翔科学仪器有限公司。
1.3主要培养基
2216E培养基:0.1 g/dL酵母粉,0.5 g/dL蛋白胨,0.01 g/dL柠檬酸铁,过滤海水,用于交替假单胞菌NJ631的培养;LB培养基:1 g/dL胰蛋白胨,0.5%酵母粉,1%氯化钠,用于大肠杆菌Rosseta(DE3)和Top10的培养。
1.4交替假单胞菌NJ631基因组DNA抽提
取1 mL处于指数生长期的Pseudoalteromonas sp.NJ631菌液,按照细菌基因组DNA抽提试剂盒说明书提取其基因组DNA。
1.5基因组中胶原蛋白酶基因的发掘
基于基因组第二代测序技术获得的Pseudoalteromonas sp.NJ631基因组草图,利用Glimmer3.0基因软件预测得到4658个开放阅读框(open reading frames,ORFs)。经蛋白数据库Blast比对,获得ORF的功能提示[10],进而发掘潜在的具有胶原蛋白酶功能的编码基因。将基因编码的氨基酸序列提交NCBI获得序列登录号,并进行Blast比对分析。
1.6胶原蛋白酶基因的PCR扩增
根据胶原蛋白酶基因设计一对引物:P1:5’-CGGGATCCATGTTTGTACCAGAACTTCT-3’;P2:5’-CCCAAGCTTTTATGCCTTTTTAAAAGGAT-3’,下划线分别为限制性内切酶BglⅡ和XhoⅠ的酶切位点,引物由Invitrogen公司生产合成。以NJ631基因组为模版进行PCR扩增,扩增条件为:95℃5 min;95℃30 s,51℃30 s,72℃90 s,共35个循环;72℃延伸10 min。经1 g/dL琼脂糖凝胶电泳检测后,回收目的片段。
1.7表达载体的构建
利用限制性内切酶BglⅡ和XhoⅠ分别对表达质粒pET28a和胶原蛋白酶基因进行双酶切,回收的酶切片段经DNA T4连接酶连接后转化大肠杆菌Rosseta(DE3)感受态细胞。通过菌落PCR检测筛选获得阳性转化子,获得重组质粒pET28a-Pnjc。核苷酸序列的测序由Invitrogen公司完成。
1.8胶原蛋白酶的诱导表达与纯化
过夜培养的重组表达菌液按1%接种体积分数转接到20 mL含卡那霉素(25μg/mL)的LB培养基中,37℃、200 r/min振荡培养。当OD600约为0.6时,添加IPTG至终浓度分别为0.2 mmol/L和1 mmol/ L,于28℃、120 r/min培养条件下诱导表达4 h。培养基经离心后收集菌体,利用buffer A(25 mmol/L Tris-HCl,(pH 8.0),400 mmol/L NaCl,体积分数10%甘油)进行重悬。菌体细胞经匀浆仪破碎后离心,分别收集上清液和沉淀进行SDS-PAGE检测。胶原蛋白酶的纯化参考McQuade等方法[11],获得的纯化蛋白经超滤离心管浓缩后测定蛋白质浓度并进行SDS-PAGE检测。
1.9胶原蛋白酶活性检测
以不溶性Ⅰ型胶原蛋白为底物,采用茚三酮显色法[12]测定胶原蛋白酶PNJC水解底物释放的水溶性氨基酸和短肽。反应体系:0.1 mL酶液,0.5 mL 0.1 mol/L Tris-HCl缓冲液(含50 mmol CaCl2,pH 7.5),不溶性I型胶原1 mg。37℃孵育30min,加入0.6mL 10%的三氯乙酸(TCA)终止反应。反应物10 000 r/min离心10 min,取上清液0.6 m L并加入0.6 mL 2 mol/L乙酸缓冲液(pH 5.4)及0.6 mL茚三酮显色溶液,充分混合后,100℃水浴加热15 min,冰水冷却5 min,经60%乙醇稀释后于570 nm处测定吸光值。以不加目的蛋白作为阴性对照,胶原蛋白酶标准品作为酶活反应的阳性对照,每组反应均重复3次。以甘氨酸为标准制作标准曲线。
酶活力定义为:在37℃,pH值7.5条件下,每分钟水解胶原蛋白产生相当于1μg甘氨酸的酶量为1个酶活力单位(U)。
2 结果与讨论
2.1NJ631基因组中胶原蛋白酶基因的发掘
根据ORF的基因功能提示,我们发现Pseudoalteromonas sp.NJ631基因组中含有一条完整的胶原蛋白酶编码基因,命名为Pnjc。该基因全长1 359 bp,GC含量45.62%,编码由452个氨基酸残基组成的约51 000大小的胶原蛋白酶。经Blast比对分析发现,该基因编码的胶原蛋白酶PNJC与同属中的蛋白酶相似性均在85%以上,其中与Pseudoalteromonas piscicida中的蛋白酶相似性最高,达到99%。
2.2重组表达载体pET28a-PNJC的构建
利用带有酶切位点的引物对进行PCR扩增结果显示,扩增片段大小与交替假单胞菌NJ631中胶原蛋白酶编码基因Pnjc的序列大小相符,见图1,表明成功获得Pnjc基因片段。
将Pnjc与表达载体pET28a分别经限制性内切酶酶切后,回收酶切片段。经转化、菌落PCR检测,筛选获得重组转化子。测序结果显示pET-28a在酶切位点BglⅡ和XhoⅠ之间成功插入Pnjc基因片段且无突变点。

图1 胶原蛋白酶编码基因Pn jc的PCR扩增Fig.1 PCR amplification of Pnjc DNA fragment
2.3重组菌的诱导表达与重组蛋白纯化
以pET-28a为表达载体,经IPTG诱导表达后发现重组蛋白PNJC在大肠杆菌Rosseta(DE3)中得到高效表达,见图2。在51 000附近有明显蛋白质条带,与胶原蛋白酶PNJC大小相符。PNJC在IPTG诱导浓度为0.2 mmol/L时的表达量与1 mmol/L IPTG诱导下的表达量相当。细胞裂解液上清液与沉淀的分析结果表明,可溶性重组蛋白PNJC表达显著。
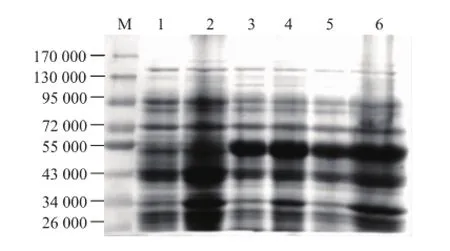
图2 重组蛋白PNJC的诱导表达与SDS-PAGE检测Fig.2 Heterogeneous expression of PNJC in Rosseta
将含有重组蛋白PNJC的细胞裂解上清液上样Ni-NTA琼脂糖凝胶纯化柱,利用PNJC碳端带有组氨酸标签对其进行亲和层析纯化,通过梯度洗脱获得纯化重组蛋白。SDS-PAGE检测表明,成功获得纯化的胶原蛋白酶PNJC,见图3。经蛋白定量试剂盒检测显示纯化得到的胶原蛋白酶PNJC蛋白质质量浓度约为1mg/mL,可进行该酶的酶活测定。
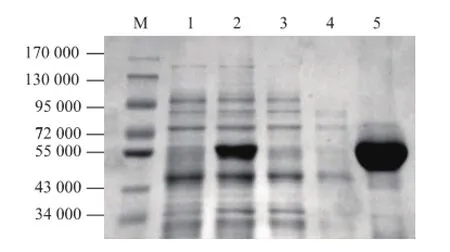
图3 重组胶原蛋白酶PNJC的纯化Fig.3 Purified recombinant collagenase PNJC
2.4胶原蛋白酶酶活测定
以不溶性Ⅰ型胶原蛋白为底物,测定纯化得到的胶原蛋白酶PNJC的酶活活性。结果显示,相较于Ⅰ型胶原蛋白酶标准品227.51 U/mg的酶活活性,PNJC表现出160.34 U/mg的酶活活性,为标准品的70.48%。这意味着Pseudoalteromonas sp.NJ631来源的胶原蛋白酶PNJC具有一定的研究价值与工业开发潜力。
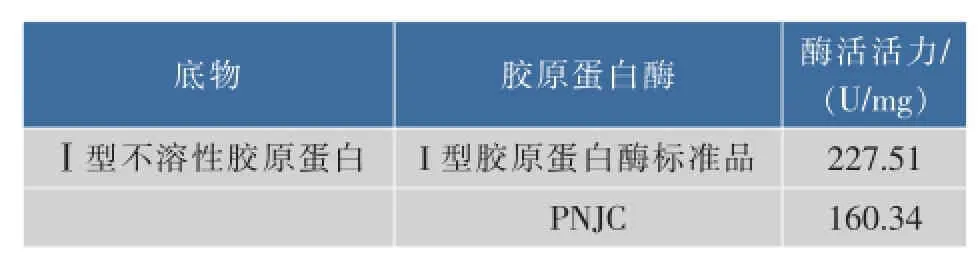
表1 胶原蛋白酶PNJC的底物活性检测Table 1 Enzym atic activity of collagenase PNJC
本研究中Pseudoalteromonas sp.NJ631基因组中胶原蛋白酶编码基因Pnjc已提交NCBI,并获得序列登录号:KF439859
3 结语
胶原蛋白酶的重要应用价值使其备受关注。本实验首次基于Pseudoalteromonas sp.NJ631基因组草图,利用基因组信息发掘方法获得胶原蛋白酶编码基因Pnjc,并通过异源表达与亲和层析纯化获得重组蛋白PNJC。胶原蛋白酶PNJC的酶活力为160.34 U/mg,达到胶原蛋白酶标准品的70.48%,具有重要的研究开发价值。异源表达系统诱导条件的优化、重组蛋白纯化方法的改进、氨基酸位点的突变将有助于我们获得高质量的具有生物活性的重组蛋白PNJC,为首个交替假单胞菌属来源的胶原蛋白酶的工业化生产奠定坚实的基础。
目前,NCBI数据库已收录超过7 000个物种的基因组数据,其中细菌来源的基因组数据约4 500个,后基因组时代已经到来。较真核生物而言,细菌具有无可比拟的优势,细菌丰富的基因资源为潜在的功能蛋白的发掘与新型化合物的指导发现提供了充足的数据资源。而基因组信息发掘方法为如何利用细菌基因组资源获得目的基因提供了思路,避免了通过构建基因组文库获得目的基因的传统方法[6],达到快速筛选、节约时间、提高效率的目的。Rainbow等从类鼻疽杆菌基因组数据库中发掘到一条胶原蛋白酶的编码基因,通过基因克隆、异源表达与酶活检测验证了该基因编码蛋白具有明胶酶与胶原蛋白酶活性[13]。以细菌基因组为基础,借助基因组发掘技术将有助于我们快速获得更加高效、工业化开发潜力的胶原蛋白酶。
[1]CakirM,Tekin A,Kucukkartallar T,etal.Effectivenessof collagenase in preventing postoperative intra-abdom inal adhesions[J]. International Journal of Surgery,2013,11(6):487-491.
[2]Torrai Bou JE,Paggi B.Collagenase and devitalized tissue in the framework of the wound bed preparation[J].Revista de Enferm ería,2013,36(2):37-42.
[3]LeonardiR,Caltabiano R,Loreto C.Collagenase-3(MMP-13)isexpressed in periapical lesions:an immunohistochemicalstudy[J].European Society of Endodontology,2005,38(5):297-301.
[4]赵海霞,赵培培,吴小峰,等.短小芽孢杆菌胶原蛋白酶基因cola的克隆及序列分析[J].四川农业大学学报,2011,29(4):524-527.
[5]Eckhard U,Schönauer E,Ducka P,et al.Biochemical characterization of the catalytic domains of three different Clostridial collagenases[J].Biological Chem istry,2009,390(1):11-18.
[6]Teramura N,Tanaka K,Iijima K,etal.Cloning of anovel collagenasegene from the gram-negativebacterium Grimontia(Vibrio)hollisae1706Band Itsefficientexpression in Brevibacillus choshinensis[J].Journalof Bacteriology,2011,193(12):3049-3056.
[7]Janw itthayananW,Keelawat S,Payungporn S,etal.In vivo gene expression and immunoreactivity of Leptospira collagenase[J]. M icrobiological Research,2013,168(5):268-272.
[8]X ie B B,Shu Y L,Qin Q L,etal.Genome sequencesof type strainsof seven speciesof themarine bacterium Pseudoalteromonas[J].Journal of Bacteriology,2012,194(10):2746-2747.
[9]Ballestriero F,Thomas T,Burke C,et al.Identification of compounds w ith bioactivity against the nematode Caenorhabditis elegans by a screen based on the functionalgenom ics of themarine bacterium Pseudoalteromonas tunicata D2[J].Applied and Environmental M icrobiology,2010,76(17):5710-5717.
[10]陈威,朱鹏,何山,等.海洋细菌Pseudoalteromonas sp.NJ631中NRPS基因簇及核心模件的发掘[J].微生物学报,2012,52(12):1531-1539.
[11]M cQuade T J,Shallop A D,Sheoran A,et al.A nonradioactive high-throughput assay for screening and characterization of adenylation domains fornonribosomalpeptide combinatorialbiosynthesis[J].Analytical Biochem istry,2009,386(2):244-250.
[12]Sung-IIKang S,Jang YB,Choi YJ,et al.Purification and properties of a collagenolytic protease produced by marine bacterium Vibrio vulnificus CYK279H[J].Biotechnology and Bioprocess Engineering,2005,10:5935-5998.
[13]Rainbow L,W ilkinson M C,Sargent P J,et al.Identification and expression of a Burkholderia pseudomallei collagenase in Escherichia coli.[J].Current M icrobiology,2004,48(4):300-304.
Molecular Cloning and Expression of Collagenase Produce by Marine Bacteria Pseudoalteromonas sp. NJ631
XUEChunxu1,CHENWei2,ZHOU Yufang3,ZHU Peng*1
(1.SchoolofM arine SciencesNingbo University,Ningbo 315211,China;2.PingYang Ooceanic&Fishery Bureau,Wenzhou 325400,China;3.Zhejiang Marine Development Research Institute,Zhoushan 316100,China)
The gene encoding collagenase from Pseudoalteromonas sp.NJ631 was cloned and expressed in E.coli cells.Subsequently,the bioactivity of recombinant protein,named PNJC,was assessed.The gene sequence encoding a putative collagenase,designed Pnjc,was obtained from the genome of Pseudoalteromonas sp.NJ631 using a genomem ining approach.The Pnjc coding region was amplified and cloned into pET-28a Vector.The plasm ids harboring the assembled full-length sequence encoding PNJC were transformed into the E.coli cells for the expression of the PNJCprotein.The expression and purification of the recombinant protein were carried on according to manufacturer's instruction.Finally,the enzymatic activity of collagenase was assessed by using recombinant protein decomposing the type Icollagen as substrate.The 1359-bp open reading frame with 45.62%GC was obtained from the genome of Pseudoalteromonas sp.NJ631,which was encoded of a protein of 452 am ino acids and shared significanthomology with the collagenase from the other genera.The PNJC was highly expressed by adding 0.2 mM IPTG.The assay of enzyme activity showed that the enzyme activity of PNJC was 160.34 U/mg,70.48%of the standard,confirm ing that the Pnjc gene encoded a functional collagenase.This is the first reportof the cloning the expression of collagenase from marine bacteria Pseudoalteromonas sp.The PNJC encoded by Pnjc gene from NJ631 showed high bioactivity on decomposing the type I collagen,which are of potentialvalue for the commercialexploitation.
Pseudoalteromonas,collagenase,genomem ining,enzymatic activity
Q 819
A
1673—1689(2015)11—0000—07
2014-00-00

