菊芋菊糖的提取、聚合度分布及抗氧化活性的研究
张宏志,马艳弘*,黄开红,李亚辉,黄玉玲
(1.江苏省农业科学院农产品加工研究所,江苏南京210014;2.盐土大地农业科技有限公司,江苏大丰224145)
菊芋菊糖的提取、聚合度分布及抗氧化活性的研究
张宏志1,马艳弘*1,黄开红1,李亚辉1,黄玉玲2
(1.江苏省农业科学院农产品加工研究所,江苏南京210014;2.盐土大地农业科技有限公司,江苏大丰224145)
以新鲜菊芋为原料,比较热水浸提、酶法、超声和微波辅助热水浸提4种提取方法对菊芋菊糖的提取率、聚合度、抗氧化能力的影响。采用不同截留相对分子质量的超滤管对提取液中菊糖聚合度分布进行分析,通过清除1,1-二苯基-2-三硝基苯肼(DPPH)、羟基自由基(·OH)和超氧阴离子自由基(O2-·)试验来研究菊糖体外抗氧化活性。结果表明,菊芋菊糖最佳提取工艺为:料液质量体积比1 g∶20 mL,微波功率800 W,间歇式辅助处理6 min,提取温度80℃,提取时间120 min,菊糖得率为15.35%。酶法辅助提取对菊糖聚合度基本没有影响,超声和微波辅助造成菊糖平均聚合度下降,其中聚合度30<DP<60的菊糖样品比例由32.5%分别下降到28.6%和16.5%,聚合度DP>60的菊糖比例由13.6%下降到6.8%和3.6%。不同体外抗氧化体系中,4种方法提取所得菊糖均表现出一定的抗氧化能力,且与其质量浓度呈明显量效关系。其中,微波辅助提取法所得菊糖对活性氧自由基的清除作用最强,显示出较强的抗氧化活性。
菊芋;菊糖;提取;聚合度;抗氧化
菊芋(Jerusalem artichoke)为菊科向日葵属植物,俗称鬼子姜、洋姜等,原产于北美洲,后经欧洲引入我国,以块茎繁殖,耐低温、贫瘠和盐碱,产量较高,在我国的沿海滩涂地区有大面积种植,是对沿海滩涂进行土壤改良的先锋植物[1]。菊芋块茎中富含菊糖(又称菊粉),质量分数为菊芋湿重的10%~20%,干重的80%左右,是加工生产菊糖及其制品的首选原料[2]。菊糖是由D-果糖经β(2→l)糖苷键脱水聚合而形成的果聚糖,呈直链结构,其末端连接1个葡萄糖残基,每个菊糖分子约含30~50个果糖残基[3]。菊糖作为天然可溶性膳食纤维,能够增殖肠道内双歧杆菌,防止肠道感染,促进矿物质的吸收,控制血脂,防治便秘和肥胖,降低血糖;此外,菊糖可作为糖、脂肪替代物大量用于低热量、低糖、低脂肪食品中,显著改善无脂、低脂食品的口感和质感,是一种纯天然的功能性食品添加剂[4-6]。
目前,国内菊芋主要被用来制作酱菜或泡菜,以其为原料提取菊粉的产业还处在起步阶段,其加工要经过切片、烘干、粉碎、提取等诸多工序,存在能耗大、生产成本高,提取率低等诸多技术难题。有关菊糖提取分离的研究虽有零星报道[7-9],但大多不适合规模化生产,且不同提取方法对聚合度和抗氧化能力的影响,以及聚合度和抗氧化能力之间的关联性也鲜有报道。鉴于此,作者系统研究了热水浸提法,以及酶法、超声、微波辅助热水浸提对菊糖提取率、聚合度及体外抗氧化活性的影响,为寻求科学高效的菊糖加工技术途径,提高菊芋经济效益,实现菊糖产业化生产提供科学依据。
1 材料与方法
1.1材料与试剂
新鲜菊芋:江苏大丰盐土大地有限公司提供;果蔬脱衣剂:购自厦门味可多食品添加剂有限公司产品;果胶酶和纤维素酶:购自南京奥多福尼生物科技有限公司;羟自由基和超氧阴离子自由基测试试剂盒:购自南京建成生物工程研究所;所用DPPH(1,1-二苯基-2-三硝基苯肼)、苯酚、浓硫酸、酒石酸钾钠、3,5-二硝基水杨酸(均为分析纯):均购自国药集团化学试剂有限公司。
1.2仪器与设备
DK-8D型电热恒温水槽:上海精宏实验设备有限公司产品;JJ500型电子天平:常熟市双杰测试仪器厂产品;HR2096型搅拌机:飞利浦电子香港有限公司产品;SCIENTZ-ⅡD超声波细胞破碎机:宁波新芝科技股份有限公司产品;WD800G型微波炉:佛山顺德格兰仕微波炉电器有限公司产品;D-8型紫外可见分光光度计:上海奥析科学仪器有限公司产品;LXJ-ⅡB型低速大容量多管离心机:上海安亭科学仪器厂产品;Milipore超滤管:南京汉隆实验器材有限公司产品;FE-20实验室pH计:梅特勒-托利仪器有限公司产品;RE6000型旋转蒸发器:上海亚荣生化仪器厂产品。
1.3工艺流程
鲜菊芋→清洗→脱皮→蒸煮→打浆→提取→过滤→除杂→脱色→浓缩→冷冻干燥→成品
1.4操作方法
1.4.1菊芋样品预处理将新鲜菊芋洗净后沥干,浸入85℃含质量浓度1.5 g/dL的果蔬脱衣剂水溶液中静置15 min,轻微搅拌,待菊芋表皮自然脱落后取出菊芋块茎,清水冲洗,蒸煮至熟化,与水按一定比例混合后打浆,得到用于提取菊芋菊糖的无褐变反应的乳白色原料液。
1.4.2菊芋菊糖提取
1)热水浸提法称取10 g预处理过的鲜菊芋于250 mL锥形瓶中,研究料液质量体积比和提取温度、时间、次数对菊糖提取率的影响。具体方法如下:
料液比:提取时间30 min,取温度60℃,提取次数1次,试验组料液质量体积比分别为1 g∶5 mL~1 g∶30 mL,试验重复3次;
提取温度:提取时间30 min,料液质量体积比为1 g∶20 mL,提取次数1次,试验组温度分别为60、70、80、90、100℃,试验重复3次;
提取时间:取温度90℃,料液质量体积比为1 g∶20 mL,提取次数1次,试验组时间分别为30、60、90、120、150 min,试验重复3次;
提取次数:提取时间90 min,取温度90℃,料液质量体积比为1 g∶20 mL、试验组提取次数分别为第1次、第2次、第3次,试验重复3次。
在上述单因素试验基础上,选定对提取率影响较大的因素进行正交设计法,以确定菊糖最佳浸提条件。
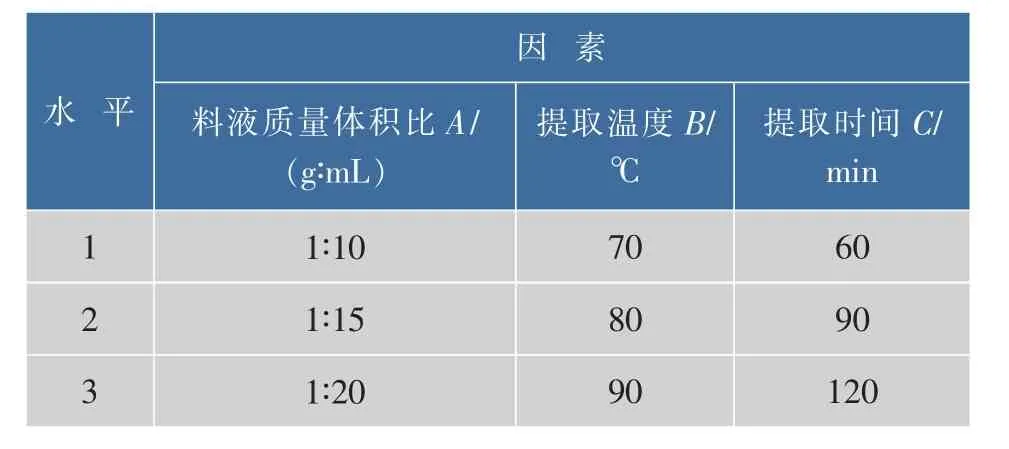
表1 正交试验因素及水平表Table 1Factors and levels of orthogonal experiment
3)超声波辅助法称取10 g预处理过的鲜菊芋于250 mL锥形瓶中,以料液质量体积比1 g∶20 mL加入蒸馏水,在超声波细胞破碎机中分别处理不同时间(5~25 min),超声输出功率为800 W,超声作用时间5 s,超声间歇时间2 s,然后按优选的热水浸提参数提取菊糖,考察超声辅助对菊糖提取效果的影响。
4)微波辅助法称取10 g预处理过的鲜菊芋于250 mL锥形瓶中,以料液质量体积比1 g∶20 mL加入蒸馏水,在微波炉中用中火功率分别处理不同时间(2~10 min),处理过程每微波1 min间歇1 min,并不断用水补齐原料液比,然后按优选的热水浸提参数提取菊糖,考察微波辅助对菊糖提取效果的影响。
1.4.3菊芋菊糖分离纯化取过滤后的菊糖提取液进行除杂处理,添加质量分数10%新鲜石灰乳调节pH值为11左右,放入70℃恒温水浴保温60 min后抽滤,滤液再用磷酸回调pH值为6.5左右,再经离心可得澄清的提取液。脱色工艺为量取上述澄清提取液100 mL置于烧杯中,加入质量分数2%高温活化处理过的活性炭粉末,搅拌均匀后于70℃恒温水浴保温60 min,冷却至室温后离心,上清液再用2层定性滤纸抽滤,以去除残留的活性炭粉末。
1.5指标测定
1.5.1总糖的测定采用苯酚-硫酸法测定菊芋汁中总糖含量。菊芋提取液经适当稀释后过滤,取滤液2 mL加入1 mL 6%的苯酚和5 mL浓硫酸,立即摇匀,在常温下放置20 min后,在490 nm下测定吸光值,最后根据标准曲线计算总糖含量。
1.5.2还原糖的测定采用3,5-二硝基水杨酸(DNS)法测定菊芋汁中还原含量。菊芋提取液经适当稀释后过滤,取滤液2 mL加入1.5 mL DNS试剂,混匀后沸水浴5 min,冷却至室温后用蒸馏水定容至25 mL,于540 nm处测定吸光值,最后根据标准曲线计算还原糖含量。
1.5.3菊芋聚合度分布测定参照文献[10~12]的原理和方法,将菊糖提取液静置过夜后离心,上清液依次通过截留分子质量1 000、5 000、3 000的超滤管进行超滤处理,离心转速为3 500 r/min,离心时间为25 min,所得截留液分别收集、浓缩,冻干,得到不同相对分子质量范围的菊芋菊糖,测定菊糖含量,以此分析菊糖的聚合度分布。
1.5.4体外抗氧化活性的测定
“我问她为什么来找我,她说在城里不认识别的律师,既然罗素青信任我,那她也只能叫我替她办这件事。她想让我帮她办理房产过户等等手续,我真的没时间,也不想跟罗瑞他们交涉,这肯定是个麻烦事,所以她就找了你。”陈律师解释道。
1)DPPH清除率的测定参照Braca[13]的方法。用无水乙醇准确配制质量分数为0.004%的DPPH溶液,4℃避光待用。将1.4.3节纯化得到的菊糖用双蒸水配制成不同质量浓度(0.5、1.0、2.0、4.0、8.0和10.0 mg/mL),各取1 mL上述多糖溶液于试管中,再加入4 mL 0.004%的DPPH溶液,混匀,避光静置30 min,无水乙醇做空白,在517 nm处测定吸光值A,重复3~5次,计算清除率E。以近似质量浓度VC作为对照,比较二者清除羟自由基能力的强弱。
2)羟自由基(·OH)清除率的测定利用Fenton反应产生羟自由基,当给予电子受体后,用Gress试剂显色,形成红色物质,其呈色与羟自由基的多少成正比关系。测定方法是将1.4.3节纯化得到的菊糖用双蒸水配制成不同质量浓度(0.5、1.0、2.0、4.0、8.0和10.0 mg/mL),按照试剂盒说明书配置好各试剂和应用液,混匀,室温放置20 min,双蒸水调零,于550 nm波长处测定各管吸光度A,重复3~5次,计算清除率E。以近似质量浓度VC作为对照,比较二者清除羟自由基能力的强弱。
3)超氧阴离子自由基(O2-·)清除率的测定模拟机体中黄嘌呤和黄嘌呤氧化酶反应系统,产生超氧阴离子自由基,加入电子传递物质及Gress显色剂,使反应系统呈现紫红色。测定方法是将1.4.3节纯化得到的菊糖用双蒸水配制成不同质量浓度(0.5、1.0、2.0、4.0、8.0和10.0 mg/mL),按照试剂盒说明书配置好各试剂和应用液,混匀,室温放置10 min,双蒸水调零,于550 nm波长处测定各管吸光度A,重复3~5次,计算清除率E。以近似质量浓度VC作为对照,比较两者清除羟自由基能力的强弱。
1.6计算方法
菊糖质量(g)=总糖质量(g)-还原糖质量(g)
菊糖提取率(%)=溶液中菊糖质量(g)/原料中菊芋质量(g)×100%
自由基清除率(%)=(A空白管-A测定管)/A空白管× 100%
2 结果与分析
2.1不同提取方法对菊糖提取率和聚合度分布的影响
2.1.1热水浸提对菊糖提取率的影响由热水浸提单因素实验结果(见表2)可知,料液质量体积比、提取温度和提取时间对菊糖的提取率影响最大,提取次数选取1次。为了了解菊糖提取的最佳工艺条件,以料液比,提取温度和提取时间为试验因素,进行3因素3水平正交试验。试验结果和极差分析见表3。
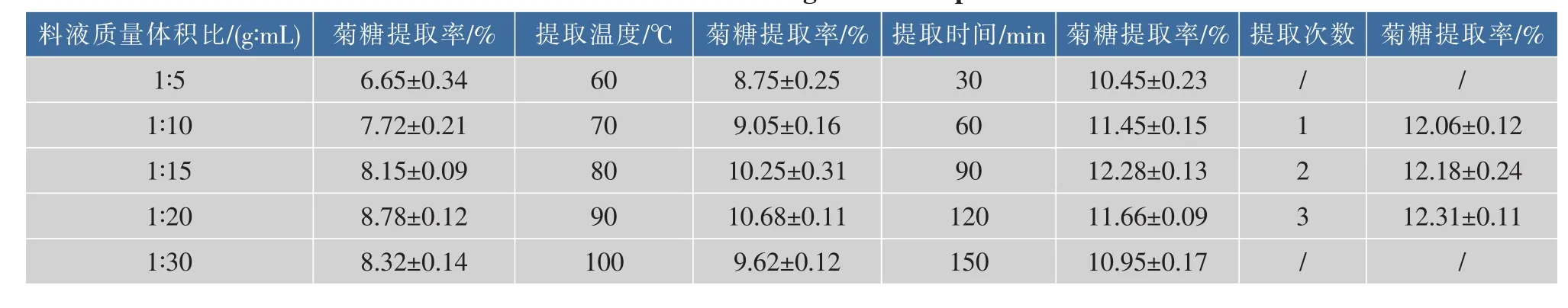
表2 单因素试验结果Table 2Results of single factor experiment
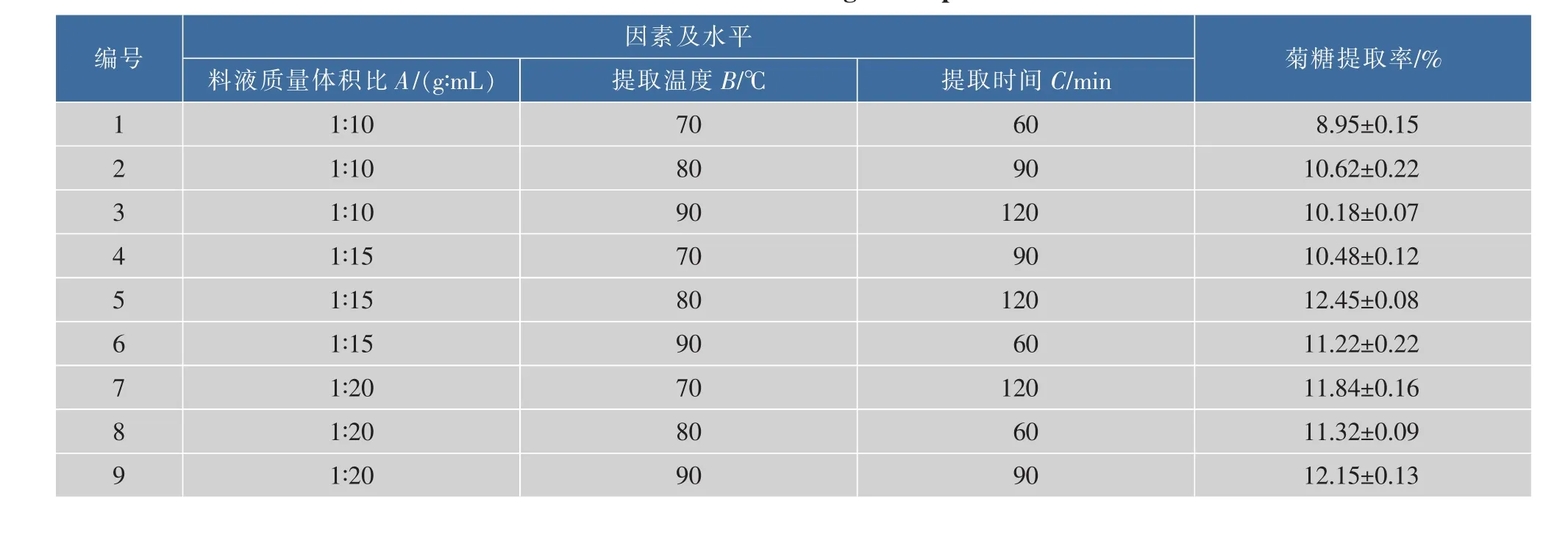
表3 正交实验结果Table 3Results of orthogonal experiment

续表3
由表3极差R可知,不同因素对菊糖提取率的影响次序为:A>B>C,即料液比>提取温度>提取时间。由K值可选出最优条件组合为A3B2C3,即菊糖热水浸提最佳工艺条件为:料液质量体积比1 g∶20 mL,提取温度80℃,提取时间120 min。经试验验证,该条件下菊糖提取率为12.84%。
2.1.2酶解辅助提取对菊糖提取率的影响酶法辅助提取主要借助酶对细胞壁结构破坏而促进多糖溶出的作用,该方式因反应条件温和、操作时间短、成本低等优势逐渐被应用于多糖的提取。作者选用不同质量分数果胶酶和纤维素酶,在自然pH(6.5)条件下对菊糖提取液先进行酶解作用,后进行热水浸提。结果由图1可知,随着酶质量分数的升高,菊糖提取率先上升后略微下降。当酶质量分数为4%时,菊糖提取率达到最高的13.15%,较热水浸提工艺并无显著提高。
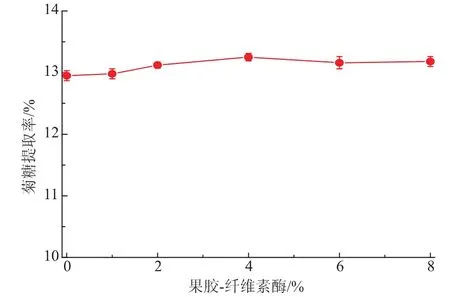
图1 酶法辅助提取对菊糖提取率的影响Fig.1Enzyme-assisted extraction on extraction ratio of inulin
2.1.3超声辅助提取对菊糖提取率的影响如图2结果显示,与热水浸提相比,菊芋经超声波处理后,菊糖得率随处理时间的延长而明显提高,20 min时达到最大值14.75%,这说明细胞在短时间内即可被超声波形成一定程度的破坏,使存在于细胞间和细胞壁的多糖释放出来。随后延长超声作用时间,菊糖的提取率反而降低,其原因一方面可能是长时间的超声剪切作用导致部分多糖的降解;另一方面细胞过释放过多的其他不溶物和黏液质进入提取液,也会影响菊糖的正常溶出。因此,选取超声时间20 min为超声辅助最优参数。

图2 超声波辅助提取对菊糖提取率的影响Fig.2Ultrasound-assisted extraction on extraction ratio of inulin
2.1.4微波辅助提取对菊糖提取率的影响从图3可知,微波作用时间对菊糖提取率有较大影响。微波处理时间为6 min时菊糖的提取率最高,达到15.35%。在处理时间为6 min以前,菊糖提取率随时间延长而逐渐升高,原因可能在于微波对细胞膜短时高效的破碎作用,菊糖溶出迅速而充分;但当时间超过6 min时,菊糖提取率趋于平缓甚至开始下降,可能是由于长时间微波处理造成环境温度过高,菊糖发生降解现象,这一现象在后续的聚合度测定中也得到了验证。因此,选取微波时间6 min为微波辅助最优参数。
2.2菊芋提取液中菊糖聚合度分布及比例
多糖的生理活性与聚合度大小有着密切的关系,相对分子质量越大,分子体积越大,越不利于跨膜障进入生物体内发挥生物学活性,相对分子质量小的多糖更容易结合活性位点,但相对分子质量过低又无法形成产生活性的聚合结构[14]。因此,除了对菊糖提取率的影响,探讨不同提取方式对菊糖聚合度的影响也至关重要。作者分析不同提取方式下得到的菊糖提取液,将它们依次通过截留相对分子质量为1 000、5 000、3 000的超滤膜,然后测定每段的菊糖的含量,以初步确定菊糖的聚合度分布。其聚合度分布情况如图4可知,与热水浸提相比,酶法辅助作用方式温和,聚合度分布基本没有变化,超声和微波辅助提取得到的聚合度30<DP<60的菊糖样品由32.5%分别下降到28.6%和16.5%,聚合度DP>60的菊糖由13.6%下降到6.8%和3.6%,而相应的低聚合度菊糖比例大幅上升,这说明作用方式相对激烈的超声和微波辅助方式下,高聚合度菊糖发生明显降解现象,平均聚合度降低。
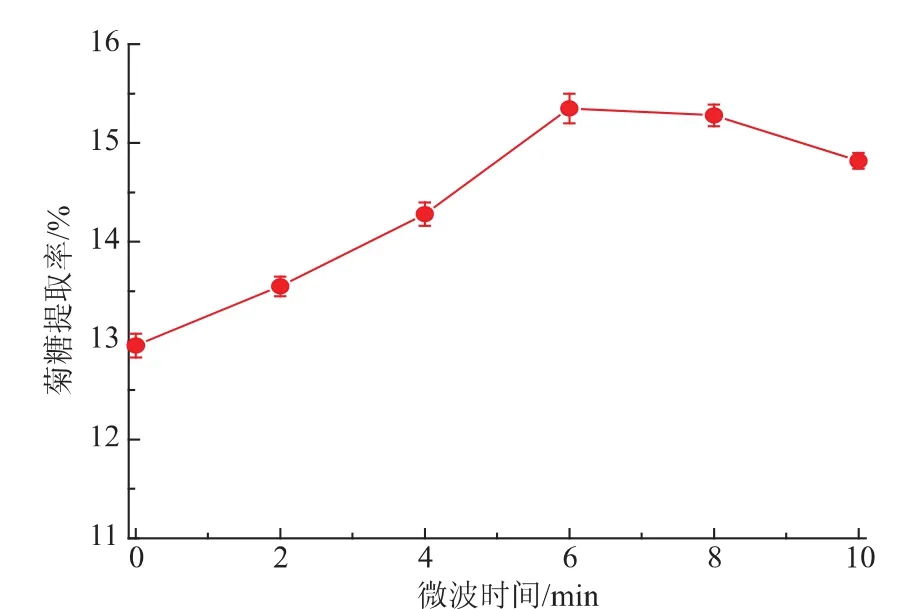
图3 微波辅助提取对菊糖提取率的影响Fig.3Microwave-assisted extraction on extraction ratio of inulin

图4 菊糖聚合度分布及比例Fig.4Polymerization degree distribution of inulin
2.3体外抗氧化活性的研究
2.3.1清除DPPH的测定结果DPPH是一种稳定的,以氮为中心的有机自由基,乙醇溶液中呈深紫色,在517 nm处有最大吸收峰。当有自由基清除剂存在时,自由基提供一个电子与DPPH自由基孤对电子配对而使吸收峰减弱或消失,其变化程度与自由基清除程度呈线性关系,据此可定量评价清除剂的清除能力[15]。如图5所示,不同提取方式得到的菊糖样品均具有显著的DPPH清除能力,在0.5~10 mg/mL的有效质量浓度范围内呈浓度依赖趋势;当样品浓度>10 mg/mL,增长趋势趋于稳定。其中,微波辅助得到的菊糖样品在5 mg/mL时清除率已达50%,清除能力明显高于其他样品。15 mg/mL时,热水浸提、酶法、超声和微波辅助得到的菊糖样品清除DPPH的能力分别是63.1%、65.4%、70.1%和88.4%。对比VC可见,菊糖各样品清除DPPH的能力低于VC。在较高质量浓度下,微波辅助得到的菊糖样品具有与VC相当的清除效果。
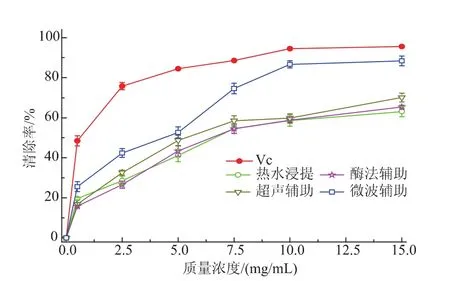
图5 菊糖清除DPPH的能力Fig.5Scavenging capacity of inulin on DPPH free radicals
2.3.2清除羟基自由基(·OH)的测定结果作为活性氧中毒性最大的自由基,·OH能够诱导生物分子如核酸、蛋白质和脂类等物质严重的氧化性损伤,·OH清除率是反映药物抗氧化作用的重要指标[16]。菊糖不同来源样品清除·OH的能力如图6所示。在0.5 mg/mL时,各菊糖样品就表现出较高清除·OH的能力,且随着浓度的增加,作用不断增强,在7.5 mg/mL后趋于平缓。从整体上看,超声和微波辅助提取的菊糖样品清除·OH的能力相对较强,而热水浸提和酶法辅助得到的菊糖样品的清除能力相当。15 mg/mL时,热水浸提、酶法、超声和微波辅助得到的菊糖样品清除·OH的能力分别是68.5%、67.1%、82.8%和88.8%,均低于同等浓度下的VC清除能力。但随着质量浓度增大,菊糖样品清除效果逐渐接近VC,尤其是微波辅助得到的菊糖样品。
2.3.3清除超氧阴离子自由基(O2-·)的测定结果生物体内氧化还原反应中,有氧会产生O2-·,在人体中含量过多会导致细胞死亡,酶失活,DNA和膜的降解,适量补充外源性清除O2-·的食物,可预防这类损伤和病变的发生和发展[17]。因此,研究菊糖清除超氧阴离子的能力是研究其抗氧化功能的重要方面。图7所示,在较低质量浓度时,菊糖对O2-·的清除能力的量效关系非常明显,样品质量浓度>7.5 mg/ mL后,随着浓度增大,清除能力不再变化。其中,超声辅助提取得到的菊糖样品清除O2-·能力略低于其他3种提取方式,其在2.5 mg/mL后清除能力就基本趋于平稳,不再上升。15 mg/mL时,热水浸提、酶法、超声和微波辅助得到的菊糖样品清除O2-·的能力分别是45.1%、46.4%、32.9%和51.4%。VC在质量浓度为2.5 mg/mL时即可完全清除溶液中的O2-·,明显高于此浓度下各菊糖样品的清除能力。
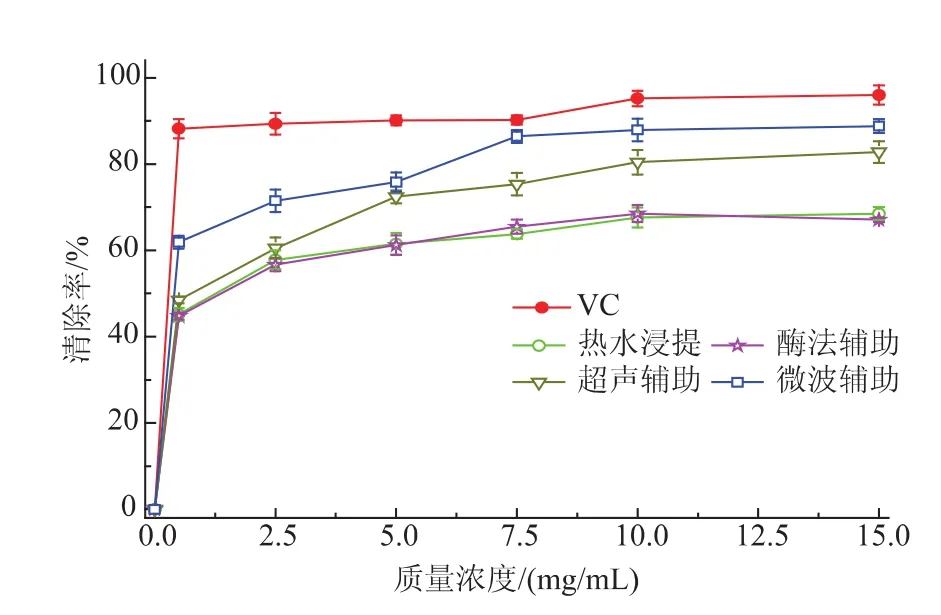
图6 菊糖清除·OH的能力Fig.6Scavenging capacity of inulin on hydroxyl free radicals

图7 菊糖清除O2-·的能力Fig.7Scavenging capacity of inulin on superoxide anion free radicals
3 讨论
提取率低下和脱色负担重是菊芋生产的技术瓶颈。作者对新鲜的菊芋进行去皮蒸煮预处理,既可有效防止菊芋褐变,减轻后续纯化负担,又有助于菊糖得率的提高,适合工业化生产需求;采用热水浸提法生产菊糖,通过单因素和正交试验确定了最佳提取条件:料液质量体积比1 g∶20 mL,提取温度80℃,提取时间120 min,菊糖得率最高为12.84%,在此最佳工艺前分别辅助酶法、超声和微波处理,菊糖得率可分别提高到13.15%、14.75%和15.35%。由此可见,在热水浸提工艺之前选用微波间歇式辅助处理,菊糖提取效率最高。
多糖具有清除多种活性氧(Reactive oxygen species,ROS)的抗氧化作用,其可能的抗氧化机理有多种解释,包括直接作用于ROS本身,作用于抗氧化酶,络合产生ROS需要的金属离子以及促进超氧化物歧化酶从细胞表面释放等[19],其中体外抗氧化机理主要是多糖直接作用于ROS达到清除效果。当前,多糖抗氧化作用的研究仅停留在表面阶段,有关抗氧化作用与多糖结构的关系至今仍不清楚,相关领域缺乏科学的依据和结论,导致寻找高活性的多糖具有较大的盲目性。现初步认为多糖生物活性与多糖的相对分子量密切相关,相对分子质量大小适当的多糖,其活性最高。菊糖是由多个果糖基以相同的糖苷键连接,且末端为一个葡萄糖残基的高聚合物。每个果糖基中都含有数目不等的活性羟基提供活泼氢。在氧化反应过程中,菊糖中每一个果糖基的活性羟基与羟自由基(·OH)的活泼氢结合生成稳定的化合物水;另一方面,多糖中的活泼氢与活泼的超氧阴离子自由基(O2-·)反应,生成稳定的化合物水;此外,菊糖还通过电子转移直接给出电子而清除自由基,如DPPH的清除,从而起到抗自由基氧化的作用[20-21]。微波辅助热水浸提提取得到的菊糖样品均聚合度最低,说明菊糖发生明显降解,由长链降解为短链或单分子的果糖,但其对自由基清除能力却最为显著,可能的原因就是低聚合度的菊糖分子链短,相对分子质量大小适中,分子间力小,更易结合活性位点,同时暴露出来更多的具有抗氧化活性的物质或基团如活性氨基和羟基,因而具有更强的抗氧化能力[22-24]。
另外,实验中提取得到的菊芋菊糖是不同聚合度果聚糖的混合物,有关不同相对分子质量(聚合度)菊糖纯品抗氧化活性的研究还未见报道,为了明确它们之间具体的构效关系,有关此方面的工作正在进一步展开。
[1]董晋军,郑璞,倪晔等.菊芋原料同步糖化发酵生产丁二酸[J].食品与生物技术学报,2008,27(5):78-82.
DONG Jinjun,ZHENG Pu,NI Ye,et al.Production of succinic acid by simultaneous saccharification and fermentation from Jerusalem artichoke[J].Journal of Food Science and Biotechnology,2008,27(5):78-82.(in Chinese)
[2]曹力强.菊芋的特征特性及栽培[J].农业科技与信息,2008(11):57.
CAO Liqiang.Characteristic and cultivation practices of Jerusalem artichoke[J].Information of Agricultural Science and Technology,2008(11):57.(in Chinese)
[3]殷洪,林学进.菊粉、低聚果糖的研究进展[J].中国食品添加剂,2008(3):97-101.
YIN Hong,LIN Xuejin.Research progress of inulin and oligofructose[J].China Food Additives,2008(3):97-101.(in Chinese)
[4]Nair K K,Kharb S,Thompkinson D K.Inulin dietary fiber with functional and health attributesa review[J].Food Reviews International,2010,26(2):189-203.
[5]Kaur N,Gupta A K.Applications of inulin and oligofructose in health and nutrition[J].Journal of Bioscience,2007,27(7):703-714.
[6]Scholz-AhrensS K E,Schaafsma G,Heuvel E G,et al.Effects of prebiotics on mineral metabolism[J].American Journal of Clinical Nutrition,2001,73(2):459-464.
[7]魏凌云,王建华,郑晓冬.响应面法优化从菊芋中浸提菊粉的工艺条件研究[J].食品科学,2008,29(10):191-194.
WEI Lingyun,WANG Jianhua,ZHENG Xiaodong.Optimization of inulin extraction process from Jerusalem artichoke tubers by response surface methodology[J].Food Science,2008,29(10):191-194.(in Chinese)
[8]熊善柏,赵山,李云捷,等.菊糖的提取与精制[J].冷饮与速冻食品工业,2001(4):1-4.
XIONG Shanbo,ZHAO Shan,LI Yunjie,et al.The extract and refinement of inulin[J].Beverage,Fast Frozen Food Industry,2001(4):1-4.(in Chinese)
[9]Wei L Y,Wang J H,Zheng X D,et al.Studies on the extracting technical conditions of inulin from Jerusalem artichoke Tubers[J]. Journal of Food Engeneering,2007,79(3):1087-1093.
[10]Kamada T,NakajimaA M,Nabetani H,et al.Availability of membrane technology for purifying and concentrating oligosaccharides[J].European Food Research and Technology,2002,214(5):435-440.
[11]王月霞,周佳栋,曹飞,等.盐碱滩涂菊芋菊糖的提取纯化及其聚合度分布[J].食品科学,2013,32(12):164-168.
WANG Yuexia,ZHOU Jiadong,CAO Fei,et al.Extraction,purification and polymerization degree distribution of inulin from Jerusalem artichoke grown in saline-alkaline soil[J].Food Science,2013,32(12):164-168.(in Chinese)
[12]Frank T M,MarinellaA B V L,Jan A D.Enrichment of higher molecular weight fractions in inulin[J].Journal of Agricultural and Food Chemistry,2004,52(12):3780-3783.
[13]Braca A,De TommasiI N,Di Bari L,et al.Antioxidant principles from Bauhinia tarapotensis[J].Journal of Natural Products,2001,64(7):892-895.
[14]谭周进,谢达平.多糖的研究进展[J].食品科技,2003(3):10-12.
TAN Zhoujin,XIE Daping.Research advancements of polysaccharomyces[J].Food Science and Technology,2003(3):10-12.(in Chinese)
[15]杨少辉,宋英今,王洁华,等.雪莲果体外抗氧化和自由基清除能力[J].食品科学,2010,31(17):166-169.
YANG Shaohui,SONG Yingjin,WANG Jiehua,et al.in vitro Antioxidant and free radical scavenging activities of Yacon(smallanthus sonchifolius)tubers[J].Food Science,2010,31(17):166-169.(in Chinese)
[16]Marklund S,MarklundD G.Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J].European Journal of Biochemistry,2005,47(3):469-474.
[17]Banerjee A,DasguptaA N,De B.In vitro study of antioxidant activity of Syzygium cumini fruit[J].Food Chemistry,2005,90(4):727-733.
[18]Singh N,Rajini P S.Free radical scavenging activity of an aqueous extract of potato peel[J].Food Chemistry,2004,85(4):611-616.
[19]俞慧红,竺巧玲,戴飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.
YU Huihong,ZHU Qiaoling,DAI Fei,et al.Advances of the antioxidative activities research of polysaccharides[J].FoodResearch and Development,2008,29(3):172-176.(in Chinese)
[20]赵琳静,宋小平,黎方雅.多糖及其衍生物抗氧化性质的研究进展[J].上海工程技术大学学报,2008,22(1):44-47.
ZHAO Linjing,SONG Xiaoping,LI Fangya.Research progress on anti-oxidation of polysaccharide and its derivatives[J]. Journal of Shanghai University of Engineering Science,2008,22(1):44-47.(in Chinese)
[21]谭榀新,叶涛,刘湘新,等.植物提取物抗氧化成分及机理研究进展[J].食品科学,2010,31(15):288-292.
TAN Pinxin,YE Tao,LIU Xiangxin,et al.Research advances in antioxidant composition of botanical extracts and their action mechanisms[J].Food Science,2010,31(15):288-292.(in Chinese)
[22]姚倩,孙涛,徐轶霞,等.壳聚糖/壳寡糖衍生物的制备及其抗氧化性能研究[J].食品与生物技术学报,2009,28(2):188-191.
YAO Qian,SUN Tao,XU Yixia,et al.Preparation of chitosan/chitosan oligosaccharide derivatives and their antioxidant activities[J].Journal of Food Science and Biotechnology,2009,28(2):188-191.(in Chinese)
[23]张力妮,张静,孙润广,等.麦冬多糖的修饰及其抗氧化活性与空间结构的研究[J].食品与生物技术学报,2014,33(1):27-33.
ZHANG Lini,ZHANG Jing,SUN Runguang,et al.Study on antioxidant activity and spatial structure of ophiopogon japonicus polysaccharide with modified[J].Journal of Food Science and Biotechnology,2014,33(1):27-33.(in Chinese)
[24]张雅利,梁花香,曹娜.提取方法对柿多糖提取率及生物活性的影响[J].食品与生物技术学报,2008,27(6):18-22.
ZHANG Yali,LIANG Huaxiang,CAO Na.Effect of extraction method on yield and bioactivities of polysaccharide from persimmonFruit[J].Journal of Food Science and Biotechnology,2008,27(6):18-22.(in Chinese)
Extraction and Polymerization Degree Distribution of Inulin from Jerusalem artichoke and Anti-Oxidation Activity Study
ZHANG Hongzhi1,MA Yanhong*1,HUANG Kaihong1,LI Yahui1,HUANG Yuling2
(1.Institute of Farm Product Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China;2. Saline Land Agricultural Science and Technology Limited Company,Dafeng 224145,China)
To compare the extraction rates,polymerization degree distribution and antioxidant properties,inulin was extracted from fresh Jerusalem artichoke via hot water,enzyme-assisted,ultrasound-assisted and microwave-assisted hot water respectively.Polymerization degree analysis of different the inulin extracts were assessed by Milipore with different molecular weight cut,and their own antioxidant activity were evaluated in vitro by radical scavenging assay such as DPPH、·OH and O2-·.The results of the experiment showed that the optimal process conditions were 1 g∶20 mL ofJerusalem artichoke and the microwave at 800 W for 6 min,before water at 80℃for 120 min,and the highest extract ratio of inulin was 15.35%in these conditions.The average degrees of inulin extracted by ultrasound-assisted and microwave-assisted technology are lower than that extracted by the traditional hot water and enzyme-assisted technology.Specifically,the polymerization degrees from 30 to 60 had decreased from 32.5%to 28.6%and 16.5%,and the polymerization degrees above 60 had decreased from 13.6%to 6.8%and 3.6%.Experimental results suggested that inulin had some antioxidant ability in vitro and there is dose-effect relation.Especially it is important to note that the antioxidant capacity of inulin varies with different extraction techniques,and the inulin sample extracted by microwave-assisted technology had relatively strong scavenging capability to reactive oxygen species.
Jerusalem artichoke,inulin,extraction,degree,anti-oxidation
TS 201.1
A
1673—1689(2015)10—1069—09
2014-10-29
江苏省农业科技自主创新资金自由探索项目(CX(14)5059);江苏省农业科技自主创新资金产业技术体系类项目(CX(12)1005);江苏省科技支撑计划(农业)(BE2014347)。
张宏志(1985—),男,山西汾阳人,工学博士,助理研究员,主要从事功能性低聚糖和多糖的研究。E-mail:zhz0731@sina.cn
马艳弘(1972—),女,山西中阳人,工学博士,副研究员,主要从事生物技术与功能食品研究。E-mail:ma_yhhyy@126.com

