Taqman探针荧光PCR检测鲨鱼源性成分
陈轩,廖秀云,陶旻,罗宝正,薄清如,沙才华,黄海超,徐海聂,杨素
(珠海出入境检验检疫局国家外来病检测重点实验室,广东珠海519015)
Taqman探针荧光PCR检测鲨鱼源性成分
陈轩,廖秀云,陶旻,罗宝正*,薄清如,沙才华,黄海超,徐海聂,杨素
(珠海出入境检验检疫局国家外来病检测重点实验室,广东珠海519015)
针对鲨鱼产品掺杂造假增多而缺乏有效鉴定技术的情况,作者根据GenBank中鲨鱼基因的线粒体DNA(mtDNA)序列,使用分子生物学软件Primer Express 2.0设计了一套特异性引物和探针,用来建立Taqman探针荧光PCR检测鲨鱼源性成分的方法。结果表明,对13份已鉴定为鲨鱼鱼翅的样品进行检测,全部出现特异性扩增曲线,阴性对照没有荧光增长。方法特异性强,对市场购买的12份鲨鱼源性样品及9份其他鱼类样品进行检测,12份鲨鱼样品均出现荧光扩增曲线,而非鲨鱼样品均未出现荧光增长;方法灵敏度较高,可检测到的最低质粒拷贝数量级为10拷贝/μL;方法快速准确,操作简便,重复性好,稳定可靠,可应用于市场上鱼翅等常见鲨鱼源性产品的真假鉴定。
鲨鱼源性成分;Taqman探针;荧光PCR;检测
鲨鱼隶属于软骨鱼纲、板鳃亚纲、鲨总目,大约包括8目35科465多种[1],是位于海洋食物链顶层的重要鱼类。以鲨鱼为原料的加工产品包括鱼翅、鲨鱼硫酸软骨素、鲨鱼肝油、鲨鱼肉等,均具备一定的药用、保健或营养价值[2,5]。近年来,由于鲨鱼产品消费趋热,鲨鱼的捕杀量常年在较高水平(73~80× 104t/year,数据来源:FAO Yearbook.Fishery and Aquaculture Statistics.2012)。在巨额经济利益的驱使下,鲨鱼产品掺杂造假的情况时有发生,尤其是鱼翅类产品造假更是屡见不鲜。目前对鲨鱼产品的研究主要集中在鲨鱼产品功能成分的提纯和生物活性研究[2-4]、鲨鱼产品对疾病的治疗和保健机理[5-10]、鲨鱼种属鉴定[11-12]等方面,而对鲨鱼产品市场所急需的鲨鱼总类成分检测与鉴定技术(非鉴定到种)的研究还较为少见,仅见郭云霞等报道了针对鲨鱼源性成分建立了PCR鉴别方法和SYBR Green实时荧光PCR方法[13-14]。为维护正常市场秩序和消费者合法权益,迫切需要开发出特异性强、灵敏度高、快速准确的鲨鱼源性成分检测鉴定方法。作者利用荧光PCR特异性强、快速灵敏、简便而不易污染等特点建立了基于Taqman探针的荧光PCR检测鲨鱼源性成分的方法。
1 材料与方法
1.1样品
13份鱼翅样品为本实验室留存样品,另外12份鲨鱼源性样品(包括4份新鲜鲨鱼和8份鱼翅样品)及9份其他鱼类样品(包括美洲鳗2份、日本鳗2份、龙头鱼1份、罗非鱼1份、池鱼1份、马鲛鱼1份、鳙鱼1份)均购自珠海海鲜及干货市场。
1.2主要试剂
DNA提取试剂盒:E.Z.N.A.TMTissue DNA Kit,美国OMEGA公司产品;TIANGEN Taq PCR Mastermix:天根生化科技(北京)有限公司产品;DNA胶回收试剂盒、质粒提取试剂盒、pMD 18-T、DNA Marker DL 2000:购自宝生物工程(大连)有限公司。
1.3主要仪器
Applied Biosystems 7500 Fast Real Time PCR System:美国ABI公司产品;Alpha Imager HP凝胶成像分析系统:美国Alpha Innotech公司产品;Sigma 3-18 K小型高速冰冻台式离心机:德国Sartorius公司产品;NanoDrop ND-1000 Spectrophotometer紫外分光光度计:美国NanoDrop Technologies公司产品。
1.4普通PCR引物及荧光PCR引物、探针的设计和合成
根据GenBank中公布的鲨鱼线粒体DNA(mtDNA)序列,利用生物学软件Clustal X比对后在高度保守区域用Primer Express 2.0分别设计了一对普通PCR引物和一套荧光PCR引物、探针,由上海辉睿生物科技有限公司合成。引物、探针序列见表1。

表1 引物和探针序列Table 1Sequences of primers and probe
1.5鱼翅样品的普通PCR扩增及种属鉴定
按照DNA提取试剂盒说明书提取样品DNA。以13份鱼翅样品DNA为模板进行普通PCR,并对PCR产物进行克隆测序。PCR反应体系为25 μL:2×Taq PCR Master mix 12.5 μL,100 μmol/L上下游引物各1.0 μL,DNA模版2.0 μL,补水至25 μL。反应程序:94℃2 min;94℃30 s,50℃1 min,72℃30 s,35个循环;72℃7 min。扩增结束后于质量浓度2 g/dL琼脂糖凝胶电泳检测,并将PCR产物测序比对,确定其种属来源。
1.6荧光PCR检测鲨鱼源性成分方法的建立
以13份鱼翅样品DNA为模板进行荧光PCR扩增。反应体系为25 μL:2×Taq PCR Master mix 12.5 μL,20 μmol/L上下游引物各1.0 μL,10 μmol/ L Taqman探针1.0 μL,DNA模版5.0 μL,补水至25 μL。反应程序:94℃2 min;94℃10 s,60℃40 s(收集荧光信号),40个循环。
1.7荧光PCR方法特异性试验
以市场购买的12份鲨鱼源性样品和9份其他鱼类样品中提取的DNA为模板,使用上述反应体系和条件进行荧光PCR扩增,验证所建立的荧光PCR方法的特异性。
1.8荧光PCR方法灵敏度试验
将荧光PCR产物电泳检测后的目的条带割胶回收,进行克隆、测序鉴定,并以此重组质粒作为阳性标准品。将重组质粒用紫外分光光度计测定质粒浓度,根据阿伏伽德罗常数换算成目的基因的拷贝数。提取阳性克隆质粒,测定浓度后,以10倍梯度稀释到10-10,对梯度稀释的样本进行荧光PCR检测。
1.9稳定性试验
以鲨鱼阳性对照为模板,使用本试验建立的方法在两个时间段各做20次重复,通过计算Ct值的变异系数验证批内及批间稳定性。
2 结果与分析
2.1鱼翅样品的普通PCR扩增及种属鉴定结果
13份鱼翅样品均被成功进行PCR扩增,产物大小约为310 bp,与预期符合(见图1)。PCR产物经克隆测序,在GenBank中比对,确认此13份鱼翅样品均为鲨鱼源性,分别来自大青鲨(4份)、犁鳍柠檬鲨(2份)、黑吻真鲨、太平洋鼠鲨、锤头双髻鲨、浅海长尾鲨、澳洲斜锯牙鲨、白边真鲨和镰状真鲨。

图1 13份鱼翅样品PCR结果Fig.1PCR Results for 13 samples of shark’s fin
2.2荧光PCR检测鲨鱼源性成分方法的建立
对已确认为鲨鱼翅的13份样品均成功进行了扩增,出现了典型的S型扩增曲线,阴性对照未见荧光增长(见图2)。反应时间较普通PCR大大缩短。

图2 13份鱼翅样品的荧光PCR结果Fig.2Fluorescent PCR results for 13 samples of shark’s fin
2.3荧光PCR方法特异性试验
所建立的方法对市场购买的12份鲨鱼源性样品(4份新鲜鲨鱼和8份鱼翅样品)可以进行特异性扩增,而属于其他种属鱼类的9份样品均未见荧光增长(见图3)。
2.4荧光PCR方法灵敏度试验
将8个浓度梯度的阳性对照进行荧光PCR反应,可检测到的最低质粒拷贝数为10拷贝/μL的数量级(见图4),即为该检测方法的灵敏度。
2.5稳定性试验
对两次试验所获得的Ct值用统计学软件SPSS 13.0分析,批内变异系数分别为1.10%和1.22%,批间变异系数为1.32%,说明20次批内重复和2次批间重复试验结果符合性较好,方法稳定(图5)。
3 结语
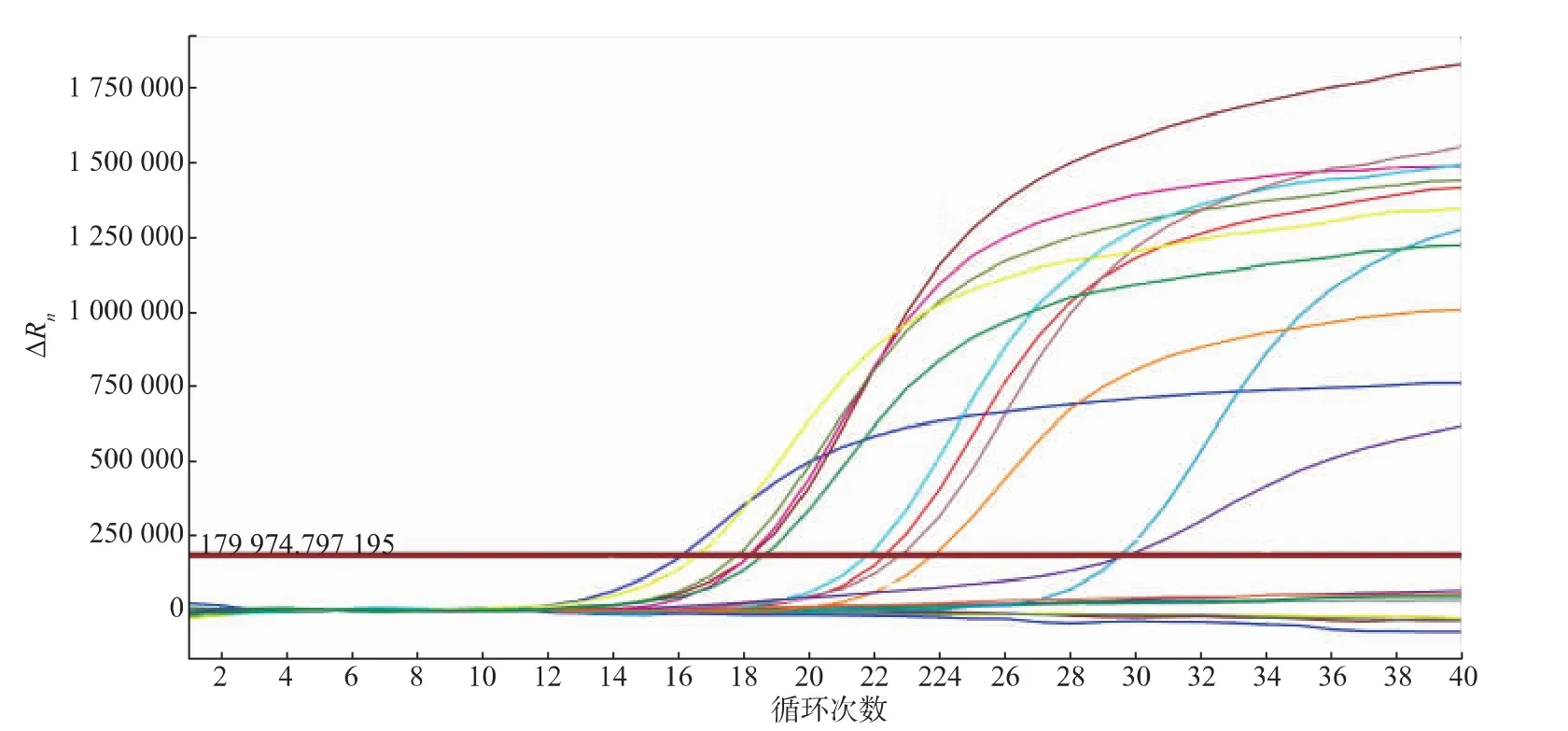
图3 荧光PCR方法特异性试验Fig.3Specificity test for the method of fluorescent PCR
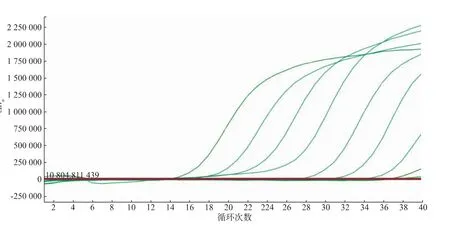
图4 荧光PCR方法灵敏度试验Fig.4Sensibility test for the method of fluorescent PCR
在现有检测鲨鱼源性成分的方法中,PCR方法具有较高的特异性和灵敏性[13],但需要电泳检测,结果判读不如实时荧光PCR方便快捷,并且开盖检测存在污染的风险。SYBR Green实时荧光PCR方法与普通PCR方法相比具有更高的灵敏度[14],但是由于SYBR Green荧光染料不仅能与靶基因的扩增产物结合,也可以与非特异性PCR产物结合,理论上存在假阳性的可能。TaqMan探针荧光PCR方法除了需一对特异性引物,还增加了一条与模版互补的特异性探针,探针上5'端和3'端分别标记了报告荧光基团和淬灭荧光基团,每进行一个特异性扩增循环释放一个分子的荧光染料,非特异性产物对检测信号没有影响。因此,与SYBR Green荧光PCR方法相比,Taqman探针荧光PCR方法具有更高的特异性[15],但其对探针的设计要求较高,需要由试验验证。作者根据GenBank中公布的鲨鱼线粒体DNA(mtDNA)序列,在其高度保守区域设计了一对特异性引物和探针,实验结果表明该引物和探针的特异性较好,对鲨鱼样品均能进行特异性扩增,并且灵敏度较高,能检测到的最低质粒拷贝数量级为10拷贝/μL。

图5 荧光RT-PCR重复性和稳定性试验Fig.5Repeatability and stability test for the method of fluorescent PCR
本方法可应用于市场上常见的鲨鱼产品的真假鉴定,如干鱼翅、泡发鱼翅、鲨鱼肉、鲨鱼硫酸软骨素初级加工品等。但对于部分深加工产品,如鲨鱼肝油等,由于经过较为复杂的加工过程,其DNA有可能被破坏或降解,应用可能受到一定的限制。
[1]Compagno,L.J.V.FAO species catalogue.Vol.4.Sharks of the world.Annotated and illustrated catalogue of shark species known to date.Part 2.Carcharhiniformes.FAO Fisheries Synopsis.(125)4,Pt.1984,2:251-655.
[2]徐凤香,高昕,李昭勇,等.鱼翅营养成分提取与定性分析[J].食品工业科技,2007,28(1):225-227.
XU Fengxiang,GAO Xin,LI Zhaoyong,et al.Extraction and analysis of nutrient components of shark fin[J].Science and Technology of Food Industry,2007,28(1):225-227.(in Chinese)
[3]杨伟兴.鲨鱼软骨中血管生成抑制因子的活性检测[J].中山大学研究生学刊:自然科学版,2001,22(1):18-21.
YANG Weixing.Using chicken chorioallantoic membrane to test the activity of angiogenesis inhibitor derived from shark cartilage[J].Journal of the Graduates Sun YAT-SEN University:Natural Sciences,2001,22(1):18-21.(in Chinese)
[4]沈先荣,吉冬梅,贾福星,等.鲨鱼软管血管生成抑制因子的纯化和功能[J].生物化学与生物物理学报,2000,32(1):43-48.
SHEN Xianrong,JI Dongmei,JIA Fuxing,et al.Purification and functional characterization of a shark cartilage factor inhibitory to angiogenesis[J].Acta Biochimica et Biophysica Sinica,2000,32(1):43-48.(in Chinese)
[5]陆焰,刘冰冰,杨文鸽.鲨鱼肉酶解物的抗氧化作用及其稳定性研究[J].食品科技,2001,36(12):135-139.
LU Yan,LIU Bingbing,YANG Wenge,et al.The anti-oxidant ability and its stability of hydrolysates obtained from shark meat[J].Food Science and Technology,2011,36(12):135-139.(in Chinese)
[6]Bradley M Wetherbee et al.Lipid composition of the liver oil of deep-sea sharks from the Chatham Rise New Zealand[J]. Comparative Biochemistry and Physiology,2000,125:511-521.
[7]Joon-Son Sim,et al.Evaluation of chondroitin sulfate in shark cartilage powder as a dietary supplement:Raw materials and finished products[J].Food Chemistry,2007,101:532-539.
[8]蒋哲,孟凡国,陈琼华,等.鲨鱼皮胶原蛋白肽的成分分析及对血管紧张素转化酶活力的影响[J].厦门大学学报:自然科学版,2008,47(6):879-882.
JIANG Zhe,MENG Fanguo,CHEN Qionghua,et al.The effects of shark skin peptides on ACE and the analysis of peptides[J]. Journal of Xiamen University:Natural Science,2008,47(6):879-882.(in Chinese)
[9]谢果凰.鲨鱼硫酸软骨素的分离提纯及其抗氧化功能的研究[D].宁波:宁波大学,2010.
[10]范秋领,黄才国,金艳,等.鲨鱼肝蛋白粗提物对大鼠肝线粒体抗氧化功能的影响[J].华东理工大学学报:自然科学版,2005,31(5):598-634.
FAN Qiuling,HUANG Caiguo,JIN Yan,et al.Effects of shark protein crude extract administration on liver mitochondrial antioxidant defenses in rats[J].Journal of East China University of Science and Technology:Natural Science Edition,2005,31(5):598-634.(in Chinese)
[11]Danillo P et al.Discrimination of shark species by simple PCR of 5S rDNA repeats[J].Genetics and Molecular Biology,2008,311:361-365.
[12]Blanco M et al.Identification of shark species in seafood products by forensically information nucleotide sequencing[J].Chemical Society,2008,56:9868-9874.
[13]郭云霞,包建强,张舒亚,等.食品中鲨鱼源性成分真实性PCR鉴别研究[J].食品工业科技,2011,32(10):421-424.
GUO Yunxia,BAO Jianqiang,ZHANG Shuya,et al.Study on authentication of shark derived material in food using PCR[J]. Science and Technology of Food Industry,2011,32(10):421-424.(in Chinese)
[14]郭云霞,张舒亚,谌鸿超,等.SYBR Green实时荧光PCR检测食品中鲨鱼源性成分真实性方法的建立[J].食品与生物技术学报,2012,31(12):1300-1306.
GUO Yunxia,ZHANG Shuya,et al.Authentication of shark derived material in food using SYBR green fluorescence real-time PCR[J].Journal of Food Science and Biotechnology,2012,31(12):1300-1306.(in Chinese)
[15]张舒亚,谌鸿超,宋青,等.食品和饲料中火鸡源性成分的实时荧光PCR检测方法[J].食品与生物技术学报,2013,32(2):207-211.
ZHANG Shuya,CHEN Hongchao,SONG Qing,et al.Identification of turkey derived material in food and feed using real-time PCR[J].Journal of Food Science and Biotechnology,2013,32(2):207-211.(in Chinese)
Detection of Shark Derived Materials by Taqman Probe Fluorescent PCR
CHEN Xuan,LIAO Xiuyun,TAO Min,LUO Baozheng*,BO Qingru,SHA Caihua,HUANG Haichao,XU Hainie,YANG Su
(State Key Quarantine Laboratory of Exotic Animal Disease,Zhuhai Entry-Exit Inspection and Quarantine Bureau,Zhuhai 519015,China)
As the problem of adulteration of shark products worsens and the effective detection method lacks,this study designed a set of primers and probe based on the mitochondria DNA sequences of shark published in GenBank using the software of Primer Express 2.0,so as to establish a method of Taqman probe fluorescent PCR for the detection of shark derived materials.Results showed that 13 samples that had been identified as shark fins all displayed the amplified curves.The specificity of this method was good with all of 12 shark derived samples indicating the existence of shark DNA and with no amplification curves for the other 9 samples not derived from shark species. The detection is sensitive and the minimum detectable plasmid copy number was 10 copies/μL.It isalso rapid and simple and the results have good repeatability and stability.Therefore,the method can be applied to the identification of shark derived products in marketplaces,such as fins.
shark derived material,Taqman probe,fluorescent PCR,detection
TS 254.7
A
1673—1689(2015)10—1083—06
2014-09-17
珠海出入境检验检疫局资助项目(ZH2013-2)。
陈轩(1983—),男,广东梅州人,理学硕士,高级兽医师,主要从事动物检验检疫与分子生物学检测研究。E-mail:65561977@qq.com
罗宝正(1975—),男,山东莱西人,理学博士,研究员,主要从事动物传染病分子诊断研究。E-mail:bzluo@163.com

