新疆第六师葡萄产区酵母菌的筛选、鉴定及发酵特性研究
郑晓吉,王顺利,史学伟,单春会*
(1.石河子大学食品学院,新疆石河子832000;2.新疆唐庭霞露酒庄有限公司,新疆五家渠831300)
新疆第六师葡萄产区酵母菌的筛选、鉴定及发酵特性研究
郑晓吉1,王顺利2,史学伟1,单春会*1
(1.石河子大学食品学院,新疆石河子832000;2.新疆唐庭霞露酒庄有限公司,新疆五家渠831300)
从新疆第六师葡萄产区葡萄表皮、葡萄园土壤和自然发酵的葡萄醪中共分离出127株酵母菌。经过初筛、复筛和综合耐受性试验,获得一株发酵性能优良的酵母菌株F12。通过糖发酵、碳氮源同化试验并结合菌落特征、细胞形态,以及5.8SrDNA ITS区基因序列测序,鉴定F12属于酿酒酵母(Saccharomyces cerevisiae)。菌株F12生长繁殖快、发酵力强,酵母絮凝性良好,对葡萄汁具有较强的适应能力,能在10~35℃、含糖>400 g/L、SO2含量>200 mg/L、乙醇体积分数>15%、含酸量>18 g/L的葡萄汁中发酵。以F12酿制的葡萄酒具有色泽纯正,葡萄酒香气浓郁,口感醇厚,酒体协调,无杂味的特点,具有典型的风格。
新疆;小产区;葡萄酒酵母;筛选;鉴定
新疆独特的气候特点决定了其在葡萄酒行业的优势。新疆地区高热、少雨、日照时间长,使酿酒葡萄着色深、糖度高,适宜于酿造优质葡萄酒。目前,新疆酿酒葡萄种植面积达32万亩,主要分布在天山北坡和焉耆盆地[1-2]。新疆天山北麓地区特定的气候适宜葡萄的生长,是新疆葡萄优良的产区。多年种植葡萄的园区有多种天然酵母与其相伴而生,经长期的自然选择和进化演变,逐渐孕育了一批适于当地环境条件和葡萄品种的优势天然酵母菌群,可从中筛分优良葡萄酒酵母,有可能酿制出具有地域特色和独特风格的产地葡萄酒[2]。
目前新疆葡萄酒生产中多采用进口的活性干酵母,葡萄酒产品产区风格特征不明显。针对新疆葡萄产区及其主栽品种,选育适合特定产区具有自主知识产权的专用酿酒酵母,突出产区葡萄酒产品风格特征,经济意义重大。作者对新疆第六师主要的葡萄产区不同品种葡萄及土壤中优势酿酒酵母进行分离、筛选和鉴定,为选育具有地域特色小产区葡萄酒专用酵母菌,提高新疆葡萄酒品质打下重要基础。
1 材料与方法
1.1材料与试剂
1.1.1主要试剂用于PCR扩增的全套试剂及扩增引物:宝生物工程大连(TaKaRa)有限公司产品;PCR产物纯化试剂盒:加拿大Bio Basic Inc.公司产品;相关生理生化试验所用试剂:天津市巴斯夫化学试剂厂及上海生工产品。
1.1.2培养基筛选培养基(YM培养基g/L):酵母浸膏3,麦芽浸膏3,蛋白胨5,葡萄糖20,琼脂20,pH 6.2,氯霉素100 mg/L。基础培养基(YEPD培养基g/L):麦芽浸膏30,蛋白胨0.5,琼脂15,pH 5.6。
1.2仪器与设备
GC/MS:美国Finnigan产品;Trace Fresco21高速冷冻离心机:美国Thermo公司产品;Tprofessional PCR仪:德国Biometra公司产品;Gel DOC XR凝胶成像系统:BioRad公司产品;170-8720icycler定量基因扩增仪:美国BioRad公司产品;WTO-80型手持折光仪:成都泰华光学有限公司产品。
1.3葡萄酒酵母菌的分离与纯化
在新疆第六师主要葡萄种植区采摘新鲜成熟的葡萄,多点采集葡萄园土样进行酵母菌分离。不同样品制成不同浓度梯度菌液,吸取100 μL涂布在YM固体培养基平板上,28℃培养2~3 d,挑取形态各异、大小不一的典型酵母菌菌落,然后再次划线接种于YM培养基上,重复纯化2~3次[3-4]。
1.4葡萄酒酵母菌的初筛和复筛
活化保藏菌种,取一环待测菌株接种于装有20 mL灭菌葡萄汁的大试管(内有杜氏发酵管),28℃下恒温培养。采用杜氏管法测试被筛菌株的发酵性能,被测指标包括发酵力、起酵时间、凝聚性、发酵气味。
将初筛菌株种子液按体积分数2%接种量接入700 mL新鲜葡萄汁(含100 mg/L的SO2),28℃恒温培养。发酵过程中每隔12 h称重一次,直到24 h失重小于0.2 g时,停止发酵,同时做空白实验。测定指标有总酸、总糖、酒精度、发酵力、凝聚性、产酒香气。
1.5葡萄酒酵母菌的耐酒精、耐SO2、耐酸试验、耐糖试验
葡萄酒酵母菌综合耐受性试验参照徐艳文[5-6]和王慧[7]的方法。
1.6优势葡萄酒酵母菌分子生物学鉴定
1.6.1酵母菌DNA的制备参考Makimura et al[8]方法提取菌株总DNA。
1.6.2酵母菌5.8S rDNA-ITS区基因的PCR扩增和系统发育树的构建采用酵母菌通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)、ITS4(5’-TCCTCCGCTTATTGATA TGC-3’)对5.8S rDNA ITS区基因片段进行PCR扩增。PCR产物用EZ-10柱纯化后根据测序结果进行Blast比对,通过Clustal X和MEGA3.1软件进行对比分析并构建系统发育树[8-12]。
1.7GC-MS测定葡萄酒挥发性成分:
GC-MS分析条件:采用DB-WAX毛细管柱(30 m×0.25 mm×0.25 μm),载气为99.999%氦气,流量1.8 mL/min。色谱柱初始温度为40℃,3 min,以6℃/min升温至80℃,再以10℃/min升温至230℃,保持10 min。质谱条件:电离方式为EV,电子能量70 eV,离子源温度为230℃,灯丝发射电流为35mA,接口温度为250℃,扫描质量范围为35~450。
2 结果与分析
2.1葡萄酒酵母菌的初筛和复筛结果
将分离得到127株酵母菌,采用杜氏管法测试菌株的发酵性能,评价指标有发酵力、起酵时间、凝聚性、发酵气味。根据试验结果从127株酵母菌中初筛出发酵性能良好的7株酵母菌,它们分别是T24、P6、F4、F9、F12、F16、F22。
初筛得到7株酵母菌,分别接入装有葡萄汁(含100 mg/L的SO2)的三角瓶中,28℃恒温培养,以总酸、总糖、酒精度、发酵力、凝聚性、产酒香气为评定指标,复筛结果见表1。可以看出:T24和F12的发酵力强、发酵残糖低、酒精度高和产酒香气良好,故选用T24和F12为复筛菌株。
2.2复筛葡萄酒酵母菌的综合耐受性能比较
葡萄酒酵母菌的综合耐受性能比较结果见图1。图1(a)为酒精耐受性试验结果,在接种16 h后测定结果显示,含乙醇体积分数6%~12%的葡萄汁已有不同程度的发酵,说明不同乙醇体积分数对F12与D254发酵延迟时间的影响不明显,但不同乙醇体积分数对发酵速率的影响十分显著,乙醇体积分数在6%~12%之间的发酵速率的影响不大,当乙醇体积分数达到12%~15%发酵速率明显降低。
图1(b)耐糖试验结果可以看出,糖溶液质量浓度在100~200 g/L期间时,T24、F12和D254其发酵速率变化不明显;含糖量在200~400 g/L时,T24和F12和D254发酵速率减缓,受到了高浓度糖液的抑制。
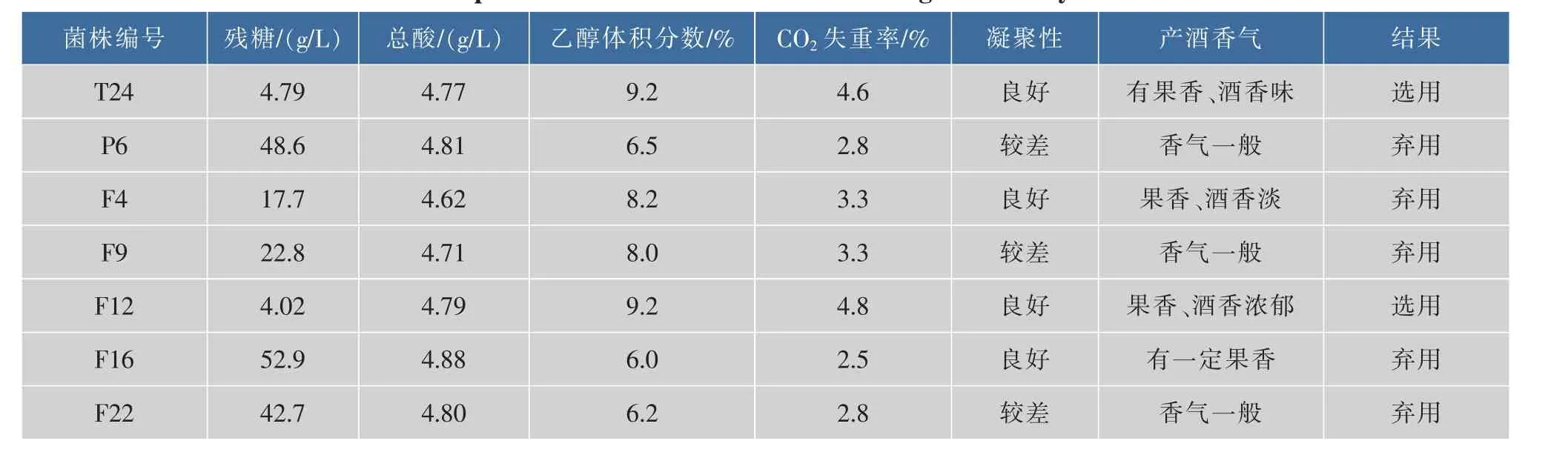
表1 酵母菌复筛结果Table 1Experimental results of further screening for seven yeast strains
从图1(c)耐酸试验结果可知:葡萄汁中的含酸量从8 g/L增加至18 g/L对发酵速率均有一定的影响。T24、F12和D254随着含酸量的增加发酵速率均逐渐减慢,在含酸量达到15 g/L时发酵速率下降趋势较快,发酵力受到了明显抑制,含酸量达到18 g/L时,T24、F12和D254发酵极为缓慢或几乎不发酵。试验说明T24、F12和D254酵母菌株均有较好的耐酸性能,对酸度的适应范围比较广。
图1(d)耐SO2试验可知:随着SO2质量浓度由50 mg/L增加至150 mg/L时,T24、F12和D254的发酵速率虽无太大变化,但均有下降的趋势。F12和D254在葡萄汁中SO2质量浓度50~100 mg/L时,发酵速率几乎无变化,当SO2质量浓度为150 mg/L时,发酵速率减慢,SO2质量浓度为200 mg/L时,发酵受到抑制,SO2质量浓度为250 mg/L时,发酵几乎不进行。T24在SO250~100mg/L时,发酵不受影响,但相对F12和D254较慢,当SO2质量浓度为150 mg/L时发酵速率明显下降,SO2质量浓度200 mg/L时发酵几乎停止,SO2质量浓度达到250 mg/L时,无发酵迹象。SO2耐受实验证明F12和D254的耐SO2能力较强,适应范围较广,T24与F12和D254相比,受抑制现象比较明显,说明T24耐SO2性能较差。
2.3优势葡萄酒酵母菌F12形态特征和生理生化特征
2.3.1优势葡萄酒酵母菌F12的菌落形态和细胞形态优势葡萄酒酵母菌F12的菌落形态和细胞形态见图2。酵母菌F12的菌落为圆形,边缘整齐,的尖峰突起,菌落为奶油色,质地光滑湿润,较厚,酒香气较浓,见图2(a)。酵母菌F12的营养细胞为圆形或卵圆形,生长方式是一端出芽生殖,无假菌丝,见图2(b)。
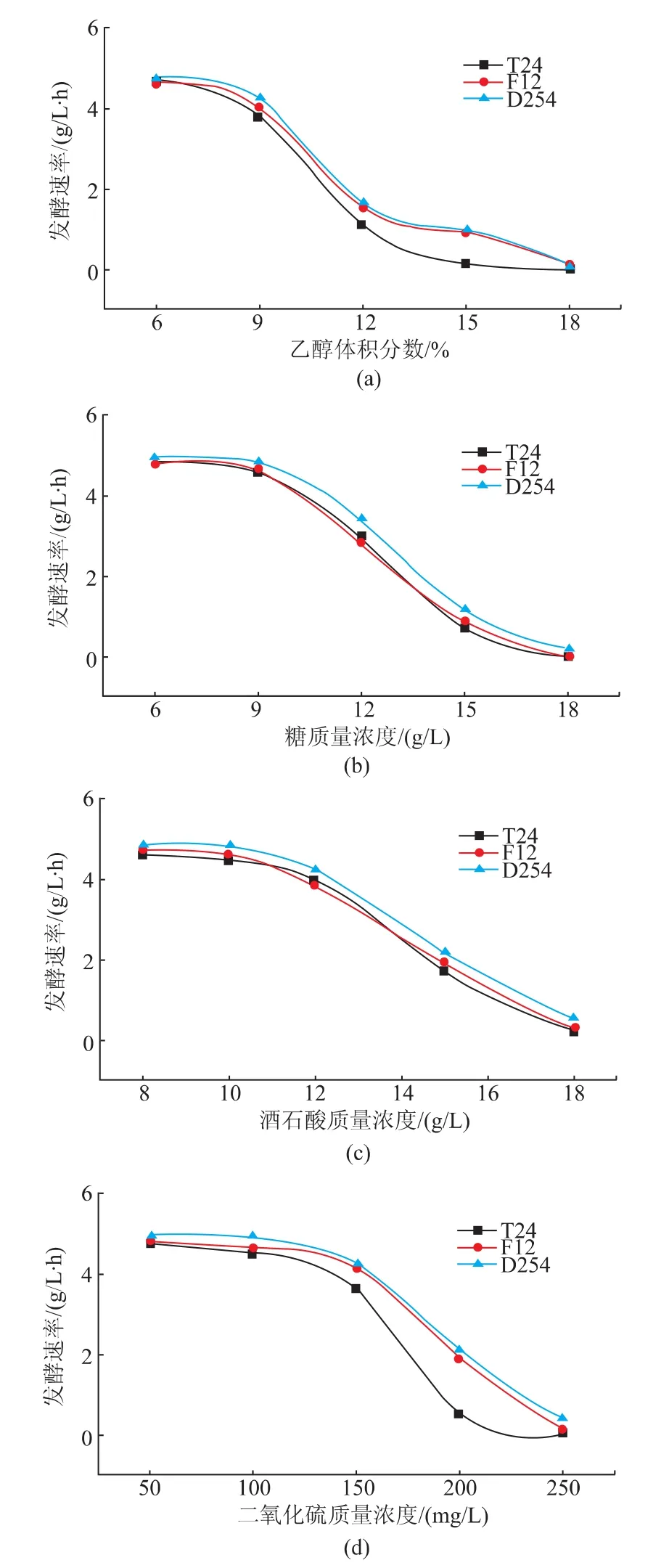
图1 T-24、F-12与对照菌株D254的综合耐受性试验结果Fig.1Results of tolerance of T24、F12 and contrast strain D254

图2 酵母菌F12菌落形态和细胞形态Fig.2Colony morphology and cell morphology of F12
2.3.2优势葡萄酒酵母菌F12生理生化试验结果同化氮源、碳源试验和酒精发酵实验结果见表2~4。
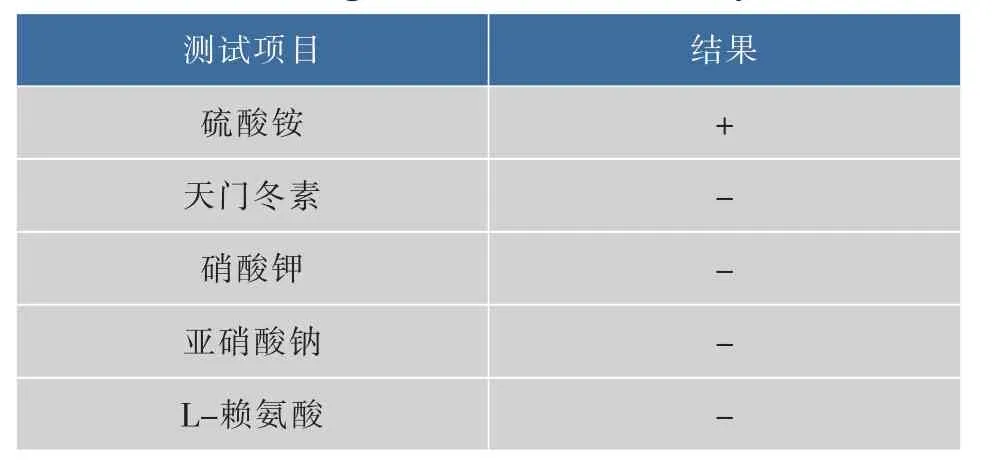
表2 优势葡萄酒酵母菌F12同化氮源试验结果Table 2Nitrogen assimilation tests of yeast F12
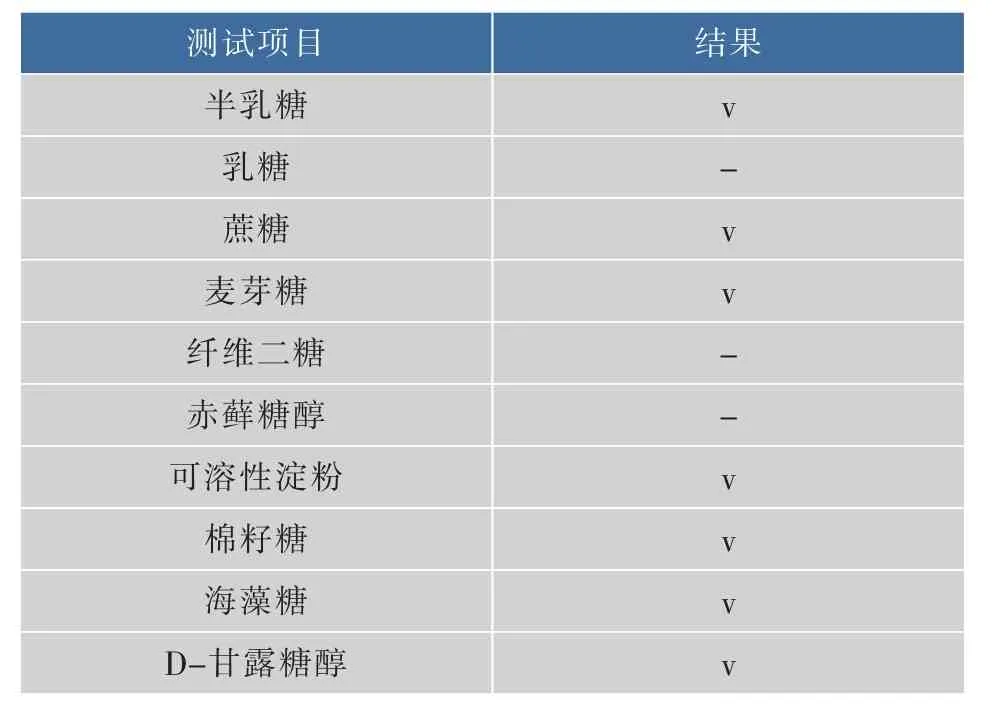
表3 优势葡萄酒酵母菌F12同化碳源试验结果Table 3Carbon assimilation tests of yeast F12
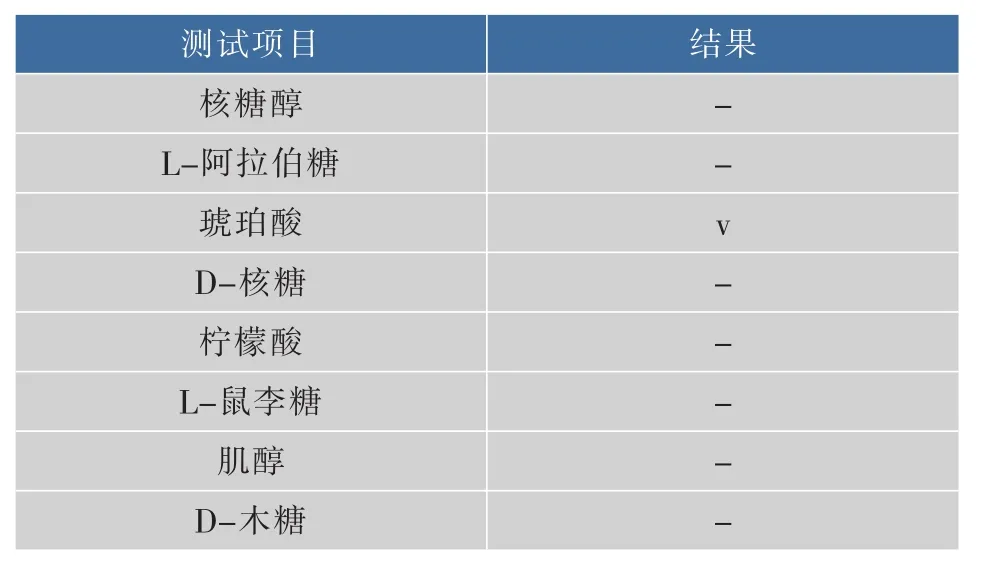
续表3
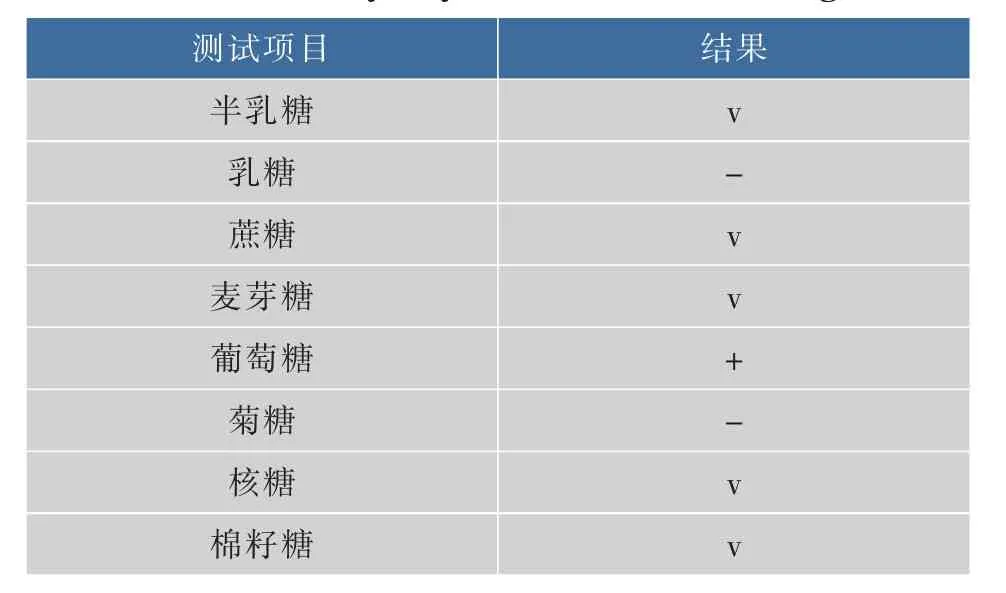
表4 优势葡萄酒酵母菌F12糖发酵试验结果Table 4Ability of yeast F12 to ferment sugars
通过对优势葡萄酒酵母菌F12的细胞形态、菌落形态、同化碳源试验、同化氮源试验和糖类发酵试验的结果与《酵母菌的特征与鉴定手册》进行对照,检索结果初步确认优势葡萄酒酵母菌F12为酵母属酿酒酵母(Saccharomyces cerevisiae)。
2.4酵母菌F12分子分类学鉴定结果
使用通用引物ITS1/ITS4对优势葡萄酒酵母菌F12的5.8S rDNA-ITS区基因序列进行PCR扩增(见图3),扩增片段大小为792bp,PCR产物测序后经Blast软件比对分析及5.8S rDNA-ITS区序列相似性计算,根据测序结果利用Blast软件从GenBank核酸序列数据库中获取对比靠前的20个相似序列,通过Clustal X和MEGA3.1软件进行对比分析并以Neighbor-Joining方法构建系统发育树,试验结果构建系统发育树,结果见图4。
结合优势葡萄酒酵母菌F12的细胞形态、菌落形态、同化碳源试验、同化氮源试验和糖类发酵试验的结果与5.8S rDNA-ITS区基因序列的分子比对结果,确定酵母菌F12为酵母属酿酒酵母(Saccharomyces cerevisiae)。

图3 酵母菌F12 5.8S rDNA-ITS区基因的PCR扩增结果Fig.3Result of the PCR-amplified in 5.8S rDNA-ITS region of yeast F12

图4 酵母菌F12与相关种的5.8S rDNA-ITS基因序列的系统发育树Fig.4Phylogenetic tree based on 5.8S rDNA ITS region partial sequence showing the relationship between yeast F12 and related members of the family yeast
2.5优势葡萄酒酵母菌F12酿酒对照试验
将优势葡萄酒酵母菌F12活化后,按体积分数0.6%的接种量接种于装有6 L新鲜葡萄浆发酵罐中,加入60 mg/L的SO228℃恒温发酵。测定指标:总酸、总糖、酒精度;感官指标有酒体香气、澄清度、滋味和酒体色泽,同时以法国葡萄酒酵母D254作为对照菌株。在完全相同的发酵条件下,F12与D254发酵性能比较见图5。
图5可知:优势葡萄酒酵母菌F12在起酵时间上与法国葡萄酒酵母D254一致,均在接种后18h开始发酵;在降糖速度方面,酵母菌F12起先略低于法国葡萄酒酵母D254,随着发酵过程的逐步推移,酵母菌F12的发酵速率逐渐与酵母菌D254相当,直至发酵结束,总之,酵母菌F12在发酵性能方面接近法国葡萄酒酵母菌D254。
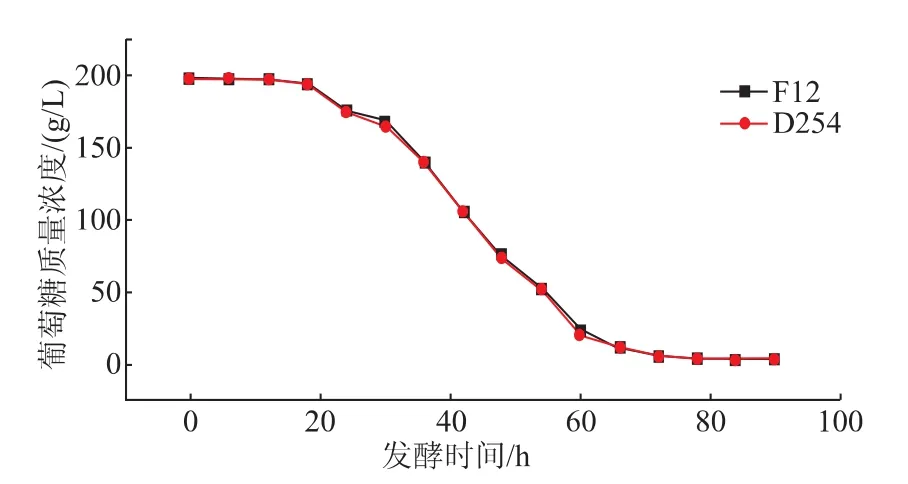
图5 优势葡萄酒酵母菌F12和D254发酵曲线Fig.5Fermentation curve of yeast F12 and yeast D254
2.6F-12和D254酿酒GC-MS挥发性成分比较
F-12和法国葡萄酒酵母D254以新疆第六师赤霞珠葡萄进行酿酒试验,GC-MS检测结果见图6。乙醛、乙酸乙酯、1-丙醇、正丁醇、1-己醇、2,3-丁二醇和丙三醇等芳香物质二者相差不大,F-12中辛酸乙酯、乙基-9-癸烯酸酯等酯类物质含量明显高于法国葡萄酒酵母D254。
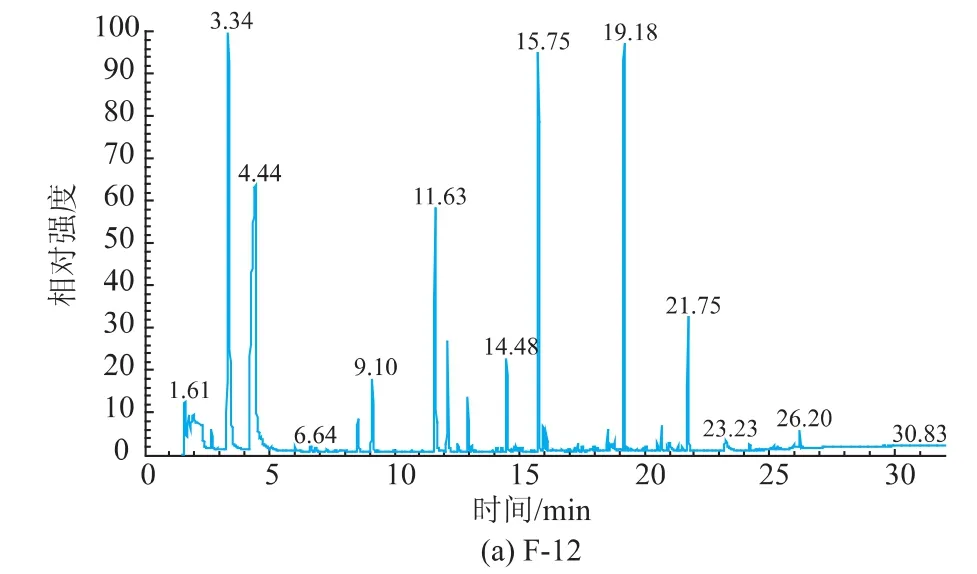
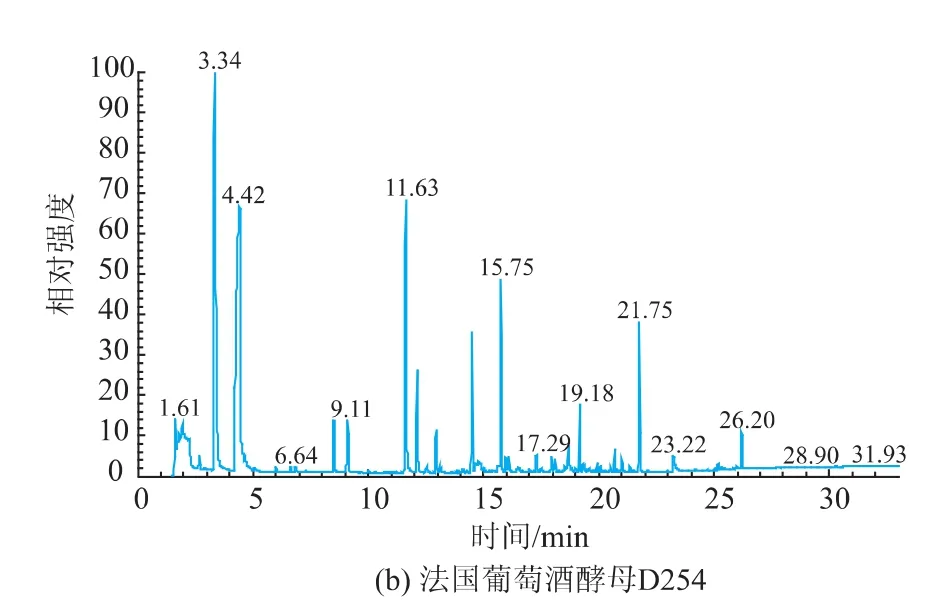
图6 F-12和法国葡萄酒酵母D254发酵果酒GC-MS挥发性成分比较Fig.6Comparison between F-12 and D254 on GC-MS results of fermented wines
在完全相同的发酵条件下,酵母菌F12与D254进行酿酒试验,葡萄酒经过6个月的陈酿后,进行理化检测和感官评价,结果见表5和表6。
由表5和表6可知:在理化指标上用酵母菌D254和F12两者所酿葡萄酒无太大差别;葡萄酒香气浓郁,口感醇厚、协调,酒味干净、无杂味。此外,以F12酿造的葡萄酒具有典型的风格。总之,在酿酒性能方面可以用于小产区葡萄酒的酿造。
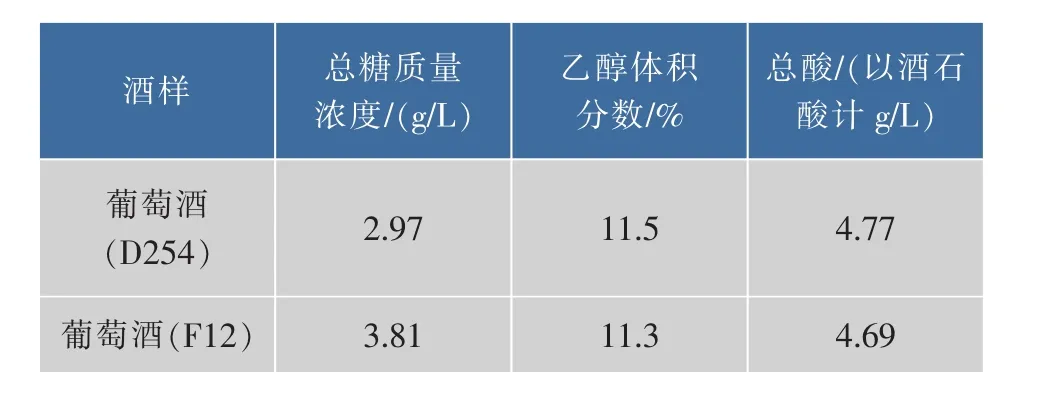
表5 葡萄酒理化分析结果Table 5Results of properties analysis to wine
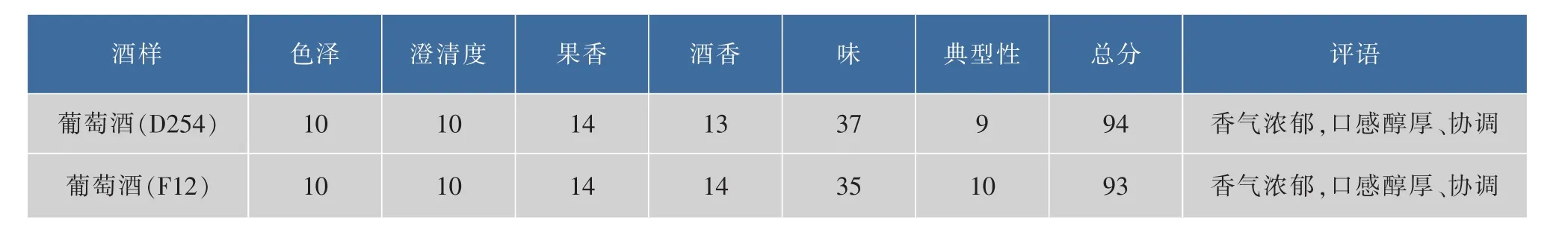
表6 葡萄酒感官检验评分表Table 6Sensory evaluation of wine
3 结语
从新疆第六师主要葡萄产区葡萄果实表皮、葡萄园土壤和自然发酵的葡萄醪中分离获得了一株发酵性能优良的酵母菌株F12。通过糖发酵、碳源同化、氮源同化试验并结合菌落特征、细胞形态,以及5.8S rDNA ITS区基因序列测序鉴定,F12属于酵母属酿酒酵母(Saccharomyces cerevisiae)。
酿酒酵母F12生长繁殖快、发酵力强,酵母絮凝性良好,对葡萄汁具有较强的适应能力,耐受性测试表明,F12菌株能在糖质量浓度>400 g/L,SO2质量浓度>200 mg/L、乙醇体积分数>15%、含酸量>18 g/L的葡萄汁中发酵,温度耐受范围为10~35℃。通过耐受性及发酵性能测试,表明菌株F12适合用于酿造葡萄酒。且发酵检测的各项指标都符合GB1037 2006的要求。
与法国葡萄酒酵母菌D254进行比较,在酿酒性能方面可以替代法国葡萄酒酵母D254。菌株F12所酿干红葡萄酒的香气成分,经GC-MS检测结果显示乙醛、1-丙醇、正丁醇、1-己醇、2,3-丁二醇和丙三醇等芳香物质二者相差不大,F-12中辛酸乙酯、乙基-9-癸烯酸酯、乙酸乙酯、乙酸异戊酯、异戊酸乙酯、乳酸乙酯、等酯类物质含量明显高于法国葡萄酒酵母D254。体现出酿酒酵母F12的优良特性。
目前,对于新疆和其他产区酵母菌的选育的研究有相关报道,但针对新疆葡萄产区及其主栽品种,选育适合第六师产区、特定葡萄品种的具有自主知识产权的专用酿酒酵母筛选未见报道,因此该试验在与新疆唐庭霞露酒庄有限公司的合作下,为生产优质具有地域特色和独特风格的产区葡萄酒,提高新疆葡萄酒产业的竞争力打下重要基础。
[1]张红梅,曹晶晶.中国葡萄酒产业的现状和趋势及可持续发展对策[J].农业现代化研究,2014,35(2):183-187.
ZHANG Hongmei,CAO Jingjing.Status and trends of Chinese wine industry and sustainable development strategy[J].Research Of Agricultural Modernization,2014,35(2):183-187.(in Chinese)
[2]李琳.关于新疆葡萄酒产业价值链提升的思考[J].新疆农业科技,2011,5:54-55.
LI Lin.Considerations of wine industry value chain in Xinjiang[J].Xinjiang Agricultural Science and Technology,2011,5:54-55.(in Chinese)
[3]冯作山.优良葡萄酒酵母的选育及发酵性能研究[D].乌鲁木齐:新疆农业大学,2002.
[4]Kreger-Van Rij.酵母菌的特征与鉴定手册[M].胡瑞卿,方善康译.青岛:青岛海洋大学出版社,1990
[5]徐艳文.甘肃地区葡萄酒相关酵母菌的分离及其分类鉴定[D].杨凌:西北农林科技大学,2007.
[6]Thais M Guimares,Danilo G Moriel,Iara P Machado,et al.,Isolation and characterization of Saccharomyces cerevisiae strains of winery interest[J].Revista Brasileirade Ciências Farmacêuticas Brazilian Journal of Pharmaceutical Sciences,2006,42(1):119-126.
[7]王慧,张立强,刘天明,等.产地葡萄酒优良酵母菌株的筛选及鉴定[J].酿酒科技,2007(9):29-34.
WANG Hui,ZHANG Liqiang,LIU Tianming,et al.Screening and identification of quality yeast strains in grape wine production area[J].Liquor Making Science and Technology,2007(9):29-34.(in Chinese)
[8]Makimura K,Murayama YS,Yamaguchi H.Detection of a wide range of medically important fungal species by polymerase chain reation(PCR)[J].Journal of Medical Microbiology,1994,40:358-364.
[9]Mannazzu I,Clementi F,Ciani M.Biodiversity and Biotechnology of Wine Yeasts[M].Kerala:Research Signpost,India,2002.
[10]Araujo S.,Ferrer A,Sulbaran de Ferrer B,et al,Yeasts isolated from fermenting juice extracted from white-wine grape varieties in Zulia state,Venezuela[J].Rev.Fac.Agron,1998,15:249-255.
[11]Nwachukwu I N,Ibekwe V I,Nwabueze R N,et al.Production of high-ethanol-yielding Saccharomyces cerevisiae of palm wine origin by protoplast fusion[J].Life Science,2008,5:64-68.
[12]诸葛健.现代发酵微生物实验技术[M].北京:化学工业出版社,2005.
Screening,Identification and Fermentation Characteristics of Yeast from the Vineyard of the Sixth Division in Xinjiang Province
ZHENGXiaoji1,WANGShunli2,SHIXuewei1,SHANChunhui/*1
(1.School of Food Sciences,Shihezi University,Shihezi 832000,China;2.Xinjiang Tangting Xialu Wine Estates Co.,Wujiaqu 831300,China)
127 strains of yeast were isolated from grape epidermis,vineyard soil and natural fermented grape mash from the vineyard of the Sixth Division in Xinjiang province.After primary screening,secondary screening and comprehensive tolerance experiment,we obtained yeast strain F12 with excellent fermentation performance.According to sugar fermentation,carbon and nitrogen sources assimilation,colony characteristics,cell morphology,and 5.8SrDNA ITS region gene sequencing,F12 was identified as Saccharomyces cerevisiae.It was found that F12,which adapted to grape juice,has a strong fermentation ability and good flocculation.F12 could ferment in grape juice with sugar content above 400 g/L,SO2concentration above 200 mg/L,alcoholic content above 15%,acid content 18 g/L with a wide temperature range of 10℃to 35℃.F12 could ferment in grape juice with sugar content above 400 g/L,SO2concentration above 200mg/L,alcoholic content above15%,acid content 18 g/L with a wide temperature range of 10℃to 35℃.The wine fermented by F12 has characteristics of pure color,full-bodied aroma,mellow taste,coordination and typical style.
Xinjiang,Small region,Saccharomyces cerevisiae,screening,identification
TS 261.11
A
1673—1689(2015)10—1107—07
2014-12-17
新疆第六师科技计划和重大科技专项项目(2015)。
郑晓吉(1982—),男,甘肃定西人,讲师,主要从事新疆特色酵母菌多样性及应用研究。E-mail:zhengxj1982@163.com
单春会(1978—),男,新疆塔城人,工学博士,副教授,主要从事新疆特色果蔬加工研究。E-mail:zhengxj229@sina.com

