黔产枫香树叶黑色素的生物活性研究
方玉梅,张萍,王毅红,谭萍,王盼,赵宗城
(六盘水师范学院,贵州水城553004)
黔产枫香树叶黑色素的生物活性研究
方玉梅,张萍,王毅红,谭萍,王盼,赵宗城
(六盘水师范学院,贵州水城553004)
采用纸片法测定其抑菌作用,并同时采用水杨酸比色法和DPPH法测定其抗氧化能力,来评价黔产枫香树叶黑色素的生物活性。结果表明:枫香树叶黑色素提取液对大肠杆菌和枯草芽孢杆菌没有抑菌作用,对金黄色葡萄球菌有抑菌作用。不同浓度的枫香叶黑色素对清除DPPH自由基和抑制·OH自由基都有明显的效果,且在一定的稀释范围内,枫香叶黑色素的浓度与DPPH自由基的清除率和·OH自由基的抑制率呈正相关。为黔产枫香叶黑色素的进一步开发利用提供参考。
枫香树;黑色素;抑菌;DPPH自由基;羟基自由基(·OH)
枫香树又名枫树,大叶枫,黑饭木(Liquidambar formosana Hance)[1]。为金缕梅科枫香属落叶乔木植物,生于海拔220 m~2 000 m之丘陵及平原或山地常绿阔叶林中。首要散布在黄河以南四川、贵州、广东、广西等地。全株都可入药,树皮、根、叶味辛,微苦,性温,气香,有祛风湿、行气、解毒、止痛的功能;果味辛,微涩、性微温,有通经活络的功效;树脂味淡,性平,有止血生肌的功效[2]。李时珍的《本草纲目》也论述了枫香树枝叶的药用功效,说它“止泄益睡,强筋益力量,久服轻身终年”。
2009年以来,我国的着色剂产业伴随着食品产业的发展而发展,国家就这一点提出了“天然、营养、多功能”的发展方针。在食品中优先使用天然色素,即起到着色,又使食品中含有天然色素的某些生理功能[3]。经过这些年的发展,我国在食用添加剂的开发、生产、使用的法规管理等方面逐步规范和完善[4]。与合成色素相比较,天然色素的最大优势是具有较高的安全性,可以更好地模仿天然物的颜色,着色色调自然,一些天然色素本身就具营养价值,还具有一定的药理作用。而在我省民间早就有食用枫香树叶黑色素的习惯,黔东南、黔南地区每年农历四月初八,常把枫香树嫩枝叶捣烂、浸汁,用其浸泡糯米,蒸出来的糯米饭乌黑发亮,味道诱人,是贵州少数民族特色食品“五色饭”的一种,经常食用能够强身健体。
我国对枫香各个部位进行了初步研究。提取研究,陈洪祖(1998)报道从枫香树叶中提取黑色素的探索,用水对枫香树叶黑色素进行浸提,并用酸碱度、温度、光对所提色素的稳定性进行初步评价[5]。辜燕飞等(2007)对海南枫香树传统食用黑色素的提取进行单因素的初步研究[6]。生物活性研究,在抗癌方面,研究者发现枫香果实中的3A-乙酰基-25-羟基齐墩果-12-烯-28-酸、马缨丹酸、白桦脂酮酸和石竹素对NFAT有强的抑制活性[7]。在抑菌方面,郑毅等发现枫香叶提取物对辣椒黑斑病病原菌有明显的抑菌作用[8]。钟有添等实验发现枫香叶对金黄色葡萄球菌、白色葡萄球菌、福氏志贺氏菌、伤寒沙门氏菌、铜绿假单胞菌、绿脓杆菌皆有较好的抗菌效果[9-10]。在止血方面,徐红权等报道,枫香叶提取物,有促进血小板黏附、聚集作用,对加快止血起到了促进作用,制成的止血纤维用于手术局部止血是其它止血方式不能替代的[11]。在抗血栓方面,枫香中桂皮酸为血栓素合成酶抑制剂,通过使血浆血栓素A2水平降低而抗血小板凝集[12]。枫香中的多种人体必须无机元素是以有机化合物或有机配合物的复杂形式存在[13],具有很好的生物活性。枫香在临床上和生产上有很好的应用价值和应用前景[14]。本课题从此基础上来对黔产枫香叶黑色素进行提取研究,为黔产枫香叶黑色素的进一步开发提供一定的实验参考。
1试验仪器与试剂
1.1主要原料及试剂
原料:枫香树叶(采于平塘县苗二河乡双江村米寅后山);
试剂:无水乙醇;蒸馏水;牛肉膏;蛋白胨;NaCl;琼脂;FeSO4·7H2O;水杨酸;过氧化氢均为市售国产分析纯。二苯代苦味酰自由基(DPPH)为Sigma公司产品。
1.2试验仪器及设备
TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;FW80型高速万能粉碎机:天津泰斯特仪器有限公司;电子天平:北京赛多利斯仪器系统有限公司;高压灭菌锅:上海宜川仪表厂;电热恒温培养箱:上海跃进医疗器械厂;超净工作台:上海博讯实业有限公司医疗设备厂。
2方法
2.1原材料的前处理及提取[15-16]
将采回来的枫香叶洗净置于30℃的恒温干燥箱里烘10 h,用粉碎机将其粉碎成粉末,过100目筛,称取枫香树叶粉末2 g,加80 mL 40%乙醇放到60℃的水浴锅中浸提6 h。取出,滤纸过滤,滤液(提取原液)放于阴暗处保存。
原液的稀释:
在10 mL容量瓶中加0.4 mL提取原液和9.6 mL 40%乙醇,稀释倍数为25倍;
在10 mL容量瓶中加0.8 mL提取原液和9.2 mL 40%乙醇,稀释倍数为12.5倍;
在10 mL容量瓶中加1.2 mL提取原液和8.8 mL 40%乙醇,稀释倍数为8.33倍;
在10 mL容量瓶中加1.6 mL提取原液和8.4 mL 40%乙醇,稀释倍数为6.25倍;
在10 mL容量瓶中加2.0 mL提取原液和8.0 mL 40%乙醇,稀释倍数为5倍;
将上述稀释液置于阴暗处保存待用。
2.2枫香叶黑色素对细菌的抑制
首先配制好适宜大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的培养基,即牛肉膏蛋白胨培养基[17],配方为:牛肉膏0.5 g、蛋白胨1 g、氯化钠0.5 g、琼脂2 g、蒸馏水100 mL、pH 7.0~7.2、灭菌1.05 kg/cm2,22 min。将大肠杆菌、金黄色葡萄球菌[18]、枯草芽孢杆菌从保藏状态恢复到室温状态。然后在超净工作台上按规范操作将上述菌种分别接种到培养基中,放到35℃恒温箱中培养,挑选培养基中茁壮的菌落,继续接种培养,重复此步骤2次~3次,得到生长良好的菌落(备用)。
在无菌操作室中将剪好并灭菌的滤纸片放入黑色素提取液和无菌水中,各9片(防止操作失误,可多放),浸泡1 h。把已活化的金黄色葡萄球菌接种到已经倒好的培养皿中央,接种4皿,在第一、二皿上放入泡有黑色素的滤纸片,每皿一片,覆盖接种菌株,第三皿中放入泡有无菌水的,第四组作对照。按上述步骤将大肠杆菌、枯草芽孢杆菌接入,放置于35℃恒温箱中培养。
2.3枫香叶黑色素对DPPH自由基的清除[19-21]
DPPH溶液的配制:用分析天平精确称取44 mg DPPH,并用水乙醇溶解定容于100mL容量瓶中,避光放入冰箱保鲜层保存。用时取配好的DPPH溶液1mL用无水乙醇稀释100 mL,此时DPPH浓度为120 μmol/L。
样液:用移液枪取0.1 mL枫香叶黑色素提取液与3 mL 120 μmol/L的DPPH溶液加入同一支比色管中,摇匀,在黑暗中放置30min,无水乙醇作空白,在517 nm波长处测定其吸光度Ai。
对照:用移液枪取0.1 mL无水乙醇与3 mL 120 mol/L DPPH溶液加入同一比色管中,摇匀,在黑暗中放置30 min,以无水乙醇作为空白,在517 nm测定其吸光度Ac。
用以下公式计算清除率。

式中:Ac为0.1 mL无水乙醇+3.0 mL DPPH溶液的吸光度;Ai为0.1 mL待测液+3.0 mL DPPH溶液的吸光度。由公式计算清除率,清除率越大抗氧化能力就越强。
2.4枫香叶黑色素对·OH的抑制率[22]
按照Smirnof(1989)的方法,通过利用H2O2与FeSO4混合产生·OH自由基,在体系内加入水杨酸捕捉·OH,并产生有色物质,该种物质在510 nm下有最大吸光值。
反应体系:分别在比色管中依次加入2 mmol/L FeSO45 mL,6 mmol/L H2O25 mL,6 mmol/L水杨酸-乙醇15 mL,于37℃水浴锅中保温15 min取出,并以超纯水作为参比,510 nm下测该溶液吸光度(A0),然后在该比色管中加入1 mL被测定样品,摇均匀,水浴37℃水浴锅中保温15 min后取出,并以超纯水作为参比,510 nm下测该溶液吸光度(Ax)。
由于色素本身可能存在吸收光值,所以我们做一组对照实验:在比色管中依次加入2mmol/LFeSO45mL,超纯水5 mL,6 mmol/L水杨酸-乙醇15 mL,放入37℃水浴锅中保温15 min,然后在该比色管中加入1 mL被测定样品,摇均匀,水浴37℃水浴锅中保温15 min后取出,并以超纯水为参比,510 nm下测该溶液吸光度(Ax0)。
按下面公式计算抑制率:

式中:A0为用蒸馏水代替样品的对照值;Ax为加样后的吸光度;Ax0为样品本身的本底值。
3结果与分析
3.1枫香叶黑色素对细菌的抑制
枫香叶黑色素对金黄色葡萄球菌的抑菌效果见图1。
图1中①无菌水对照培养皿和②空白对照培养皿金黄色葡萄球菌长势良好,说明蘸无菌水的纸片对金黄色葡萄球菌的生长无较大的影响,③黑色素样品培养皿中加入蘸有枫香叶黑色素的纸片进行培养,最终没有培养出现金黄色葡萄球菌,说明枫香叶黑色素对金黄色葡萄球菌的生长有较好的抑制作用。

图1 枫香叶黑色素对金黄色葡萄球菌的抑制图片Fig.1Maple geranyl melanin images on staphylococcus aureus
枫香叶黑色素对大肠杆菌的抑菌效果见图2。
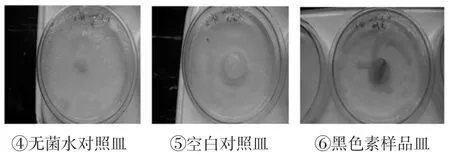
图2 枫香叶黑色素对大肠杆菌的抑制图片Fig.2Maple geranyl melanin on inhibition of e.Coli
图2中④无菌水对照培养皿、⑤空白对照培养皿大肠杆菌长势良好,说明蘸有无菌水的纸片对大肠杆菌的生长无较大的影响,⑥黑色素样品培养皿中加入蘸有枫香叶黑色素的纸片进行培养,大肠杆菌的长势很好,说明枫香叶黑色素对大肠杆菌生长无影响。
枫香叶黑色素对枯草芽孢杆菌的抑菌效果见图3。

图3 枫香叶黑色素对枯草芽孢杆菌的抑制图片Fig.3Maple geranyl inhibition of melanin to bacillus subtilis images
图3中⑦无菌水对照培养皿和⑧空白对照培养皿枯草芽孢杆菌长势良好,说明蘸有无菌水的纸片对枯草芽孢杆菌的生长无较大的影响,⑨黑色素样品培养皿中加入蘸有枫香叶黑色素的纸片进行培养,枯草芽孢杆菌的长势很好,说明枫香叶黑色素对枯草芽孢杆菌生长无影响。
综上所述,在料液比为1∶40,40%乙醇,温度为60℃,时间为6 h的条件下提取出来的枫香树黑色素提取液对大肠杆菌和枯草芽孢杆菌没有抑制作用,对金黄色葡萄球菌有较好抑菌作用。
3.2枫香叶黑色素对DPPH自由基的清除率
由于DPPH在有机溶剂中是一种比较稳定的自由基,呈紫色,而且在517 nm处有强吸收光值,并在有自由基清除剂存在时,DPPH的孤电子被配对,溶液颜色变浅,在517 nm波长处的吸光度也变小,而且这种颜色变浅的程度与配对的电子数成一定化学计量关系。因此,可以通过在517 nm波长处吸光度的测定来评价该色素对DPPH自由基的清除率。
取已稀释好的枫香叶黑色素提取液0.1 mL,测量其对DPPH自由基的清除率,测得Ac=0.732,根据公式清除率(%)=[(Ac-Ai)/Ac]×100%计算清除率,其结果见表1和图4。
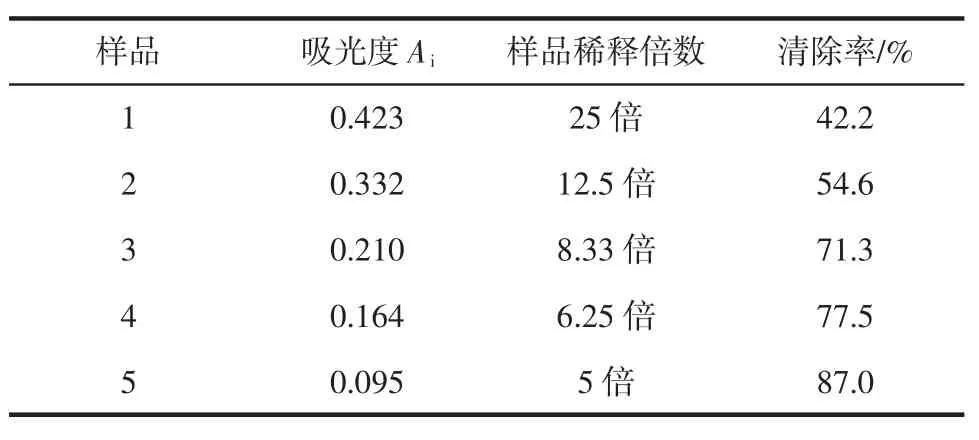
表1 枫香叶黑色素对DPPH自由基的清除率Table 1Maple geranyl melanin on DPPH free radical clearance

图4 枫香叶黑色素对DPPH自由基的清除率折线图Fig.4Maple geranyl melanin on DPPH free radical clearance line chart
由表1和图4可知,枫香叶黑色素提取液对DPPH具有较好的清除作用,且该提取液在稀释倍数为25倍原液到5倍原液的稀释范围内,枫香叶黑色素提取液的浓度与DPPH自由基清除效果呈正相关,在稀释5倍时,清除效果最好,达到87.0%。
3.3枫香叶黑色素对·OH抑制作用的效果
取已稀释好的枫香叶黑色素提取液,测量其对·OH抑制作用,根据公式抑制率(%)=[A0-(Ax-Ax0)]/A0× 100%计算抑制率,其结果见表2和图5。

表2 枫香叶黑色素对·OH抑制作用的效果Table 2Maple geranyl melanin of·OH inhibition effect
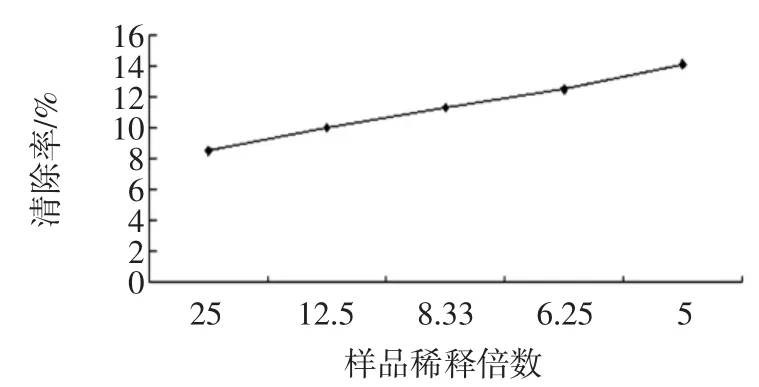
图5 枫香叶黑色素对·OH抑制作用的效果Fig.5Maple geranyl melanin of·OH inhibition effect
从表2和图5可以看出枫香叶黑色素提取液对羟基自由基也有抑制作用,且稀释倍数在25倍原液至5倍原液的稀释范围内,是随着浓度的增大,抑制率也增大,呈正相关,当稀释倍数在5倍时,抑制率达到最大且为14.1%。
4讨论
随着社会的成长和科技的前进,消费者对纯自然食物的乐趣日趋增添,天然色素在市场上的份额也敏捷增添。天然色素不但可以赋予食物所需的色彩,并且有一些还具有多种生物活性。所以研究天然色素的生物活性,可以代替合成色素作为食物添加剂。枫香叶黑色素作为天然色素,我省民间早就有食用枫香树叶黑色素的风俗,在黔东南、黔南地域每一年夏历四月初八,常把枫香树嫩枝叶捣烂、浸汁,用其浸泡糯米,蒸出来的糯米饭黝黑发亮,味道醒觉,是贵州少数民族特色食物“五色饭”的一种。常常食用可以强体健身。
由于天然色素的优点发展空间巨大,为了进一步开发黔产枫香叶这一植物资源,本文就枫香叶黑色素的生物活性进行了三方面的研究,其结果表明,枫香叶黑色素在抑菌方面对金黄色葡萄球菌有很好的抑菌效果。枫香叶黑色素对清除DPPH自由基和抑制·OH都有明显的效果,且在一定范围内,随着浓度的增大,枫香叶黑色素提取液对DPPH自由基的清除和其对·OH的抑制均程正相关。
[1]陈德昌.现代实用本草(中册)[M].北京:人民卫生出版社,2000:404
[2]江苏新医学院.中药大辞典(上册)[M].上海:上海人民出版社,1977:1261
[3]施跃峰.食用天然色素的应用与开发动向[J].今日科技,1994(9): 4-5
[4]余焕玲,杨参,阚建全.食品中食用天然色素的作用[J].广州食品工业科技,2001,17(3):63-65
[5]陈祖洪.从枫香树叶中提取黑色素的探索[J].林产化工通讯,1998(1):20-21
[6]辜燕飞,黄澜,何孟雄,等.海南枫香传统食用黑色素初步研究[J].品工业科技,2007,17(8):86-87
[7]王立青,江荣高.枫香树中对激活的T-细胞核因子具抑制活性的齐墩果烷型三萜类化合物[J].国外医药植物药分册,2005,29(3):119
[8]郑毅,刘宁芳,肖伟洪,等.枫香叶提取物对辣椒黑斑病菌防效作用的研究[J].江西农业大学学报,2005,21(1):96-98
[9]钟有添,王小丽,马廉兰.枫香树叶抗菌活性研究[J].时珍国医国药,2007,18(7):1693-1694
[10]钟有添,黄真,张瑞其,等.枫香树叶对金黄色葡萄球菌和绿脓杆菌抑菌作用的观察[J].赣南医学院学报,2007,27(2):169-170
[11]徐红权,尹波,李毅勇,等.新型生物医用材料止血纤维的制备与应用研究[J].上海生物医学工程,2001,22(2):47-49
[12]李蓓,车镇涛,郭济贤.胶束电动毛细管电泳色谱法测定苏合香和枫香脂中总桂皮酸的含量[J].上海医科大学学报,1999,26(5): 380-381
[13]谢跃生,郑小军,郑丽蓉.枫香树叶中某些水溶性微量元素的分析[J].广西师范学院学报,2000,17(3):5-7
[14]刘志林,刘惠.枫香成分及其生物学活性研究进展[J].西北药学杂志,2009,24(6):513-515
[15]陈小原.月见草花黄色素提取工艺研究[J].吉首大学学报,2001,10(3):152-255
[16]朱笃.金鸡菊黄色素提取工艺研究[J].江西师范大学学报,2005,29(4):49-57
[17]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:250
[18]胡东良,林雁春,刘佩红.乳及乳制品中金黄色我葡萄球菌的分布及其理化特性研究[J].食品科学,1996,17(1):69-73
[19]方允中,郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002
[20]张燕平.天然蜂胶对自由基的清除作用[J].食品与发酵工业,2002,28(1):48-52
[21]谭萍,方玉梅,张春生,等.苦荞种子黄酮类化合物清除DPPH自由基的作用[J].食品研究与开发,2008(12):20-23
[22]汪河滨,白红进,王金磊,等.黑果枸杞色素清除自由基活性的研究[J].食品研究与开发,2006(11):8-10
Study on Biological Activity of Melanin from Leaves of Guizhou Liquidambar Formosana Hance
FANG Yu-mei,ZHANG Ping,WANG Yi-hong,TAN Ping,WANG Pan,ZHAO Zong-cheng
(Liu Panshui Normal College,Shuicheng 553004,Guizhou,China)
The experimental determination of the antimicrobial effected by slip method,and the antioxidantability by salicylic acid colorimetric method and DPPH method,to evaluate the biological activity of melanin from leaves of Guizhou Liquidambar formosana Hance.The results showed that:the melanin from leaves of Guizhou Liquidambar formosana Hance had no inhibitory effect on Escherichia coli and Bacillus subtilis,had bacteriostasis to Staphylococcus aureus.Different concentrations of melanin fromleaves of Guizhou Liquidambar formosana Hance had obvious effect scavenging rate of DPPH free radical and inhibition rate of·OH free radical.And in a certain range of dilution,scavenging rate of DPPH free radical and inhibition rate of·OH free radical,was positively related to concentration of melanin from leaves of Guizhou Liquidambar formosana Hance.To provide basis for further development and utilization of melanin from leaves of Guizhou Liquidambar formosana Hance.
Liquidambar formosana Hance;melanin;bacteriostasis;DPPH free radical;·OH free radical
10.3969/j.issn.1005-6521.2015.14.010
2014-06-06
方玉梅(1982—),女(布依),副教授,硕士,研究方向:植物生理与微生物学。

