尿素包合分离核桃油中亚油酸工艺优化
翟元春,张润光,封斌奎,杜西民,胡 菡,张有林,*
(1.陕西师范大学食品工程与营养科学学院,陕西西安710119;2.陕西大统生态产业开发有限公司,陕西西安710065)
尿素包合分离核桃油中亚油酸工艺优化
翟元春1,张润光1,封斌奎2,杜西民2,胡菡1,张有林1,*
(1.陕西师范大学食品工程与营养科学学院,陕西西安710119;2.陕西大统生态产业开发有限公司,陕西西安710065)
对尿素包合分离核桃油中亚油酸的工艺进行了优化,在单因素实验基础上,利用响应面法优化包合温度(℃)、包合时间(h)、m1(混合脂肪酸)∶m2(尿素)、V(95%乙醇)∶m2(尿素)四个因素对亚油酸纯度和得率的影响。结果表明尿素包合核桃油中亚油酸最佳工艺参数为:包合温度-10℃、包合时间24h、m1(混合脂肪酸)∶m2(尿素)为0.3、V(95%乙醇)∶m2(尿素)为4。在此条件下,经过一次尿素包合,亚油酸的纯度可由原来的52.1%上升到80.20%。
核桃油,尿素包合,亚油酸
核桃(Juglans regia L),属胡桃科落叶乔木,适应性强,种植面积广泛,是我国重要的木本油料植物。核桃仁中油脂含量高达60%~70%,其油脂中油酸、亚油酸、亚麻酸等不饱和脂肪酸高达90%以上,具有重要的生理作用和药用价值[1-3],尤其亚油酸有助于降低人体内血清胆固醇含量,使机体高密度脂蛋白胆固醇(HDL-C)升高,减少脂质在血管壁上的沉积,防止动脉血栓的形成,使血管壁功能得到提高和完善[4]。从核桃油中分离和纯化亚油酸,对生产具有保健功能的油脂具有重要意义。
目前国内纯化不饱和脂肪酸的方法主要有:尿素包合法[5]、银离子配位法、超临界流体萃取法[6]、冷冻结晶法[7]、分子蒸馏法[8]、色谱柱法[9]等,其中尿素包合法由于其设备相对简单,生产成本低,操作方便,在分离植物油中饱和脂肪酸和不饱和脂肪酸方面备受青睐。尿素本身具有充实的四方晶系,当其在有机溶剂中遇到脂肪族化合物时,尿素分子间会通过强大的氢键力以右旋方式在有机物分子的周围沿棱柱边螺旋上升,形成宽大的六方晶体。直链饱和脂肪酸因其分子能自由旋转,位置取向较多,故最易与尿素形成稳定包合物,而不饱和脂肪酸中的双键限制分子旋转,造成空间位阻大,不易被包合,从而可得到较高纯度的多不饱和脂肪酸[10-11]。国内外多次使用尿素包合法分离纯化动植物油中多不饱和脂肪酸及其甲酯,但在核桃油方面应用较少,本实验探究了尿素包合反应中几个主要影响因素,采用响应面法研究各因素对亚油酸纯度及得率的影响,为工业化生产高级核桃保健油提供技术方法。
1 材料与方法
1.1材料与仪器
供试核桃品种为香菱,由西安市核桃种质资源圃提供;核桃油由香菱核桃品种取仁采用冷榨法制得;尿素、无水硫酸钠、95%乙醇、石油醚(30~60℃)、甲醇、硫酸、氢氧化钾、盐酸等均为分析纯,由天津市天力化学试剂有限公司提供;异辛烷为色谱纯;棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸混合甲酯标准品由美国Sigma公司提供,纯度>99.6%。
气相色谱仪(TRACE2000,ThermoFisher Scientific,USA)配备火焰离子化检测器(Flame Ionization Detector,FID)美国菲尼根公司;JB-3定时恒温磁力搅拌器上海雷磁新泾仪器有限公司;RE-52旋转式蒸发器上海安亭实验仪器有限公司。
1.2实验方法
1.2.1脂肪酸混合液制备参考文献[12]中的方法,称取50g核桃油于烧瓶中,加入200mL 4%的氢氧化钾-95%乙醇溶液,用磁力搅拌器缓慢搅拌升温至75℃,皂化回流2h至皂化完全。加入一定量温水,继续搅拌30min使其皂化物充分溶解,在上述反应液中缓慢加入20%的盐酸调节pH约为2,继续恒温搅拌15min,分液漏斗分出油层,加入适量石油醚溶解,并用温水洗涤有机层至中性,加入适量无水硫酸钠脱水,过滤,40℃旋转蒸发除去有机溶剂,得脂肪酸混合液,称取重量。
1.2.2尿素包合法纯化核桃油中亚油酸参考文献[12]中方法稍加修改,将95%乙醇与尿素按照一定比例加入烧瓶中,用磁力搅拌器缓慢搅拌升温至65℃,待尿素全部溶解后,加入一定量脂肪酸混合液,水浴回流40min,冷却至室温后转入低温包合。取出后迅速减压抽滤,分离出滤液和尿素结晶物,将滤液旋转蒸发除去乙醇,用40℃温水分别溶解滤液剩余物及尿素结晶物,并用20%的盐酸调节pH约为2,分别转移至分液漏斗中,加入石油醚,水洗至中性,加入无水硫酸钠脱水,旋转蒸发,即可得到分离后的不饱和脂肪酸,称取重量。
亚油酸得率(%)=(纯化的亚油酸质量/混合脂肪酸质量)×100
1.2.3亚油酸纯度测定
1.2.3.1脂肪酸甲酯的制备参考文献[13]中的方法,取脂肪酸样品0.1g于烧瓶中,向其中加入2mL 1%硫酸-甲醇溶液,于70℃水浴锅中甲酯化30min。给经甲酯化的脂肪酸样品中加入2mL色谱纯异辛烷,倒入适量蒸馏水至瓶颈处,静止分层,取异辛烷层进行气相色谱分析。
1.2.3.2脂肪酸含量测定方法GC分析条件:HPINNOWAX石英毛细管色谱柱(30m×0.32mm×0.25μm,Agilent,USA);采用程序升温模式,经前期大量预实验确定起始温度140℃,保持5min,后以4℃/min升至220℃,保持15min;进样口温度:260℃,检测器温度:280℃;以氮气为载气,流速1.0mL/min;氢气为燃烧气体,流速35mL/min,氧气为助燃气体,流速350mL/min,氮气为保护气体,流速35mL/min。分流进样,分流比20∶1,进样量1μL。经气相色谱测定亚油酸甲酯的峰面积,利用面积归一化法求各组样品中亚油酸的纯度。
1.2.4单因素实验保持包合温度-10℃、m1(混合脂肪酸)∶m2(尿素)比值是0.4、V(95%乙醇)∶m2(尿素)比值是4不变,考察在6、12、18、24、30、36h时包合时间对亚油酸纯度和得率的影响;保持包合时间24h、m1(混合脂肪酸)∶m2(尿素)比值是0.4、V(95%乙醇)∶m2(尿素)比值是4不变,考察在-15、-10、-5、0、5、10℃时包合温度对亚油酸纯度和得率的影响;保持包合温度-5℃、包合时间24h、V(95%乙醇)∶m2(尿素)比值是4不变,考察m1(混合脂肪酸)∶m2(尿素)比值在0.2、0.3、0.4、0.5、0.6、0.7时对亚油酸纯度和得率的影响;保持包合温度-5℃、包合时间24h、m1(混合脂肪酸)∶m2(尿素)比值为0.3保持不变,考察V(95%乙醇)∶m2(尿素)比值在2、3、4、5、6、7时对亚油酸纯度和得率的影响。
1.2.5响应面实验在单因素实验基础上,以亚油酸纯度为响应值,以包合温度(℃)、包合时间(h)、m1(混合脂肪酸)∶m2(尿素)比值、V(95%乙醇)∶m2(尿素)比值为考察因素,设计4因素3水平的响应面进行实验,响应面实验因素水平编码见表1。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface experiment
1.2.6数据处理实验采用Design Expert 7.0软件、Excel软件进行统计分析,使用单因素方差分析,结果以(平均数±标准差)表示。
2 结果与分析
2.1混合脂肪酸甲酯组成分析

图1 脂肪酸标准品气相色谱图Fig.1 Fatty acids standard by gas chromatogram
将核桃油中混合脂肪酸出峰时间与标样比较,测定出核桃油中主要的脂肪酸为棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)、亚麻酸(C18∶3),气相色谱图见图2。根据色谱峰面积计算出核桃油中各组分的含量见表2。
对比图1、图2、表2可以看出,冷榨核桃油中主要脂肪酸含量为棕榈酸8.1%,硬脂酸2.9%,油酸28.1%,亚油酸52.1%,亚麻酸8.7%。
2.2尿素包合单因素实验结果与分析
2.2.1包合时间对纯化的影响如图3所示,包合过程中,在24h内,随着包合时间的延长,亚油酸纯度和得率均升高。当包合时间达到24h时,结晶过程基本完成,考虑到纯度和得率的综合因素,包合时间选择24h为宜。

图2 冷榨核桃油中混合脂肪酸气相色谱图Fig.2 Gas chromatogram of mixed fatty acids determination in cold pressed walnut oil

表2 冷榨核桃油中混合脂肪酸组成Table 2 Composition of fatty acids in cold pressed walnut oil

图3 包合时间对亚油酸纯度和得率的影响Fig.3 Effect of adduction time on the purity and yield of linoleic acid
2.2.2包合温度对纯化的影响由图4可知,包合24h,包合温度在-15~10℃范围内,随着温度升高,亚油酸得率提高,但纯度降低。这是因为形成尿素包合物的过程是一个放热过程,温度降低时,反应将向生成包合物的方向进行,包合物晶体快速形成,便于抽滤分离,而当温度过低时,只能使一部分亚油酸被尿素包合进去,虽然滤液中亚油酸纯度得到提高,但影响了亚油酸得率。当温度过高时,长时高温易引起亚油酸氧化,影响包合后纯度。故当包合温度为-5℃时,亚油酸纯度和得率均较为理想,为最适包合温度。
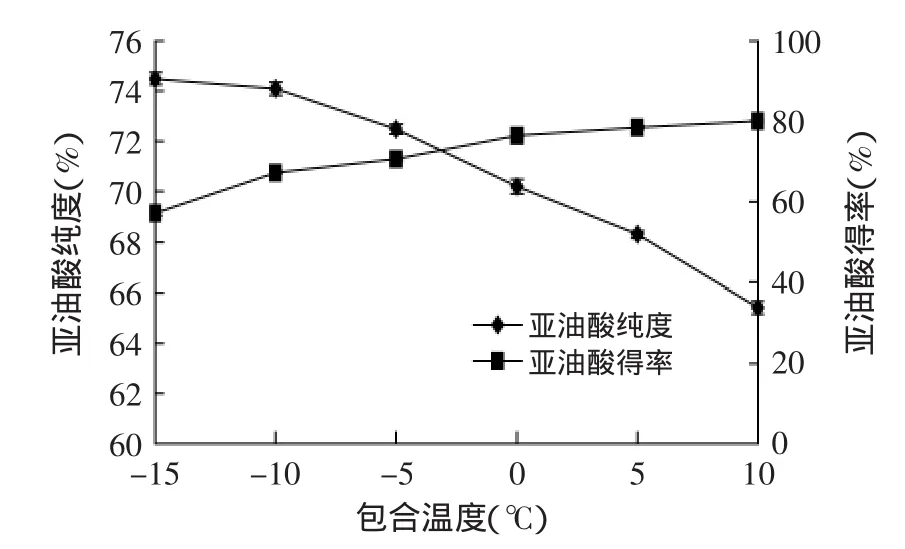
图4 包合温度对亚油酸得率和纯度的影响Fig.4 Effect of adduction temperature on the purity and yield of linoleic acid
2.2.3混合脂肪酸与尿素的质量比对纯化的影响由图5看出,随着m1(混合脂肪酸)∶m2(尿素)比值增加,亚油酸纯度在降低。当m1(混合脂肪酸)∶m2(尿素)比值小于0.3时,随着比值增加,亚油酸得率上升,当m1(混合脂肪酸)∶m2(尿素)比值大于0.3时,亚油酸得率基本保持不变。这是因为尿素分子在结晶过程中能够与饱和脂肪酸或单不饱和脂肪酸形成较稳定的晶体包合物析出,而多不饱和脂肪酸由于双键较多,碳链弯曲,具有一定的空间构型,不易被尿素包合。在包合过程中,尿素的量如果过少,对饱和脂肪酸或单不饱和脂肪酸的包合程度就会下降,达不到理想的效果。尿素量如果过多,部分亚油酸与尿素形成包合物析出,降低了亚油酸的得率。综合上述因素,m1(混合脂肪酸)∶m2(尿素)比值0.3为尿素包合时最佳比例。

图5 m1(混合脂肪酸)∶m2(尿素)比值对亚油酸包合效果的影响Fig.5 Effect of urea-to-biodiesel ratio on the purity and yield of linoleic acid
2.2.495%乙醇与尿素的体积质量比对纯化的影响溶剂在包合过程中主要起到溶解尿素的作用,考虑到毒性、溶解度等因素,经预实验选用95%乙醇作为溶剂。当尿素完全溶于溶剂中并达到饱和状态时,为包合效果最佳。由图6看出,随着V(95%乙醇)∶m2(尿素)比值的增加,亚油酸的纯度和得率均缓慢升高。这可能是随着溶剂增多,亚油酸溶解度逐渐增加,得率得以提高,且使尿素对饱和脂肪酸以及单不饱和脂肪酸结合能力变强,亚油酸纯度得到了提高。由图可见,在V(95%乙醇)∶m2(尿素)比值为5时,亚油酸纯度及得率两个指标均比较理想。

图6 V(95%乙醇)∶m2(尿素)比值对亚油酸包合效果的影响Fig.6 Effect of the solvent-to-biodiesel ratio on the purity and yield of linoleic acid

表3 Box-Behnken实验设计及结果Table 3 Design and Results of Box-Behnken experiment

表4 回归方程方差分析表Table 4 Analysis results of regression and variance
2.3响应面实验设计及结果分析
根据Box-Behnken中心组合实验设计原理,Box-Behnken实验设计及结果见表3。
使用Design Expert 7.0软件,以包合时间、包合温度、m1(混合脂肪酸)∶m2(尿素)比值,V(95%乙醇)∶m2(尿素)比值为响应变量,以亚油酸纯度(%)为响应值,对表3数据进行处理,得到表4回归方程方差分析表,利用软件进行非线性回归的二次多项式拟合。得到预测模型如下:
Y=80.24-0.35A-0.18B+3.33C-0.67D+0.23AB-0.50AC+0.57AD-0.025BC-0.87BD-0.77CD-0.11A2-0.92B2-6.53C2-2.20D2
回归方差分析显著性检验表明,该模型回归系数显著(p<0.0001),失拟项不显著,并且该模型R= 0.9986,RAdj=0.9972,说明该模型与实际实验拟合情况较好。自变量与响应值之间线性关系显著,可用于分析和预测核桃油中亚油酸纯化效果。
方差分析结果还表明,回归方程中的一次项A、C、D对响应值影响极显著(p<0.01),交互项AC、AD、BD、CD对响应值影响极显著(p<0.01),二次项中B2、C2、D2对响应值影响极显著(p<0.01)。一次项B对响应值影响显著,其余因子均不显著。
各因素的F值可反映各因素对实验指标的重要性,F值越大,表明对实验指标影响越大,从方差分析表得到各因素对尿素包合法纯化亚油酸的影响效应依次为m1(混合脂肪酸)∶m2(尿素)比值>V(95%乙醇)∶m2(尿素)比值>包合温度>包合时间。
2.3.1响应面分析条件优化依据各因素对其响应值所构成的三维立体曲面图,可反映各因素对其响应值的影响。本实验中固定2个因素在0水平上,研究另2个因素间的交互作用,根据三维空间曲面图,分析AC、AD、BD、CD交互作用对提取效果的影响。根据回归分析结果作出响应曲面图,见图7~图10。

图7 包合温度与m1(混合脂肪酸)∶m2(尿素)比值对亚油酸包合纯度的影响Fig.7 Effect of adduction temperature and urea-to-biodiesel ratio on the purity of linoleic acid
由图7可看出,m1(混合脂肪酸)∶m2(尿素)比值与包合温度交互极显著。当m1(混合脂肪酸)∶m2(尿素)比值不变时,随着包合温度的升高,亚油酸纯度基本保持不变,当包合温度不变时,随着m1(混合脂肪酸)∶m2(尿素)比值的增加,亚油酸纯度呈现一个先明显上升后下降的趋势,且在其比值为0.3时,亚油酸纯度达到最高,但达到一定极值后,比值的增加对亚油酸纯度有一定负面影响。等高线呈椭圆形,等高线沿m1(混合脂肪酸)∶m2(尿素)比值轴向较包合温度轴向密集,说明m1(混合脂肪酸)∶m2(尿素)比值对亚油酸纯度的影响比包合温度的影响大。
由图8可看出,V(95%乙醇)∶m2(尿素)比值与包合温度交互极显著。当V(95%乙醇)∶m2(尿素)比值不变时,随着包合温度的升高,亚油酸纯度呈现缓慢下降趋势。当包合温度不变时,随着V(95%乙醇)∶m2(尿素)比值增加,亚油酸纯度上升较快,当达到一定极值后,亚油酸纯度快速下降。说明V(95%乙醇)∶m2(尿素)比值过大或过小均不利于核桃油中亚油酸纯度的提高。等高线呈椭圆形,等高线沿V(95%乙醇)∶m2(尿素)比值轴向较包合温度轴向密集,说明V(95%乙醇)∶m2(尿素)比值对亚油酸纯度的影响比包合温度的影响大。

图8 包合温度与V(95%乙醇)∶m2(尿素)比值对亚油酸包合纯度的影响Fig.8 Effect of adduction temperature and solvent-to-biodiesel ratio on the purity of linoleic acid

图9 包合时间与V(95%乙醇)∶m2(尿素)比值对亚油酸包合纯度的影响Fig.9 Effect of adduction time and solvent-to-biodiesel ratio on the purity of linoleic acid
由图9可以看出,交互相V(95%乙醇)∶m2(尿素)比值与包合时间对响应值影响极显著。当V(95%乙醇)∶m2(尿素)比值保持不变时,随着包合时间的增加,亚油酸纯度呈现先增后减的趋势,当包合时间不变时,V(95%乙醇)∶m2(尿素)比值的增加使得亚油酸纯度也呈现先增后减的趋势,说明V(95%乙醇)∶m2(尿素)比值和包合时间过大过小都影响核桃油中亚油酸纯度。等高线呈椭圆形,等高线沿V(95%乙醇)∶m2(尿素)比值轴向较包合时间轴向密集,说明V(95%乙醇)∶m2(尿素)比值对亚油酸纯度的影响比包合时间的影响大。
由图10可看出,m1(混合脂肪酸)∶m2(尿素)比值与V(95%乙醇)∶m2(尿素)比值对响应值影响极显著,当m1(混合脂肪酸)∶m2(尿素)比值不变时,V(95%乙醇)∶m2(尿素)比值的增加使得亚油酸纯度呈现先迅速增加后减少的趋势。当V(95%乙醇)∶m2(尿素)比值不变时,亚油酸纯度随m1(混合脂肪酸)∶m2(尿素)比值的增加也呈现先增后减的趋势。说明适当的提高m1(混合脂肪酸)∶m2(尿素)比值与V(95%乙醇)∶m2(尿素)比值可提高亚油酸纯度。等高线呈椭圆形,等高线沿m1(混合脂肪酸)∶m2(尿素)比值轴向较V(95%乙醇)∶m2(尿素)比值轴向密集,说明m1(混合脂肪酸)∶m2(尿素)比值对亚油酸纯度的影响比V(95%乙醇)∶m2(尿素)比值的影响大。
由Design Expert软件分析得到尿素包合法纯化核桃油中亚油酸的最佳工艺条件为:包合时间为24h,包合温度为-10℃,m1(混合脂肪酸):m2(尿素)比值为0.3,V(95%乙醇)∶m2(尿素)比值为4。
2.3.2优化工艺的验证在上述优化条件下进行3次平行验证实验,得到亚油酸的平均纯度为80.20%,与预测值80.22%相近,说明优化得到的提取条件可靠,具有实用价值。采用尿素包合法纯化核桃油得到亚油酸的气相色谱图见图11,尿素包合核桃油后脂肪酸组成见表5。

图10 m1(混合脂肪酸)∶m2(尿素)比值与V(95%乙醇)∶m2(尿素)比值对亚油酸包合纯度的影响Fig.10 Effect of urea-to-biodiesel ratio and solvent-tobiodiesel ratio on the purity of linoleic acid

图11 核桃油经尿素包合法纯化后脂肪酸气相色谱图Fig.11 Gas chromatogram of purified fatty acids determination in walnut oil by urea adduction
由图11、表5得出,冷榨后的核桃油经过一次尿素包合后,亚油酸的含量由原来的52.1%增加到80.20%,亚麻酸含量由原来的8.7%增加到19.5%,棕榈酸、硬脂酸、油酸含量降至最低,亚油酸与亚麻酸占整个脂肪酸组成的99%以上,说明尿素包合法有效地将核桃油中多不饱和脂肪酸富集了出来。

表5 尿素包合核桃油后脂肪酸组成Table 5 Composition of purified fatty acids in walnut oil by urea adduction
3 结论
在单因素实验的基础上,通过响应面分析对尿素包合法纯化核桃油中亚油酸工艺条件进行了优化,确定了目标函数与工艺条件之间的关系。各因素对亚油酸纯度影响程度大小依次为m1(混合脂肪酸)∶m2(尿素)>V(95%乙醇)∶m1(尿素)>包合温度>包合时间。包合温度与m1(混合脂肪酸)∶m2(尿素)、包合温度与V(95%乙醇)∶m2(尿素)、包合时间与V(95%乙醇)∶m2(尿素)、m1(混合脂肪酸)∶m2(尿素)与V(95%乙醇)∶m2(尿素)对亚油酸纯度交互作用显著。经回归优化后,最佳工艺条件为:包合时间24h,包合温度-10℃,m1(混合脂肪酸)∶m2(尿素)比值为0.3,V(95%乙醇)∶m2(尿素)比值为4。经一次尿素包合后亚油酸纯度达到80.20%。
[1]曾思敏.多不饱和脂肪酸及其联合5-FU影响胃癌细胞生长的细胞生物学研究[D].杭州:浙江大学,2014.
[2]岳崟,叶诚,郑冬冬,等.多不饱和脂肪酸对大鼠大脑细胞膜脂肪酸组成的影响[J].中国酿造,2014(1):36-39.
[3]潘小姣,夏宁,汪泉,等.n-3多不饱和脂肪酸对不同饲料喂养大鼠血糖及血脂的影响[J].食品工业科技,2014,20(6):343-346,372.
[4]王来平,鲁宁琳,杨兴华,等.核桃油研究进展[J].落叶果树,2009(6):21-23.
[5]LIU Shucheng,ZHANG Chaohua,HONG Pengzhi,et al.Concentrationofdocosahexaenoicacid(DHA)and eicosapentaenoic acid(EPA)of tuna oil by urea complexation:optimization of process parameters[J].Journal of Food Engineering,2006,73:203-209.
[6]FLECKA U,TIEGSA C,BRUNNERB G.Fractionation of fatty acid ethyl esters by supercritical CO2:high separation efficiency usinganautomatedcountercurrentcolumn[J].Journalof Supercritical Fluids,1998,14(1):67-74.
[7]张骁,束梅英.超临界流体萃取技术及其在油脂加工中的应用[J].沙棘,1998,11(3):26-33.
[8]徐世民,刘颖,胡晖.分子蒸馏富集海狗油中多不饱和脂肪酸[J].化学工业与工程,2006,23(6):495-498.
[9]ADLOF R O.Separation of conjugated linoeic acid methyl esters by silver-ion high performance liquid chromatography in semi-preparative mode[J].Journal of Chromatography A,2004,1033(2):369-371.
[10]王华,杨琦,薛刚,等.尿素包合法分离月见草油中γ-亚麻酸-包合工艺参数对结晶物的影响[J].食品科学,2010,31(8):125-131.
[11]Maria DL,Vind J,Oxenbφll KM,et al.Phospholipases and theirindustrialapplications[J].AppliedMicrobiologyand Biotechnology,2007,74(2):290-300.
[12]GU Haibo,MA Xueyi,WU Jingbo,et al.Concentration of α-Linoleic Acid of Perilla Oil by Gradient Cooling Urea Inclusion[J].Agricultural Sciences in China,2009(6):685-690.
[13]寇秀颖,于国萍.脂肪和脂肪酸甲酯化方法的研究[J].食品研究与开发,2005,25(2):46-47.
Optimization of purifying linoleic acid from walnut oil with urea adduction fractionation
ZHAI Yuan-chun1,ZHANG Run-guang1,FENG Bin-kui2,DU Xi-min2,HU Han1,ZHANG You-lin1,*
(1.College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710119,China;2.Shaanxi Datong Ecological Industry Development Limited Company,Xi’an 710065,China)
The technology of separating linoleic acid from walnut oil by urea adduction was optimized in the paper.On the basis of single factor experiments,the effects of adduction temperature(℃),adduction time(h),m1(mixed fatty acid)∶m2(urea),V(95%ethanol)∶m2(urea)on the purity and yield of linoleic acid were analyzed by response surface method.The results showed that the optimal parameters of the urea adduction technology were adduction temperature-10℃,adduction time 24h,m1(mixed fatty acid)∶m2(urea)=0.3 and V(95% ethanol)∶m2(urea)=4.On this condition,the purity of linoleic acid could rise from original 52.1%to above 80.20%by initial urea adduction.
walnut oil;urea adduction;linoleic acid
TS224.8
B
1002-0306(2015)10-0311-07
10.13386/j.issn1002-0306.2015.10.057
2014-08-14
翟元春(1990-),女,硕士研究生,研究方向:农产品加工及贮藏。
张有林(1956-),男,教授,研究方向:农产品加工及贮藏。
西安市现代农业推进计划项目(NC1203.3);西安市现代农业创新计划项目(NC1317.3);国家级大学生创新训练计划项目(201410718015)。

