山杏仁种皮多酚的闪式提取工艺优化及体外抗氧化活性研究
崔 洁,潘 倩,张乔会,董施斌,王建中,*
(1.北京林业大学自然保护区学院,北京100083;2.林业食品加工与安全北京市重点实验室,北京林业大学生物科学与技术学院,北京100083)
山杏仁种皮多酚的闪式提取工艺优化及体外抗氧化活性研究
崔洁1,2,潘倩2,张乔会2,董施斌2,王建中2,*
(1.北京林业大学自然保护区学院,北京100083;2.林业食品加工与安全北京市重点实验室,北京林业大学生物科学与技术学院,北京100083)
利用闪式提取法对山杏仁种皮中多酚的提取工艺进行优化,并通过DPPH法、邻苯三酚法、水杨酸法以及还原能力实验,研究了其体外抗氧化能力。得到最佳工艺条件为:料液比1∶20(g/mL)、乙醇体积分数30%、闪提时间120s,多酚得率为9.650mg/g。结果表明:当多酚提取物浓度为0.4mg/mL时,对DPPH·的清除率为92.9%;浓度为3.0mg/mL时,对O2-·清除率为93.1%;浓度为2.0mg/mL时,对OH·的清除率为98.1%;浓度为1.0mg/mL时,还原力为1.411。
山杏种皮,多酚,闪式提取,抗氧化活性
山杏种皮作为杏仁加工过程中产生的下脚料,利用率极低,资源浪费严重。山杏仁种皮中主要含有多酚类物质、色素等。其中,多酚类物质是植物体内复杂酚类次级代谢产物,具有抗氧化[1]、抑菌[2]、延缓机体衰老、预防心血管疾病[3]、抑制胆固醇上升、防癌[4]等生物活性功能。目前,除少数学者用山杏种皮提取黑色素[5]外,尚无其他有关山杏种皮开发利用的报道。
闪式提取是近些年发展起来的快速提取技术。闪式提取器通过组织破碎使充分暴露的被提取成分在负压、剪切、高速碰撞等各种外力作用下被溶剂分子包围、解离、溶解,瞬间达到溶剂浓度的平衡,从而达到快速提取的目的,减少了有效成分的降解或损耗[6]。故本研究以山杏仁为原料,用闪式提取法提取其中的多酚类物质,建立山杏种皮多酚的闪式提取工艺,并考察其抗氧化活性,探索山杏加工废弃物的有效利用途径。
1 材料与方法
1.1材料与仪器
山杏仁平泉亚欧杏仁有限公司提供;没食子酸(标准品)、Folin-Ciocalteu、1,1-二苯基-2-苦肼基(1,1,-dipheny1-2-picry-hydrazy,DPPH)美国Sigma公司;无水碳酸钠、盐酸、无水乙醇北京化工厂;邻苯三酚、三羟甲基氨基甲烷(Tris)、抗坏血酸、三氯醋酸、水杨酸、硫酸亚铁、双氧水、铁氰化钾、三氯化铁天津市津科精细化工研究所;除特殊说明外,其他试剂均为分析纯;实验用水为蒸馏水。
JHBE-505型闪式提取控制器北京金鼎科技发展有限公司;752-SPECTROPHOTOMETER紫外分光光度计上海美谱达仪器有限公司;PHS-3D型精密型pH计上海三信仪表厂;真空冷冻干燥机赛默飞世尔科技(中国)有限公司;SENCOR-201型旋转蒸发仪上海申顺生物科技有限公司;FW100型高速万能粉碎机天津市泰斯特仪器有限公司;TDL-5型飞鸽牌台式离心机。
1.2实验方法
1.2.1山杏仁种皮多酚提取的工艺流程杏仁→煮制[料液比1∶2(g/g),90℃,2min]→手工剥皮→干燥(37℃)→除杂→粉碎→过筛(60目)→闪式提取→离心(5000r/min,10min)→收集上清液→多酚粗提物。
1.2.2标准曲线的绘制多酚含量测定采用福林酚法(Folin-Ciocalteu)(GB/T 8313-2008),以没食子酸为基准物,计算山杏仁种皮多酚含量。
分别取没食子酸标准溶液(0.34mg/mL)0.0、0.1、0.2、0.4、0.6、0.8、1.0mL于20mL具塞试管中,加入1mL Folin-Ciocalteu试剂混合,再加入5mL碳酸钠溶液(7.5%W/V),之后用蒸馏水定容至20mL,避光室温下(25℃)反应1h。然后以吸光度值(760nm)和没食子酸溶液体积为变量绘制标准曲线。计算得吸光度对体积分数的线性回归方程为:y=1.77x+0.553,R2= 0.9993。
1.2.3山杏种皮多酚得率的测定根据标准曲线计算山杏仁种皮多酚含量。多酚提取得率按照公式(1)计算:

式中:m,样品质量(g);V,提取液的体积(mL);C,样品中多酚含量(mg/mL)。
1.2.4山杏种皮中多酚类物质提取单因素实验从乙醇体积分数、闪提时间、料液比三个方面进行单因素实验,考察其对山杏种皮多酚得率的影响。
1.2.4.1乙醇体积分数对得率的影响在提取时间90s、料液比1∶20(g/mL)条件下,分别以体积分数20%、30%、40%、50%、60%、70%、80%的乙醇为提取溶剂,重复3次,考察不同乙醇体积分数对多酚得率的影响。
1.2.4.2闪提时间对多酚得率的影响在乙醇浓度为60%、料液比1∶20(g/mL)条件下,分别闪提40、60、80、100、120、140s,重复3次,研究不同闪提时间对多酚得率的影响。
1.2.4.3料液比对多酚提取率的影响在乙醇体积分数60%、提取时间90s条件下,分别选择料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),重复3次,考察料液比对多酚得率的影响。
1.2.5山杏仁种皮中多酚类物质提取正交实验在单因素实验基础上,对乙醇体积分数、闪提时间、料液比3个因素选取三个水平,采用L9(33)表作正交实验优化,确定最佳提取工艺,并进行验证实验。正交实验因素和水平如表1。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test orthogonal test
1.2.6山杏仁种皮多酚体外抗氧化活性测定方法样品制备参照方法1.2.5确立的最佳工艺条件。
1.2.6.1清除DPPH·能力的测定[7]称取0.0038~0.0040g DPPH,用无水乙醇溶解,定容至50mL,摇匀得到浓度为2×10-4mol/L的DPPH溶液,放在冰箱中避光保存备用;在10mL离心管中分别加入2mL不同浓度梯度的样品溶液和VC溶液,再分别加入2mL DPPH溶液,避光反应30min后在波长517nm处测吸光度;以2mL样品溶液加2mL无水乙醇作对照,以2mL DPPH加入2mL蒸馏水作空白,以等体积蒸馏水和乙醇调零,计算对DPPH·自由基的清除率。公式(2)如下:

式中:A,DPPH溶液2mL+样品溶液2mL的吸光度值;B,样品溶液2mL+无水乙醇2mL的吸光度值;C,DPPH溶液2mL+蒸馏水2mL的吸光度值。
1.2.6.2清除O2-·能力的测定[8]称取三羟甲基氨基甲烷(Tris)12.11g,用蒸馏水溶解定容至1000mL,得到0.1mol/L Tris溶液;取50mL 0.1mol/L Tris溶液与22.9mL 0.1mol/L HCl混匀并用蒸馏水稀释至1000mL,调整pH为8.2,得50mmol/L Tris-HCl缓冲溶液;称取0.315g邻苯三酚用10mmol/L盐酸溶解定容至1000mL,得到25mmol/L邻苯三酚,棕色瓶避光保存。
取50mmol/L Tris-HCl缓冲溶液(pH=8.2)2.25mL,加入2mL不同浓度的待测样品;加25mmol/L加入的邻苯三酚1mL,混匀后25℃水浴20min;向其中加入1滴10mol/L HCl,终止反应,在波长为420nm处测吸光度,重复实验3次,取平均值,对照组加蒸馏水,计算样品对O2-·的清除率。公式(3)如下:

式中:A,Tris-HCl+样品+邻苯三酚+HCl的吸光度值;B,Tris-HCl+样品+HCl的吸光度值;C,Tris-HCl+邻苯三酚+HCl的吸光度值。
1.2.6.3清除·OH能力的测定[9]称取0.0834g FeSO4·7H2O溶于少量蒸馏水中,定容至50mL,得到6mmol/L FeSO4溶液;称取0.0414g水杨酸,加入少量无水乙醇,搅拌,用无水乙醇定容至50mL,得到6mmol/L的水杨酸-乙醇体系;吸取166.7μL 30%的双氧水用蒸馏水定容至50mL,得到0.1%的H2O2。
在10mL的具塞试管中分别加入1mL 6mmol/L FeSO4溶液,1mL 6mmol/L的水杨酸-乙醇溶液,再分别加入1mL浓度梯度样品溶液,最后加入1mL H2O2启动反应,37℃水浴反应30min后,在510nm处测定吸光度,以蒸馏水代替H2O2作为对照组,以蒸馏水代替样品作为空白,公式(4)如下:

式中,A样品组:FeSO4·7H2O+水杨酸-乙醇+样品+H2O2的吸光度值;B对照组:FeSO4·7H2O+水杨酸-乙醇+样品的吸光度值;C空白组:FeSO4·7H2O+水杨酸-乙醇+蒸馏水+H2O2的吸光度值。
1.2.6.4还原力测定[10]分别取1mL不同浓度的样品溶液于10mL离心管中,加入2mL磷酸盐(PBS)缓冲液(0.2mol/L)和2mL的1%铁氰化钾溶液,混匀,放入50℃水浴锅中20min后取出,加入2mL10%的三氯乙酸溶液,摇匀,放入冷水中迅速冷却。然后,取2mL上述混合液于10mL离心管中,加入2mL蒸馏水和0.4mL 0.1%的FeCl3溶液,其在700nm处有最大吸收,以A700表示样品的还原能力,以蒸馏水为空白,平行三次实验,取平均值。
1.2.7数据处理采用Microsoft excel 2007软件处理数据、作图,添加标准误差和数据分析。所有实验至少重复3次。
2 结果与讨论
2.1单因素实验及结果
2.1.1乙醇体积分数对得率的影响从图1中可看出,乙醇体积分数为40%时,多酚得率达到最大值10.01mg/g;乙醇体积分数在20%~40%时,多酚得率呈线性上升,这是因为,低浓度时提取液中水的体积分数高,水断裂氢键的能力较弱,不足以破坏样品中多酚类物质与蛋白、多糖或其他物质的连接,多酚得率低,糖类等水溶性杂质浸出率也较高;乙醇体积分数超过40%以后,多酚得率呈下降趋势,可能由于乙醇体积分数过高,脂溶性成分浸出较多,不利于多酚类物质的提取[11]。

图1 不同乙醇体积分数对多酚得率的影响Fig.1 Effect of ethanol concentration on extraction rate of polyphenols
2.1.2闪提时间对得率的影响由图2可知,适当延长闪式提取时间有助于提高多酚得率,在100s时达到了极大值,但随着时间的延长,得率反而有所下降,这可能是由于长时间的闪式提取会产生大量的热,多酚在高温下发生了降解、缩合、氧化等化学反应[12],导致多酚热损失。
2.1.3料液比对得率的影响由图3可知,料液比为1∶15时,多酚得率达到最大值,说明大部分种皮多酚已被提取出来;料液比继续升高,多酚得率反而下降,大于1∶25以后,多酚得率趋于稳定,这可能是因为,料液比过大不但不能将有效成分提取出来,反而使醇溶性杂质浸出增多,而且造成溶剂浪费,对后处理不利[13]。因此,从提取效果和降低成本方面考虑,料液比1∶15最佳。
2.2正交实验结果与方差分析

图2 不同闪提时间对多酚得率的影响Fig.2 Effect of extraction time on extraction rate of polyphenols

图3 不同料液比对多酚得率的影响Fig.3 Effect of material-liquid ratio on extraction rate of polyphenols

表2 正交实验结果Table 2 The result of orthogonal experiment

表3 正交实验方差分析Table 3 Analysis of variance
正交实验结果如表2所示。由表2的直观分析可以看出,3个因素对多酚得率的影响主次顺序为C>A>B,即料液比>乙醇体积分数>闪提时间,并得出闪式提取山杏仁种皮多酚的最佳工艺条件为A1B3C3,即乙醇体积分数30%、闪提时间120s、料液比1∶20(g/mL)。在此条件下进行验证实验,得出多酚得率为9.650mg/g。
为了进一步判断实验误差与条件是否影响实验结果,将正交结果的数据进行方差分析,从表3可知,料液比对山杏种皮中总酚得率有显著性影响(p<0.05),提取时间和乙醇体积分数均未显示出差异性(p>0.05),与表2的分析结果一致。
2.3山杏种皮多酚的体外抗氧化活性测定
2.3.1清除DPPH·能力的测定DPPH·的单电子在波长517nm处有最大吸收峰,在乙醇溶液中呈深紫色,加入抗氧化剂后,可与DPPH·的孤对电子配对使光吸收减弱甚至消失,溶液颜色由深变浅,褪色的程度与抗氧化剂的清除能力及浓度相关[14],从而评价该物质的抗氧化能力。

图4 山杏仁种皮多酚与VC清除DPPH·能力比较Fig.4 Comparison of DPPH radical scavenging activity on polyphenols from apricot seed coats with vitamin C
由图4可看出,山杏仁种皮多酚有着较强的清除DPPH·的能力,且清除率与剂量相关。在此浓度范围内,VC的清除能力非常强,在0.05mg/mL时已经几乎清除所有DPPH·;而在0.1~0.3mg/mL浓度范围内样品清除率几乎呈线性上升;当浓度大于0.3mg/mL时,样品清除率随浓度增大而上升的趋势缓慢,表明此时溶液中大部分的DPPH·已被清除;浓度为0.4mg/mL时,样品清除率达到最大值92.9%,非常接近VC的清除水平96.1%,表明山杏仁种皮多酚有很好的清除DPPH·的作用。
2.3.2清除O2-·能力的测定由图5可知,样品清除超氧阴离子的能力随着浓度的增加而增强。当浓度为0.6mg/mL时,样品和VC的清除率分别是34.2%、72.23%;而后随浓度增加,样品清除率的增加趋势明显强于VC;当浓度达到3mg/mL时,样品对超氧阴离子的清除能力超过了VC,分别达到了93.1%、89.73%。可见,在较高浓度时,山杏仁种皮多酚样品的清除效果优于VC。
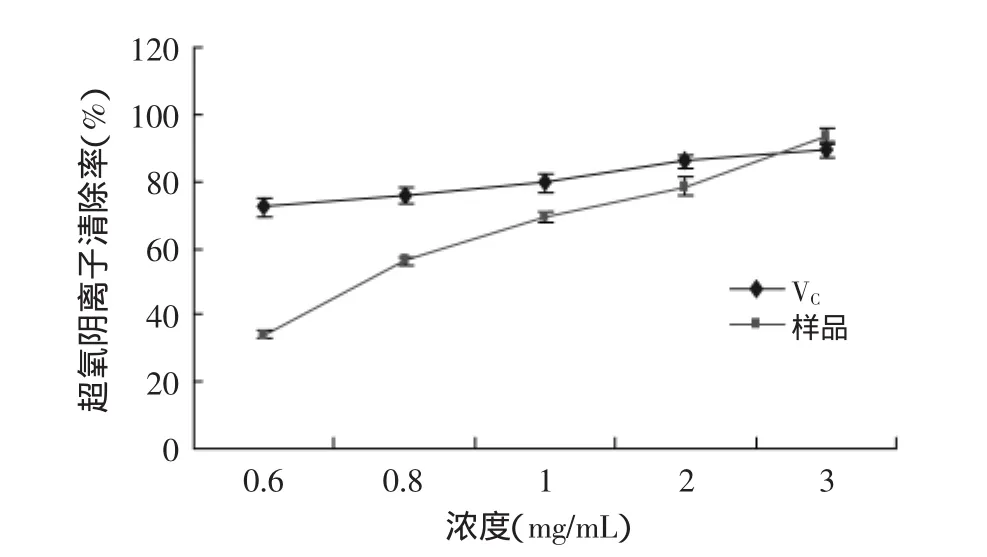
图5 山杏仁种皮多酚与VC清除O2-·能力比较Fig.5 Comparison of superoxide radical scavenging activity on polyphenols from apricot seed coats with VC
2.3.3清除·OH能力的测定如图6所示,随浓度升高VC清除率从90.89%到98.12%,变化幅度不明显,但一直处于较高水平,这与VC是纯品有关。多酚样品以浓度2mg/mL为分界点,小于该浓度时样品的清除率基本呈线性上升趋势;大于该浓度时清除率又开始下降,在浓度2mg/mL达到最大值98.1%,此时,VC的清除率为97.6%,该浓度时的清除效果明显优于VC。

图6 山杏仁种皮多酚与VC清除·OH能力比较Fig.6 Comparison of hydroxyl radical scavenging activity on polyphenols from apricot seed coats with Vitamin C
这是因为一定浓度范围内,多酚结构的供氢体能够提供氢质子来还原OH·,终止自由基的连锁反应,起到清除或抑制自由基的效果;但在高浓度时,多酚将反应H2O2+Fe2+→OH·+H2O+Fe3+中的Fe3+还原成Fe2+,反而促进了羟自由基的产生,清除率不会再继续增大,反而会维持不变甚至降低[15]。
2.3.4总还原力的测定如图7所示,当浓度在0.2mg/mL时VC的吸光度值就已经达到了1.02以上,而样品是0.59;随浓度增加,二者吸光度值增加趋势一致;当浓度达到1mg/mL时,VC达到1.78,样品为1.411。因此,相同浓度时山杏仁种皮多酚粗提物的总还原能力稍弱于抗氧化剂VC。
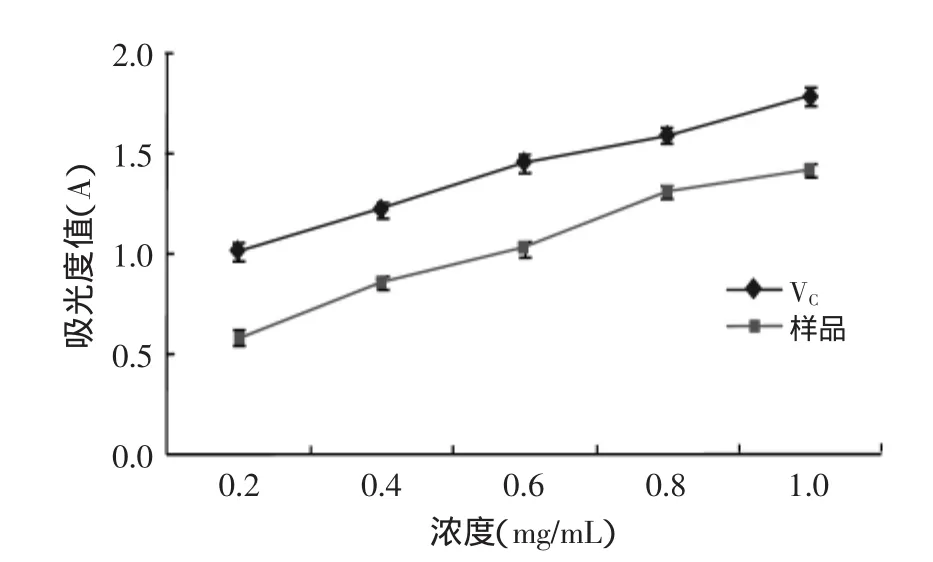
图7 山杏仁种皮多酚与VC还原能力比较Fig.7 Comparison of reducing power on polyphenols from apricot seed coats with Vitamin C
3 结论
3.1用闪式提取器提取山杏仁种皮多酚的最优条件为:料液比1∶20(g/mL)、乙醇体积分数30%、闪提时间120s,在此条件下,多酚得率为9.650mg/g。
3.2体外抗氧化实验结果表明:在2.0~3.0mg/mL浓度范围内,山杏仁种皮多酚对O2-·和OH·的清除效果优于VC;在浓度0.3~0.4mg/mL范围内,对DPPH·的清除效果与VC水平相近;相同浓度下还原能力稍弱于VC。
[1]郜海燕,李兴飞.山核桃多酚物质提取及抗氧化进展[J].食品科学,2011,32(5):336-340.
[2]庄英斌,刘军海.天然活性多酚提取纯化及功能性研究进展[J].粮食与油脂,2012(8):44-48.
[3]Chang C P,Huang W T,Cheng B C,et al.The flavonoid baicalinprotectsagainstcerebrovasculardysfunctionbrain inflammation in experimental heatstroke[J].Neuroparmacology,2007,5(3):1024-1033.
[4]Piero D,Cristina L,Carlotta D F,et al.Red wine polyphenols influence carcinogenesis,intestinal microflora,oxidative damage and gene expression profiles of colonic mucosa[J].Mutation research,2005,591:237-246.
[5]姚增玉.山杏种皮黑色素提取及其性质研究[D].陕西:西北农林科技大学,2007:1-93.
[6]吴冬梅.闪式提取器在中药研究中的应用[J].中国实验方剂学杂志.2006,12(7):34,37.
[7]Moon J Y.Antioxidant and antiproliferative activities of mango(Mangifera indica L.)flesh and peel[J].Food Chemistry,2010,121(2):429-436.
[8]Ribeiro S M R,Barbosa L C A,Queiroz J H,et al.Phenolic compoundsandantioxidantcapacityofBrazilianmango(Mangifera indica L.)varieties[J].Food Chemistry,2008,110(3):620-626.
[9]吴艳兵,吴大付,颜振敏,等.柳树乙醇提取物体外抗氧化活性[J].资源开发与市场,2010,26(2):100-101.
[10]崔洁,顾欣,黄昆,等.山杏果肉可溶性膳食纤维的抗氧化活性与红外光谱分析[J].食品与发酵工业,2012,38(1):123-127.
[11]王燕,滕建文.柿子皮多酚物质的提取和除臭效果的研究[J].食品研究与开发,2008,29(6):33-36.
[12]任虹,朱晓霞,韩东桓,等.微波辅助提取花生红衣多酚及其抗氧化活性研究[J].中国食品学报,2013,13(7):25-33.
[13]Silva E M,Rozeg H,Larondelle Y.Optimization of extraction of phenolics from Inga edulis leaves using response surface methodology[J].Separation and Purification Technology,2007,55(3):381-387.
[14]Aruoma O I.Nutrition and health aspects of freeradicals and antioxidants[J].Food Chemistry Toxicology,1994,32(7):671-683.
[15]杨明惠,刘满红,何丽仙,等.褪色光度法测定Fenton反应产生的羟自由基及其应用[J].分析实验室,2007,25(12):77-80.
Extraction technology and antioxidant activity analysis of polyphenols from apricot(Armeniaca sibirica)seed coat
CUI Jie1,2,PAN Qian2,ZHANG Qiao-hui2,DONG Shi-bin2,WANG Jian-zhong2,*
(1.College of Nature Conservation,Beijing Forestry University,Beijing 100083,China;2.Beijing Key Laboratory of Forest Food Processing and Safety,College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
The optimum extraction condition of polyphenols from apricot seed coat with the herbal blitzkrieg extractor and the antioxidant activity were investigated in this paper.The four antioxidant assays were contained total reductive ability,scavenging ability for DPPH·,·OH,and O2-·.The optimum extraction condition was listed:solid-liquid ratio 1∶20(g/mL),ethanol concentration 30%and time 120s.Under this situation,the extraction rate of polyphenols was 9.650mg/g.When the polyphenols concentration was 0.4mg/mL,the rate of scavenging DPPH·was 92.9%.When it was 3.0mg/mL,the rate of scavenging O2-·was 93.1%.When it was 2.0mg/mL,the rate of scavenging OH·was 98.1%.When it was 1.0mg/mL,reducing force was 1.411.
apricot seed coat;polyphenols;flash extraction;antioxidant
TS201.1
B
1002-0306(2015)10-0273-05
10.13386/j.issn1002-0306.2015.10.049
2014-09-12
崔洁(1986-),女,博士研究生,研究方向:植物资源利用与天然产物开发。
王建中(1952-),男,硕士,教授,研究方向:植物资源利用与天然产物开发,农副产品加工与贮藏保鲜,区域农业规划。
林业公益性行业科研专项(201004081)。

