微生物絮凝剂BN-25的特性及其在甘蔗混合汁澄清工艺中的应用
罗玉琴,扶 雄,侯 轶
(华南理工大学轻工与食品学院,广东广州510640)
微生物絮凝剂BN-25的特性及其在甘蔗混合汁澄清工艺中的应用
罗玉琴,扶雄,侯轶*
(华南理工大学轻工与食品学院,广东广州510640)
对实验室筛选得到的一种微生物絮凝剂BN-25的特性及化学成分进行了研究。研究发现其絮凝活性物质主要分布在发酵液中,具有良好的热稳定性,100℃下连续沸水浴30min,絮凝活性保持不变。紫外光谱(UV)、红外光谱扫描(FTIR)和化学测定结果表明,微生物絮凝剂BN-25含有大量的氨基、羟基、羧基、硫酸根等有利于絮凝的基团,多糖为其主要成分,含量达89.5%。通过正交实验和方差分析确定了微生物絮凝剂BN-25与聚丙烯酰胺(PAM)复配处理甘蔗混合汁的最佳工艺条件为中和pH6.8,二次加热温度100℃,BN-25添加量12mg/L,PAM添加量1.0mg/L。处理后蔗汁色值仅为273IU,浊度仅为84MAU,澄清效果明显优于PAM单独应用,并降低PAM的添加量75%以上,为微生物絮凝剂应用于制糖行业提供了基础数据和理论依据。
微生物絮凝剂,热稳定性,多糖,PAM,甘蔗混合汁澄清
微生物絮凝剂是一类由微生物产生的有絮凝活性的代谢产物,其组成主要为蛋白质、多糖、糖蛋白、核酸和脂类等,如Bacillus licheniformis CCRC 12826产生的絮凝剂为聚谷氨酸[1],Corynebacterium glutamicum CCTCC M201005产生的絮凝剂REA-11为聚半乳糖醛酸[2],Bacillus firmus产生的絮凝剂为酸性多糖[3],Aspergillus flavus产生的絮凝剂IH-7为糖蛋白,由28.5%的蛋白质和69.7%的多糖组成[4],Rhodovulum sp产生的絮凝剂为核酸[5],Zoogloea ramigera产生的絮凝剂为聚-β-羟丁酸[6]。
与传统化学絮凝剂相比,微生物絮凝剂因具有安全无毒、无二次污染、易生物降解的优点[7],具有广阔的应用前景。目前,微生物絮凝剂已广泛应用于水处理、食品加工和发酵工业中,在制糖行业中的应用,国内外研究较少。李楠等[8]用筛选得到的富产絮凝剂菌株轮枝孢属(Verticillium sp)处理蔗汁,蔗汁沉降实验的絮凝率为69.2%,清汁色值为87.4IU。吴春兰等[9]用3种微生物絮凝剂在甘蔗糖业中的应用进行初步研究,发现微生物絮凝剂能有效提高混合汁的沉降速度,压缩滤泥体积并有脱色效果,但除浊效果不理想。本文研究了微生物絮凝剂BN-25的絮凝活性分布、热稳定性及化学成分分析,并以BN-25为主体,复配少量的聚丙烯酰胺(PAM),处理甘蔗混合汁,以期降低PAM的使用量而达到较好的澄清效果。
1 材料与方法
1.1材料与仪器
普通变形杆菌(Proteus vulgaris)N-25由本实验室筛选鉴定,现已保藏于中国典型培养物保藏中心,编号为CCTCC NO:M2014549;甘蔗混合汁pH5.1~5.6,锤度15~18°Bx,简纯度71%~74%,由广东英德东桥糖业有限公司提供。
TG16-WS型台式高速离心机湖南湘仪离心机仪器有限公司;Scientz-18N型冷冻干燥机宁波新芝生物科技有限公司;TU-1901型双光束紫外可见分光光度计北京普析通用仪器有限责任公司;HH-6型数显恒温水浴锅常州澳华仪器有限公司;Scientz-18N型冷冻干燥机宁波新芝生物科技有限公司;傅里叶红外光谱仪NICOLET IS10美国热电Thermo公司;WAY-Z型自动阿贝折射仪、SGW-2型自动旋光仪上海精密科学仪器有限公司。
1.2实验方法
1.2.1培养基及菌种培养斜面培养基[10]:牛肉膏5g/L,蛋白胨10g/L,NaCl 5g/L,琼脂20g/L,pH7.4,121℃下灭菌30min。种子及发酵培养基[11]:葡萄糖20g/L,尿素0.5g/L,酵母膏0.5g/L,(NH4)2SO40.2g/L,K2HPO45.0g/L,KH2PO42.0g/L,NaCl 0.1g/L,MgSO4·7H2O 0.2g/L,pH7.0,115℃下灭菌20min。
从斜面培养基挑取一环菌种接入5mL种子培养基,培养24h后,接入100mL发酵培养基中,30℃恒温培养4d,摇床转速为150r/min。
1.2.2絮凝物质的分布发酵液7000r/min离心15min,将菌体沉淀用无菌水洗涤两次稀释至原来的体积,作为菌体悬浊液。分别测定发酵液、上清液和菌悬液对高岭土悬浊液的絮凝活性,研究絮凝活性物质的分布。
1.2.3絮凝活性测定[12]准确量取9.3mL质量浓度为5g/L的高岭土悬浊液,加入0.5mL质量分数为1%的CaCl2溶液作助凝剂,同时加入0.2mL的微生物絮凝剂样品,调pH至7.5,搅拌后静置5min,用分光光度计测定上清液在波长550nm处的吸光度,同时以蒸馏水代替待测样品作为对照,计算待测微生物絮凝剂样品的絮凝率:
絮凝率(%)=(A-B)/A×100
其中:A为对照上清液在550nm处的吸光度,B为样品上清液在550nm处的吸光度。
1.2.4微生物絮凝剂BN-25的提取参照Aljuboori AHR等[13]的方法,略有改动,具体操作如下。将1L发酵液5000r/min离心30min去除菌体和杂质,取上清液在45℃下旋蒸浓缩至原来体积的1/5,装入3000u透析袋中透析48h,每6h更换蒸馏水,用苯酚-硫酸法检测透析液中有无单糖存在。加入4倍体积的无水乙醇,充分搅拌于4℃静置24h。离心(5000r/min,15min),收集沉淀。将沉淀重新溶于100mL蒸馏水中,加入质量分数为2%的氯化十六烷基吡啶(Cetylpyridinium Chloride,CPC),直至无沉淀析出,充分搅拌,3h后收集CPC多糖复合沉淀。将沉淀溶于100mL 0.5mol/L的NaCl溶液中,加入2倍体积的无水乙醇,充分混合后静置20min。用60%乙醇冲洗沉淀2次,-50℃下冷冻干燥24h,制成微生物絮凝剂BN-25成品。
1.2.5微生物絮凝剂BN-25热稳定性研究将微生物絮凝剂BN-25配成0.5g/L的溶液,取20mL于比色管中放入100℃水浴加热,每隔5min测定BN-25溶液对高岭土悬浊液的絮凝率。
1.2.6微生物絮凝剂BN-25成分分析将微生物絮凝剂BN-25分别用紫外光谱扫描分析是否有蛋白质、核酸存在;苯酚-硫酸法测定多糖含量;Bradford法测定蛋白质含量;用红外光谱分析BN-25中的特征基团。
1.2.7微生物絮凝剂BN-25与聚丙烯酰胺(PAM)复配处理甘蔗混合汁澄清工艺采用磷酸-亚硫酸澄清法,具体如下:取甘蔗混合汁500mL,加入85%的磷酸300mg/L,用石灰乳调至pH6.8,加热搅拌至60℃后保温2min。加入亚硫酸硫熏,硫熏量为1.8g/L,中和至一定pH,二次加热后,快速加入微生物絮凝剂及PAM,搅拌均匀后静置。记录沉降250mL清汁所需时间。30min后测量泥底体积,取上清液用0.45μm微孔滤膜过滤,分别测量过滤前后蔗汁的折光锤度及560nm处的吸光度,计算蔗汁的色值和浊度[14]:
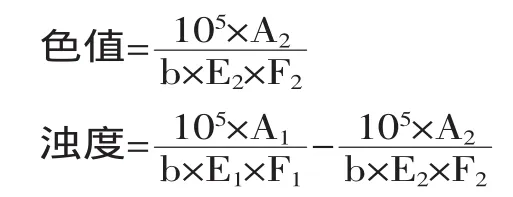
A1和A2分别为过滤前和过滤后蔗汁在560nm处的吸光度,b为比色皿厚度(单位cm),E1、E2为过滤前和过滤后蔗汁的相对视密度,F1、F2为过滤前和过滤后蔗汁的折光锤度。
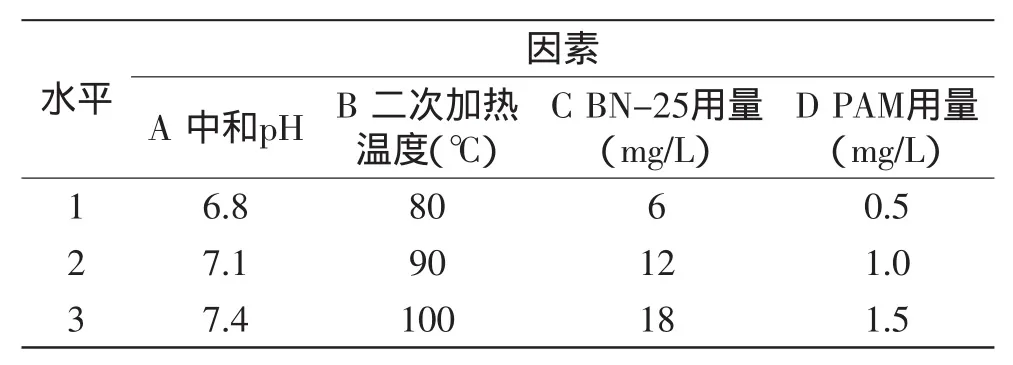
表1 因素水平表Table 1 Orthogonal design
1.2.8实验设计由于澄清工艺涉及中和pH、二次加热温度和絮凝剂添加量等因素,根据糖厂澄清工艺条件、多次预实验及以往相关实验经验[15-16],选择工艺条件中的中和pH A、二次加热温度B、BN-25用量C(mg/L)和PAM用量D(mg/L)四因素按L9(34)安排正交实验[17]。见表1所示。
1.3数据分析处理
所有实验重复3次,采用Origin 8.0和SPSS 17.0软件对数据进行作图和统计分析。
2 结果与讨论
2.1絮凝活性物质的分布
测定发酵液、去菌体的上清液和菌体悬浊液的絮凝率,结果如图1所示。菌体悬浊液的絮凝率仅为16.0%,而上清液的絮凝率为81.2%,占混合发酵液的95%。表明起絮凝作用的活性物质主要分布在发酵液中,是微生物发酵过程中产生的多糖、蛋白质等物质,可通过乙醇沉淀法提取微生物絮凝剂[18]。
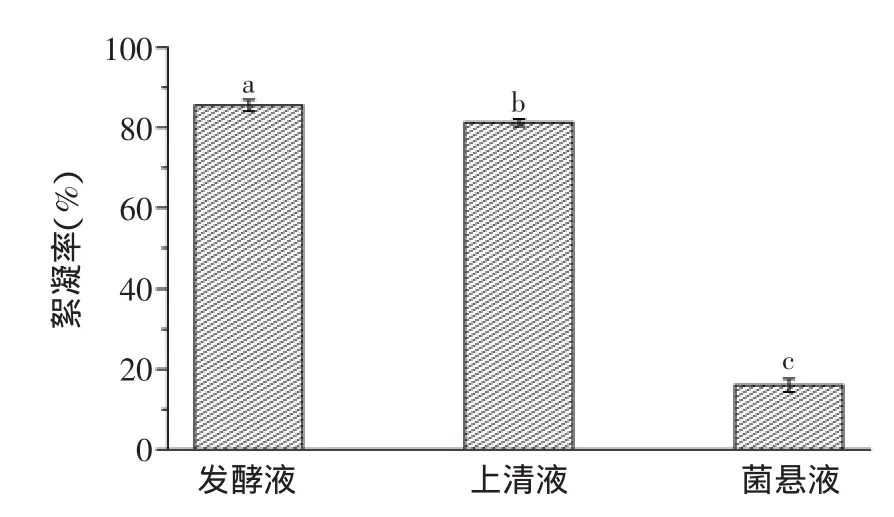
图1 絮凝物质的分布Fig.1 The distribution of flocculation activity
2.2微生物絮凝剂BN-25热稳定性研究
微生物絮凝剂BN-25在沸水浴中加热0~30min,絮凝率变化情况如图2所示。微生物絮凝剂BN-25的热稳定性很好,能耐受较长时间的高温,絮凝活性基本无变化,只在较小范围内上下波动,絮凝率均在81%以上。说明BN-25的活性成分不是对热较为敏感易变性的蛋白质,而可能是不易受热影响的多糖类物质。微生物絮凝剂BN-25的热稳定性具有重要意义,目前已有报道的大部分微生物絮凝剂在80℃以上高温下容易失活[19],絮凝性较差。而在蔗汁澄清工艺中,往往需要将蔗汁加热到80℃以上。因此,微生物絮凝剂BN-25较好的热稳定性为其处理甘蔗混合汁提供了重要的理论依据。
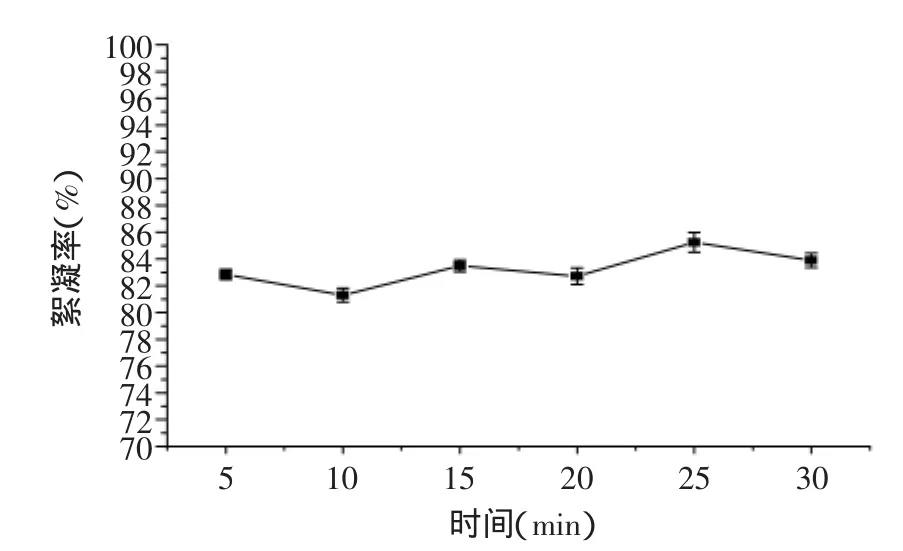
图2 微生物絮凝剂BN-25的热稳定性Fig.2 Thermal stability of bioflocculant BN-25
2.3微生物絮凝剂BN-25成分分析
冷冻干燥后得到微生物絮凝剂BN-25成品0.58g。将絮凝剂BN-25溶于蒸馏水中配成1mg/mL溶液在200~400nm波长范围内进行紫外光谱扫描,如图3所示。在260nm处无核酸的吸收峰,280nm处有一微弱吸收峰,说明微生物絮凝剂BN-25中不含核酸,含有少量蛋白质。经苯酚-硫酸法和Bradford法分别测得BN-25的多糖含量和蛋白质含量为89.5%和9.4%,说明BN-25的主要成分是多糖,这也是其具有较好热稳定性的主要原因。
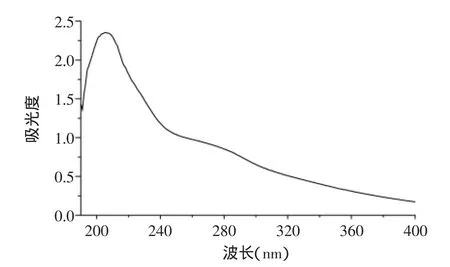
图3 微生物絮凝剂BN-25的紫外光谱图Fig.3 UV scanning spectrum of bioflocculant BN-25
BN-25的红外光谱图如图4所示,在3383、2924、2853、1653、1544、1455、1415、1378、1244、1079、1050cm-1处出现了多个吸收峰。3383cm-1出现的强而宽的吸收峰为羟基和氨基的特征峰,2924cm-1和2853cm-1两处较弱的吸收峰为C-H伸缩振动,1653cm-1处的吸收峰为CONH或CONH2基团中C=O的伸缩振动[20],1544cm-1处吸收峰为氨基的弯曲振动,1455cm-1处吸收峰为C-H的弯曲振动,1415cm-1和1378cm-1处吸收峰为COOH基团中C=O对称伸缩振动[11],1244cm-1处吸收峰为S=O伸缩振动[21],说明BN-25中可能含有硫酸根基团,1079cm-1和1050cm-1处较强吸收峰为C-O伸缩振动引起。因此,根据红外图谱的分析结果可知,微生物絮凝剂BN-25中含氨基、羟基、羧基、硫酸根基团,这些基团在絮凝过程中会通过电离、电中和、吸附架桥等作用使悬浮物质沉淀,达到较好的絮凝效果[22]。
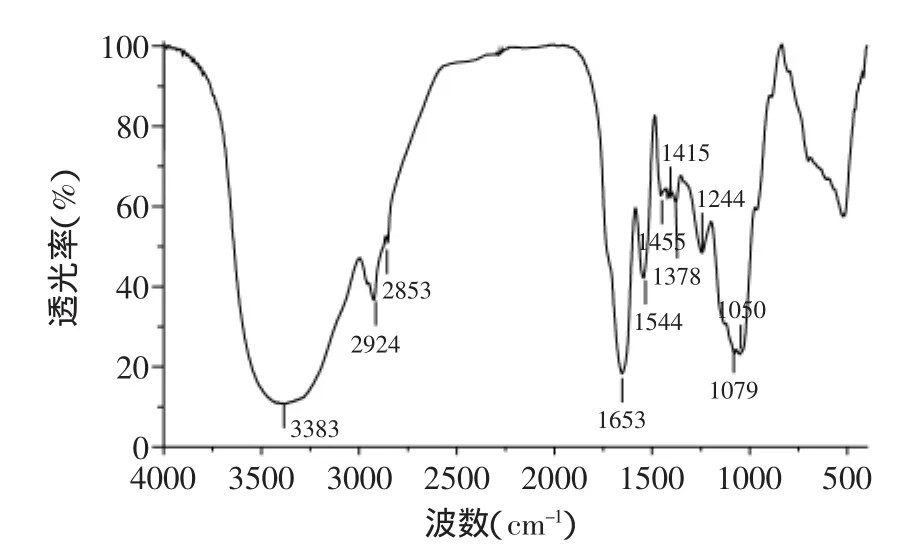
图4 微生物絮凝剂BN-25的红外光谱图Fig.4 FTIR scanning spectrum of bioflocculant BN-25
2.4微生物絮凝剂BN-25与PAM复配处理甘蔗混合汁
将微生物絮凝剂与目前糖厂常用的PAM复配处理甘蔗混合汁。正交实验结果见表2。根据实验结果,分别以色值和浊度为指标进行极差分析和方差分析,结果见表3和表4。

表2 正交实验结果Table 2 The results of orthogonal experiment

表3 各因素水平对色值和浊度的极差分析Table 3 Range analysis of effects on color and turbidity
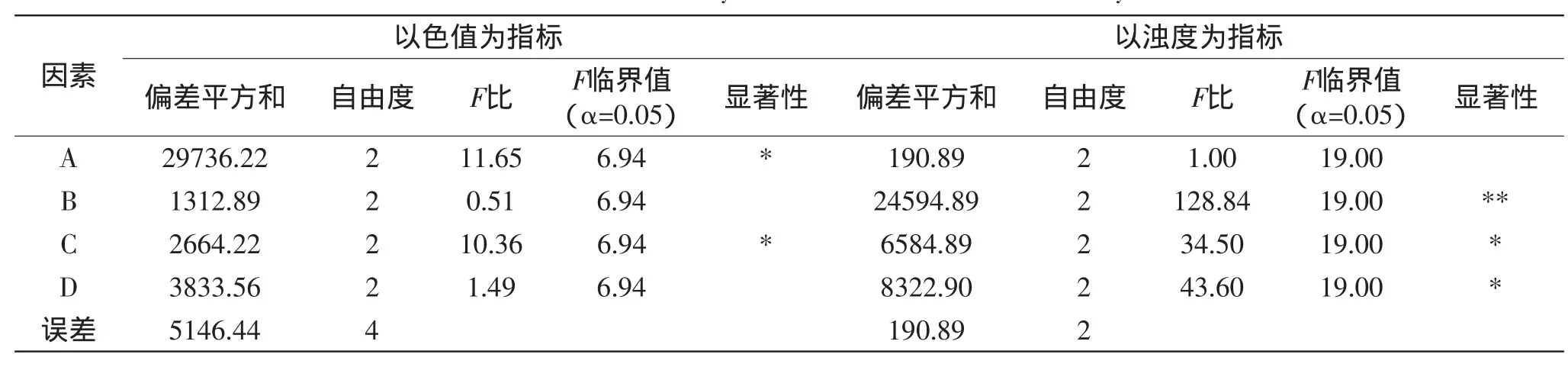
表4 各因素水平对色值和浊度的方差分析Table 4 Variance analysis of effects on color and turbidity
由表3可以看出,各因素对色值影响的大小顺序为C>A>D>B,优水平为A1B2C2D3,对浊度的影响大小顺序为B>D>C>A,优水平为A3B3C3D2。由此可见,达到最大脱色效果时,不一定能达到最大除浊效果[15],需要结合糖厂的实际情况选择合适的工艺条件。由表4可以看出,中和pH和BN-25添加量对色值都有显著影响,二次加热温度和PAM添加量对其没有显著影响。对浊度而言,二次加热温度对其有极显著影响,PAM添加量和BN-25添加量对其也有显著影响,而中和pH对其没有显著影响。综合正交分析结果,确定微生物絮凝剂BN-25与PAM复配最佳工艺条件为:中和pH为6.8,二次加热温度为100℃,BN-25添加量为12mg/L,PAM添加量为1.0mg/L。
按复配条件的最佳工艺条件进行实验,并与单独使用微生物絮凝剂BN-25及PAM的澄清效果对比,结果如图5所示。微生物絮凝剂BN-25和PAM单独处理甘蔗混合汁的添加量分别为18、4mg/L(均为最佳添加量,具体实验数据未列出)。图5结果表明,微生物絮凝剂BN-25对蔗汁具有一定的澄清效果,单独添加BN-25蔗汁色值去除率为40.1%,但浊度去除效果不及PAM,蔗汁仍具有较高的浊度,而单独添加PAM虽然取得了较好的浊度去除效果,但色值仍高达428IU。而微生物絮凝剂BN-25和PAM在最佳复配条件下取得了较明显的脱色和澄清效果,处理后蔗汁色值仅为273IU,浊度仅为84MAU。由此可见,微生物絮凝剂BN-25与PAM复配使用可同时达到较好的脱色和澄清效果,并且PAM的添加量可从4mg/L降至1mg/L,可大大降低蔗汁澄清工艺中PAM的用量,虽然PAM由于其较好的絮凝和助凝效果而广泛用于水处理和部分食品工业,但PAM很难降解,并且其残留单体丙烯酰胺具有致癌作用[23],因此在食品工业中尽可能减少这类有机高分子物质的应用具有重要意义。
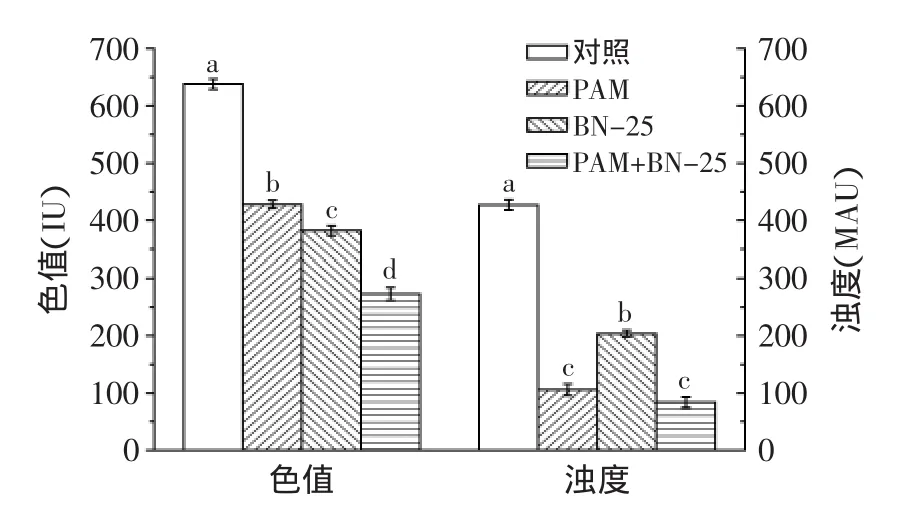
图5 微生物絮凝剂BN-25与PAM复配、单独添加PAM及单独添加BN-25分别处理甘蔗混合汁效果对比Fig.5 Combination of bioflocculant BN-25 and PAM,addition PAM alone,and addition bioflocculant BN-25 alone in clarification process of sugarcane juice
3 结论
微生物絮凝剂是一种新型高效絮凝剂,本文研究了微生物絮凝剂BN-25的絮凝活性分布、热稳定性及其化学成分分析,并将其应用于蔗汁澄清工艺,与PAM复配处理甘蔗混合汁。微生物絮凝剂BN-25的絮凝活性成分主要分布在发酵液中,絮凝率高达81.2%,具有较强的热稳定性,100℃下连续沸水浴30min,絮凝活性保持不变,适合处理二次加热后的甘蔗混合汁。微生物絮凝剂BN-25的主要成分为多糖,其含量达89.5%,且含有大量的氨基、羟基、羧基、硫酸根基团等有利于絮凝的基团。与PAM复配处理甘蔗混合汁,最佳复配条件为中和pH6.8,二次加热温度100℃,BN-25添加量12mg/L,PAM添加量1.0mg/L,处理后澄清效果明显,蔗汁色值仅为273IU,浊度仅为84MAU,优于单独添加PAM,并降低PAM用量75%以上,表明微生物絮凝剂BN-25在制糖行业中具有良好的应用前景。
[1]Liu C,Wang K,Jiang J-H,et al.A novel bioflocculant produced by a salt-tolerant,alkaliphilic and biofilm-forming strain Bacillus agaradhaerens C9 and its application inharvesting Chlorellaminutissima UTEX2341[J].Biochemical Engineering Journal,2015,93:166-172.
[2]He N,Li Y,Chen J.Production of a novel polygalacturonic acid bioflocculant REA-11 by Corynebacterium glutamicum[J]. Bioresource Technology,2004,94(1):99-105.
[3]Salehizadehh,Shojaosadati S A.Isolation and characterisation of a bioflocculant produced by Bacillus firmus[J].Biotechnology Letters,2002,24:35-40.
[4]Aljuboori AHR,Idris A,Abdullah N,et al.Production and characterization of a bioflocculant produced by Aspergillus flavus[J].Bioresource Technology,2013,127:489-493.
[5]Watanabe M,Sasaki K,Nakashimada Y,et al.Growth and flocculation of a marine photosynthetic bacterium Rhodovulum sp[J].Applied Microbiology and Biotechnology,1998,50(6):682-691.
[6]Crabtree K,McCoy E,Boyle W-C,et al.Isolation,identification,and metabolic role of the sudanophilic granules of Zoogloea ramigera[J].Applied Microbiology,1965,13(2):218-226.
[7]Zhong C,Xu A,Wang B,et al.Production of a value added compoundfromtheh-acidwastewater-Bioflocculantsby Klebsiella pneumoniae[J].Colloids and Surfaces B:Biointerfaces,2014,122:583-590.
[8]李楠,邓智年,李贤桢,等.微生物絮凝剂在甘蔗糖厂中的应用研究[J].工业微生物,2006,36(1):43-46.
[9]吴春兰,卢家炯,孙卫东,等.微生物絮凝剂在甘蔗糖业中应用的初步研究[J].甘蔗糖业,2004(2):22-29.
[10]Yin Y-J,Tian Z-M,Tang W,et al.Production and characterization ofhigh efficiency bioflocculant isolated from Klebsiella sp.ZZ-3[J].Bioresource Technology,2014,171:336-342.
[11]Deng S,Bai R,hu X,et al.Characteristics of a bioflocculant produced by Bacillus mucilaginosus and its use in starch wastewater treatment[J].Applied Microbiology and Biotechnology,2003,60(5):588-593.
[12]Zhong C,Xu A,Chen L,et al.Production of a bioflocculant from chromotropic acid waste water and its application in steroid estrogen removal[J].Colloids and Surfaces B:Biointerfaces,2014,122:729-737.
[13]Aljuboori AHR,Uemura Y,Osman N-B,et al.Production of a bioflocculant from Aspergillus niger using palm oil mill effluent as carbon source[J].Bioresource Technology,2014,171:66-70.
[14]李墉.甘蔗制糖化学管理分析方法[M].广州:中国轻工业总会甘蔗糖业质量监督检测中心,1995.
[15]陆冬梅,杨连生.壳聚糖絮凝剂处理亚硫酸法糖厂混合汁的实验研究[J].食品工业科技,2003,24(1):36-37.
[16]吴春兰.微生物絮凝剂在甘蔗糖业中的应用研究[D].南宁:广西大学,2004.
[17]苑慎怀.应用慨率论与数量统计[M].北京:中国纺织出版社,1994.
[18]Xiong Y-Y,Wang Y-P,Yu Y,et al.Production and charatierizationofanovelbioflocculantfromBacillus licheniformis[J].Applied and Environmental Microbiology,2010,76(9):2778-2782.
[19]Gong W X,Wang S G,Sun X-F,et al.Bioflocculant production by culture of Serratia ficaria and its application in wastewater treatment[J].Bioresource Technology,2008,99(11):4668-4674.
[20]Spanò A,Gugliandolo C,Lentini V,et al.A novel EPS-producing strain of Bacillus licheniformis isolated from a shallow vent off Panarea Island(Italy)[J].Current Microbiology,2013,67:21-29.
[21]Yim J-H,Kim S J,Ahn S-H,et al.Characterization of a novel bioflocculant,p-KG03,from a marine dinoflagellate,Gyrodinium impudicum KG03[J].Bioresource Technology,2007,98(2):361-367.
[22]Guo J-Y,Yu J,Xin X,et al.Characterization and flocculation mechanism of a bioflocculant fromhydrolyzate of rice stover[J]. Bioresource Technology,2015,177:393-397.
[23]Matthys C,Bilau M,Govaert Y,et al.Risk assessment of dietary acrylamide intake in Flemish adolescents[J].Food and Chemical Toxicology,2005,43:271-278.
Study on characteristics of bioflocculant BN-25 and its application in clarification process of sugarcane juice
LUO Yu-qin,FU Xiong,HOU Yi*
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
Present study was aimed to assess the characteristics and chemical composition of bioflocculant BN-25.It was observed that active flocculation substances of bioflocculant BN-25 were found mainly in the fermentation broth.The flocculation activity of bioflocculant BN-25 exhibited thermal stability during continuous boiling on water bath for 30minutes.Ultraviolet(UV),Fourier transform infrared(FTIR)and content analysis revealed that bioflocculant BN-25 contained large amount of amino,hydroxyl,carboxyl,and sulfate groups which were favorable for flocculation.With ahigh content of 89.5%,polysaccharide was the main component of bioflocculant BN-25.During the clarification processing of sugarcane juice,bioflocculant BN-25 and polyacrylamide(PAM)were combined and the optimum conditions were pH of 6.8,secondheating temperature of 100℃,bioflocculant BN-25 dosage of 12mg/L,and PAM dosage of 1.0mg/L,which were determined by orthogonal experiment and variance analysis.After treatment by bioflocculant BN-25 and PAM,the color value of sugarcane juice was 273IU and the turbidity was 84MAU,which were superior to those of addition PAM alone.Present findings provided basic data and theoretical foundation for the application of bioflocculant BN-25 in the sugar industry.
bioflocculant;thermal stability;polysaccharide;PAM;clarification processing of sugarcane juice
TS244
B
1002-0306(2015)10-0205-05
10.13386/j.issn1002-0306.2015.10.034
2015-01-16
罗玉琴(1990-),女,硕士研究生,研究方向:功能碳水化合物。
侯轶(1973-),女,博士,高级工程师,研究方向:废水生化处理。
广州市科技计划项目(2013J4500036);广东省科技计划项目(2012B050500003);广东省领军人才项目。

