响应面优化转谷氨酰胺酶改善大豆分离蛋白酶解液乳化稳定性的研究
关天琪,刘 颖,*,窦博鑫,王 秋,张 璐,王胜威,Tatyana K.Kaleni
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.俄罗斯远东联邦大学生物医学学院,俄罗斯海参崴690091)
响应面优化转谷氨酰胺酶改善大豆分离蛋白酶解液乳化稳定性的研究
关天琪1,刘颖1,*,窦博鑫1,王秋1,张璐1,王胜威2,Tatyana K.Kaleni3
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.俄罗斯远东联邦大学生物医学学院,俄罗斯海参崴690091)
实验以大豆分离蛋白为原料,利用碱性蛋白酶对其进行酶解,采用截留分子量为20ku与6ku的中空纤维膜组件对大豆分离蛋白酶解液进行超滤,然后利用转谷氨酰胺酶分别对分子量>20ku、6~20ku以及<6ku的大豆分离蛋白酶解液进行交联。经比较得到:分子量>20ku的大豆分离蛋白酶解液的乳化稳定性上升最为明显,为16.1。采用响应面实验设计,以分子量>20ku的大豆分离蛋白酶解液为研究对象,以反应时间、反应温度、酶添加量及pH为实验因素,乳化稳定性为响应值,获得最佳交联条件为:反应时间1.2h、酶添加量20.6U/g、pH=7.5、反应温度40℃,在此条件下,其乳化性为0.696,较改性前略有降低,但其乳化稳定性为16.25,较改性前提高了33.20%。
大豆分离蛋白酶解液,转谷氨酰胺酶,乳化稳定性,响应面法
大豆分离蛋白是一种重要的植物蛋白产品,其资源丰富,品质优良,蛋白质含量接近动物蛋白,同时还含有大量对人体健康有益的微量元素、磷脂及必需脂肪酸,逐渐成为食品加工中的重要原料[1-2]。但在某些食品体系中,由于大豆分离蛋白溶解性及乳化能力较差的原因限制了其在食品工业中的应用,因而需要对原有大豆分离蛋白进行改性[3]。目前改性的方法有物理改性、化学改性以及酶法改性,其中酶法改性具有催化反应温和而且专一、无副产物等优点,已经成为大豆分离蛋白改性的主要研究发展方向,是具有广阔前景的大豆蛋白的改性方法[4-6]。
转谷氨酰胺酶(transglutaminase,TG)是从微生物中提取的一种能够催化酰基转移反应的转移酶[7-8],它不仅可以改变食品的功能特性,还可以通过交联作用来开发新型及具有更高营养资源的食品[9]。转谷氨酰胺酶对大豆分离蛋白具有很好的改性作用[10],改性后的蛋白质在其乳化稳定性[11]、热稳定性[12]、起泡性[13]、凝胶性[14-15]等方面均有显著改善,因此其在食品领域内的应用已经受得广泛关注。
本实验利用转谷氨酰胺酶对大豆分离蛋白进行改性,研究酶法改性对大豆分离蛋白乳化性及乳化稳定性的影响,采用响应曲面法对交联条件进行优化,从而得到具有最佳乳化稳定性的交联条件,以达到提高大豆分离蛋白乳化稳定性的目的。
1 材料与方法
1.1材料与仪器
脱脂大豆粉哈尔滨高科技集团股份有限公司;转谷氨酰胺酶(TGase) 合肥博美生物科技有限责任公司;碱性蛋白酶北京博奥拓达科技有限公司;十二烷基磺酸钠(SDS)、还原型谷胱甘肽、N-α-CBZ-Gln-GlySigma公司;盐酸、磷酸二氢钠、磷酸氢二钠、氢氧化钠、福林酚试剂均为分析纯;大豆油市售。
Spectrum722E型紫外可见分光光度计上海光谱仪器有限公司;SY-2-4型恒温水浴锅天津市欧诺仪器仪表有限公司;中空纤维膜柱组件、TP10-20型双向恒流泵天津膜天膜工程技术有限公司;pHS-3C型精密pH计上海雷磁仪器厂。
1.2实验方法
碱性蛋白酶酶活采用福林-酚方法测定,参照GB547-80;转谷氨酰胺酶活性采用Folk等报道[16]的分光Hydroxamate分析法测定。大豆分离蛋白的制备以脱脂大豆粉为原料,采用碱提酸沉的方法制取[17]。
1.2.1水解大豆分离蛋白配制质量分数1%的大豆分离蛋白溶液,充分搅拌使其溶解。用0.5mol/L的NaOH调节pH至8.0后,再加入20U/g的碱性蛋白酶,于55℃下酶解120min,反应过程中及时滴加0.5mol/L的NaOH,使其pH稳定在8.0[18]。
1.2.2超滤法分离纯化大豆分离蛋白酶解液采用截留分子量分别为20、6ku的中空纤维膜组件对大豆蛋白酶解液进行超滤分离。得到三种不同分子量范围即分子量>20ku、6~20ku、<6ku的大豆分离蛋白酶解液。
1.2.3不同分子量范围大豆分离蛋白酶解液乳化特性及乳化稳定性的测定乳化性测定采用Pearce and Kinsella方法[19]。取30mL浓度为1%的大豆分离蛋白溶液与10mL大豆油混合,用高速搅拌机剪切5min后用0.1%SDS稀释至10mL立即于500nm下测定其吸光度值,放置10min后再次测定吸光度(以0.1%SDS为空白)。乳化性(EA)=OD500nm;乳化稳定性(ES)=(OD′500nm/OD500nm)×t。其中OD500nm为0min时的吸光度,OD′500nm为10min时的吸光度,t为两次测定吸光度之间的时间间隔。
1.2.4转谷氨酰胺酶交联不同分子量段大豆分离蛋白酶解液质量分数1%的大豆分离蛋白酶解液中加入一定量的TGase,调节pH为6.0,40℃下反应2h,80℃水浴5min灭酶,测定不同分子量段大豆分离蛋白酶解液的乳化性及乳化稳定性。
1.2.5转谷氨酰胺酶交联大豆分离蛋白酶解液对其乳化稳定性的影响
1.2.5.1加酶量对转谷氨酰胺酶催化大豆分离蛋白乳化稳定性的影响以分子量>20ku的大豆分离蛋白酶解液为底物,反应时间1h,转谷氨酰胺酶添加量分别为0、10、20、30、40U/g,pH=7.0,反应温度40℃,测定大豆分离蛋白酶解液的乳化稳定性。
1.2.5.2pH对转谷氨酰胺酶催化大豆分离蛋白酶解液乳化稳定性的影响以分子量>20ku的大豆分离蛋白酶解液为底物,反应时间1h,酶添加量20U/g,调节pH分别至5.0、6.0、7.0、8.0、9.0,在40℃下进行交联,测定大豆分离蛋白酶解液的乳化稳定性。
1.2.5.3反应温度对转谷氨酰胺酶催化大豆分离蛋白酶解液乳化稳定性的影响以分子量>20ku的大豆分离蛋白酶解液为底物,反应时间1h,酶添加量20U/g,pH=7.0,分别在温度35、40、45、50、55℃进行交联,测定大豆分离蛋白酶解液的乳化稳定性。
1.2.5.4反应时间对转谷氨酰胺酶催化大豆分离蛋白酶解液乳化稳定性的影响以分子量>20ku的大豆分离蛋白酶解液为底物,反应温度为40℃,酶添加量20U/g,pH=7.0,反应时间分别为0.5、1、2、4、6h,测定大豆分离蛋白酶解液的乳化稳定性。
1.2.6转谷氨酰胺酶交联大豆蛋白酶解液乳化性能的响应曲面优化设计采用Design-Expert V 8.0.6实验设计及统计分析软件中的Box-Behnken程序,根据单因素实验确定反应时间、酶添加量、pH、反应温度为转谷氨酰胺酶催化大豆分离蛋白乳化稳定性实验的主要考察因素,分别以X1、X2、X3及X4表示。设计大豆分离蛋白酶解液的响应曲面实验,因素水平编码见表1。

表1 响应面实验优化大豆分离蛋白酶解液的因素水平编码表Table 1 Factors and levels in response surface design
1.2.7数据处理采用Design-Expert V 8.0.6进行实验设计和数据处理,所有实验数据均进行3次重复。
2 结果与讨论
2.1大豆分离蛋白的水解及其对乳化特性的影响
如图1所示,经碱性蛋白酶酶解后,LP的乳化性有所升高,但其他组分的乳化性与未酶解的SPI相比均有所下降,这说明体系的乳化性与大豆蛋白的分子量有一定的关系,随着分子量的减小,其乳化性呈现出下降的趋势。酶解后LP、LP-SP、SP的乳化稳定性也有所下降。

图1 不同分子量段大豆分离蛋白酶解液以及大豆分离蛋白溶液的乳化特性比较Fig.1 The emulsifying property of the SPI hydrolysates with the different molecular and SPI
2.2TGase交联不同分子量段大豆分离蛋白酶解液对其乳化性的影响
如图2所示,转谷氨酰胺酶交联大豆蛋白酶解液,使大豆蛋白酶解液乳化性略有降低,其中LP的乳化性从0.734下降到了0.541。这种现象出现的原因是大豆分离蛋白经TGase交联后,其二级结构和三级结构逐渐打开,多肽链变的舒展,使原先埋藏于分子内部的诸多疏水区域暴露于溶液,然而这种疏水区域在水溶液中是不稳定的,它们会因相互疏水作用而凝集或聚合在一起,进而从溶液中析出而沉降,从而使大豆分离蛋白的表面疏水性增加[20]。这说明转谷氨酰胺酶对大豆分离蛋白酶解液的交联并没有使其乳化性有所改善,反而使其乳化性略有降低,这一现象与唐传核[13]、田少君[20]在研究转谷氨酰胺酶改性大豆分离蛋白乳化性方面得出的结论一致。

图2 转谷氨酰胺酶交联大豆分离蛋白酶解液前后乳化性的比较Fig.2 The influence of cross-linking of TGase on the emulsifying property of SPI hydrolysates
如图3所示,分子量20ku以上的肽段之间相互交联,其乳化稳定性最好,改性前为12.2,而改性后达到16.1,较改性前提高了33.20%。其他组分的乳化稳定性也有所上升,但是没有LP组分的乳化稳定性高,这说明分子量对于体系的乳化稳定性有很大的影响。

图3 转谷氨酰胺酶交联大豆分离蛋白酶解液前后乳化稳定性的比较Fig.3 The influence of cross-linking of TGase on the emulsion stability of SPI hydrolysates
2.3转谷氨酰胺酶改善大豆分离蛋白乳化稳定性研究
2.3.1加酶量对转谷氨酰胺酶改善大豆分离蛋白乳化稳定性的影响如图4所示,在加酶量0~10U/g时,由于经过碱性蛋白酶酶解,使其分子内的疏水基大部分裸露在外,不能较好的形成油水界面,随着加酶量的增加,一些小分子聚合形成稳定的小分子团,使其乳化稳定性有所改善;在加酶量为30U/g时,可能由于加酶量的增加,使分子间的聚合能力增强,导致其乳化稳定性降低。从图4中可以看出加酶量为20U/g时大豆蛋白酶解液的乳化稳定性最高为15.5,所以确定转谷氨酰胺酶改善大豆分离蛋白酶解液乳化稳定性的较优加酶量为20U/g。
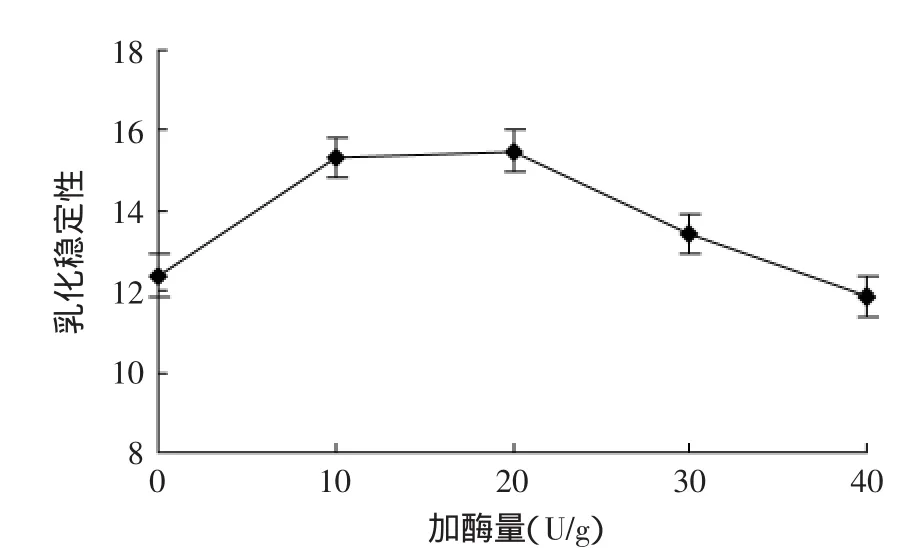
图4 加酶量对大豆分离蛋白酶解液乳化稳定性的影响Fig.4 Effect of TGase addition amount on the emulsion stability of SPI hydrolysates
2.3.2pH对转谷氨酰胺酶改善大豆分离蛋白乳化稳定性的影响如图5所示,大豆分离蛋白的乳化稳定性在pH范围为5.0~6.0时呈下降的趋势,原因是由于大豆分离蛋白在酸性环境下的溶解度较低,随着pH的升高其亲水能力增加,疏水能力降低,导致溶液乳化稳定性降低;在pH范围为6.0~7.0时,经酶的聚合作用使溶液内小分子聚合,整个溶液体系逐渐趋于稳定,使大豆分离蛋白的乳化稳定性增加;随着pH的逐渐增大,溶液就会出现过碱的情况,导致酶活力的降低,使大豆分离蛋白的稳定环境遭到破坏,最终导致其乳化稳定性降低。从图5中可以看出,当反应溶液的pH为7.0时溶液的乳化稳定性较其他pH条件下的乳化稳定性高,在此反应条件下为15.8,所以确定转谷氨酰胺酶改善大豆分离蛋白酶解液乳化稳定性的较优pH为7.0。

图5 pH对大豆分离蛋白酶解液乳化稳定性的影响Fig.5 Effect of pH on the emulsion stability of SPI hydrolysates
2.3.3反应温度对转谷氨酰胺酶改善大豆分离蛋白乳化稳定性的影响如图6所示,当反应温度为40℃时,大豆分离蛋白的乳化稳定性达到最高,这可能是因为酶有自身的最适温度,在这一温度下反应速度最大,可以使大豆分离蛋白最大限度水解从而使其侧链的亲水基朝向水相,疏水基朝向油相,使酶解后的蛋白质分子易于定位于油-水界面,使得水和油之间的界面张力减小,乳化性稳定增大[21]。如果反应温度继续增加,酶将失去活性从而导致整个溶液体系的乳化稳定性再次降低。从图6中可以看出反应温度为40℃时溶液的乳化稳定性最高为15.8,所以确定转谷氨酰胺酶改善大豆分离蛋白乳化稳定性的较优反应温度为40℃。

图6 反应温度对大豆分离蛋白酶解液乳化稳定性的影响Fig.6 Effect of hydrolysis temperature on the emulsion stability of SPI hydrolysates
2.3.4反应时间对转谷氨酰胺酶改善大豆分离蛋白乳化稳定性的影响如图7所示,随着反应时间的增加,溶液中的小分子逐渐聚合,最终形成即具有疏水性又逐渐稳定的大分子聚合物,从而使溶液的乳化稳定性增加;随着反应时间的延长,溶液的乳化稳定性又出现下降的趋势,反应4h后溶液的乳化稳定性又有所升高。推断出现这一现象的原因是随着反应时间的延长,导致溶液中形成的大分子聚合物不稳定,其疏水基团裸露在外,从而使溶液的乳化稳定性略有增加。从图7中可以看出当反应时间为1h,大豆分离蛋白溶液的乳化稳定性最高为14.3,所以确定转谷氨酰胺酶改善大豆分离蛋白乳化稳定性的较优反应时间为1h。

图7 反应时间对大豆分离蛋白酶解液乳化稳定性的影响Fig.7 Effect of hydrolysis time on the emulsion stability of SPI hydrolysates
2.4转谷氨酰胺酶改善大豆分离蛋白酶解液乳化稳定性的响应曲面优化设计结果分析
2.4.1实验结果及模型方差分析响应曲面实验结果见表2,以回归系数建立大豆蛋白酶解液乳化稳定性(Y)与反应时间(X1)、酶添加量(X2)、pH(X3)、反应温度(X4)的响应面回归方程为:
Y=-547.75474+10.29125X1+0.71596X2+ 125.67500X3+3.80615X4-0.050000X1X2+0.74000X1X3-0.19625X1X4+0.11800X2X3+8.87500X2X4+0.085000E-003X3X4-2.97833X12-0.046183X22-8.77333X32-0.054740X42
由表3可知,从回归方程各项方差的检验可以看出,回归模型p<0.05,模型显著,而失拟项p值为0.8997>0.05,模型失拟项不显著,无失拟因素存在。相关系数(Adj R-Squard)R2adj=0.9976、R2=0.9988,说明该模型能反映99%响应值的变化,因而该模型拟合程度较好,实验误差较小,说明模型的预测值与实际值非常吻合;由表3可知,一次项的回归系数绝对值的大小依次为X1>X2>X3>X4,即影响转谷氨酰胺酶改善大豆分离蛋白酶解液的乳化稳定性的因素的顺序依次为:反应时间>酶添加量>pH>反应温度。这表明反应温度对大豆蛋白酶解液的乳化稳定性影响最小,但影响还是显著的(p<0.05);反应时间对大豆分离蛋白酶解液的乳化稳定性影响最大;X1、X2、X3、X4均为正效应影响。
利用响应曲面设计实验,运用根据Box-Benhnken的中心组合实验设计原理,得到转谷氨酰胺酶改善大豆分离蛋白酶解液的乳化稳定性最佳组合条件为:反应时间1.2h、酶添加量20.6U/g、pH=7.5、反应温度40℃,此条件下的乳化性为0.696,乳化稳定性为16.25。
2.4.2因素交互作用响应面分析结合本研究中的二次回归方程及表3可知,二次项X1X2、X1X4、X1X3、X2X3、X2X4、X3X4具有显著的交互作用(p<0.05)。通过立体响应面和等高线可解释说明实验中自变量和因变量的关系,如图8~图13所示。

表2 响应曲面实验设计及结果Table 2 Design and results of response surface experiment

表3 响应曲面实验结果方差分析Table 3 Variance analysis of response surface design

图8 反应时间与酶添加量对大豆分离蛋白酶解液的乳化稳定性影响的响应曲面图Fig.8 Response surface of hydrolysis time and TGase addition amount on the emulsion stability of SPI hydrolysates

图9 反应时间与pH对大豆分离蛋白酶解液的乳化稳定性影响的响应曲面图Fig.9 Response surface of hydrolysis time and pH on the emulsion stability of SPI hydrolysates
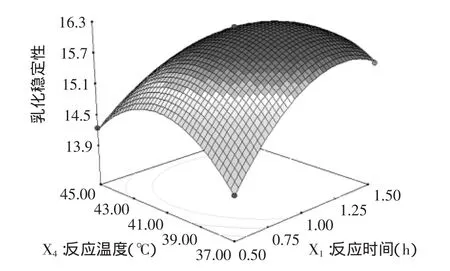
图10 反应时间与反应温度对大豆分离蛋白酶解液的乳化稳定性影响的响应曲面图Fig.10 Response surface of hydrolysis time and hydrolysis temperature on the emulsion stability of SPI hydrolysates
在四个显著影响因素交互作用的响应面中,从图10中可以看出,反应时间和反应温度的交互作用对大豆蛋白酶解液的乳化稳定性有明显影响,当反应时间不变时,随着反应温度的增加乳化稳定性出现先升高后降低的趋势,由此可见,反应时间和反应温度对大豆分离蛋白酶解液的乳化稳定性的交互影响存在极大值。比较反应时间、酶添加量、pH、反应温度这四个因素中每两个因素的交互作用,对大豆分离蛋白酶解液的乳化稳定性的影响结果,均升高后降低,响应值呈抛物线形趋势,因此回归方程有极大值。采用最优工艺:反应时间1.2h、酶添加量20.6U/g、pH=7.5、反应温度40℃。重复实验3次并计算平均值,此条件下得到的乳化稳定性为16.25,与理论预测值16.268相比,其相对误差为0.005%,说明该模型可以较好的模拟和预测大豆分离蛋白酶解液的乳化稳定性,拟合情况良好,达到设计要求。

图11 酶添加量与pH值对大豆分离蛋白酶解液的乳化稳定性影响的响应曲面图Fig.11 Response surface of TGase addition amount and pH on the emulsion stability of SPI hydrolysates

图12 酶添加量与反应温度对大豆分离蛋白酶解液的乳化稳定性影响的响应曲面图Fig.12 Response surface of TGase addition amount and hydrolysis temperature on the emulsion stability of SPI hydrolysates

图13 pH与反应温度对大豆分离蛋白酶解液的乳化稳定性影响的响应曲面图Fig.13 Response surface of pH and hydrolysis temperature on the emulsion stability of SPI hydrolysates
3 结论
3.1大豆分离蛋白经碱性蛋白酶酶解后进行超滤,获得三种不同分子量范围的大豆蛋白酶解液,即分子量为>20ku、6~20ku之间以及<6ku。经转谷氨酰胺酶分别对其进行交联后的三种组分乳化性均有所降低,其中分子量<6ku的大豆分离蛋白酶解液的乳化性下降最为明显,下降到0.222;但三种组分的乳化稳定性均有所上升,其中分子量>20ku的大豆分离蛋白酶解液的乳化稳定性上升最为明显,达到16.1,其乳化稳定性明显优于其他两种组分。
3.2响应曲面优化转谷氨酰胺酶改善分子量>20ku的大豆分离蛋白酶解液乳化稳定性的最佳工艺条件为:反应时间1.2h、酶添加量20.6U/g、pH=7.5、反应温度40℃。在此条件下,其乳化性为0.696,较改性前略有降低,但其乳化稳定性为16.25,较改性前提高了33.20%。
[1]连玉新,张东杰,王颖.响应面法优化酶改性大豆分离蛋白条件的研究[J].黑龙江八一农垦大学学报,2012,24(2):65-70.
[2]李玉珍,林亲录,肖怀秋.大豆分离蛋白在肉制品中的应用研究[J].肉类研究,2006(1):26-29.
[3]黄友如,华欲飞,裘爱泳.醇洗豆粕对大豆分离蛋白功能性质的影响(II)--乳化性能[J].中国油脂,2003,28(11):35-37.
[4]李川.大豆蛋白改性[J].食品工业科技,2000,21(3):75-76.
[5]陈春佳,张宝琴.大豆蛋白质功能性调整及其他产品的开发利用[J].食品科技,2000,25(4):21-23.
[6]刘大川,杨国艳.大豆分离蛋白的制备及产品功能性研究[J].中国油脂,2004,29(12):56-61.
[7]刘心伟,吕加平,范贵生.微生物转谷氨酰胺酶在食品工业中的研究进展[J].内蒙古农业大学学报,2005,26(4):54-57.
[8]Kanaji T,Ozaki H,Takao T,et al.Primary structure of microbial transglutaminase from Streptovertillium[J].Agric Biol Chem,1993,268(16):11565-11572.
[9]贺雷雨,李新华,王璋.谷氨酰胺转胺酶及其在食品加工中的应用[J].中国食物与营养,2004(4):32-34.
[10]梁华民,田少君,周怡,等.转谷氨酰胺酶对大豆分离蛋白交联聚合作用研究[J].粮食与油脂,2004(2):3-6.
[11]张海均,程仲毅,姚开.转谷氨酰胺酶聚合改性大豆分离蛋白的功能特性研究[J].食品科学,2013,38(2):33-37.
[12]Chuan-He Tang,Zhong Chen,Lin Li,et al.Effects of transglutaminase treatment on the thermal properties of soy protein isolates[J].Food Research International,2006(39):704-711.
[13]唐传核,杨晓泉,赵谋明,等.MTGase聚合大豆蛋白及其改性机理(II)MTGase聚合改性大豆蛋白研究[J].中国粮油学报,2004,19(2):66-70.
[14]田少君,梁华民.转谷氨酰胺酶对大豆分离蛋白凝胶性的影响[J].中国油脂,2005,30(8):42-45.
[15]张华江,迟玉杰.两种改性技术提高大豆分离蛋白凝胶性能的研究[J].中国粮油学报,2008,23(4):56-60.
[16]Folk JE.Structural requirements of specific substrate for guinea pig liver Transglutaminase[J].Biol Chem,1965(240):2951-2960.
[17]石彦国.大豆制品工艺学[M].北京:中国轻工业出版社,2009:246-249.
[18]汪建斌,邓勇.Alcalase碱性蛋白酶对大豆分离蛋白水解作用的研究[J].食品工业科技,2002,23(1):61-62.
[19]Xian-Sheng Wang,Chuan-He Tang,Bian-Sheng Li,et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids,2008,6(4):560-567.
[20]田少君,梁华民.转谷氨酰胺酶对大豆分离蛋白的改性研究[J].粮油加工与食品机械,2005(6):54-56.
[21]张平安,赵秋艳,李宁,等.响应曲面优化木瓜蛋白酶提高大豆分离蛋白乳化性的研究[J].河南农业大学学报,2011,45(5):585-589.
Optimization of transglutaminase improve the emulsion stability of soy protein isolate hydrolysates by response surface methodology
GUAN Tian-qi1,LIU Ying1,*,DOU Bo-xin1,WANG Qiu1,ZHANG Lu1,WANG Sheng-wei2,Tatyana K.Kaleni3
(1.College of Food Engineering,Harbin University of Commerce,Harbin 150076,China;2.College of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;3.School of Biomedicine Russian Far Eastern Federal University,Vladivostok 690091,Russia)
The experiment took soy protein isolate as the raw material,used alkaline protease to hydrolysis them. The separation and purification of soy protein isolate hydrolysates was done by hollow fiber ultrafiltration,which the polymer molecular weight were 20ku,6ku respectively.Then cross-linking the different molecular weight ranges>20ku,6~20ku and<6ku soy protein isolate hydrolysates with transglutaminase respectively.The results showed that after transglutaminase crosslinked,the emulsion stability of the molecular weight range>20ku soy protein isolate hydrolysates was the best,increased to 16.1.On the basis of the single factor experiment,response surface methodology was used to optimize the technical parameters.The molecular weight>20ku soy protein isolate hydrolysates as the research object and the optimal parameters were as follows:enzymolysis time 1.2h,enzyme added 20.6U/g,pH7.5,temperature 40℃.Under these conditions the emulsification of soy protein isolate hydrolysates was 0.696,compared to unmodified soy protein isolate decrease slightly.The emulsifying stability of soy protein isolate hydrolysates increased to 16.25,compared to unmodified soy protein isolate increase 33.20%.
soyproteinisolatehydrolysates;transglutaminase;emulsifyingproperties;respondsurfacemethodology
TS201.2
A
1002-0306(2015)10-0192-07
10.13386/j.issn1002-0306.2015.10.031
2014-09-26
关天琪(1989-),女,硕士研究生,研究方向:植物蛋白。
刘颖(1968-),女,博士,教授,研究方向:食品生物技术。
哈尔滨商业大学研究生创新项目(YJSCX2013-235HSD);中俄合作项目(13-06-0610-m_a)。

