树莓酒自然发酵过程中酵母菌的分离与鉴定
武伟伟,牟德华,李 艳,2,*
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050018)
树莓酒自然发酵过程中酵母菌的分离与鉴定
武伟伟1,牟德华1,李艳1,2,*
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050018)
目的:从树莓酒自然发酵过程中分离和鉴定酵母菌,目的是筛选适宜树莓酒发酵特点的专用酵母菌株。方法:采用传统微生物分离纯化技术与和26S rDNA D1/D2区序列分析相结合的方法,从树莓酒自然发酵的不同时期分离纯化酵母菌,结合菌落和细胞显微形态特征进行区分,随机选择代表菌株进行26S rDNA D1/D2区序列分析。结果:从树莓酒自然发酵过程中共分离出323株酵母菌,形态学初步鉴定为12类,分子鉴定为分属于5个属的7种酵母菌,分别为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、东方伊萨酵母(Issatchenkia terricola)、酿酒酵母(Saccharomyces cerevisiae)、覆膜孢酵母属亚种(Saccharomycopsis crataegensis)、叉开假丝酵母(Candida diversa)、东方拟无枝酸菌(Candida sorboxylosa)和假丝酵母属亚种(Candida stellimalicola)。结论:传统的微生物培养形态区分与分子鉴定技术结合,对筛选树莓酒自然发酵过程中的酵母菌准确有效。
树莓酒,自然发酵,酵母菌,26S rDNA D1/D2区序列分析
树莓为蔷薇科悬钩子属植物,其果实营养丰富,风味独特,色泽诱人[1-2]。树莓果富含维生素、氨基酸、矿物元素等多种营养成分以及黄酮、花青素和水杨酸等药用成分,具有抑制癌细胞生长和预防心血管病等功效,是理想的天然保健食品[3-6]。我国对树莓进行生产性栽培,现已实现大规模人工种植[7-8],深加工产品主要是树莓酒,它属于非粮食酿造的低度酒,在国际市场中十分名贵,是西方国家的高档果酒。长期饮用树莓酒能调整人体生理平衡,益于身体健康[9]。目前国内对于树莓和树莓酒的研究多集中于育苗和酿酒工艺[2,7],所用发酵菌都使用葡萄酒酵母,尚无树莓酒发酵专用酵母菌,而树莓含酸量远高于葡萄,且有机酸种类和比例也有很大差异,香气物质基础也有所不同。因此,从树莓自然发酵过程中分离鉴定酵母菌,对于筛选具有发酵树莓酒特色的菌株具有现实意义。
树莓酒是一系列酵母菌相互作用的结果,在发酵过程中,酵母菌的代谢作用将树莓汁中的可发酵糖类转化成酒精和各种风味物质[10-11]。因树莓汁糖度低、酸度高,普通酵母菌的生理代谢会受到抑制,导致生产性能下降。26S rDNA D1/D2区序列分析法是目前常用于鉴定酵母菌的分子方法,26S rDNA是编码核糖体26S rRNA的基因,26S rDNA D1/D2区序列长度在600bp左右,位于大亚基的5′端。研究表明该段区域具有较高的突变率,可用于亲缘关系较近的菌株之间的分类研究[12]。本研究是采用传统的微生物分离纯化技术结合26S rDNA D1/D2区序列分析法,对树莓酒自然发酵过程中不同时期的酵母菌进行分离纯化,并进行分子鉴定,以确定酵母菌的属、种及变化规律,为进一步筛选具有快速启动低酸环境果汁发酵、且耐酸、降酸的树莓酒发酵用酵母菌奠定基础。
1 材料与方法
1.1材料与仪器
树莓果2013年采摘于河北省石家庄市赞皇县;葡萄糖、蛋白胨、酵母浸粉、琼脂、胰蛋白胨、磷酸二氢钾、氯化钾、硫酸镁、氯化钙、氯化铁、硫酸锰、溴甲酚绿、琼脂、引物[NL1(5′-GCATATCAATAAGCGG AGGAAAAG-3′)、NL4(5′-GGTCCGTGTTTCAAGAC GG-3′)]、限制性内切酶(HaeⅢ,HinfⅠ,HhaⅠ) 均为分析纯,购自上海生工生物工程技术服务有限公司。
S1000TMThermal Cycler PCR仪、Molecular Imager Gel DocTMXR+凝胶成像分析仪均为美国BIO-RAD公司;DYY-8C型琼脂糖水平板电泳仪北京六一仪器厂。
1.2实验方法
1.2.1培养基配制YEPD培养基参考文献[13]方法配制,WL培养基参考文献[14]方法配制。
1.2.2样品的采集与处理树莓采摘后,置于无菌袋中,密封,24h内运回实验室。取100g在超净工作台的无菌条件下进行手工破碎,破碎后放入250mL已灭菌的锥形瓶中,盖好发酵栓后水封。28℃恒温培养箱中进行自然发酵。实验共进行了3批。
1.2.3酵母菌的分离鉴定和动态规律研究在树莓酒自然发酵过程中设6个采样点,分别在发酵的第0、2、4、7、9、11d取样进行酵母菌的分离,并研究酵母菌的动态变化。每次取发酵液1mL,连续梯度稀释后取三个适当稀释度的稀释液0.2mL分别涂布于3个YEPD平板培养基,28℃下恒温培养2d,对不同形态的酵母菌进行分离并计数,得到各形态酵母菌所占比例,以研究各种酵母在发酵过程中的动态变化。经划线纯化培养后进行初筛保藏。在此基础上,挑选各形态的酵母菌,在WL培养基上划线纯化,28℃下培养2d,进行酵母菌的纯化和复筛,所得单菌落酵母菌用20%甘油,-20℃下保藏备用。
1.2.4酵母菌形态聚类分析将保藏的酵母进行活化,用WL培养基复筛鉴别,28℃培养2d后,依据酵母菌的菌落大小、颜色、表面光滑程度、边缘是否整齐等特征进行初步形态聚类[15-16]。
1.2.5酵母菌26S rDNA D1/D2区序列分析将不同形态的酵母菌,随机选择1株进行26S rDNA D1/D2区序列分析鉴定。鉴定程序如下:
a.DNA提取:SDS裂解法[17]。
b.PCR反应体系(50uL):ddH2O 40.5uL,缓冲液buffer 5uL,dNTP 1uL,上游引物1uL,下游引物1uL,Taq聚合酶0.5uL,DNA模板1uL。
c.PCR反应条件:95℃预变性5min,95℃变性1min,52℃退火2min,72℃延伸2min,共35个循环,最终72℃延伸10min[11]。
琼脂糖凝胶电泳的胶浓度为1%,90V下电泳1h。经EB溶液染色10min后置于凝胶成像仪上观察,拍照和分析。
d.限制性内切酶HhaⅠ,HaeⅢ和HinfⅠ[18]酶切分析。
酶切体系(20uL):双蒸水9uL,buffer2uL,PCR产物8uL,限制性内切酶1uL。
酶切条件:37℃水浴2.5h。
琼脂糖凝胶电泳的胶浓度为2%,90V下电泳1h。经EB溶液染色10min后置于凝胶成像仪上观察,拍照和分析。
e.测序:将26S PCR产物送至上海生工生物工程技术服务有限公司进行测序。
1.3数据分析及菌种的比对鉴定
凝胶成像及条带分析使用软件Image Lab Version 4.0,分析各PCR片段及酶切片段的大小,初步分类后将26S PCR产物送至上海生工生物工程技术服务有限公司进行测序。将所得基因序列结果登陆NCBI,进行BLAST比对,与模式菌相似度大于99%确定其属种。使用数据和图表处理软件Microsoft Excel 2003发酵过程中酵母菌动态变化。
2 结果与分析
2.1酵母菌的分离与形态聚类分析
从三批自然发酵的树莓酒中共分离筛选出323株酵母菌。根据菌落形态结合细胞显微形态初步区分为12种类型,结果见表1。菌落形态主要包括:菌落大小、颜色、表面光滑程度、边缘是否整齐、菌落是否有突起等。
分别进行的3批树莓酒自然发酵,前2批发酵样品果香味浓郁,而第三批发酵样品有染菌现象,表面有菌醭出现,味道不新鲜。从表1也可看出,3批自然发酵的树莓酒中所分离到的酵母菌不尽相同,有染菌现象的第三批样品中,酵母菌种类明显比前2批多。3批样品中均分离到的酵母菌有形态1、2、3和12,形态5、6、7、8、9、10只出现在第三批发酵样品中。形态4出现在前2批发酵中,形态11出现在第一和第三批发酵中。可见自然发酵的可控程度较差,受树莓原料的新鲜、成熟度、生长环境和条件的影响极大。仅在第3批样品中出现的酵母菌会导致发酵失败或风味破坏,应该防治。

表1 WL培养基上酵母菌的形态特征及数量Table 1 Morphological characteristics and number of the yeasts on WL medium
2.226S rDNA D1/D2区序列分析
核糖体DNA(rDNA)是编码核糖体RNA的基因,其上26S rDNA D1/D2区具有较高的突变率,可作为亲缘关系较近的菌株之间的分类研究[12,19]。在初步形态聚类的基础上,从每种形态的酵母菌中随机选取1株进行26S rDNA D1/D2区序列分析,PCR扩增产物电泳图见图1。利用三种限制性内切酶HaeⅢ、HinfⅠ和HhaⅠ对PCR扩增产物特定片段进行酶切,酶切电泳图见图2。
如图1所示,只有形态9酵母菌的PCR扩增产物长度在425bp,其余11种形态的酵母菌PCR扩增产物长度均在650bp左右。因此,对于PCR扩增产物长度相近,难以区分的菌种,需要采用内切酶进行酶切予以区分。由图2可见,PCR扩增产物经三种限制性内切酶酶切后,可将12种形态的酵母菌区分为7种分子类型。酵母菌26S rDNA D1/D2区PCR产物及酶切产物分析见表2。
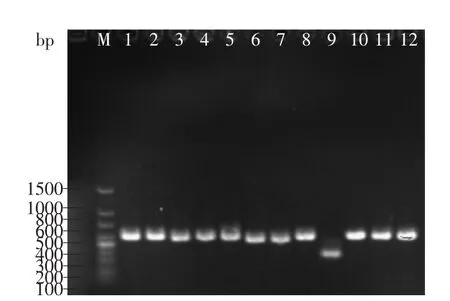
图1 26S rDNA D1/D2区PCR产物电泳图谱Fig.1 PCR electrophoretogram of 26S rDNA D1/D2 region

图2 三种限制性内切酶酶切分析图谱Fig.2 Restriction analysis pattern of PCR-amplified 26S rDNA D1/D2 region

表2 酵母菌26S rDNA D1/D2区PCR产物及酶切产物分析Table 2 Analysis of 26S rDNA D1/D2 region PCR production and restriction fragment about yeast isolates
由表2可知,形态不同的1、2、8、11、12以及形态6、7酵母菌,分子类型相同。3批发酵实验样品中均分离到的酵母菌只涉及到分子类型Ⅰ、Ⅱ。分子类型Ⅲ在发酵正常的前2批样品中分离到。其他4种分子类型的酵母菌都是在第3批染菌的样品中分离出来的。在三批发酵中,分子类型Ⅰ、Ⅱ、Ⅲ为优势菌群,其菌落形态如图3。
7种分子类型酵母菌26S rDNA D1/D2区序列分析的结果见表3。
从表3可看出,经过形态初步聚类分析和26S rDNA D1/D2区分析,12种形态的酵母菌分别属于5个属的7个种。5个属分别为汉逊酵母属(Hanseniaspora),涉及形态1、2、8、11、12;伊萨酵母属(Issatchenkia),形态3;酿酒酵母属(Saccharomyces),形态4;覆膜孢酵母属(Saccharomycopsis),形态5;假丝酵母属(Candida),涉及形态6、7、9、10。其中假丝酵母属中出现三个种,分别为Candida diversa(形态6、7),Candida sorboxylosa(形态9),Candida stellimalicola(形态10)。由此可知,发酵正常的树莓酒涉及到汉逊酵母(Hanseniaspora)、伊萨酵母(Issatchenkia)和酿酒酵母(Saccharomyces)。而造成染菌的酵母是覆膜孢酵母(Saccharomycopsis)和假丝酵母(Candida),前者是一种生防菌,其与NaHCO3结合使用能够显著提高对柑橘果实绿霉病的防治效果[20-21]。李双石等[22]研究后者,表明假丝酵母属等非酿酒酵母中的大多数可引起酒类的病害,但若控制得当,也可丰富酒的风味。
2.3树莓酒自然发酵过程中酵母菌的动态变化
自然发酵是一个复杂的过程,涉及到一系列不同酵母菌的相互作用[23]。一般来说,发酵前期,非酿酒酵母为优势菌种[24]。随着发酵进行到中后期,酒精含量升高,不耐酒精的非酿酒酵母逐渐减少,耐酒精的酿酒酵母逐渐占据主导地位,直至发酵结束[17,25]。树莓酒自然发酵过程中酵母菌的菌群动态变化见图4。

表3 酵母菌26S rDNA D1/D2区序列分析结果Table 3 Results of sequence analysis about yeast 26S rDNA D1/D2 region
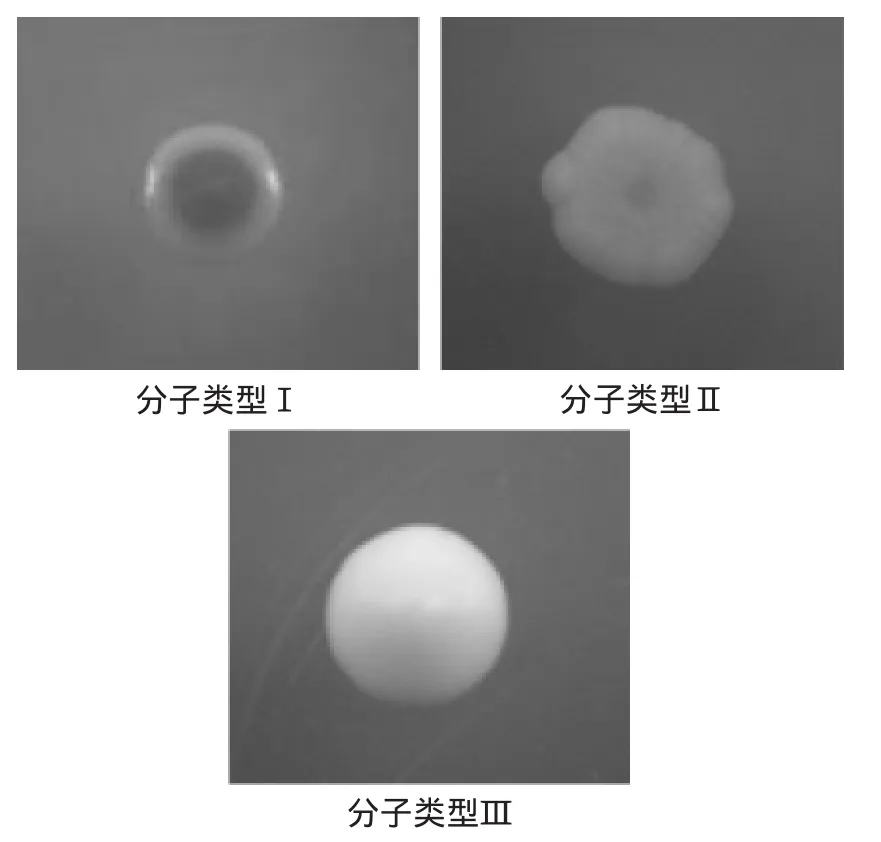
图3 三种优势酵母菌的菌落形态Fig.3 Colony morphology of three genera of the dominant yeast

图4 树莓酒发酵过程中酵母菌的菌群动态变化Fig.4 Yeast population dynamics during raspberry fermentations
从图4可看出,前2批发酵过程中酵母菌的动态变化较一致。发酵初期(0~2d)优势菌群为Hanseniaspora uvarum和Issatchenkia terricola,即非酿酒酵母。随着发酵的进行,到2~4d时,开始出现酿酒酵母Saccharomyces cerevisiae;随后,逐渐成为优势菌群,直至发酵结束,与David Espírito Santo[26]和R.Pando Bedriñana等[27]研究的发酵趋势较一致。第三批树莓酒自然发酵中,酵母菌的种类和数量发生了明显的变化。出现了Saccharomycopsis crataegensis、Candida diversa、Candida sorboxylosa和Candida stellimalicola四种酵母,这是前2批没有出现的。发酵的第0d,优势菌群仍然是Hanseniaspora uvarum,但有极少量的Candida sorboxylosa出现。第2~4d时,酵母菌群落结构依然是Hanseniaspora uvarum和Issatchenkia terricola构成。自发酵的中后期第7d开始出现Saccharomycopsis crataegensis、Candida diversa和Candida stellimalicola,但比例较小。Issatchenkia terricola始终是优势菌群。发酵过程中没有分离到酿酒酵母(Saccharomyces cerevisiae),发酵前期可能是因为数量少没有分离到;发酵中后期可能是大量杂菌的出现抑制了酿酒酵母的生长,反过来说,酒精生成量少也利于杂菌的繁殖。自然发酵毕竟是一个开放的环境,除原料影响外,环境中微生物的多样性也会影响发酵的结果。
3 结论与讨论
本文研究了3批树莓酒自然发酵过程中酵母菌的多样性。采用传统微生物分离纯化技术与26S rDNA D1/D2区分析技术结合的技术,有效的筛选鉴定了树莓酒自然发酵过程中的酵母菌。结果表明在发酵过程中,Hanseniasporauvarum、Issatchenkia terricola和Saccharomyces cerevisiae为优势菌群。由此可确定,适宜树莓酒工业发酵过程的酵母菌可以在Hanseniasporauvarum、Issatchenkiaterricola和Saccharomyces cerevisiae中进一步筛选和驯化。因此,本研究为树莓酒发酵专用菌的开发奠定了基础。
[1]房玉林,张莉,宋建强,等.树莓果及其发酵产品挥发性成分的分析[J].林业科学,2007,19(43):133-138.
[2]王海峰,赵艳玲.红树莓酒发酵工艺的研究[J].酿酒科技,2013(11):65-67.
[3]丁杰.树莓酒不同降酸工艺研究[J].安徽农学通报,2009,15(17):198-200.
[4]刘建华,张志军,李淑芳.树莓中功效成分的开发浅论[J].食品科学,2005,25(10):370-373.
[5]赵文琦,曲长福,王翠华,等.树莓的营养保健价值与市场前景浅析[J].北方园艺,2007(6):114-115.
[6]Venskutonis P R,Dvaranauskaite A,Labokas J.Radical scavenging activity and composition of raspberry(Rubus idaeus)leaves from different locations in Lithuania[J].Fitoterapia,2007,78(2):162-165.
[7]李正涛.树莓果酒发酵工艺研究[J].安徽农业科学,2010,38(36):20729-20731,20758.
[8]姜河,修英涛,蔡骞.我国树莓发展现状及产业化前景分析[J].辽宁农业科学,2006(2):45-48.
[9]吴继军,肖更生,徐玉娟,等.吹扫捕集-气质联用法检测树莓蒸馏酒中的挥发性成分[J].酿酒,2013(5):57-60.
[10]Clavijo A,Calderón I L,Paneque P.Diversity of Saccharomyces and non Saccharomyces yeasts in three red grape varieties cultured in the Serranía de Ronda(Spain)vine-growing region[J].International journal of food microbiology,2010,143(3):241-245.
[11]Sun Y,Liu Y.Investigating of yeast species in wine fermentationusingterminalrestrictionfragmentlength polymorphism method[J].Food Microbiology,2014,38:201-207.
[12]王庆国,刘天明.酵母菌分类学方法研究进展[J].微生物学杂志,2007,27(3):97-98.
[13]王凤梅,马利兵,刘树文.内蒙古土默川平原葡萄酒相关酵母多样性研究[J].食品与生物技术学报,2009,28(3):385-389.
[14]李艳,卢君,张利中,等.沙城龙眼葡萄自然发酵过程相关酵母生物多样性研究[J].食品科学,2009(21):237-240.
[15]Milanovic'V,Comitini F,Ciani M.Grape berry yeast communities:influence of fungicide treatments[J].International Journal of Food Microbiology,2013,161(3):240-246.
[16]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南(金冬雁译)[M].北京:科学出版社,1996:465-467.
[17]李艳,董振玲,牟德华.羊羔美酒大曲中酵母菌多样性研究及分子鉴定[J].食品科学,2014,35(5):144-149.
[18]Kurtzman C P,Robnett C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J].Antonie van Leeuwenhoek,1998,73(4):331-371.
[19]赵丽丽,陈存社,郭凤莲.26SrDNA序列分析法鉴定酵母菌[J].中国酿造,2008,27(15):49-51.
[20]韦莹莹,毛淑波,屠康.果蔬采后病害生物防治的研究进展[J].南京农业大学学报,2012,35(5):183-189.
[21]Pimenta R S,Silva J F M,Coelho C M,et al.Integrated controlofPenicilliumdigitatumbythepredaciousyeast Saccharomycopsiscrataegensisandsodiumbicarbonateon oranges[J].Brazilian Journal of Microbiology,2010,41(2):404-410.
[22]李双石,陈晶瑜,韩北忠.中国本土葡萄酒酵母种群多样性分布的研究进展[J].China Brewing,2011,237(12):4-8.
[23]Fleet G H.Wine yeasts for the future[J].FEMS yeast research,2008,8(7):979-995.
[24]Fleet G H,Heard G M.Yeasts:growth during fermentation[J].Wine Microbiology and Biotechnology,1993:27-54.
[25]van Keulen H,Lindmark D G,Zeman K E,et al.Yeasts present during spontaneous fermentation of Lake Erie Chardonnay,Pinot Gris and Riesling[J].Antonie van Leeuwenhoek,2003,83(2):149-154.
[26]Santo D E,Galego L,Gonçalves T,et al.Yeast diversity in the Mediterranean strawberry tree(Arbutus unedo L.)fruits’fermentations[J].Food Research International,2012,47(1):45-50.
[27]Pando Bedriñana R,Querol Simón A,Suárez Valles B. Genetic and phenotypic diversity of autochthonous cider yeasts in a cellar from Asturias[J].Food Microbiology,2010,27(4):503-508.
Ⅰsolated and identification of yeast strain during raspberry natural fermentation
WU Wei-wei1,MOU De-hua1,LI Yan1,2,*
(1.College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050018,China;2.R&D Center for Fermentation Engineering of Hebei Province,Shijiazhuang 050018,China)
Purpose:the yeasts isolation and identification was carried out during raspberry natural fermentation in order to investigate special yeast strains which was suitable for raspberry fermentation.Method:the yeasts were selected and purification during the different stages of fermentation using the combination of the traditional microbial purification technology and 26S rDNA D1/D2 region analysis.Then,on the base of colony and cell microstructure morphology,the represent strain was selected to be identified by 26S rDNA D1/D2 region analysis.Result:a total of 323 yeasts strains were achieved during the raspberry natural fermentation. All above yeasts were divided into 12 morphotypes,5 genera,7 species,including Hanseniaspora uvarum,Issatchenkia terricola,Saccharomyces cerevisiae,Saccharomycopsis crataegensis,Candida diversa,Candida sorboxylosa and Candida stellimalicola.Conclusion:the yeasts in raspberry natural fermentation could be detected accurately and effectively by the combination methods of the traditional microbial purification technology and 26S rDNA D1/D2 region analysis.
raspberry wine;natural fermentation;yeast;26S rDNA D1/D2 region analysis
TS201.1
A
1002-0306(2015)10-0187-05
10.13386/j.issn1002-0306.2015.10.030
2014-08-26
武伟伟(1989-),女,在读硕士研究生,研究方向:传统发酵工程创新技术研究。
李艳(1958-),女,教授,研究方向:传统发酵工程创新技术研究,葡萄酒和果酒酿造。
国家农业科技成果转化资金项目(2013GB2A200037)。

