不同方法提取的草鱼鱼皮胶原蛋白性质比较
刘焱,刘伦伦,罗灿,瞿朝霞
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128)
不同方法提取的草鱼鱼皮胶原蛋白性质比较
刘焱1,2,刘伦伦1,罗灿1,瞿朝霞1
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128)
采用酸法、碱法、酶法、水法从鱼皮中提取胶原蛋白,对其性质进行分析比较。结果表明,提取率,酸法>酶法>碱法>水法;热变性温度,水法>酶法>碱法>酸法;水法和碱法提取的胶原蛋白SDS-PAGE电泳图谱条带中出现β二聚体和γ三聚体,酶法和酸法没有出现,但是酶法和酸法的α链位置明显色带浓于水法和碱法;紫外吸收光谱中,酸法和碱法的吸收峰强度大于水法和酶法,碱法和酶法左侧出现了杂峰;红外光谱显示,碱法提取的鱼皮胶原蛋白不具备酰胺带特征吸收峰,其二级结构已破坏,酸法、酶法和水法提取的胶原蛋白均存在酰胺带特征吸收峰,而且出现位置相似,符合胶原蛋白特征吸收峰。
鱼皮胶原蛋白;酸法;提取率;电泳
胶原蛋白由糖、甘氨酸、脯氨酸、羟脯氨酸等组成,以不溶性纤维形式存在多细胞动物体的皮肤、骨骼、血管中[1],它具有生物相容性、生物降解性、低抗原性,其提取制品已广泛应用与医药、保健、食品加工、化妆品等众多领域[2]。长期以来,胶原蛋白主要从一些陆生哺乳动物如牛、猪等的皮肤中提取[3],近年来,人们逐渐将关注点转移到鱼类胶原蛋白的研究上来[4]。鱼类胶原蛋白以Ⅰ型胶原为主,无支链,有四级结构[5],具有一定的凝胶性、高度的分散性、低黏度性、吸水性、持水性以及乳化性等特点[6],具有较高的机械强度,可以作为一种安全的美容和医用生物材料[7],鱼胶原蛋白材料的开发利用日益成为研究的热点[8]。鱼皮是水产品副产物中胶原蛋白含量比较多的部位,草鱼是我国的重要淡水经济鱼[9],草鱼鱼皮中,蛋白质含量达到25.4%[10]。目前关于鱼类胶原蛋白的研究大都是以测定提取液中羟脯氨酸含量乘以换算系数[11-12],并未对多种方法提取所得的胶原蛋白物质的特性进行具体系统的分析比较。
1 材料与方法
1.1 材料与试剂
新鲜草鱼:湖南农业大学新合作超市;冰乙酸、氯化钠、氧化钙、冰醋酸、硫酸、盐酸、氢氧化钠、氯胺T、高氯酸、异丙醇、甲醇、碱性蛋白酶(酶活力≧200 U/mg)、三羟基甲基氨基甲烷(生物试剂)等:国药集团化学试剂有限公司;L-羟脯氨酸标准品(优级纯):上海金穗生物科技有限公司。
1.2 主要仪器与设备
681型数显恒温磁力搅拌器:上海越众仪器设备有限公司;THZ-92气浴恒温振荡器:上海浦东物理光学仪器厂;JJ-1精密增力电动搅拌器:金坛市成辉仪器厂;SHZ-D(Ⅲ)减压抽滤装置:梅特勒-托利多仪器(上海)有限公司;FD-1D-50 WFJ7200分光光度计:龙尼柯(上海)仪器有限公司;UV-2450紫外吸收光谱仪:岛津(香港)有限公司;DYCZ-24DN电泳仪:北京市六一仪器厂;Nicolet6700傅里叶红外光谱仪:赛默飞世尔科技(原热电公司)分子光谱部。
1.3 胶原蛋白的提取及纯化方法
1.3.1 鱼皮的预处理
先将鱼皮用浓度为10%的异丙醇处理以除去脂肪,然后用0.1 mol/L氢氧化钠处理以除去其中的杂蛋白及色素,将处理后的鱼皮漂洗干净,备用。
1.3.2 鱼皮胶原蛋白的酸法提取及纯化
预处理后鱼皮→加入0.5 mol/L柠檬酸溶液,柠檬酸溶液∶鱼皮为10∶1(mL/g)室温下振荡提取24 h→纱布过滤(滤渣续提24h)→提取液(4000r/min离心20min)→上清液→加5 mol/L氯化钠(使浓度为0.9 mol/L)→静置分层(12 h)→离心(5 000 r/min,20 min)→回收絮状物→加0.5 mol/L醋酸使其溶解→取清液→加5mol/L氯化钠(使浓度为0.9 mol/L)→回收上浮絮状物→透析(蒸馏水中透2 d,每8 h换一次液)→冷冻干燥
1.3.3 鱼皮胶原蛋白的碱法提取
预处理后鱼皮→加入3%Ca(OH)2溶液,Ca(OH)2溶液∶鱼皮为20∶1(mL/g)室温下振荡提取24 h→纱布过滤(滤渣续提24h)→提取液(4000r/min离心,20min)→上清液→加6 mol/LHCl(使pH为3)→静置分层(12 h)→离心(5 000 r/min,20 min)→回收沉淀→透析(蒸馏水中透2 d,每8 h换一次液)→冷冻干燥
1.3.4 鱼皮胶原蛋白的水法提取
预处理后鱼皮→加入蒸馏水,蒸馏水∶鱼皮为20∶1(mL/g)70℃下震荡提取48 h→纱布过滤(滤渣续提48 h)→提取液(4 000 r/min离心20 min)→上清液→加5 mol/L NaCl(使浓度为0.9 mol/L)→静置分层(12 h)→离心(5 000 r/min,20 min)→回收上浮絮状物→透析(蒸馏水中透2 d,每8 h换一次液)→冷冻干燥
1.3.5 鱼皮胶原蛋白的酶法提取
预处理后鱼皮→加入0.5 mol/L乙酸溶液,乙酸溶液∶鱼皮为20∶1(mL/g)50℃振荡提取8 h→纱布过滤(滤渣续提8 h)→提取液(4 000r/min离心20 min)→上清液→加5 mol/L NaCl(使浓度为0.9 mol/L)→静置分层(12h)→离心(5000r/min,20 min)→回收上浮絮状物→透析(蒸馏水中透2 d,每8 h换一次液)→冷冻干燥
1.4 鱼皮胶原蛋白提取率测定方法
1.4.1 羟脯氨酸标准曲线的绘制[13]
以L-羟脯氨酸的吸光度值为纵坐标,L-羟脯氨酸标准溶液溶度(μg/mL)为横坐标,绘制标准曲线,得曲线方程:y=0.026 8x-0.001 1,其中R2=0.999 2,y为560 nm处测定的吸光度值,x为羟脯氨酸含量。
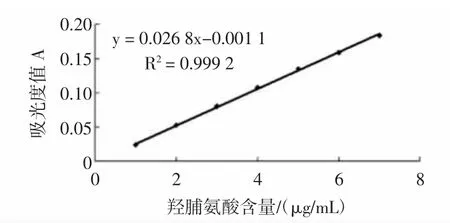
图1 羟脯氨酸含量与吸光度值关系的标准曲线Fig.1 The content of hydroxyproline and the absorbance of standard curve
1.4.2 鱼皮胶原蛋白的提取率测定[14]
精确称取样品3 mg~5 mg,操作步骤同标准曲线的制作,得出吸光度,从标准曲线得各样品中羟脯氨酸的含量。用测定的羟脯氨酸含量乘以相应的系数(11.1)得出样品中胶原蛋白的含量(g/g样品),原料中胶原蛋白理论含量为原料的质量(湿重)乘以相应的系数(13.13%),提取率为样品中提取的胶原蛋白含量与原料中胶原蛋白理论含量的比值,按测定羟脯氨酸的数值和胶原蛋白的提取率绘制柱形图。
样品中胶原蛋白提取量的计算公式:

式中:M为样品中胶原蛋白的提取量,g;x为某个吸光度在标准曲线上所对应的羟脯氨酸含量,(ug/mL);v1为吸收提取液的体积,mL。v2为稀释后的体积,mL;11.1为羟脯氨酸与胶原蛋白的换算系数。
胶原蛋白提取率/%=(样品中胶原蛋白提取量/原料中胶原蛋白理论含量)×100%
1.5 鱼皮胶原蛋白的特性分析方法
1.5.1 鱼皮胶原蛋白的紫外吸收光谱扫描
将冻干的胶原蛋白粉溶于0.5 mol/L的乙酸,配成1 g/L胶原溶液。用UV-2550紫外分光光度计,在190 nm~400 nm波长范围内,高速扫描最大吸收波长,得紫外光最大吸收波图。
1.5.2 鱼皮胶原蛋白的SDS-PAGE电泳
分离胶和浓缩胶以SDS-PAGE不连续体系凝胶配制[15],其中分离胶:12%的丙烯酰胺;浓缩胶:5%的丙烯酰胺。染色液:0.25%考马斯亮蓝R-250-甲醇溶液,以45%的甲醇作为母液来配制0.25%考马斯亮蓝R-250;脱色液(醋甲醇液):5%醋酸-7.5%甲醇液,以7.5%的甲醇作为母液来配制5%醋酸。配制好后制胶,然后加电极缓冲液,对样品进行处理后上样、电泳。
1.5.3 鱼皮胶原蛋白的热变性温度测定
准确称取75mg胶原蛋白冻干品于25mL0.1mol/L乙酸中,用超声波促进完全溶解,设置快速粘度计程序为2℃/min,初始温度为室温23℃,终止温度60℃,测定粘度,按增比粘度值与温度关系作折线关系图。
1.5.4 鱼皮胶原蛋白的傅里叶变换红外光谱(FT-IR)扫描
取冻干的胶原蛋白2 mg与KBr压片,置于红外光谱仪的变温附件中。扫描范围为400 cm-1~4 000 cm-1分辨率为4 cm-1。采用仪器的变温附件和控温装置,扫描温度点为20、35、60、90、110℃,每个温度点保温20 min,对前3个温度点扫描信号累加200次,得红外光谱图。
2 结果与分析
2.1 不同方法的鱼皮胶原蛋白提取率比较
不同方法提取鱼皮胶原蛋白前的脱脂和杂蛋白的前处理都一致,且每个提取方法所采用的工艺是现有研究报道中总结所得的最佳提取的工艺,图2对四种不同方法提取鱼皮胶原蛋白的提取率进行了对比。

图2 不同方法提取鱼皮胶原蛋白的提取率比较Fig.2 Comparison of extraction rate of collagen extracted of skin in different methods
从图2可以看出,酸法和酶法提取的效果明显优于碱法和水法,水法的得率最低,酸法得率最高,酶法中所用木瓜蛋白酶作用化学键较广泛,所以胶原蛋白提取率较低。碱法在蛋白质盐析过程中絮状物多,且透析后絮状物有明显减少,这说明可能有低分子水溶性物质从透析袋中流失,这与碱法提取胶原时键破坏情况有一定的关联,碱法提取的胶原还存在消旋转变的风险。水法提取率低则可能源于水分子与氢键作用力不大。
2.2 不同方法提取的鱼皮胶原蛋白感官性状比较
不同方法提取的胶原蛋白均为冷冻干燥后的感官性状,酸法和酶法提取产物多,结构蓬松,呈棉絮状,表面平整,水法提取物呈棉花丝状,碱法提取物呈黄褐偏黑色,粘着在平皿上。具体结果见表1。

表1 不同方法提取的鱼皮胶原蛋白感官比较Table 1 Comparison of characteristics of collagen extracted of fish skin in different methods
2.3 不同方法提取的鱼皮胶原蛋白性质比较
2.3.1 鱼皮胶原蛋白的紫外吸收光谱分析
据紫外光谱图分析,在紫外光谱220 nm~250 nm区内有强吸收峰,说明该溶液中存在有共轭不饱和双键结构的物质。在紫外光谱区250 nm~290 nm内有强吸收峰的物质,说明该溶液中有含苯环结构的物质。而就蛋白质水解溶液而言,脯氨酸、羟脯氨酸、苯丙氨酸、酪氨酸、色氨酸5种氨基酸都具有共轭双键的结构,而后三者都是含苯环的芳香族氨基酸,他们的紫外最大吸收峰分别苯丙氨酸257 nm、酪氨酸275 nm、色氨酸280 nm,其中以色氨酸紫外吸收最为强烈,常利用色氨酸在280 nm处有一个紫外强吸收峰对未知蛋白溶液进行定量分析[16]。胶原蛋白因为不含色氨酸等芳香族氨基酸,所以在280 nm左右都没有强吸收峰,这是辅助鉴别胶原蛋白的一种方法。图3为酸法、酶法、水法、碱法提取的胶原蛋白紫外吸收光谱图。

图3 不同方法提取的鱼皮胶原蛋白紫外吸收光谱Fig.3 UV spectra of collagen extracted of skin in different method
从图中可以看出,4种不同方法提取的鱼皮胶原蛋白溶液在220 nm~230 nm处均有一个尖锐的吸收峰,与Ⅰ型胶原蛋白紫外特征吸收峰出现的位置(225 nm处左右)基本一致。4种方法提取的鱼皮胶原蛋白溶液在250 nm~290 nm处不存在特征吸收峰,说明提取物中没有色氨酸、酪氨酸和苯丙氨酸等这些氨基酸。从图中发现在胶原蛋白溶液220 nm左侧还有些许小吸收峰,特别是碱法和水法所提取的鱼皮胶原蛋白溶液,这可能是由于水法和碱法的提取中产生了一些含-COOH或-COOR结构的物质,而酸法和酶法提取的鱼皮胶原蛋白溶液中可能含有的物质这类不多,所以只是最大吸收峰稍微左移一点没有形成独立的特征峰。
2.3.2 不同方法提取的鱼皮胶原蛋白SDS—PAGE电泳分析
胶原蛋白是(αl)(αl)(α2)、(αl)(α2)(α3)组成的三螺旋结构[17]。从哺乳动物提取的胶原蛋白三条α肽链可能两条相同,而从鱼类中提取的胶原蛋白三条肽链可能全不同,其中γ三聚体为三条α肽链组成的胶原分子,β二聚体为两条α肽链的组成的胶原分子,电泳图谱中条带的光密度反映提取物的大致浓度,条带出现位置反映分子量的大小[18]。图4为4种方法提取的鱼皮胶原蛋白SDS—PAGE电泳图谱。
从图4中电泳图谱结果可以看出,酸法、酶法条带宽明显粗于水法、碱法,从条带的光密度来看,酸法和酶法条带在α链处有,水法和碱法几乎都没有,看到的α链较为模糊,但γ三聚体和β二聚体有痕迹。根据在电泳中的迁移位置,水法和酶法有两条不同的α链,含量和位置也几乎相同,只是碱法和水法的γ三聚体的位置出现了痕迹,这可能与乙酸破坏了γ三聚体和β二聚体的交联有关,条带其它部分基本与酸法的相同。

图4 不同方法提取的鱼皮胶原蛋白SDS-PAGE电泳图谱Fig.4 SDS-PAGE electrophoresis of skin collagen extracted of skin in different methods
2.3.3 不同方法提取的鱼皮胶原蛋白的热变性温度比较
热变性温度是胶原蛋白三螺旋被破坏时的温度,它主要由羟脯氨酸含量决定,一般认为水产胶原蛋白热变性温度低于哺乳动物胶原蛋白。有研究指出,胶原蛋白的热稳定性与羟脯氨酸的含量呈正相关关系,含量越高,热稳定性温度就越高,胶原蛋白稳定性也就越强[19]。羟脯氨酸决定热稳定性的本质是羟脯氨酸吡咯环对胶原的二级结构的固定化的贡献和羟脯氨酸的中氢键的作用力。
胶原蛋白热稳定性可以由胶原溶液的热变性温度表达,通过热变性曲线来反映。胶原蛋白的变性温度可以通过增比粘度与温度的关系来确定。从胶原蛋白热变性温度曲线上,增比粘度变为原来的50%时所对应的温度即为热变性温度[20]。图5为4种方法提取的鱼皮胶原蛋白增比粘度与温度曲线。
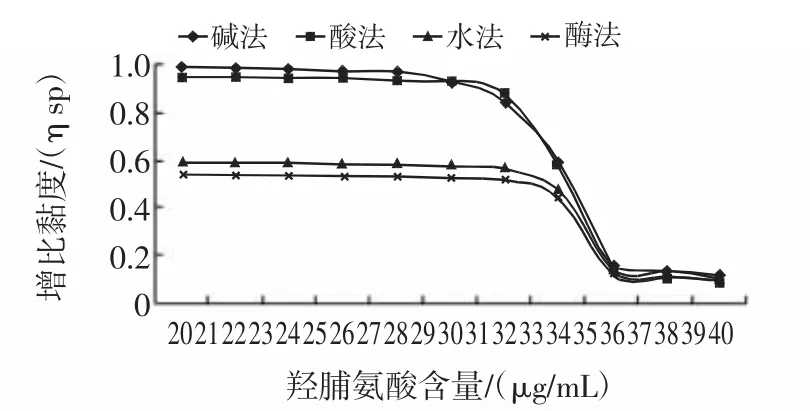
图5 鱼皮胶原蛋白增比粘度与温度曲线图Fig.5 Change curve of viscosity of collagen extracted of skin with temperature rising
从图5可以看出,四法提取的鱼皮胶原蛋白的热变性温度在33℃~36℃之间,水法>酶法>碱法>酸法,其中碱法和酸法提取的胶原蛋白增比粘度差距不大,其热变性温度也很相近;水法和酶法所提取的胶原蛋白虽然增比粘度比碱法和酸法提取的胶原蛋白小很多,但其热变性温度均大于碱法和酸法提取的胶原蛋白。
2.3.4 不同方法提取的鱼皮胶原蛋白傅里叶变换红外光谱(FT-IR)分析比较
分别对酶法、碱法、酸法、水法4种方法提取所得草鱼鱼皮胶原蛋白进行傅里叶变换红外光谱分析,结果见图6~图9。
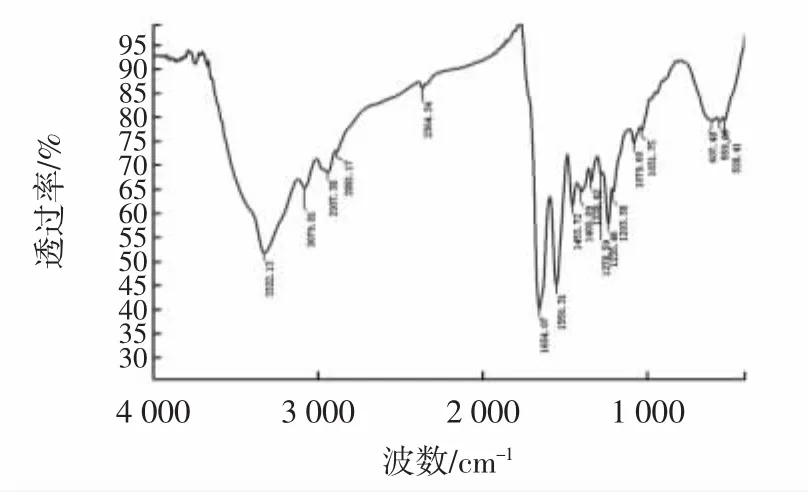
图6 酶法提取的鱼皮胶原蛋白傅里叶变换红外光谱Fig.6 Fourier transform infrared spectrum of PSC from grass carp skin

图7 碱法提取的鱼皮胶原蛋白傅里叶变换红外光谱Fig.7 Fourier transform infrared spectrum of ASF from grass carp skin
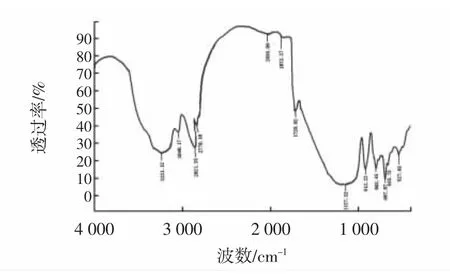
图8 酸法提取的鱼皮胶原蛋白傅里叶变换红外光谱Fig.8 Fourier transform infrared spectrum of ASC from grass carp skin
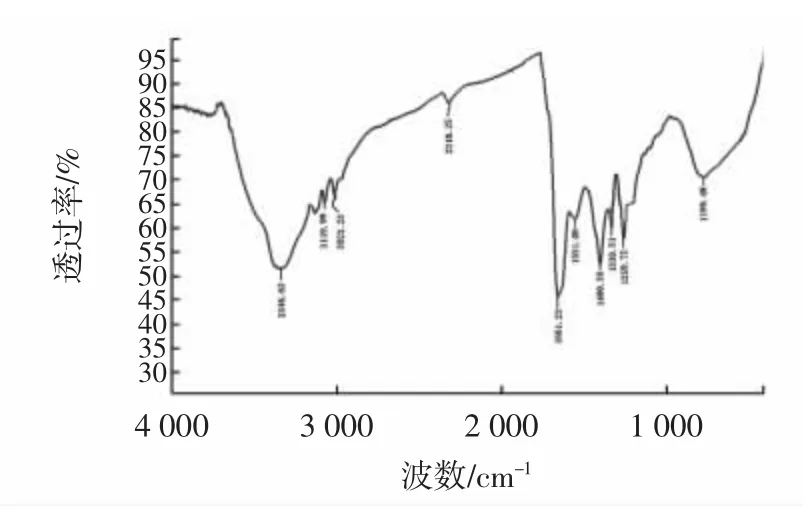
图9 水法提取的鱼皮胶原蛋白傅里叶变换红外光谱Fig.9 Fourier transform infrared spectrum of WSF from grass carp skin
根据4种不同方法提取的草鱼鱼皮胶原蛋白傅里叶变换红外光谱图,表2给出了酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ和羟脯氨酸的吸收峰和峰强度变化。
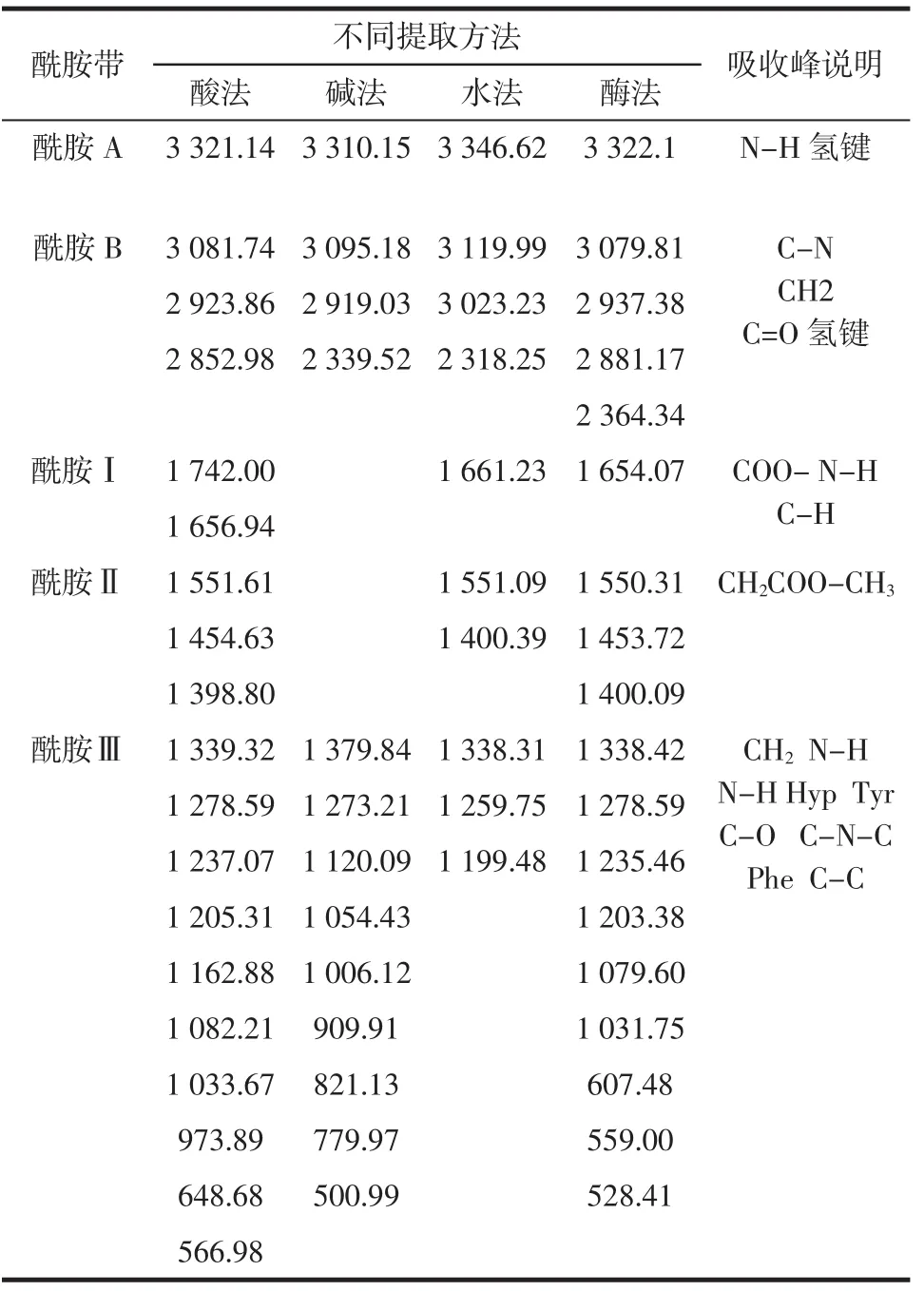
表2 不同方法提取的草鱼皮胶原红外光谱特征吸收峰的位置及说明Table 2 Fourier transform infrared spectroscopy spectra peak locations and assignment of grass carp skin collagen cm-1
从表2可以看出:①酰胺A带。酸法、酶法、碱法和水法从鱼皮中提取的胶原蛋白在由N-H伸缩振动引起的酰胺A带处特性吸收峰分别出现在3 321.14 cm-1、3 310.15cm-1、3 346.62cm-1、3 322.1 cm-1处,都出现向低波数位移的现象,表明4种方法提取的鱼皮胶原蛋白的N-H伸缩都与氢键形成了缔合体。②酰胺B带。四种方法提取的鱼皮胶原蛋白均在3 084 cm-1具有吸收峰,即由C-N伸缩引起的特征吸收峰。③酰胺Ⅰ带。由C=O伸缩振动引起的特征吸收峰,一般在1 600 cm-1~1 700 cm-1处,是二级结构变化的敏感区域。除碱法外,酸法、水法以及酶法均在此处具有特征吸收峰,其中酸法和酶法特征吸收峰在酰胺Ⅰ带对应的α螺旋结构1 651 cm-1附近,水法在酰胺Ⅰ带对应的转角1 662 cm-1附近,表明碱法提取的鱼皮胶原蛋白二级结构已经受到破坏,酸法和酶法的鱼皮胶原蛋白α螺旋结构保存完整,水法提取破坏了维系蛋白三螺旋结构的氢键,α螺旋结构已向转角结构转变。④酰胺Ⅱ带。主要由C-N伸缩振动和N-H弯曲振动引起的特征吸收峰,一般在1 480 cm-1~1 600 cm-1处。除碱法外,其他3种方法都在此处具有吸收峰,并且均保存了酰胺Ⅱ带的α螺旋结构(1 552 cm-1处的吸收峰)。⑤酰胺Ⅲ带。作为胶原蛋白特有的红外特征吸收峰,一般在1 200 cm-1~1 400 cm-1处,主要由C-N伸缩振动和N-H弯曲振动引起的特征吸收峰。酸法和酶法在1203 cm-1、1 238 cm-1以及1 281 cm-1附近出现不连续特征吸收峰,表明这两种方法提取的胶原蛋白的二级结构在此处没有明显改变,而水法则在1 338 cm-1处出现了Pro侧链-CH2的摇摆振动吸收峰,表明水法虽然出现α螺旋结构向转角结构转变的现象,但是基本的二级结构还存在。
综上所述,碱法提取的鱼皮胶原蛋白在酰胺Ⅰ带、酰胺Ⅱ带以及酰胺Ⅲ带均不具备相应的特征吸收峰,表明碱法的胶原蛋白二级结构已破坏,且被分解成比较小的多肽链;酸法和酶法提取的胶原蛋白都具有二级结构,且酰胺Ⅰ带和酰胺Ⅱ带区的α螺旋结构均保存比较的完好;水法提取的鱼皮胶原蛋白虽然在酰胺Ⅰ带区域其α螺旋结构变成了转角结构,但其基本的二级结构没有被破坏,符合Ⅰ型胶原蛋白的结构特征吸收峰。
3 结论
酸法、碱法、酶法、水法4种方法从草鱼鱼皮中提取胶原蛋白,提取率方面,酸法>酶法>碱法>水法;在所提取的草鱼鱼皮胶原蛋白热稳定性方面,碱法>酸法>水法>酶法;对4种方法提取的胶原蛋白SDSPAGE电泳图谱比较发现,水法和碱法提取的鱼皮胶原蛋白的条带中出现β二聚体和γ三聚体的条带位置,酶法和酸法提取的胶原蛋白没有出现,但是酶法和酸法提取的胶原蛋白的α链色带明显浓于水法的和碱法的;在紫外吸收光谱方面,酸法和碱法提取的鱼皮胶原蛋白的吸收峰强度大于水法和酶法,且碱法和酶法左侧出现了杂峰;红外光谱显示,碱法提取的鱼皮胶原蛋白不具备酰胺带特征吸收峰,其二级结构已破坏,酸法、酶法和水法提取的胶原蛋白均存在酰胺带特征吸收峰,而且出现位置相似,符合Ⅰ型胶原蛋白特征吸收峰。
[1]蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006:79-90
[2]汤克勇.胶原物理与化学[M].北京:科学出版社,2012,161-200
[3]Muyonga J H,Cole C G B,Duodu K G.Characterization of acid soluble collagen from skins of young and adult Nile perch[J].Food Chemistry,2004,85(1):81-89
[4]刘晓丹,陈嘉彦.崭露头角的鱼胶原蛋白[J].明胶科学与技术, 2010,30(1):43-45.
[5]李国辉,危冬发,苏彩秀.胶原蛋白理化性质的研究[J].江西化工, 2011(3):117-121
[6]徐海菊,蔡健,陈江萍.水产胶原蛋白质的基本特性及其在食品加工中的应用[J].浙江农业科学,2010,(2):324-327
[7]刘邦辉,郁二蒙,谢骏,等.脆肉鲩鱼皮和肌肉胶原蛋白的理化特性及其影响因素研究[J].江苏农业科学,2012,40(2):200-204
[8]李燕妮,曹红光,倪艳波.国内鱼胶原蛋白制品的市场研究[J].云南化工,2008,35(3):63-65
[9]孔繁东,李跃,祖国仁,等.低值鱼及下脚料的加工与综合利用[J].中国酿造,2008(24):21-24
[10]徐文杰,李俊杰,贾丹,等.基于近红外光谱技术的草鱼营养成分的分析[J].食品科学,2013,1(7):123-128
[11]潘峰,扈成军.水产品胶原蛋白研究进展[J].中国科技博览,2012 (33):264
[12]艾超,黄灿灿,李致瑜,等.鱼皮胶原蛋白提取工艺的研究进展[J].农产品加工(学刊),2012,(5):93-94,105
[13]郭恒斌,曾庆祝,闫磊,等.分光光度法测定鱼皮中羟脯氨酸含量[J].现代食品科技,2007,23(7):81-83
[14]张笑,刘杰,陈翠岚.比色法测定明胶中的L-羟脯氨酸[J].食品安全质量检测学报,2010,1(3):124-127
[15]沃兴德.蛋白质电泳与分析[M].北京:军事医学科学出版社,2009: 47-58
[16]张俊生,李纯毅,王晓莉.浅谈紫外吸收光谱在有机化学中的应用[J].内蒙古石油化工,2010,36(9):27-28
[17]Satto M,Takenouchly.Complete primary Structure of rainbow trout type I collagen consisting ofα1α21α3 beteromtrimers[J].European Journal of Biochemistry,2001,268(10):28l7-2827
[18]郭尧君.蛋白质电泳试验技术[M].北京:科学出版社,1999
[19]张俊杰,段蕊,陈玲,等.鱼皮ASC、PSC的提取和性质比较[J].食品科技,2008(10):173-177
[20]鸿巢章二,桥本周久.水产利用化学[M].郭晓风,邹胜祥,译.北京:中国农业出版社,1994,65(68):271-276
Property Comparison of Grass Carp Skin Collagen Extracted by Different Method
LIU Yan1,2,LIU Lun-lun1,LUO Can1,QU Zhao-xia1
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,Hunan,China;2.Hunan Province Key Laboratory of Food Science and Biotechnology,Changsha 410128,Hunan,China)
Extract collagen of grass carp's skin with acid,alkali,enzyme and water method,the result of collagen's extraction yield in different method was as follow:acid>alkali>enzyme>water.The result of collagen's in different method was as follow:alkali>acid>water>enzyme.The result of collagen's SDS-PAGE electrophoresis was:the ribbons from water and alkali appeared in β-dipolymer and γ-tripolymer ribbons position,the ribbons from enzyme and acid no appearance,but α-chain's ribbons from enzyme and acid marks significantly thicker than ribbons from water and alkali.The result of collagen's UV scanning spectrum was:UV absorption intensity from acid and alkali were greater than that from water and enzyme,the maximum UV absorption left side from alkali and enzyme appeared some miscellaneous peaks.The result of collagen's FI-IR spectrum was:according with the characteristic absorption peak.The collagen extracted in four methods all have characteristic absorption peaks which are amideⅠ,amideⅡ,amideⅢ,and their position are similar to each other,It was in accordance withⅠcollagen's characteristic absorption peak.
fish skin collagen;acid method;extraction rate;electrophoresis
10.3969/j.issn.1005-6521.2015.08.010
国家星火计划重大项目(2011GA770007);湖南省重大科技专项(2010FJ1007-2)
刘焱(1970—),女(汉),副教授,博士,主要从事动物食品加工及贮藏研究。
2013-11-15

