利用原生质体融合技术选育淀粉发酵产DHA的新型裂殖壶菌
王迪路福平王海军李德茂陈树林张可
(1. 天津科技大学生物工程学院,天津 300457;2. 中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室,天津 300308)
利用原生质体融合技术选育淀粉发酵产DHA的新型裂殖壶菌
王迪1路福平1王海军1李德茂2陈树林2张可2
(1. 天津科技大学生物工程学院,天津 300457;2. 中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室,天津 300308)
以生产DHA的裂殖壶菌(Schizochxtrium)B4D1和黑曲霉(Aspergillus niger)CGMCC 3.316为出发菌株,利用原生质体融合技术选育可以利用淀粉发酵生产DHA的新型裂殖壶菌。用裂解酶制得了两亲本的原生质体,通过研究两亲本培养时间、培养方法、酶解时间等条件对原生质体产量影响的基础上,以PEG介导进行了原生质体的融合,最终确定了原生质体融合最佳条件为40%的 PEG6000,融合温度30℃,融合时间为10 min,在此条件下融合率可达1.9%。通过比较菌落外观、颜色、形态以及分离培养筛选获得了一株利用淀粉裂殖壶菌融合子。经过RAPD验证表明B4D1与CGMCC 3.316发生了重组,融合菌株表达了更多源于B4D1的遗传信息。
裂殖壶菌;DHA;原生质体;融合;淀粉
二十二碳六烯酸(docosahexaenoic acid,简称DHA),是人体所必需的一种多不饱和脂肪酸,能够辅助婴幼儿脑细胞发育,而且还具抗衰老和降低血脂、改善血液循环、抑制肿瘤等功效[1,2]。因此,DHA己经广泛应用于生产婴幼儿食品、保健食品和辅助治疗剂等产品。由于裂殖壶菌DHA含量高、生长快、易于培养、对人畜无毒害,目前是一种极具生产前景的DHA微生物资源[3]。
国内外的研究主要集中在用裂殖壶菌以葡萄糖为底物高效发酵产DHA[4,5],但是葡萄糖原料比较贵,导致产品价格比较高。淀粉相对于葡萄糖来讲是一种量大、价廉的底物,通常在工业生产中,必需先将淀粉以酶法或酸法制成淀粉水解糖,再加以利用[6]。如果能选育出可直接以淀粉为碳源生产DHA的优良菌株,将会大大简化生产程序,降低生产成本。
原生质体融合是一种基因重组技术,指通过人为的方法,将遗传性状不同的两个细胞的原生质体进行融合,借以获得兼有双亲遗传性状的稳定重组子的过程。这种方法打破了微生物的种界界限,可发生在种内、种间,甚至亲缘很远的两个物种之间,可以扩大融合频率和幅度,是一种常见的育种方法。原生质体融合与常规杂交相比有很多优势,不但能显著提高重组频率,而且具有定向育种的含义,目前该技术已成为细胞生物学迅速发展的方向之一[7]。
针对裂殖壶菌不能利用淀粉的问题,本试验采用原生质体融合技术,选取高效利用淀粉的黑曲霉和DHA高产菌株裂殖壶菌B4D1,通过两亲本对碳源的利用不同,灭活后进行原生质体融合,筛选出能以淀粉为碳源生产DHA的融合菌株。
1 材料与方法
1.1 材料
1.1.1 菌株 裂殖壶菌 B4D1本实验室保存;黑曲霉CGMCC 3.316购于中国科学院微生物研究所普通菌种保藏中心。
1.1.2 培养基 斜面培养基:PDA培养基。菌丝生长培养基[8]:1.2%葡萄糖,0.2% KH2PO4,0.05% MgSO4,0.04% NaH2PO4,0.1% NH4NO3,0.1%微量元素(4% CuSO4,1.1% ZnSO4,0.6% MnSO4,0.1% FeSO4,0.03% CoCl2,0.06% H3BO3,pH5.8)。淀粉培养基:可溶性淀粉5 g/L,蛋白陈10 g/L,酵母粉5 g/L,海水晶15 g/L,琼脂20 g/L,用HPBS配置。以上培养基121℃灭菌20 min。
GYP培养基[9]:葡萄糖20 g/L,蛋白陈10 g/L,酵母粉5 g/L,海水晶15 g/L,115℃灭菌20 min。
高渗培养基用高渗缓冲液HPBS配置,固体培养基添加2%琼脂[10]。
1.1.3 试剂 缓冲溶液PBS:0.2 mol/L磷酸缓冲溶液,pH5.8,121℃灭菌 20 min。高渗缓冲液HPBS: PBS中添加0.7 mol/L的KCl。预处理剂0.3% β 巯基乙醇-0.1% EDTA[11]:于PBS中添加0.1% EDTA,121℃灭菌20 min。临用前添加0.3% β 巯基乙醇。酶液[12]:溶壁酶(Lysing enzyme)购自Sigma公司。称取裂解酶,悬于HPBS中充分振荡并静置,使之完全溶解,至浓度为5 mg/mL。经0.22 μm微孔滤膜过滤除菌,保存于4℃冰箱备用。促溶剂:PEG6000用HPBS配制成一定质量浓度的的溶液,121℃灭菌20 min。
1.1.4 主要仪器设备 超净工作台、高压灭菌锅、恒温摇床、恒温水浴箱、显微镜、离心机、紫外凝胶成像仪、研钵、培养皿、移液枪、试管、锥形瓶、离心管等。
1.2 方法
1.2.1 菌体培养及收集 黑曲霉菌丝培养:将原始菌种转接至PDA斜面固体培养基上,待孢子生长成熟后,用PBS洗脱孢子,调整孢子浓度为108个/mL,以10%的接种量接入菌丝生长培养基中,250 mL三角瓶装液量50 mL,摇床转速200 r/min,培养温度30℃,培养时间12-15 h,收集培养液置于灭菌的50 mL离心管中,4 000 r/min 离心10 min,用PBS缓冲液洗涤离心2次[13],弃上清液,保留菌丝体。
裂殖壶菌菌体培养:将B4D1菌株接种于GYP液体培养基,25℃、180 r/min 条件下培养24-48 h,收集培养液15 mL于灭菌的50 mL离心管中,4 000 r/min离心10 min,用PBS缓冲液洗涤离心两次,收集菌体。
1.2.2 原生质体的制备 黑曲霉原生质体的制备:向黑曲霉菌丝体中加入酶液,酶液按照 Wmycelium/ Venzymesolution=1∶10(g/mL)加入[14],25-38℃,100 r/min恒温振荡酶解,酶解结束后,酶解液经4层高级擦镜纸过滤,滤液离心(4 000 r/min,10 min),高渗缓冲液HPBS洗涤两次,弃上清,收集原生质体并重悬于10 mL高渗缓冲液HPBS中,血球板计数。
裂殖壶菌原生质体制备:经洗涤的菌体加入预处理剂[7]10 mL,30℃,180 r/min恒温振荡30 min,用HPBS缓冲也洗涤离心(4 000 r/min,10 min),加入酶液至菌体浓度为107/mL,25-38℃,100 r/min恒温振荡酶解一段时间,酶解结束后,酶解液离心(4 000 r/min,10 min)[7]。用高渗缓冲液HPBS洗涤两次,重悬于10 mL高渗缓冲液HPBS中。取1 mL原生质体悬液,经高渗溶液HPBS适当稀释,用再生培养基倾注法培养2-4 d,计算菌落数。
1.2.3 黑曲霉原生质体灭活 取黑曲霉原生质体细胞悬液5 mL在55℃水浴中,不同时间灭活后,经高渗溶液HPBS适当稀释,用再生培养基倾注法测定细胞数,计算致死率。
1.2.4 原生质体融合 取B4D1原生质体和灭活后的黑曲霉原生质体悬液(浓度106个/mL)在离心管中等量混合,于 4℃冷冻离心机中4 000 r/min 离心10 min,弃上清,加入促溶剂,混匀后放入20-40℃、转速为 100 r/min 的恒温摇床中数分钟以待融合;取出融合后的原生质体悬液4℃冷冻离心后用HPBS缓冲液离心洗涤两次,以将融合剂洗净,将洗涤后的原生质体重悬于 HPBS缓冲液中,得到融合后的原生质体用高渗淀粉培养基倾注法25℃培养3-5 d,检出融合子,测定细胞数[15]。
1.2.5 计算公式 原生质体形成率、再生率、灭活率和融合率的计算公式参考文献[2,16]。
1.2.6 融合子筛选 挑选能够在高渗淀粉培养平板上生长的菌落,根据裂殖壶菌菌落形态初步检出融合子,然后转接入含有200 μL GYP 培养基的96孔板中,于 25℃ 180 r/min发酵3 d。以出发菌株B4D1作为对照,用尼罗红检测初步检测油脂含量[17],筛选油脂产量较高的融合子接入淀粉培养基,发酵6 d,气相检测DHA。
气相色谱法条件为:岛津GC-2010气相色谱仪,色 谱 柱:SP-2560(100.0 m×0.25 mm×0.20 μm)。N2为载气,采用程序升温,起始温度140℃,保持5 min,然后以4℃/min的速度升至240℃,保持11 min。FID检测器,进样口温度为250℃,检测器温度为280℃。采用分流进样,分流比为30,进样量为1 μL。
1.2.7 融合菌株的稳定性检验 对筛选得到的融合菌株连续传代10次,测定细胞干重和油脂含量,检验融合子的遗传稳定性。
1.2.8 融合菌株的鉴定 应用 RAPD 技术对融合菌株进行鉴定,分析亲本与融合菌株之间的遗传相似性和遗传距离[18]。
RAPD 的引物筛选:用20个10 bp的寡核苷酸引物对亲本基因组 DNA 进行 PCR 扩增,从中筛选扩增条带清晰、重复性好、多态性高的引物,用于全部样本的扩增。反应体系(25 μL):DNA 模板 0.5 μL,2×EasyTaq PCR SuperMix 12.5 μL,随机引物 0.5 μL,无菌双蒸水 11.5 μL。反应程序为:94℃预变性5 min;94℃ 变性 30 s,37℃退火 30 s,72℃延伸 1 min,40 个循环;72℃延伸 8 min,4℃保存。
PCR 扩增反应结束后,采用 1×TAE 电泳缓冲液,用 1%琼脂糖凝胶在电压为 120 V 的电场中电泳 20 min,GoldView染色。在紫外凝胶成像仪上观察并拍照,记录结果。
数据处理:按照公式相似系数Sxy=2· Nxy/(Nx+Ny)×100%获得各样品间的遗传相似度,其中Nxy是比较后两种材料x和y共有的DNA片段数目,Nx和Ny分别为材料x和y各自的DNA扩增片段数目。再由 D=1-S 获得相应的遗传距离[6]。
1.2.9 培养基淀粉含量的测定 将融合子在淀粉培养基中发酵培养,每隔24 h取样测定培养基中淀粉含量,方法参考文献[19]。
2 结果
2.1 裂殖壶菌和黑曲霉原生质体制备与再生条件的确定
2.1.1 菌龄对原生质体形成的影响 细胞壁的成分和结构在细胞不同的时期有所不同,因而细胞对酶的敏感性有差异。通过测定生长曲线及不同培养时期细胞原生质体形成率,发现裂殖壶菌和黑曲霉原生质体化的较适菌龄分别为36 h和15 h左右,约处于对数生长早期。
2.1.2 酶解温度和时间对原生质体形成的影响 选择原生质体最佳的制备条件不仅要使原生质体制备率达到最高,同时还要考虑原生质体再生率不能过低,因此原生质体制备条件要在选择保证原生质体再生率的同时选择原生质体制备率最高的条件。由图1-图4结果可确定裂殖壶菌B4D1的最佳原生质体制备条件:酶作用温度为 32℃,酶作用时间为 60 min,黑曲霉的最佳原生质体制备条件:酶作用温度为 32℃,酶作用时间为2.5 h。
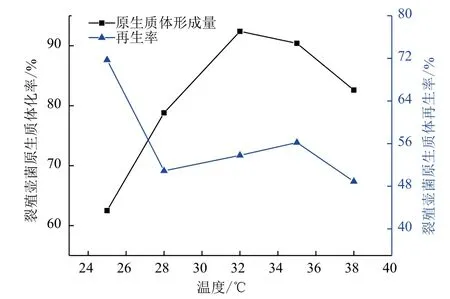
图1 裂殖壶菌原生质体制备作用温度
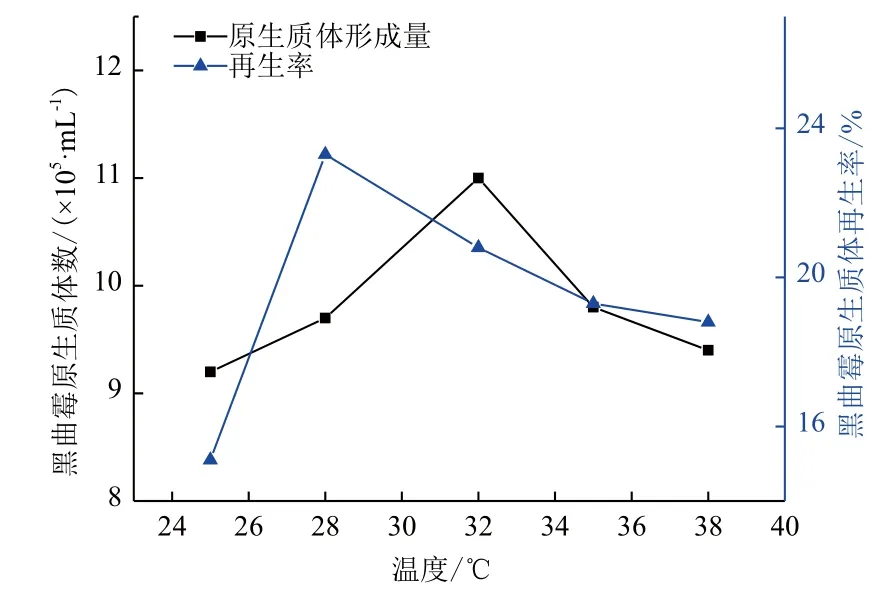
图2 黑曲霉原生质体制备作用温度

图3 裂殖壶菌原生质体制备作用时间

图4 黑曲霉原生质体制备作用时间
2.2 黑曲霉原生质体的灭活及融合条件的确定
2.2.1 原生质体灭活条件的选择 灭活的目的是为了标记融合子,即让亲本黑曲霉原生质体全部致死,而经过融合后所生长的即为融合二倍体,所以灭活率需达到 100%。原生质体热灭活的试验结果,如图5所示。为保证原生质体的灭活率为 100%,最后确定黑曲霉高温灭活温度为 55℃,时间为20 min。
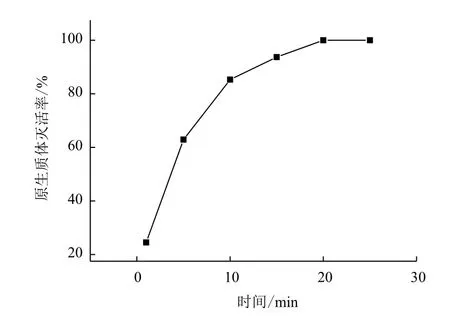
图5 不同作用时间对黑曲霉原生质体的灭活效果
2.2.2 促溶剂PEG6000质量分数的影响 由于PEG6000对原生质体的毒性和原生质体对有机质稳定剂的敏感性,PEG6000质量分数不能过大,否则融合频率会迅速下降。由图6可知,融合率随PEG6000 浓度升高增加到1.9%当浓度超过60%时,融合率下降到0.7%。因此选择 PEG6000 浓度为40%作为原生质体融合时的 PEG 浓度。

图6 PEG浓度对融合率的影响
2.2.3 融合时间的影响 分别选取1、5、10、15和20 min进行融合,测定融合率如图7 所示,随着融合时间增加到10 min时,融合率提高到1.2%,当融合时间继续增加到20 min 时,原生质体的融合率则降为0.3%,因此为了获得最大的融合率,选择10 min 作为原生质体的融合时间。
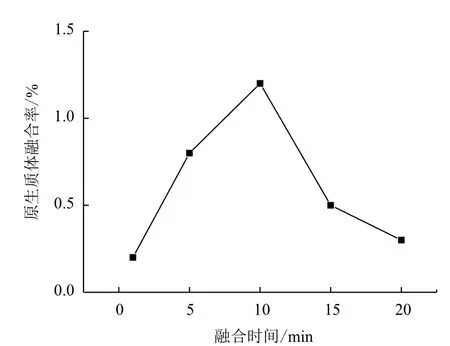
图7 融合时间对融合率的影响
2.2.4 融合温度的影响 温度在一定程度上影响原生质体融合率,较高的温度可以增加性细胞膜流动性,降低 PEG 黏度,有助于原生质体的融合。由图8可知,融合温度上升到 30℃时,原生质体融合率提高到1.1%。温度继续升高后,融合率降低至0.6%。因此选择 30℃作为融合温度。
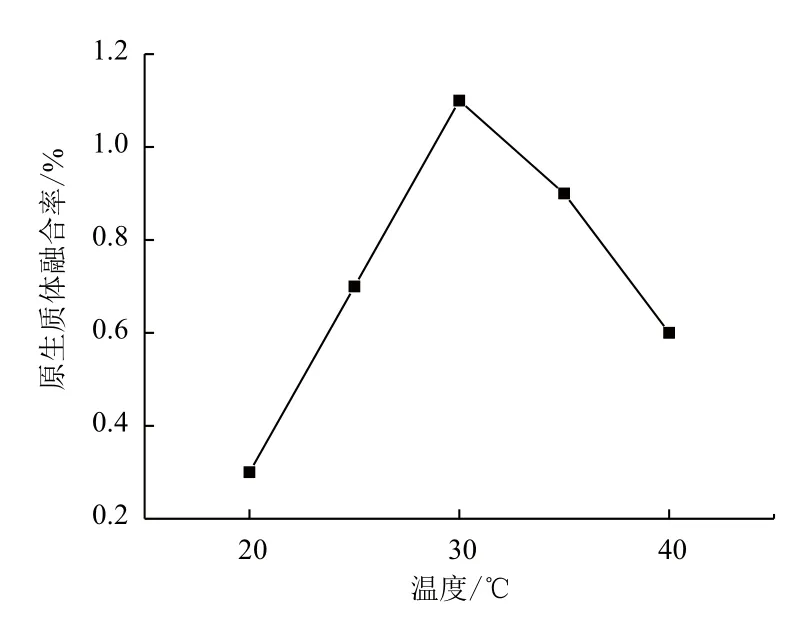
图8 融合温度对融合率的影响
2.3 融合子的获得
2.3.1 融合子筛选 由于裂殖壶菌不能利用淀粉,因而无法在淀粉筛选培养基上生长,只有融合了黑曲霉的新型裂殖壶菌才能生长,从原生质体融合后的淀粉高渗培养基平板上,分离筛选了5株在25℃生长旺盛,菌落形态与黑曲霉菌株不同而与裂殖壶菌形态相同的淡黄色菌株,编号为M-1-M-5,然后接种到含200 μL的GYP培养基的96孔板进行发酵培养,B4D1为对照,用尼罗红检测油脂含量,结果表明M-3菌株油脂含量和亲本B4D1产油量相当。将M-3发酵6 d后,经气相色谱法检测(图9),对比DHA标准品可知,融合得到的新型裂殖壶菌具有产DHA能力,而且其可以在淀粉为碳源的培养基上生长,具有双亲本的特性。

图9 融合子M-3油脂气相色谱图
2.3.2 融合菌株稳定性分析 融合菌株M-3经过10次传代,仍然能够在淀粉培养基上稳定生长,并且由表1可以看出产油性状稳定。

表1 M-3培养1代和5代干重和油脂含量的比较
2.4 融合子M-3的RAPD分析
2.4.1 RAPD扩增结果 从20个随机引物中筛选出条带清晰、稳定性好的8个引物,分别为P1(GTTTCGCTCC)、P4(GGACTGGAGT)、P5(TGCGCCCTTC)、P10(CTGCTGGGAC)、P11(GTAGACCCGT)、P15(GGAGGGTGTT)、P19(ACCCCCGAAG)、P20(GGACCCTTAC),对亲本B4D1、CGMCC 3.316及融合子M-3的基因组DNA进行PCR扩增,扩增出的随机片段大都在500-2000 bp,结果见图10。亲本B4D1、CGMCC 3.316及其融合子M-3基因组DNA扩增的RAPD带谱存在差异。同一引物对两亲本和融合子扩增的RAPD条带也存在一定的差异。融合子M-3的条带有的与B4D1相同,有的与CGMCC 3.316相同,说明融合子M-3的基因组DNA既有与B4D1同源的序列,又有与CGMCC 3.316同源的序列。表明在基因水平上,B4D1与CGMCC 3.316发生了重组,得到了融合菌株M-3。
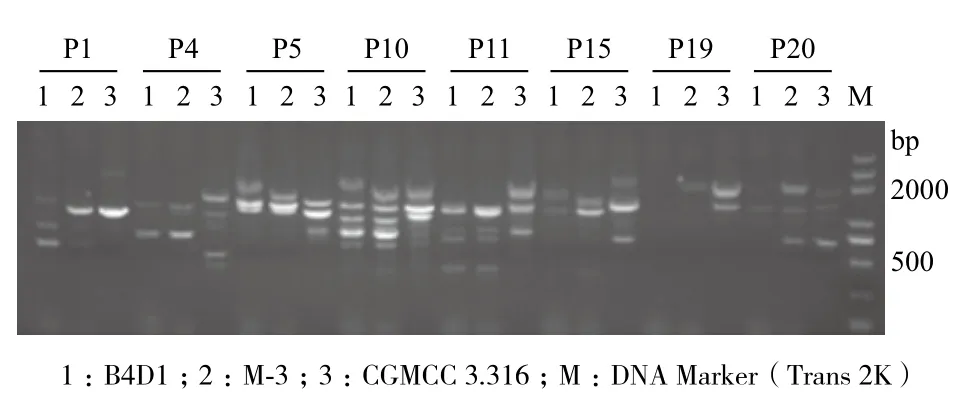
图10 部分引物对亲本及其融合子的 RAPD 扩增图谱
2.4.2 遗传相似系数分析 根据表2的数据计算M-3与两亲本的相似系数:SSM=0.698,SMC=0.34,SSC=0.182;DSM=0.302,DMC=0.66;DSC=0.818。融合菌株 M-3与亲本B4D1的遗传相似系数大于与亲本CGMCC3.316的遗传相似系数,表明融合菌株M-3与亲本B4D1的遗传关系更近,或者M-3表达了更多源于B4D1的遗传信息。
表2 八种随机引物的扩增谱带
2.5 培养基剩余淀粉含量测定
用淀粉培养基培养融合子M-3,测定培养基中剩余淀粉含量结果见图11。由图11可看出,随着时间增加,淀粉含量不断减少,从最初5 g/L减少到2.91 g/L,说明融合子可以利用淀粉。
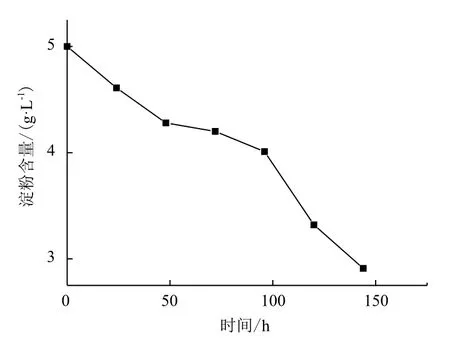
图11 培养基中淀粉含量随时间变化曲线
3 讨论
原生质体融合技术具有重组频率高,遗传物质完善,容易获得性状优良和生产量高的融合菌等优点,已被广泛应用于各种研究工作中。本试验通过利用双亲对某种碳源利用状况的差异作为筛选标记进行原生质体融合,得到了同时可以产油脂以及以淀粉作为碳源生长的融合菌株M-3,大大减轻了背景干扰,提高了菌种筛选效率。
徐新立等[20]将油脂高产菌深黄被孢霉3.3410和具有高纤维素活性的黑曲霉SL2-111进行原生质体融合,筛选得到能直接利用纤维素原料的产油菌株。其黑曲霉原生质体制备浓度达到7.2×107个/mL,再生率达到28.6%,而本试验只达到8.7×105个/mL的原生质体浓度和28.4%的再生率。后续研究需要进一步提高黑曲霉原生质体的制备率以及再生率。张淑君等[21]利用桑树内生菜豆壳球孢菌分别与绿色木霉及长柄木霉进行融合,同样获得了以纤维素钠作为唯一碳源产油脂的融合菌株,油脂产量及含量均高于亲本。本试验得到的融合菌株,能够产油脂尤其是DHA,后续研究需进一步融合菌株继续融合或诱变,以提高融合率,从而得到更多的融合子进行筛选。本试验证明了利用原生质体融合进行菌株选育的可行性。后期还应探讨其最佳培养条件和发酵条件,以最终能将其应用于生产,发挥经济效益。
4 结论
本研究确定了原生质体融合最佳条件为40%的PEG6000,融合温度 30℃,融合时间为10 min,在此条件下融合率可达1.9%。筛选出一株可以在淀粉为碳源的培养基上生长的融合子,经过气相色谱检测其可以生产DHA。通过RAPD验证表明B4D1与CGMCC 3.316发生了重组,融合菌株表达了更多源于B4D1的遗传信息。
[1] 陈诚. 裂殖壶菌(Schizochytrium limacinum SR21)发酵制备二十二碳六烯酸(DHA)过程的初步研究[D]. 杭州:浙江大学,2007.
[2]Armenta RE, Valentine MC. Single-cell oils as a source of omega-3 fatty acids:an overview of recent advances[J]. Journal of the American Oil Chemists’ Society, 2013, 90(2):167-182.
[3] 王申强. 裂殖壶菌产DHA的发酵工艺研究及高产菌株选育[D]. 无锡:江南大学, 2013.
[4]Wu ST, Yu ST, Lin LP. Effect of culture conditions on docosahexaenoic acid production by Schizochytrium sp. S31[J]. Process Biochemistry, 2005, 40(9):3103-3108.
[5]常桂芳. 氧对裂壶藻利用甘油产DHA影响机制及其高密度发酵控制策略的研究[D]. 无锡:江南大学, 2013.
[6]陈宁, 王艳萍, 王一芃, 张克旭. 利用淀粉直接发酵生产肌苷菌株的构建[J]. 微生物学报, 1997(3):184-189.
[7]刘虹, 程秀芳, 张志焱, 谷巍. 利用原生质体融合技术选育高产虾青素酵母菌株[J]. 中国饲料, 2013(11):5-9.
[8]Manger-Jacob F, Muller T, Janssen M, et al. Isolation and sequencing of a new glucoamylase gene from an Aspergillus niger aggregate strain(DSM 823) molecularly classified as Aspergillus tubingensis[J]. Antonie Van Leeuwenhoek, 2005, 88(3-4):267-275.
[9]Yokochi T, Honda D, Higashihara T, Nakahara T. Optimization of docosahexaenoic acid production by Schizochytrium limacinum SR21[J]. Applied Microbiology and Biotechnology, 1998, 49(1):72-76.
[10]Cheng R, Ma R, Li K, et al. Agrobacterium tumefaciens mediated transformation of marine microalgae Schizochytrium[J]. Microbiol Res, 2012, 167(3):179-186.
[11] 何忠宝. 原生质体融合构建葡萄酒降酸酵母的研究[D]. 杨凌:西北农林科技大学, 2004.
[12] 姚婷婷, 王正祥. 黑曲霉原生质体的制备、再生及转化条件[J]. 食品与生物技术学报, 2006(4):116-120.
[13]骆健美, 李建姝, 王艳婷, 王敏. 褐黄孢链霉菌双亲灭活原生质体融合的研究[J]. 现代化工, 2008(S2):349-351, 353.
[14]王春丽, 武改红, 陈畅, 陈树林. 黑曲霉原生质体诱变选育β-葡萄糖苷酶高产菌株[J]. 生物工程学报, 2009, 12:1921-1926.
[15]王岁楼, 王海翔, 杨志萍, 等. 酵母原生质体制备、融合及高产β-胡萝卜素融合子的筛选[J]. 食品科学, 2013(9):99-103.
[16]何小妮, 蒋波, 王玉海, 等. 非对称灭活双亲原生质体融合法选育产果糖基转移酶的米曲霉新菌株的研究[J]. 现代食品科技, 2013(5):993-997.
[17] 林义, 钟添华, 骆祝华, 等. 尼罗红染色法筛选产油酵母及定量检测胞内油脂含量的研究[J]. 微生物学通报, 2012(1):125-137.
[18] 吕雪梅, 杨关福, 张细权. RAPD分析中遗传距离计算方法的比较[J]. 华南农业大学学报, 1997(S1):93-100.
[19] 王福荣. 生物工程分析与检验[M]. 北京:中国轻工业出版社,2010:141-142.
[20] 徐新丽. 原生质体融合技术选育纤维素发酵产油菌株[J].武夷学院学报, 2011(2):27-31.
[21] 张淑君. 原生质体融合构建纤维素发酵产油脂菌株的研究[D]. 泰安:山东农业大学, 2012.
(责任编辑 李楠)
Screening a New Type of Schizochxtrium Strain Producing DHA Using Starch by Protoplast Fusion Technology
Wang Di1Lu Fuping1Wang Haijun1Li Demao2Chen Shulin2Zhang Ke2
(1. College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457;2. Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308)
Schizochxtrium B4D1 and Aspergillus niger CGMCC 3.316 as original strains, a new strain of Schizochxtrium was selected using starch for producing DHA. The protoplasts from two parents strains were obtained respectively with Lysing enzyme. The study was investigated on the effect of culture time, culture method, enzymolysis time on the protoplasts preparation. Finally, the protoplasts fusion was done under the PEG mediated condition. The optimum condition of protoplast fusion was as follows:PEG6000 concentration of 40%, fusion temperature of 30℃, fusion time of 10 min. Furthermore, the fusion rate reached 1.9% at the optimum condition. Through comparing its colony characteristics, color, morphology and purified spore culture, a new strain has been selected using starch as carbon source. RAPD verification showed that the fusant having integrated genome of B4D1 and CGMCC 3.316 expressed more genetic information from B4D1.
Schizochytrium;DHA;protoplast;fusion;starch
10.13560/j.cnki.biotech.bull.1985.2015.02.012
2014-07-28
国家“863”计划(2014AA021701),国际合作重点项目(2014DFA61040)
王迪,女,硕士研究生,研究方向:轻工技术与工程(发酵);E-mail:wangdi0808@hotmail.com
李德茂,男,博士,副研究员,研究方向:工业生物系统工程;E-mail:li_dm@tib.cas.cn

