高产水稻剑叶的叶绿素含量、捕光色素分子的内禀特性与饱和光强关系的研究
叶子飘,闫小红,段世华
(1.井冈山大学生命科学学院,江西,吉安 343009; 2.井冈山大学数理学院,江西,吉安 343009;3.南京林业大学生物与环境学院,江苏,南京 210037)
高产水稻剑叶的叶绿素含量、捕光色素分子的内禀特性与饱和光强关系的研究
*叶子飘1,2,闫小红1,3,段世华1
(1.井冈山大学生命科学学院,江西,吉安343009; 2.井冈山大学数理学院,江西,吉安343009;3.南京林业大学生物与环境学院,江苏,南京210037)
叶绿素是水稻叶片进行光合作用的重要物质之一。为了研究叶片叶绿素的含量、捕光色素分子的内禀特性与饱和光强的关系,利用LI-6400XT便携式光合测定系统测量了6个水稻品种的光响应曲线,并利用光合作用对光响应的机理模型进行了拟合。结果表明:供试的6种水稻品种的饱和光强只与植物捕光色素分子的物理参数如本征光能吸收截面、激子传递到光反应中心的速率(kp)、热耗散速率(kD)和激发态的平均寿命(τ)等有关,与叶片的叶绿素含量无关。
光合作用对光响应的机理模型;水稻;本征光能吸收截面;饱和光强
水稻是人类最重要的粮食作物之一,而光合作用是作物生长发育和产量形成的生理基础,也是作物生产力高低的决定性因素[1]。研究表明:水稻干物质产量的90%~95%来自生育后期的叶片光合作用[2],而稻谷产量的40%~60%直接来自剑叶的光合作用[3],因此研究剑叶的光合特性对探讨水稻产量形成机理具有重要意义,也是历来研究的热点。
饱和光强(saturation irradiance)是植物光合能力的重要体现,它的大小反映了植物光合机构碳同化过程对同化力的最大需求。碳同化能力越强,所需要的同化力就越多,饱和光强就越高[4]。并且,高饱和光强也说明植物不易受强光的伤害,其适应光强的范围就更为广泛。
叶绿素是水稻叶片进行光合作用的重要物质之一,其含量和组成与光合速率有着密切的关系[5]。因此,在水稻的高光效育种中,叶绿素含量作为重要指标倍受关注。已有的研究结果表明:叶绿素含量的高低与叶片净光合速率存在高度正相关[6],但也有研究结果表明它们之间并不存在正相关[7]。此外,植物的饱和光强是否与植物叶片的叶绿素含量成正相关却并没有定论。我们的研究结果表明:遮阴条件下的叶绿素含量比全日照条件下三叶鬼针草的叶绿素含量高一倍以上,但对应的饱和光强却是全日照条件下饱和光强的1/3[8]。而张斯斯[9]的研究则表明:增温条件下叶绿素含量较高的加拿大一枝黄花和大狼把草两种植物的饱和光强要比其对照高。为什么会产生这种现象?Kühlbrandt 等人[10]认为这是由于植物叶片对光能的吸收、激发、传递和转换等过程受捕光色素分子的空间结构和电荷分布等内禀特性所决定,不同的植物以及同种植物在不同环境下其内禀特性也不相同,从而影响到其对光能的吸收与利用。由此我们推测植物叶片的饱和光强可能也是由其捕光色素内禀特性所决定。为此,本研究拟以光合作用对光响应的机理模型[11]为基础,利用LI-6400XT测量了6个水稻品种在正常环境下抽穗盛期时剑叶的光响应曲线并用机理模型拟合其光响应曲线以估算这6个水稻品种的饱和光强,并探讨它与叶绿素含量和捕光色素内禀特性之间的关系。解释为什么有些水稻品种的叶绿素含量高,其饱和光强却不高的原因,探索其内在规律性,为研究高产水稻的光合特性提供理论依据。
1 材料与方法
6个水稻品种分别为02428、淦鑫688、JR8892-1、JR8892-2、JR3392和赣香优3392。品种“02428”是高光效粳稻品种,叶色浓绿,相对于南方籼稻既有耐强光抑制特性,又对弱光有较强的适应能力[12];“淦鑫688也(天丰A伊昌恢121)是目前在江西省大面积应用的籼型超级杂交晚稻,光合能力较强、产量高;“JR8892-1”和“JR8892-2”是一对持绿和早衰的近等基因系,杂交晚稻恢复系“JR8892-1”带有少量粳稻血缘,全生育期叶色都比较浓绿,是少有的籼稻持绿材料;“JR8892-2”是从“JR8892-1”群体中单选出的后期叶片早衰株系。“JR3392-1”和“JR3392-1”分别为同一籼稻恢复系品种中选育出的两个不同株系,具有不同的农艺性状。水稻种子材料由江西省农业科学院水稻研究所尹建华研究员提供。所有水稻材料种子于2012年5月7日入水浸泡,5月11日播种于生物园玻璃温室塑料盆中,材料长至4叶期,于6月15日移栽至大田。大田管理水平与当地种植水平相当,肥力略高于当地农户,田块肥力为中等水平。实验于2012年7月20日连续晴天进行光合光响应曲线的测定,此时6个水稻品种均处于分蘖盛期,随机选取3株长势均匀一致的健壮植株。每株挑选自上而下第一片叶进行测量,3次重复。
1.1光响应数据的测定
按照LI-6400XT的技术要求,水稻自然光诱导1~1.5 h后,采用LI-6400XT便携式光合测定系统进行测定,CO2浓度控制在(390 ± 2) μmol·mol-1,温度控制在(33 ± 2)℃,空气相对湿度为70%左右。对于水稻品种02428、淦鑫688、JR8892-1、JR8892-2,光合有效辐射的梯度设置为2000、1800、1600、1400、1200、1000、800、600、400、200、100、50、0 μmol photons·m-2·s-1下。在预实验中,我们发现赣香优3392和JR3392的饱和光强较高,所以,在测量这两个水稻品种光响应曲线时,光合有效辐射的梯度增加了2500、2300、2100 μmol photons·m-2·s-1。在这些条件下测定水稻的净光合速率(Pn)(μmol CO2·m-2·s-1)、气孔导度和胞间CO2浓度等,然后用叶子飘等人构建的光合作用对光响应机理模型拟合光响应曲线[11],得到光响应曲线的初始斜率(α)、饱和光强(Isat)、最大净光合速率(Pnmax)、光补偿点(Ic)、暗呼吸速率(Rd)和捕光色素分子的本征光能吸收截面(σik)等光合参数。
1.2光合作用对光响应的机理模型
光合作用对光响应的机理模型[11]是:

式中的α'为光能在PSII和PSI的分配系数(无量纲);β'为叶片的光吸收系数(无量纲);S为所测叶片的面积(单位为m2);φ为激子的利用效率(无量纲);σik为捕光色素分子的本征光能吸收截面(单位为m2),即它为植物捕光色素分子吸收光能的能力,不同植物其数值是不同的;N0为捕光色素分子数;kP是光反应常数(单位为s-1),kD是热耗散常数(单位为s-1),τ为捕光色素分子处于最低激发态的平均寿命(单位为s);gi和gk分别为捕光色素分子处于基态i和激发态k的简并度(无量纲);θ为电子的利用效率;ξ1、ξ2和ξ3分别为激子传递到光反应、热耗散和荧光的统计权重(无量纲)。I为光强(单位为μmol photons·m-2·s-1);Rlight为植物的光下呼吸速率,它是光强的函数,随光强的变化而改变[13-15]。但在一般情况下可以近似地等于暗呼吸速率(Rd)。
由(1)式可知,在低光强时,净光合速率随光强的增加直到饱和光强,之后其速率随光强的增加而下降,出现光饱和或光抑制现象。
在一定的环境条件下,植物天线色素分子的参数是确定的,且认为光下呼吸速率等于暗呼吸速率时,我们就可以假设:
令

式可以简化为:

(2)式中的αp称为光合作用对光响应曲线的初始斜率,也称为光合电子流转化为同化碳的最大能力。
此外,由(1)式可得饱和光强(Isat)为:

当忽略Rlight对饱和光强的影响时,那么由(2)式可知,植物的饱和光强与叶绿素含量的多少无关。
与此相对应的最大净光合速率(Pmax)为:

1.3 捕光色素分子的内禀特性
1.3.1捕光色素分子的有效光能吸收截面与光强之间的关系
捕光色素分子有效光能吸收截面与光强之间的关系[11]为:

则(5)式可以简化为:

由此式可知,捕光色素分子的有效光能吸收截面随光强的增加而非线性下降。
1.3.2处于激发态的捕光色素分子数与光强之间的关系
处于激发态的捕光色素分子数与光强之间的关系[11]为:
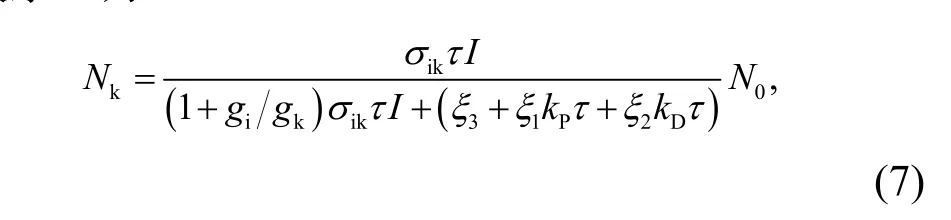
由(7)式可知,Nk随kP或kD增大而减少,这表明光反应或热耗散的速率越大,处于激发态的捕光色素分子就越少,有利于光能的吸收;Nk随τ的增加而增加,即τ越大,处于最低激发态的捕光色素分子就越多,不利于光能的吸收。

由(7)式可知,Nk随kP或kD增大而减小,这表明光反应或热耗散的速率越大,捕光色素分子处于激发态的数目就越小;Nk随τ的增加而增加,即τ值越大,意味着激子处于激发态的时间就越长,这些处于激发态的捕光色素分子将不再吸收光能。所以,τ值越大,将越不利于植物的光能吸收。
1.3.3 捕光色素分子本征光能吸收截面的估算
由(1)式,我们可以估算捕光色素分子的本征光能吸收截面为[10]:

式中的φ一般取值为0.9~0.95[16-18],α'一般取值为0.5[19-21],β'一般取值为0.84[19-20]。
1.4叶绿素含量的测定
测定时间与叶片选择同上,参照Arnon 的方法[22]。即叶绿素含量采用丙酮法测定,3次重复取平均值。
1.5数据处理和分析
所有数据的平均值的计算与统计分析均在Excel 和SPSS 19.0 统计分析软件中进行。本研究中所有图、表的数据均用平均值±标准误差(mean ± SE)表示。
2 结果与分析
2.16个水稻品种光合作用对光响应曲线
由图1可知,6个水稻品种的响应曲线是典型的C3植物的光合作用对光的响应曲线,即在低光强时,净光合速率随光强的增加而快速增加,然后到达一个较为平坦的区域--饱和区域,之后随光强的增加而下降,发生光抑制现象(图1a,d);淦鑫688、JR8892-1和赣香优3392 (图1b, c, e)三种水稻品种的净光合速率在光合有效辐射在2000 μmol photons·m-2·s-1左右时才达到光饱和,尤其是赣香优3392,其饱和光强的估算值达到了(2363.71 ± 142.56)μmol photons·m-2·s-1。这表明该水稻品种在现有的光照条件下其光合能力尚未达到其最佳值。

图1 水稻光合作用对光的响应曲线Fig.1 Light-response curves of photosynthesis for six rice varieties
2.26个水稻品种的光合参数和生理参数
由表1可知,赣香优3392的初始斜率最大,为(0.078 ± 0.005) µmol CO2(µmol photons)-1,表示该水稻品种的光合电子流转化为同化碳的能力最大;最小的是JR8892-1,其初始斜率为(0.032 ± 0.011)µmol CO2(µmol photons)-1。赣香优3392的最大净光合速率最大,为(33.05 ± 0.67) µmol CO2·m-2·s-1,最小的是淦鑫688,为(21.59 ± 1.08) µmol CO2·m-2·s-1。JR8892-1的光补偿点最大,为(37.47 ± 1.88) µmol photons·m-2·s-1,最小的是淦鑫688,为(17.57±1.40)µmol photons·m-2·s-1。赣香优3392的暗呼吸速率最大,为(1.66 ± 0.06) µmol CO2·m-2·s-1,最小的是淦鑫688,为(0.98 ± 0.10) µmol CO2·m-2·s-1。JR3392-1的叶绿素含量最大,为(392.3 ± 2.72)mg·m-2,最小的是JR8892-2,为(321.4 ± 40.34)mg·m-2。由此可知,6个水稻品种最大净光合速率、光补偿点和暗呼吸速率等光合参数与叶绿素含量的多少并没有直接的关联。

表1 6个水稻品种的光合参数的拟合值Table 1 Date were simulated photosyn thetic parameters for six rice varieties
2.36个水稻品种的饱和光强
由表1的数据可知,赣香优3392的饱和光强最大,达(2363.71 ± 142.56) μmol photons·m-2·s-1,其次是淦鑫688,其饱和光强达(2025.75 ± 200.26)μmol photons·m-2·s-1,02428的饱和光强最小,为(1646.72 ± 48.82) μmol photons·m-2·s-1。此外,由表1的数据还可知,叶绿素含量最多的是JR3392-1,达(392.3 ± 2.71) mg·m-2,其次是淦鑫688,达(389.3 ± 3.52) mg·m-2,JR8892-2的叶绿素含量最少,为(321.4 ± 40.34) mg·m-2。由此可知,6个水稻品种的饱和光强与其叶绿素含量之间既没有正相关,也没有负相关。
2.46个水稻的有效光能吸收截面对光的响应曲线
由表1的数据可知,6个水稻品种捕光色素分子的本征光能吸收截面分别为:3.29×10-21、2.90 ×10-21、1.65×10-21、3.51×10-21、4.43×10-21、2.67 ×10-21m2。捕光色素分子的本征光能吸收截面最大的是赣香优3392,表明它的吸收光能的能力最大;最小的是JJ8892-1,表示它的吸收光能的能力最小。
捕光色素分子的有效光能吸收截面是指其在任意光强下的光能吸收能力。由图2可知,有效光能吸收截面随光强的增加而下降速度最慢的是赣香优3392(图2e),即使光强为2500 μmol photons·m-2· s-1,其有效光能吸收截面依然较高,表示在高光强下它的捕光色素分子吸收光能的能力依然很强;在高光强时,捕光色素分子的有效光能吸收截面最小的是JR3392-1(图2f),表示在强光下它的光能吸收能力最小。此外,从图2c可知,JR8892-1的捕光色素分子光能吸收截面在低光强时,其有效光能吸收截面最小(图2c),表示在低光强时其利用光能的能力最小。6个水稻品种的有效光能吸收截面对光的响应曲线也略有不同(图2)。
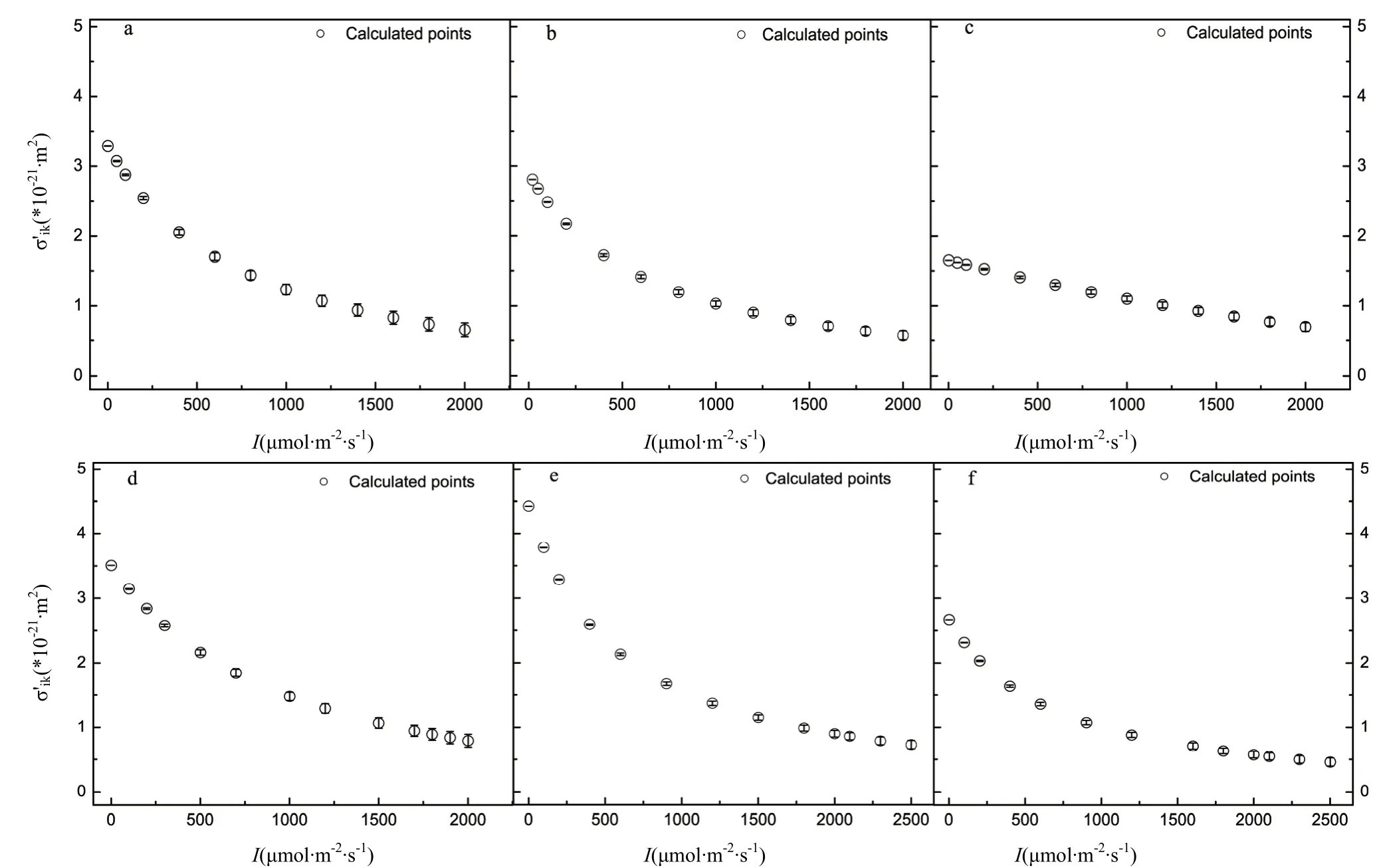
图2 水稻的有效光能吸收截面对光的响应曲线Fig.2 Light-response curves of effective light energy absorption cross-section for six rice varieties
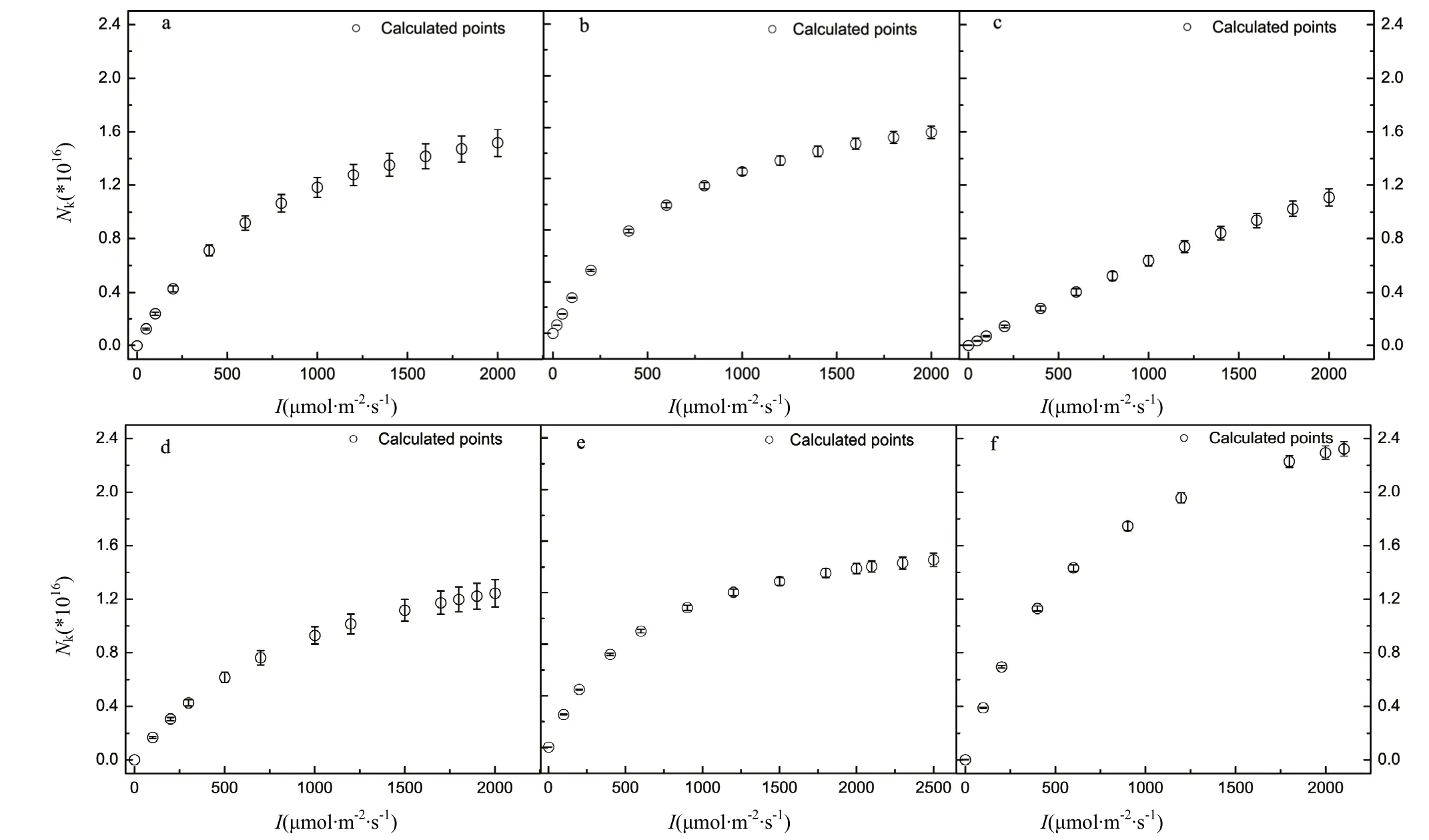
图3 水稻处于激发态的捕光色素分子对光的响应曲线Fig.3 Light-response curves of Nkversus I for six rice varieties
2.5 处于激发态的捕光色素分子对光的响应曲线
由图3可知,6个水稻品种处于最低激发态的捕光色素分子数 (Nk) 随光强的增加而非线性增加,表明它们处于最低激发态的捕光色素分子数随光强的增加,其吸收光能的能力下降。此外,Nk上升最快的是JR3392-1,上升最慢的是JR8892-1。这表明JR8892-1的捕光色素分子在高光强时依然有较多的捕光色素分子处于基态,因而其有利于其吸收光能作用。
3 讨论与结论
3.1水稻的叶绿素含量以及其捕光色素分子的内禀特性与最大净光合速率之间的关系
叶绿素是植物进行光合作用的基础,但已有的研究结果证明:叶绿素含量的高低与叶片净光合速率并不存在正相关[23]。本研究的实验结果也表明:赣香优3392的最大净光合速率最大,为(33.05 ± 0.67)µmol CO2·m-2·s-1,最小的是淦鑫688,为(21.59 ± 1.08) µmol CO2·m-2·s-1;JR3392-1的叶绿素含量最大,为(392.3 ± 2.72) mg·m-2,最小的是JR8892-2,为(321.4 ± 40.34) mg·m-2。由此可知,赣香优3392的最大净光合速率和饱和光强最大,但其叶绿素含量却不是最大的。此外,由表1的数据可知,6个水稻品种的其它光合参数与叶绿素含量的多少也没有直接的关联。对于这个问题的解释,有学者认为可能是由于光合作用是一个多种组分参加的复杂反应过程,不仅有捕光色素分子的参与,还有两个光系统的多种电子传递体包括反应中心复合体和细胞色素b6f复合体以及催化碳同化的多种酶,仅叶绿素含量高,而其它组分的含量不高,叶片净光合速率也不会高[24]。这种解释有其合理的一面,但植物经过漫长的进化和长期的适应之后,在正常环境条件下其构成光合作用的原初光反应、光合能力形成和碳同化这三个主要过程彼此之间定然匹配,那种存在色素含量多,而其它组分少这种情况的几率应该较少。
而由叶子飘等人构建的光合作用对光的响应机理模型[11]可知,最大净光合速率不仅与叶绿素含量有直接的关系,还与捕光色素分子的本征光能吸收截面、激子的传递效率有关,更与植物叶片色素分子的物理特性如kp、kD和τ等物理参数有关。由表1可知,尽管赣香优3392的叶绿素含量偏少,但其捕光色素分子的本征光能吸收截面最大,达到4.43 ×10-21m2;JR8892-1捕光色素分子的本征光能吸收截面最小,为1.65×10-21m2。由此可知,赣香优3392可以通过增加捕光色素分子的本征光能吸收截面来增加其光能的吸收。此外,光合作用对光响应的机理模型还表明:如果植物单纯地增加叶绿素含量,则必定会以牺牲捕光色素分子的本征光能吸收截面为代价,否则植物叶片吸收过量的光能将无法快速有效地传递到光反应中心,而是形成三线态的叶绿素分子(3Chl*),它们将与氧气发生作用形成活性氧(O2-),这些活性氧很容易与水作用形成过氧化氢(H2O2),过多的过氧化氢将对植物叶片的光反应系统产生伤害[25-26]。
3.2植物叶片叶绿素的含量、捕光色素的内禀特性与饱和光强之间的关系
植物叶绿素含量的多少除了影响植物的净光合速率外,也将影响植物的饱和光强。但植物的饱和光强是否与植物叶片的叶绿素含量成正相关却并没有定论。有实验数据表明,遮阴条件下三叶鬼针草的叶绿素含量比全日照条件下的叶绿素含量高一倍以上,但对应的饱和光强却是全日照条件下饱和光强的1/3[8];增温条件下叶绿素含量较高的加拿大一枝黄花和大狼把草两种植物的饱和光强要比其对照高[9]。但在本研究中,赣香优3392的饱和光强为 (2363.71 ± 142.56) μmol photons·m-2·s-1,其次是淦鑫688,其饱和光强为(2025.75 ± 200.26)μmol photons·m-2·s-1,02428的饱和光强最小,为(1646.72±48.82) μmol photons·m-2·s-1。但赣香优3392的叶绿素含量除了比JR8892-2多以外,低于比其它4种水稻品种。由植物光合作用对光响应的机理模型可知,饱和光强与叶片叶绿素含量并没有直接的关系,且与激子的利用效率和电子的利用效率无关,只与植物捕光色素分子的σik、kp、kD和τ等物理参数有关。然而这个结论是否具有普适性,还需要有更多的实验数据加以验证。
由光合作用的原初反应过程可知,捕光色素分子吸收光能后, 将从基态跃迁到激发态。处于激发态的捕光色素分子将通过光反应、热耗散和荧光发射三种方式退激发回到基态, 这三种退激发方式相互竞争[25,27-28]。由此可知,处于激发态的捕光色素分子可以将激子共振传递到光反应中心,引起PSII发生电荷分离,产生光合电子流。但如果过多的捕光色素分子处于激发态且不能及时通过光反应、热耗散和荧光退激发,将对植物产生伤害,甚至破坏光系统[25-26]。但如果植物处于强光胁迫下,则植物捕光色素分子的这种特性将有利于减少强光对植物的伤害[11,29]。
由图3可知,6个水稻品种处于最低激发态的捕光色素分子数 (Nk) 随光强的增加而非线性增加,一方面表明它们处于最低激发态的捕光色素分子数随光强的增加,而处于基态的捕光色素分子将随光强的增加而减少,其吸收光能的能力将下降;另一方面,处于激发态上的捕光色素分子将通过热耗散、叶绿素荧光和光化学反应等方式退激发,其退激发的速率将取决于捕光色素分子处于最低激发态的最小平均寿命(τmin),其值小,表明其退激发的速率就快,越有利于光能转化为化学能[11,29]。而退激发回到基态的捕光色素分子将重新吸收光子后跃迁到激发态,进行新一轮的光能吸收循环。τmin的值小,有利于激子传递到PSII产生电荷分离并产生光合电子流。然而,如果激子不断快速地传递到PSII,而由PSII产生的电子流不能及时传递到下一个环节,那么在光合电子传递链上某个节点上堆积过多的电子也将对植物产生伤害[26]。因此,并非τmin的值越小越好,这是一把双刃剑。
[1] 沈允钢, 施教耐, 许大全.光合作用动力学[M].北京:科学出版社, 1998:1-3.
[2] Zelitch I.The close relationship between net photosynthesis and crop yield[J].Bioscience, 1982,32(10): 796-802.
[3] Yoshida S.Physiological analysis of rice yield [M].In: Fundamentals of Rice Crop Science.Makita City(Phiippines) : International Rice Research Institute, 1981: 231-251.
[4] 杨兴洪, 邹琦, 赵世杰.遮阴和全光下生长的棉花光合作用和叶绿素荧光特征[J].植物生态学报, 2005, 29(1): 8-15.
[5] 方志伟, 张荣铣, 朱培仁.水稻叶片叶绿素含量的变化与光合作用的关系[J].南京农业大学学报, 1987(4): 18-22.
[6] 郭兆武.高产杂交稻两优培九的光合特性研究[D].长沙: 湖南农业大学,2007.
[7] 林金科, 熊发顺, 钟天英, 等.适制乌龙茶品种叶绿素含量与净光合速率关系探讨[J].福建茶叶, 1984(4):12-15.
[8] 叶子飘,赵则海.遮光对三叶鬼针草光合作用和叶绿素含量的影响[J].生态学杂志, 2009, 28(1) : 19-22.
[9] 张斯斯.模拟增温对菊科2种入侵植物繁殖生态学及光合特性的影响[D].重庆: 西南大学,2014.
[10] Ye Z P, Suggett J D, Robakowski P, et al.A mechanistic model for the photosynthesis-light response based on the photosynthetic electron transport of PS II in C3and C4species[J].New Phytologist, 2013, 152, 1251-1262.
[11] Kühlbrandt W, Wang D N, Fujiyoshi Y.Atomic model of plant light-harvesting complex by electron crystallography[J].Nature, 1994, 367(6464):614-621.
[12] 严建民, 焦德茂, 朱献玳, 等.水稻光合对不同光强的响应及品种间差异[J].中国水稻科学, 1992, 6(2): 53-56.
[13] Atkin O K, Evans J R, Ball M C, et al.Leaf respiration of snow gum in the light and dark.Interactions between temperature and irradiance[J].Plant physiology, 2000,122(3): 915-924.
[14] Crous Y K, Zaragoza-Castells J, Ellsworth D S, et al.Light inhibition of leaf respiration in field-grown Eucalyptus saligna in whole-tree chambers under elevated atmospheric CO2and summer drought[J].Plant,cell & environment, 2012, 35(5): 966-981.
[15] Shapiro J B, Griffin K L, Lewis J D, et al.Response of Xanthium strumarium leaf respiration in the light to elevated CO2concentration, nitrogen availability and temperature[J].New Phytologist, 2004, 162(2): 377-386.
[16] Brody S S, Rabinowitch E.Excitation lifetimes of photosynthetic pigments in vivo and in vitro[J].Science,1957, 125: 265-557.
[17] Hu X, Ritz T, Damjanovic A, et al.Pigment organization and transfer of electronic excitation in the photosynthetic unit of purple bacteria[J].The Journal of Physical Chemistry B, 1997, 101(19): 3854-3871.
(参考文献[18]- [29][18] Panitchayangkoon G, Hayes D, Fransted K A, et al.Long-lived quantum coherence in photosynthetic complexes at physiological temperature[J].Proceedings of the National Academy of Sciences, 2010, 107(29): 12766-12770.
[19] Ehleringer J R.Leaf absorptances of Mohave and Sonoran deserts plants[J].Oecologia,1981,49(3): 366-370.
[20] Krall J P, Edward G E.Relationship between photosystem II activity and CO2fixation in leaves[J].Physiologia Plantarum, 1992, 86(1): 180-187.
[21] Major K M, Dunton K H.Variations in light-harvesting characteristics of the seagrass, Thalassia testudinum: evidence for photoacclimation[J].Journal of Experimental Marine Biology and Ecology, 2002, 275(2): 173-189.
[22] Arnon D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J].Plant physiology,1949, 24(1): 1-15.
[23] Chen Y, Xu D Q.Two patterns of leaf photosynthetic responses to irradiance transition from saturating to limiting one in some plant species[J].New Phytologist,2006, 169(4): 789-798.
[24] 许大全.光合作用学[M].北京: 科学出版社, 2013: 91.
[25] Takahashi S, Badger M.Photoprotection in plants: a new light on photosystem II damage[J].Trends in Plant Sciences, 2011, 16(1): 53-59.
[26] Niyogi K K, Truong T B.Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis[J].Current Opinion in Plant Biology, 2013, 16(3): 307-314.
[27] Baker N R.Chlorophyll fluorescence: A probe of photosynthesis in vivo[J].Annual Review of Plant Biology, 2008, 59: 89-113.
[28] Reynolds M, Foulkes J, Furbank R, et al.Achieving yield gains in wheat[J].Plant, cell & environment, 2012,35(10): 1799-1823.
[29] 叶子飘,胡文海,肖宜安,等.光合电子流对光响应的机理模型及其应[J].植物生态学报,2014,38(11): 1241-1249.
INVESTIGATION ON THE RELATIONSHIP BETWEEN SATURATION IRRADIANCE AND CHLOROPHYLL CONTENTS OF FLAG LEAVES AND INTRINSIC CHARACTERISTICS OF LIGHT-HARVESTING PIGMENT MOLECULES IN HIGH-YIELDING RICE
*YE Zi-piao1,2, YAN Xiao-hong1,3, DUAN Shi-hua1
(1.School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi 343009, China;
2.Maths & Physics College, Jinggangshan University, Ji’an, Jiangxi 343009, China;
3.College of Biology and Environment, Nanjing Forestry University, Nanjing, Jiangsu 210037, China)
Chlorophyll is one of important matters for photosynthesis in rice leaf.To investigate the relationship between chlorophyll contents and saturation irradiance, light-response curves of photosynthesis for six rice varieties were measured by LI-6400XT.Then these data were simulated by a mechanistic model of light-response of photosynthesis.The results showed that there is no direct relationship between the saturation irradiance and chlorophyll contents among six rice varieties.The saturation irradiance is a function of eign-absorption cross-section, rate of photochemistry (kp), rate of heat-dissipation (kD) and average life-time of photosynthetic pigments in the excited state(τ) from the mechanistic model of light-response of photosynthesis.
a mechanistic model of light-response of photosynthesis; rice; eign-absorption cross-section;saturation irradiance
Q945.11
ADOI:10.3969/j.issn.1674-8085.2015.02.008
1674-8085(2015)02-0025-08
2014-12-11;修改日期:2015-02-25
国家自然科学基金项目(30960031);江西省自然科学基金项目(20142BAB20402)
*叶子飘(1964-),男,江西永新人,教授,博士,主要从事植物生理等方面的研究(E-mail: yezp@jgsu.edu.cn);
闫小红(1977-),女,内蒙古赤峰人,高级实验师,硕士,主要从事植物生理等方面的研究(E-mail: yanxiaohong325@126.com);
段世华(1968-),男,江西永新人,教授,博士,主要从事植物分子遗传学和水稻植物生理等方面的研究(E-mail:wanwanlong2008@jgsu.edu

