1-氯-1,1-二氟乙烷裂解制备偏氟乙烯
王 刚,郑海峰,尹 红,袁慎峰,陈志荣
(浙江大学化学工程与生物工程学系,浙江杭州310027)
1-氯-1,1-二氟乙烷裂解制备偏氟乙烯
王 刚,郑海峰,尹 红,袁慎峰,陈志荣
(浙江大学化学工程与生物工程学系,浙江杭州310027)
在镍质裂解管中利用1-氯-1,1-二氟乙烷(HCFC-142b)空管裂解制备偏氟乙烯(VDF),探究进料流量和裂解温度对原料转化率和产物选择性的影响.结果表明:裂解温度为550~600℃,进料流量为0.15~0.60 mL/min时原料转化率较高,产物选择性较好,该工艺较适宜制备VDF.通过量子化学计算得到HCFC-142b脱HCl和脱HF反应过程的过渡态结构,计算600℃下脱HCl和脱HF反应的热力学数据和动力学数据,得到反应活化能为225.49和271.15 kJ/mol,计算结果与文献值较为接近,说明该计算方法可靠.
1-氯-1,1-二氟乙烷;裂解;偏氟乙烯;量子化学
偏氟乙烯(vinylidene fluoride,VDF)是生产含氟聚合物的重要化工单体,VDF自身均聚或与其他含氟乙烯基共聚可合成聚偏氟乙烯(polyvinylidene fluoride,PVDF)[1],也可与六氟丙烯二元或与六氟丙烯及四氟乙烯三元共聚制备氟橡胶(FKM)[2].
目前,VDF的制备工艺主要有HCFC-142b脱HCl法[3-4]、二氟乙烷脱氢法和1,1,1-三氟乙烷脱HF法[5],其中主要以HCFC-142b脱HCl法为主.裂解方法主要有空管裂解、助剂裂解和催化裂解.裂解管主要以石英[6-7]和镍合金[8]为管材,温度通常在700℃以上,原料转化率一般为33.5%~84.0%,VDF选择性为67.5%~90.3%.研究结果表明:裂解温度较高时易出现结焦现象,裂解管材质会影响VDF的选择性.常用的助剂有水蒸汽[9-10]、N2[11]、Cl2[12]和CCl4[6],加入助剂可以使VDF选择性在90.0%以上,原料转化率在70.0%以上,但助剂用量较多会导致后续分离困难.已报道的裂解催化剂有金属氧化物[13](如:NiO、Fe2O3和Zn O)、金属氟化物(如:NiF2和AlF3)[14]和Al2O3负载NiCl2和ZnCl2[15],催化温度为300~525℃,此时原料转化率为50.0%~96.0%,VDF选择性为50.0%~99.0%.催化裂解温度低,原料转化率和VDF选择性较高,但裂解产物HCl和HF会与催化剂的活性组分和载体反应,导致催化剂失活,使用寿命较短.
空管裂解工艺简单,操作方便,适合工业应用,国内外已报道的工艺条件主要为高温(700℃以上)短停留时间(<2 s),关于较低温度和较小进料流量(即长停留时间)条件下HCFC-142b在纯镍管中裂解制备VDF的研究报道较少,对主反应HCFC-142b脱HCl生成VDF和副反应HCFC-142b脱HF生成CH2=CFCl的理论研究报道也较少.
本文以HCFC-142b为原料,在纯镍管中裂解制备VDF,考察裂解温度和进料流量对反应的影响.在裂解条件研究的基础上,运用量子化学计算对主、副反应进行反应途径、热力学和动力学分析.
1 实验部分
1.1 主要试剂和仪器
原料HCFC-142b(CP)取自利民化工有限公司,氢氧化钠(AR)购于国药集团化学试剂有限公司,无水氯化钙(AR)购于衢州巨化试剂有限公司,管式电阻炉(SK2-4-10,恒温段为50 cm)和电炉温度控制器(DR2-4)购于天津天有利科技有限公司,自制纯镍裂解管(Φ26 mm×1 200 mm,壁厚为0.8 mm).
1.2 HCFC-142b裂解制备VDF
搭建实验装置如图1所示.检查反应装置气密性后用纯氮气置换管路,打开电阻炉开关,设定加热参数.待反应管温度稳定后打开冷却水开关、HCFC-142b流量计开关,并控制流量进行反应.裂解产物经换热器冷却、NaOH溶液除酸性气体和无水CaCl2干燥后收集分析.
1.3 分析方法
1.3.1 气相色谱分析 Agilent 4890D GC型气相色谱仪,采用FID检测器,色谱柱为GS-GSPRO型(60 m×0.32 mm);载气为氮气(3.0 m L/min);柱前压力为30 kPa.采用程序升温,初始柱温50℃保持4 min,以10℃/min升温至150℃,保持6 min;汽化室温度为200℃,检测器温度为250℃,进样量为0.1~0.3 m L.
1.3.2 GC-MS分析 TRACE DSQⅡ型气相色谱-质谱联用仪,MS条件为EI离子源,电子能量为70 eV,温度为200℃,接口温度为230℃,扫描范围为10~350 m/z.GC条件为载气He(3.0 m L/min),柱前压力为30 kPa,汽化室温度为200℃,程序升温过程与上述气相色谱分析相同.
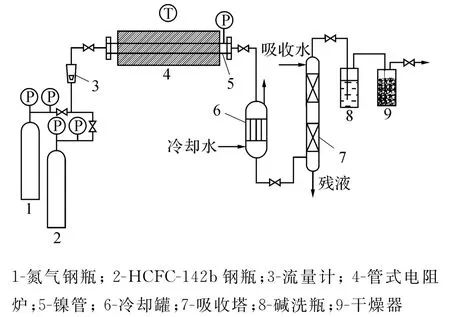
图1 裂解实验装置图Fig.1 Pyrolysis experimental equipment
1.4 量子化学计算
量子化学计算采用密度泛函(density functional theory,DFT)理论,通过Gaussian 03程序包在DELL OPTIPLEX 780工作站上进行,采用uB3LYP水平的6-31+G(d,p)基组对反应物、过渡态和产物进行计算,矫正因子为0.961 4[16-17].根据Eyring的过渡态理论[18],基元反应的活化焓ΔrH≠、活化能Ea和反应速率常数k可由基元反应过渡态(transient state,TS)焓值HTS、反应物焓值HR、基元反应反应物分子数n、普适气体常数R、裂解温度t、玻尔兹曼常数k′、普朗克常数h和基元反应的活化吉布斯自由能ΔrG≠按下式得到:
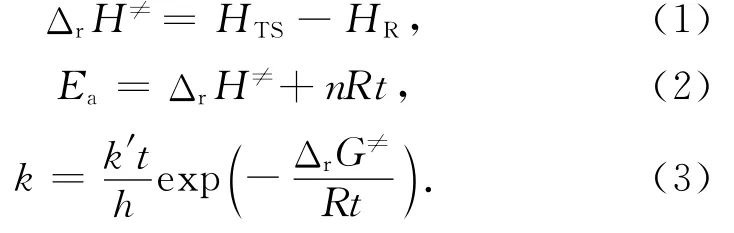
2 实验结果与讨论
2.1 产物GC-MS的分析结果
通过GC-MS(气相色谱-质谱联用仪)分析,得到各产物和原料的MS数据如下:VDF的MS数据为64、45、44,31 m/z;CH3CF3的MS数据为84、69、65 m/z;CHF2Cl的MS数据为86、67、51、31 m/z;CFCl=CH2的MS数据为82、80、61、45、31、26 m/z;CHF2CH3的MS数据为65,51、47、27 m/z;HCFC-142b的MS数据为85、65、45、31 m/z;CCl2=CH2的MS数据为100、98、96、61、26 m/z.
2.2 温度对反应的影响
当HCFC-142b的进料流量Q=0.15和0.60 L/min时,裂解温度t对原料转化率X、VDF选择性SVDF和副产物CH2=CFCl选择性SCH2=CFCl的影响结果如图2所示.可以看出,当裂解温度为450~550℃时,HCFC-142b的转化率随裂解温度升高而迅速升高;当裂解温度高于550℃时则趋于平稳.HCFC-142b脱HCl裂解生成VDF为吸热反应,高温有利于该反应的进行.当裂解温度较低时,脱HCl反应占主导地位,VDF的选择性随裂解温度的升高而升高;当裂解温度较高时,HCFC-142b同时发生脱HCl和脱HF反应,高温更有利于脱HF反应,生成CFCl=CH2,导致VDF选择性下降.
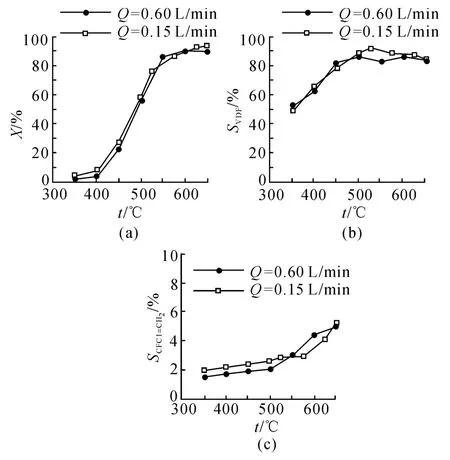
图2 裂解温度对转化率和VDF及副产物选择影响Fig.2 Effect of pyrolysis temperature on conversion and selectivity of VDF and by-product
从上述实验结果可以得出以下结论:当裂解温度为530℃,进料流量为0.15 L/min时,HCFC-142b的转化率为80.0%左右,VDF的选择性为95.0%左右,主要副产物CFCl=CH2的选择性为2.5%左右.与文献[6~8]的研究结果相比,上述结果表明:可以通过减小进料流量而降低裂解温度,但原料转化率仍较高,结碳结焦现象减少;同时,镍质裂解管可以提高VDF的选择性,抑制CFCl=CH2的生成.
2.3 原料进料流量对反应的影响
当裂解温度为500和550℃时,HCFC-142b进料流量对原料转化率VDF选择性和副产物选择性的影响结果如图3所示.由图3可知,当HCFC-142b进料流量增大时,HCFC-142b在裂解管内停留时间变短,HCFC-142b转化率下降,不同温度下的影响规律基本一致.进料流量对VDF和CFCl=CH2选择性的影响不明显,当进料流量较小时,靠近壁面处的物料流速小,与流量较大时相比,易出现结碳结焦现象,但降低裂解温度仍可以达到减少结碳结焦的目的.
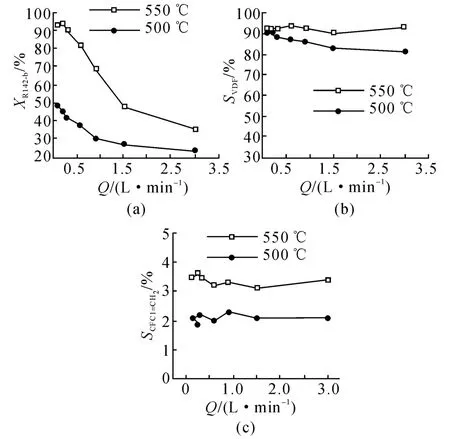
图3 流量对转化率和VDF及副产物选择影响Fig.3 Effect of flow rate on conversion and selectivityof VDF and by-product
2.4 量子化学计算
2.4.1 反应过程分析 对反应物、中间体和产物进行几何构型优化,经频率分析验证后得到稳定构型,采用过渡态法搜索反应过程的过渡态,并采用内禀反应坐标法计算确定过渡态结构.

图4 HCFC-142b脱HCl反应过程各物质构型优化参数Fig.4 Structure optimal parameters of each substantial during HCl elimination of HCFC-142b
如图4所示为HCFC-142b脱HCl裂解过程各物质的构型优化结果,TS1和TS2分别为HCFC-142b和过渡态的优化结构,其中过渡态的虚频为-1 020.24 cm-1.脱HCl反应过程存在分子内旋转、过渡态形成和烯烃形成3个阶段,HCFC-142b分子受热内旋转形成构型TS1,分子内C-C键键长由0.150 82 nm增长到0.152 43 nm,C-Cl键键长由0.180 18 nm增长到0.192 9 nm.在过渡态形成阶段,Cl原子与H1原子靠近,C-C键键长缩短为0.141 50 nm,C-Cl和C-H1键键长分别增长为0.280 3 nm和0.119 7 nm,C-Cl键和CH1键开始断裂.在烯烃形成阶段,H1-Cl键键长由过渡态的0.188 9 nm缩短至0.128 68 nm,C-C键键长缩短为0.132 24 nm,形成H1-Cl键和C=C双键,形成构型TS2.
如图5所示为HCFC-142b脱HF过程各物质的构型优化结果,图中,TS3和TS4分别为HCFC-142b和过渡态的优化结构.其中,过渡态虚频为-1 665.88 cm-1.脱HF的反应路径与脱HCl的反应路径相同,HCFC-142b分子受热内旋转形成构型TS3,分子内C-C键键长由0.150 82 nm增长为0.152 43 nm,C-F1键键长由0.136 14 nm增长为0.137 81 nm.在过渡态形成阶段,F1原子与H1原子靠近,C-C键键长缩短至0.141 28 nm,C-F1键和C-H1键键长分别增长至0.205 37 nm和0.127 88 nm,C-F1键和C-H1键开始断裂.在烯烃形成阶段,H1-F1键键长缩短为0.927 9 nm,C-C键键长缩短为0.132 58 nm,形成H1-F1键和C=C双键.
对构型TS1-TS4进行自然键轨道理论[19]分析得到脱HCl和脱HF过程各结构的Wiberg键级,结果如表1、2所示.从Wiberg键级数据可以看出,脱HCl和脱HF过程中C-C键的Wiberg键级逐渐增大,演变为双键,C-H1、C-Cl和C-F1键的Wiberg键级逐渐减小,说明这3个键正在断裂,H1-Cl健和H-F1键的Wiberg键级逐渐增大,说明H1-Cl键和H-F1键正在形成.在烯烃分子形成阶段,C-C键键长变短,C-C键的Wiberg键级变长,说明已形成C=C,H-F1键和H1-Cl键键长缩短,Wiberg键级增大,说明HF和HCl已生成.

图5 HCFC-142b脱HF反应过程各物质构型优化参数Fig.5 Structure optimal parametersof each substantial during HF elimination of HCFC-142b

表1 脱HCl反应过程中各构型的Wiberg键级Tab.1 Wiberg bond order of each configuration during HCl elimination reaction

表2 脱HF反应过程各构型Wiberg键级Tab.2 Wiberg bond order of each configuration during HF elimination reaction
3.4.2 热力学分析 在uB3LYP/6-31+G(d,p)水平上计算600℃时HCFC-142脱HCl和脱HF反应的热力学函数,计算结果如表3所示.可以看出,HCFC-142b脱HCl和脱HF反应的ΔrHΘ>0,均为吸热反应.脱HF反应的ΔrHΘ较大,说明高温更有利于脱HF反应,这与上文反应温度升高,VDF选择性下降的结果一致.ΔrGΘ越小,反应越容易进行,且达到平衡时反应物的转化率越高,说明HCFC-142b脱HCl反应较易进行,产物以VDF为主,这也与上述实验结果相符.

表3 600℃时脱HCl和脱HF反应的热力学函数计算值Tab.3 Thermodynamic calculation data of HCl elimination and HF elimination reaction under 600℃kJ/mol
3.4.3 动力学分析 热力学数据分析表明高温有利于生成VDF和CFCl=CH2.但当温度较高时,VDF和CFCl=CH2的生成量随温度的变化规律无法从所得热力学数据中推测.在uB3LYP/6-31+G(d,p)水平上计算600℃时,HCFC-142脱HCl和脱HF反应的动力学函数值计算结果如表4所示.
由表4可知,脱HF反应活化能较脱HCl反应高,说明高温对脱HF反应有利.当裂解温度较高时,VDF选择性下降,这与实验结果吻合,因此,必须选择合适的温度以提高VDF的选择性.高温气相裂解反应的准确活化能数据通常较难获得,文献报道的脱HF和脱HCl反应的活化能是通过化学活化法测得[20].随着计算机的发展,反应活化能可以通过高斯计算得到.对比表4中文献值和计算结果可以看出,在uB3LYP/6-31+G(d,p)水平下计算所得的活化能数据与报道值较为接近,说明该计算方法较为可靠.

表4 600℃时脱HCl和脱HF反应的动力学函数计算值Tab.4 Dynamic calculation data of HCl elimination and HF elimination reaction under 600℃ kJ/mol
3 结 语
HCFC-142b的较适宜裂解温度为550~600℃,进料流量为0.15~0.60 m L/min.此时,原料转化率为88.0%左右,产物选择性为92.0%.通过减小进料流量可以降低裂解温度,纯镍对脱HCl副反应具有一定的抑制作用.600℃下脱HCl和脱HF反应的热力学函数计算结果表明:高温更有利于脱HF反应的进行,这与实验事实吻合;动力学函数计算结果表明:脱HCl和脱HF反应均为强吸热反应,其活化能分别为225.49和271.15 kJ/mol,与文献报道的结果较为接近.
(References):
[1]张士林,范孜娟.聚偏氟乙烯树脂性能和加工应用[J].工程塑料应用,2005,33(4):67- 69.
ZHANG Shi-lin,FAN Zi-juan.Properties of polyvinylidene fluoride and its application[J].Engineering Plastics Application,2005,33(4):67- 69.
[2]钱伯章.氟橡胶的国内外发展现状[J].中国橡胶,2008,24(7):14- 16.
QIAN Bo-zhang.The development of fluorine rubber at home and abroad[J].China Rubber,2008,24(7):14- 16.
[3]李嘉.氟橡胶市场现状与应用前景[J].中国石油与化工经济分析,2013(1):44- 47.
LI Jia.Situation and application prospect of fluorine rubber market[J].Economic Analysis of China Petroleum and Chemical Industry,2013(1):44- 47.
[4]朱顺根.1-氯-1,1-二氟乙烷热解反应的动力学特征和热解方法[J].有机氟工业,2004(2):30- 43.
ZHU Shun-gen.Dynamic characterization and pyrolysis method of 1-chloro-1,1-difluoroethane[J].Organo-fluorin Industry,2004(2):30- 43.
[5]EARLEY J J.Production of vinylidene fluoride:US,3246041[P].1966-04- 12.
[6]CHARLES B M,LYNBROOK N Y.Manufacture of fluoroolefins:US 2628989[P].1953-02-17.
[7]STOVER A W.Pyrolysis of difluoromonochloroethane:US 2627529[P].1953-08-23.
[8]DOWNING F B.Pyrolysis of chloro-fluoro alkanes:US 2551573[P].1951-05-08.
[9]张在利,曾本忠,曾子敏,等.二氟一氯乙烷裂解生产偏氟乙烯的方法:CN 1428320[P].2003-07-09.
[10]BARABANOV V G,VOLKOV G V.Method of synthesis of vinylidene fluoride:RU 1823419[P].1996-6-10.
[11]刘新民,王兵,荆海洋,等.用R142b裂解制备偏氟乙烯的方法和设备:CN 101003460[P].2007-07-25.
[12]MAURICE M,JAMES E.Production of vinylidene fluoride:US 3246041[P].1966-04-12.
[13]FRANCIS H,WALKER A E.Dehyrohalogenationof 1,1,1-trihaloethanes[J].Journal of Organic Chemistry,1965,30(10):3284- 3285.
[14]ELSHELKH M Y.Catalytic process for the dehyrohalogenation of 1-chloro-1,1-difluoroethane:EP 0407711[P].1991-01-16.
[15]GARDENER L E.Production of gem-difluoroalkenes:US 3444251[P].1969-5-13.
[16]SCOTT A P,RADOM L.Harmonic vibrational frequencies:an evaluation of Hartree-Fock,Moller-Plesset,quadratic configuration interaction,density functional theory,and semiempirical scale factors[J].Journal of Chemical Physics,1996,100(41):16502-16513.
[17]HALLS M D,VELKOVSKI J,SCHLEGEL H B.Harmonic frequency scaling factors for Hartree-Fock,S-VWN,B-LYP,B3-LYP,B3-PW91 and MP2 with the Sadlej p VTZ electric property basis set[J].Theoretical Chemistry Accounts,2001,105(6):413- 421.
[18]EYRING H.The activated complex and the absolute rate of chemical reactions[J].Chemical Reviews,1935,17(1):65- 77.
[19]GLENDENING E D,LANDIS C R,WEINHOLD F.Natural bond orbital methods[J].Wiley InterdisciplinaryReviews Computational Molecular Science,2012,2(1):1- 42.
[20]JONES Y,HOLMES B E,DUKE D W.Threshold energies and substituent effects for unimolecular elimination of HCl(DCl)and HF(DF)from chemically activated CF2ClCH3and CF2ClCD3[J].Journal of Physical Chemistry,1990,94(12):4957- 4963.
Pyrolysis of 1-chloro-1,1-difluoroethane to vinylidene fluoride
WANG Gang,ZHENG Hai-feng,YIN Hong,YUAN Shen-feng,CHEN Zhi-rong
(Department of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310027,China)
Pyrolysis of 1-chloro-1,1-difluoroethane(HCFC-142b)to vinylidene fluoride(VDF)was carried out in nickel tube.The effects of pyrolysis temperature and feeding flow on the conversion of HCFC-142b and the selectivity of VDF was investigated.Results showed that the process was suitable at 550-600℃and the feeding rate of 0.15-0.60 m L/min,the conversion of HCFC-142b and the selectivity of VDF were acceptable.The transition state structures of hydrogen chloride elimination and hydrogen fluoride elimination reaction were obtained by quantum chemistry calculation.The thermodynamic data and dynamic data of these two reactions under 600℃were calculated as 225.49 and 271.15 kJ/mol.The calculation results of active energy were close to the reported data,indicating that the calculation method is reliable.
1-chloro-1,1-difluoroethane;pyrolysis;vinylidene fluoride(VDF);quantum chemistry
10.3785/j.issn.1008-973X.2015.09.027
TQ 655
A
1008- 973X(2015)09- 1812- 05
2014- 08- 01. 浙江大学学报(工学版)网址:www.journals.zju.edu.cn/eng
浙江省重点科技创新团队计划资助项目(2011R50007).
王刚(1989-),男,硕士生,从事应用化学研究.ORCID:0000-0002-9342-4771.E-mail:kjxywg@126.com
尹红,女,副教授.ORCID:0000-0003-0742-3754.E-mail:yinh@zju.edu.cn

