血清MMP-9与DMD 骨骼肌纤维化的相关性分析
陈盼盼 李 哲 韩春锡 林婧娴 廖建湘
1)山东滨州市人民医院儿科 滨州 256600 2)山东滨州市人民医院骨科 滨州 256600 3)广东深圳市儿童医院神经内科 深圳 518038 4)广东珠海市人民医院儿科 珠海 519000
杜氏型肌营养不良(Duchenne muscular dystrophy,DMD)是X-连锁隐性遗传病,占活产男婴的1/3 500~1/4 000[1-2]。DMD 患 者 由 于dystrophin基 因 突 变,导 致 肌 纤 维膜上的dystrophin蛋白缺失,从而出现肌纤维变性、坏死、再生,炎细胞浸润,纤维结缔组织和脂肪组织增生。研究表明,改善肌肉纤维化可延缓患者疾病进展,并可通过改变肌纤维的微环境提高基因治疗、干细胞治疗的成功率[3-4]。本研究探讨骨骼肌纤维化与年龄的关系,探讨血清MMP-9与DMD骨骼肌纤维化的关系及作为DMD 病情变化指标的可行性。
1 资料与方法
1.1 一般资料 收集2011-08—2012-06就诊于深圳市儿童医院神经肌肉病专科并通过肌肉病理检查和(或)基因检查诊断为DMD/BMD、且未经药物治疗的50 例患儿(均为男孩)为研究对象,收集患者腓肠肌和非抗凝血资料。其中DMD 组42例,平均年龄(6.55±2.72)岁;BMD 组8 例,平均年龄(8.80±4.17)岁;收集正常对照组非抗凝血18例,平均年龄(8.07±3.86)岁。DMD 组又根据年龄分为3组,其中<5岁组13例,5~9岁组21例,>9 岁组8例。收集的肌肉标本均来自于肌活检。本研究标本收集均经患儿家长同意,并签写知情同意书。
1.2 方法 行HE染色观察骨骼肌基本病理改变,Masson染色观察骨骼肌纤维化程度,免疫组织化学链霉素抗生物素蛋白过氧化物酶连结(SP)法观察MMP-9在肌肉组织中的分布情况;并对行DMD、BMD 及正常对照组行ELISA 法行血清MMP-9浓度测定。
2 结果
2.1 各组骨骼肌比较 DMD 组骨骼肌中可见纤维组织增生,其中<5岁组DMD 患者骨骼肌纤维组织增生不明显,5~9 岁组DMD 骨骼肌纤维组织增生明显(图1),>9 岁组DMD 骨骼肌纤维组织增生明显,且肌纤维数量明显减少。BMD 对照组未见明显纤维组织增生。除可见纤维化组织增生情况外,<5岁组DMD 骨骼肌可见肌束间界限欠清,较多萎缩、肥大、变性、坏死肌纤维和以及少量再生肌纤维;5~9岁组DMD 骨骼肌肌束间界限欠清,大量萎缩、肥大、变性、坏死以及少量再生肌纤维(图2);>9岁组DMD 骨骼肌肌束间界限欠清,大量萎缩、肥大、变性、坏死肌纤维,少量再生肌纤维。BMD 对照组骨骼肌肌束间界限清,较多萎缩、肥大、变性、坏死以及再生肌纤维。
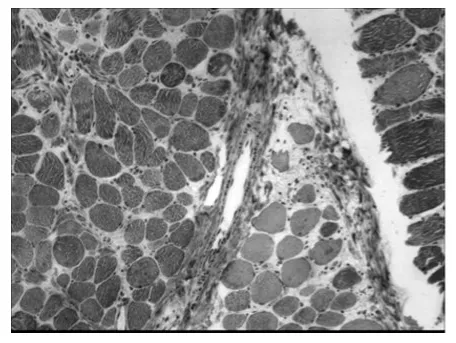
图1 DMD MASSON染色×100
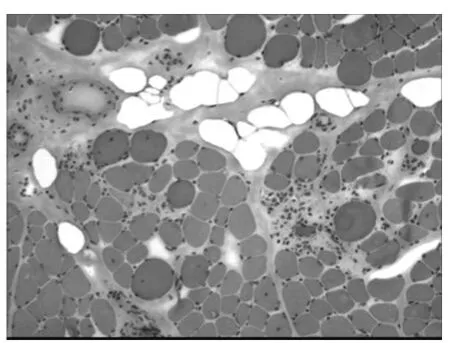
图2 DMD HE染色×100
2.2 各组纤维化程度通过胶原纤维/(胶原纤维+肌纤维)面积百分比比较 DMD 组纤维化程度均值为(40.29±15.27)%,明 显 高 于BMD 对 照 组(20.04±8.50)%(t=3.653,P<0.05)。见表1。DMD<5 岁组、5~9 岁组、>9岁组相比,纤维化程度逐渐增高,差异有统计学意义(P<0.05,表2)。采用Pearson线性相关与回归分析DMD 组纤维化程度与年龄的关系,结果提示胶原纤维含量随患儿年龄的增长而增加,两者成正相关(r=0.6721,P<0.05)。
表1 DMD 组、BMD 对照组纤维化程度测量结果比较
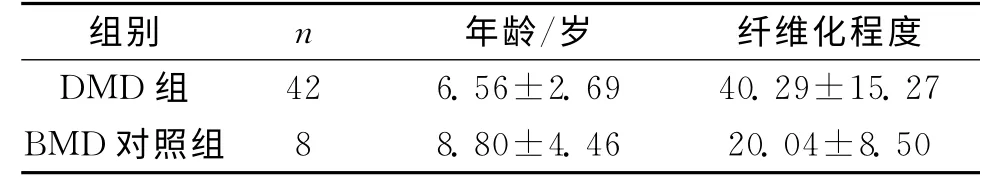
表1 DMD 组、BMD 对照组纤维化程度测量结果比较
注:2组数据均近似正态分布,经两独立样本t检验,F=2.457,P=0.124,方差齐,t=3.653,P=0.001
组别 n 年龄/岁 纤维化程度DMD 组42 6.56±2.69 40.29±15.27 BMD 对照组8 8.80±4.46 20.04±8.50
表2 DMD 各组纤维化程度测定结果比较

表2 DMD 各组纤维化程度测定结果比较
注:三组数据都近似正态分布。经单因素方差分析,方差齐,P=0.293,总体分析,F=18.643,P=0.000
组别 n 年龄/岁 纤维化程度/%<5岁组13 3.48±0.28 30.53±10.26 5~9岁组 21 6.83±0.94 39.79±11.89>9岁组8 10.81±0.93 59.59±13.65
2.3 α-SMA 是肌成纤维细胞的特异性标记物,图3b 示DMD 骨骼肌中存在肌成纤维细胞。CD68标记巨噬细胞,在DMD 骨骼肌中,巨噬细胞浸润,且坏死肌纤维周围多见。MMP-9存在于DMD 骨骼肌中,且在巨细胞浸润的部位表达较强。
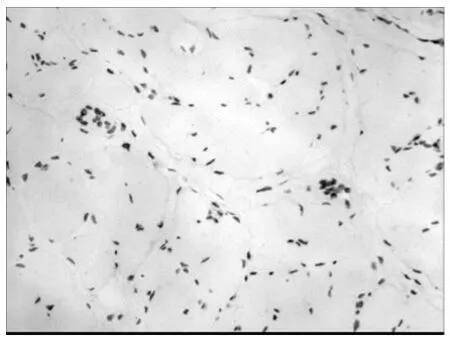
图3a DMD 阴性对照×200
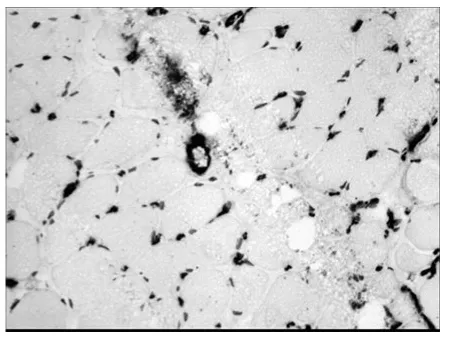
图3b DMDα-SMA染色×200
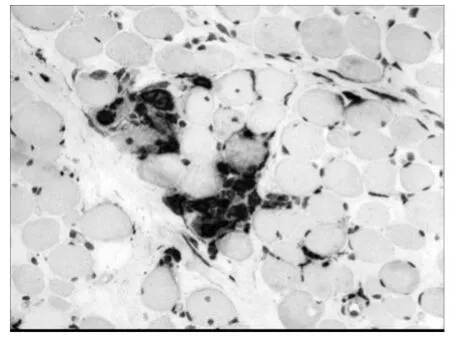
图3c DMD CD68染色×200
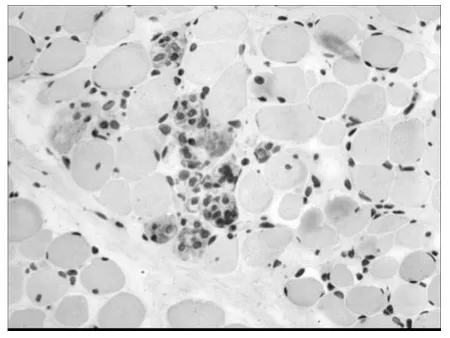
图3d DMD MMP-9染色×200
2.4 各 组MMP-9 浓 度 比 较 DMD 组、BMD 对 照 组 血 清MMP-9浓度比正常对照组明显升高,且DMD 组血清MMP-9浓度升高最明显,3组血清MMP-9浓度比较差异有统计学意义(P<0.05)。在DMD 患者中,>9岁组、5~9岁组与<5岁组相比血清MMP-9均升高(P<0.05);>9岁组与5~9岁组相比,血清MMP-9略下降,但差异无统计学意义(P>0.05)。见表3、表4。经Pearson相关分析,9岁前的DMD患者,血清MMP-9与年龄正相关(r=0.6118,P<0.05)。
表3 DMD 组、BMD 对 照 组、正 常 对 照 组 血 清MMP-9浓度测定结果

表3 DMD 组、BMD 对 照 组、正 常 对 照 组 血 清MMP-9浓度测定结果
注:近似正态分布,经单因素方差分析,方差不齐,P=0.000,总体分析F=46.398,P=0.000
组别 n 年龄(岁) MMP-9(ng/mL)DMD 组42 6.56±2.69 742.37±309.12 BMD 对照组 8 8.80±4.47 286.94±82.95正常对照组18 8.07±3.86 89.93±41.27
表4 DMD各组血清MMP-9浓度测定结果及P值表

表4 DMD各组血清MMP-9浓度测定结果及P值表
注:近似正态分布,经单因素方差分析,方差齐,P=0.241,总体分析F=8.873,P=0.001
组别 n 年龄/岁 MMP-9(ng/mL)<5岁组13 3.48±0.28 499.83±205.52 5~9岁组 21 6.83±0.94 887.07±310.77>9岁组8 10.81±0.93 756.69±229.55
3 讨论
本研究采用Masson染色观察、测定纤维化程度。目前,Masson染色是检测纤维化最常用的病理方法,该方法成熟、可靠、方便,并广泛应用于肝肾纤维化、骨骼肌纤维化、mdx小鼠心肌纤维化等纤维化疾病的测定中[5-6]。对DMD、BMD患者的冰冻肌肉组织进行Masson染色,染色后胶原纤维呈现蓝色,肌纤维呈现红色,容易区分,便于纤维化程度的计算。
本研究中,DMD 与贝克型肌营养不良(Becker muscular dystrophy,BMD)的纤维化严重程度不同。DMD 组纤维化程度较BMD 组明显升高(P<0.05),这与DMD、BMD 的发病机制相关。在DMD 中,dystrophin基因发生框移突变,导致合成的dystrophin蛋白缺失C末端,而且dystrophin蛋白的含量不足正常人的3%,dystrophin-C、N、R 免疫组化染色多为0~2级。在BMD 中,dystrophin基因突变并不改变翻译阅读框架,产生的dystrophin蛋白保留C 末端,合成dystrophin蛋白功能降低,且dystrophin-C、N、R 免疫组化染色多为3~4级[1,7-8]。dystrophin蛋白的缺失使细胞膜结构不完整、功能受损,这导致肌细胞变性坏死、炎细胞浸润、纤维结缔组织增生[9]。DMD 患者dystrophin蛋白缺失严重,其肌纤维结构功能受影响较大,因此,在DMD 中可见较多变性、坏死、再生肌纤维。BMD 患者中dystrophin蛋白含量较多,对肌纤维结构和功能的影响较小,细胞坏死发生的较缓慢,炎性反应、纤维化程度较DMD 轻[10]。由于BMD 患者与DMD患者的发病机制类似,病理改变的特点密切相关,故本研究在观察DMD 组纤维化程度时,选用BMD 早期患者作为对照组。
本研究观察DMD 患者Masson染色,发现<5岁组者纤维结缔组织增生不明显,5~9 岁组肌纤维结缔组织增生明显,>9岁组纤维结缔组织增生最明显,且DMD 骨骼肌纤维化程度随年龄的增加而加重(r=0.6721,P<0.05),表明随着年龄的增加,DMD 肌纤维逐渐被纤维结缔组织取代,骨骼肌病理变化越来越严重。大量研究表明[1,11],在DMD 中,骨骼肌病理改变的严重程度与年龄相关,在年幼患儿中肌肉病理改变较轻,在年龄大的患儿中病理改变较重,其中纤维化程度随着年龄的增加逐渐加重,与本研究结果一致。
MMP-9作为一种分泌蛋白,由受损的肌肉及炎性细胞释放,存在于mdx小鼠骨骼肌的肌纤维及其周围组织表明,且巨噬细胞密度高的地方,MMP-9水平也较高[12]。在本研究中,MMP-9存在于DMD 骨骼肌组织中,且巨噬细胞密度高的地方表达较强,与MMP-9在mdx小鼠骨骼肌中的分布相符。
本研究中,除了DMD 组、BMD 对照组血清MMP-9浓度均比正常对照组高外,DMD 组血清MMP-9浓度比BMD对照组高(P<0.05),且DMD 组纤维化程度比BMD 组高,这表明血清MMP-9浓度可能与纤维化程度有关。国外研究报道,生后6周、8周的mdx小鼠与同龄wt小鼠相比,血清MMP-9浓 度 升 高[13-14],些 研 究 均 表 明MMP-9与mdx小 鼠骨骼肌纤维化有关,与本研究结果相符。
DMD>9岁组、5~9岁组与<5岁组相比,血清MMP-9浓度较高(P<0.05),>9 岁组与5~9 岁组相比,血清MMP-9略有下降,但差异无统计学意义(P>0.05)。在第8到14周的mdx小鼠中,血清MMP-9水平在随mdx小鼠年龄的增加而下降[13],而本研究中>9岁组与5~9岁组差异无统计学意义,这可能与mdx小鼠与DMD 患者的病理改变程度不同有关。
本研究中,可见DMD5~9岁组血清MMP-9浓度均比<5岁组较高,且9岁之前,DMD 血清MMP-9(r=0.6118,P<0.05)浓度随年龄的增加而升高。DMD 患者纤维化程度随年龄的增加而加重,因此,我们推断DMD 在9岁之前,血清MMP-9浓度随纤维化程度的加重而升高。Nadarajab VD等[13]以接受了糖皮质激素治疗的DMD 患者为研究对象,发现血清MMP-9浓度随年龄的增长而增加,这可能与糖皮质激素有关。在其他疾病中,糖皮质激素可使血清MMP-9水平降低[15],或 先 升 高 后 降 低[16],亦 有 研 究 表 明 无 明 显 影响[17];在Nadarajab VD 等[13]的 研 究 中,不 仅 应 用 了 糖 皮 质激素且治疗时间长短不一,不能完全排除糖皮质激素治疗对研究结果的影响。Hughes等[53]指出,在DMD 中,糖皮质激素可能通过钙调磷酸酶/NF-AT(nuclear factor of activated T-cell,NF-AT)途径减缓DMD 肌纤维化的病理过程,这可能会影响MMP-9水平。因此,本实验中选择未经过经过糖皮质激素治疗的DMD 患者为研究对象,结果可以排除糖皮质激素的影响。
本研究表明,DMD 患者血清MMP-9 浓度升高,且在DMD 患者9岁之前,血清MMP-9浓度随年龄的增长、纤维化程度的增加而升高。因此,血清MMP-9浓度可与其他指标共同作为评估DMD 病情变化的重要指标,尤其是作为评估早中期DMD 病情变化的评估指标,以及作为评估DMD早期治疗效果的评估指标。
[1] 喻绪恩,王训,王永光,等.Duchenne型肌营养不良的临床和病理及抗肌萎缩蛋白表达[J].中国临床神经科学,2012,20(12):153-158.
[2] 李秋香,杨欢,张宁,等.杜兴型肌营养不良50例临床及病理分析[J].中国当代儿科杂志,2012,14(10):746-750.
[3] Zhou L,Lu H.Targeting fibrosis in Duchenne muscular dystrophy[J].J Neuropathol Exp Neurol,2010,69(8):771-776.
[4] Mann CJ,Perdiguero E,Kharraz Y,et al.Aberrant repair and fibrosis development in skeletal muscle[J].Skelet Muscle,2011,1(1):21.
[5] Au CG,Butler TL,Sherwood MC,et al.Increased connective tissue growth factor associated with cardiac fibrosis in the mdx mouse model of dystrophic cardiomyopathy[J].Int J Exp Pathol,2011,92(1):57-65.
[7] Matsuo M.Duchenne and Becker muscular dystrophy:from gene diagnosis to molecular therapy[J].IUBMB Life,2002,53(3):147-152.
[8] Werneck LC,Scola RH,Maegawa GH,et al.Comparative analysis of PCR-deletion detection and immunohistochemistry in Brazilian Duchenne and Becker muscular dystrophy patients[J].Am J Med Genet,2001,103(2):115-120.
[9] Aartsma-Rus A,Van Deutekom JC,Fokkema IF,et al.Entries in the Leiden Duchenne muscular dystrophy mutation database:An overview of mutation types and paradoxical cases that confirmthe reading-frame rule1[J].Muscle Nerve,2006,34(2):135-144.
[11] 陈琳,郭玉璞,邹丽萍,等.DMD 患者骨骼肌抗萎缩蛋白表达与临床病理改变[J].基础医学与临床,2005,25(11):1 049-1 053.
[12] Dahiya S,Givvimani S,Bhatnagar S,et al.Osteopontin-stimulated expression of matrix metalloproteinase-9causes cardiomyopathy in the mdx model of Duchenne muscular dystrophy[J].J Immunol,2011,187(5):2723-2731.
[13] Nadarajah VD,van Putten M,Chaouch A,et al.Serum matrix metalloproteinase-9(MMP-9)as a biomarker for monitoring disease progression in Duchenne muscular dystrophy(DMD)[J].Neuromuscul Disord,2011,21(8):569-578.
[14] Kherif S,Lafuma C,Dehaupas M,et al.Expression of matrix metalloproteinases 2and 9in regenerating skeletal muscle:a study in experimentally injured and mdx muscles[J].Dev Biol,1999,205(1):158-170.
[15] My liwiec J,Adamczyk M,Paw owski P,et al.Serum gelatinases(MMP-2and MMP-9)and VCAM-1as a guideline in a therapeutic approach in Graves'ophthalmopathy[J].Endokrynol Pol,2007,58(2):105-109.
[16] Mirowska D,Wicha W,Czlonkowski A,et al.Increase of matrix metalloproteinase-9in peripheral blood of multiple sclerosis patients treated with high doses of methylprednisolone[J].J Neuroimmunol,2004,146(1/2):171-175.
[17] Goleva E,Hauk PJ,Boguniewicz J,et al.Airway remodeling and lack of bronchodilator response in steroid-resistant asthma[J].J Allergy Clin Immunol,2007,120(5):1 065-1 072.

