司来吉兰对帕金森病模型大鼠结肠α-Syn Bcl-2表达的影响
毕树立 高海英
1)河北唐山市开平医院急诊科 唐山 063021 2)河北唐山市丰南区医院 唐山 063300
帕金森病(Parkinson’s disease,PD)是中、老年人临床常见的神经系统退行性变性疾病。除典型的运动症状表现外[1],常伴自主神经功能紊乱,肠神经功能紊乱等非运动系统症状,且发生率较高[2],便秘等结肠功能紊乱是临床中常见的下消化道功能紊乱[3-5]。本研究以鱼藤酮制作的帕金森病大鼠模型为对象,观察司来吉兰对帕金森病大鼠模型结肠中α-Syn及Bcl-2表达的影响,探讨司来吉兰在帕金森患者消化道功能紊乱中的作用及可能机制。
1 材料与方法
1.1 主要试剂与仪器 盐酸司来吉兰(Orion CorPoration,芬兰);鱼藤酮(北京博奥森生物工程有限公司,北京);葵花油(唐山沃尔玛超市,唐山);兔抗大鼠Bcl-2抗体和兔抗大鼠α-Syn抗体(Cell Signaling Technology,美 国);SP 免 疫 组 化试剂盒、DAB显色液购自(中杉生物有限公司,北京);奥林巴斯BX63全自动显微镜扫描系统(OLYMPUS,日本)。
1.2 实验动物 体质量180~250g的健康雄性SD 大鼠60只,按照随机原则将实验动物随机分为正常对照组(对照组)、帕金森病模型组(PD 组)和司来吉兰治疗组(治疗组),各组再随机分为模型制作成功后4d和8d2个时间点,每组每个时间点各10只。
1.3 试验方法
1.3.1 帕金森病模型的制备:采用颈背部皮下注射鱼藤酮制备帕金森病模型[6]。具体操作方法:鱼藤酮应用葵花油溶解配制成2mg/mL 鱼藤酮葵花油乳液,充分震荡混匀后避光保存。PD 组和治疗组大鼠称质量后以鱼藤酮2mg/kg计算鱼藤酮葵花油乳液用量。常规碘伏消毒后,捏起大鼠颈背部皮肤,用1mL注射器皮下注射鱼藤酮葵花油乳液。以出现行为学改变作为判定模型成功的指标[7],选择2~6分作为实验大鼠。模型制备成功后,治疗组:司来吉兰0.5 mg/kg每日灌胃,4d及8d2个时间点分别连续灌胃4d和8d。对照组及PD 组每只每日均连续灌胃等体积生理盐水,直至试验时间点。
1.3.2 标本制备及检测:腹腔注射10%水合氯醛溶液4 mL/kg麻醉实验大鼠。满意后用4%多聚甲醛灌流组织固定,剖腹后取大鼠结肠,清洗干净后去除多余组织,取约3cm肠标本多聚甲醛固定24h 过夜行免疫组化检测,另取约3 cm 肠标本投入液氮,于-80 ℃保存以备行Western blotting。免疫组化检测:将结肠标本制作成石蜡切片,采用免疫组化SP 法,切片常规脱蜡脱水,3%H2O2溶液室温作用封闭内源性酶,微波进行抗原修复,滴加血清封闭,滴加适当稀释的兔抗大鼠一抗(Bcl-2、α-Syn均为1∶200),湿盒孵育,4℃过夜,滴加HRP标记山羊抗兔二抗,37 ℃恒温箱孵育30 min,蒸馏水洗涤后DAB显色,苏木素复染,常规脱水、透明、中性树脂封片,显微镜观察。采用Image Pro-Plus 6.0图像分析软件分析。每张切片在高倍镜下观察,阳性产物为棕黄色,以积分光密度(intensive optical density,IOD)为指标进行图像分析,计算5个高倍显微镜下平均光密度值。Western blotting蛋白印记:取各组制备好的大鼠结肠组织20μg,10%SDS-PAGE 电泳分离后,以湿转法电转移至PVDF 膜上。转移后的PVDF膜于封闭液中封闭,然后分别加入兔抗大鼠Bcl-2一抗(1∶1000)、兔抗大鼠α-Syn一抗(1∶1000)孵育过夜。PBS 洗膜,加人相应浓度的二抗(羊抗兔,1∶2000),室温反应1h,洗膜后ECL 显色,胶片曝光显影后,使用Image J软件进行测定平均灰度值。
1.4 统计学方法 采用SPSS 19.0 统计软件进行统计分析,计量资料以¯x±s表示,多组间比较采用单因素方差分析,组间多重比较采用t检验,P<0.05为差异有统计意义。
2 结果
2.1 各组α-Syn及Bcl-2免疫组化检测结果 3组试验大鼠结肠中均可见α-Syn与Bcl-2阳性表达细胞。PD 组与对照组比较,发现α-Syn表达在2个不同试验点上均明显增高(P<0.05);Bcl-2在2个不同试验点上均明显减低(P<0.05)。PD 大鼠通过司来吉兰治疗后,治疗组与对照组比较,发现Bcl-2表达在2个试验时间点上明显减低(P<0.05),α-Syn表达在2个不同试验点上均明显增强(P<0.05)。治疗组与PD 组比较,发现Bcl-2 表达在2 个试验时间点上明显增强(P<0.05),α-Syn表达在2个不同试验点上均明显减低(P<0.05)。各组在不同时间点,发现治疗组8d时较4d时α-Syn表达显著减低(P<0.05),Bcl-2 表达显著增强(P<0.05)。见表1。
表1 各组大鼠结肠组织中α-Syn及Bcl-2平均光密度比较
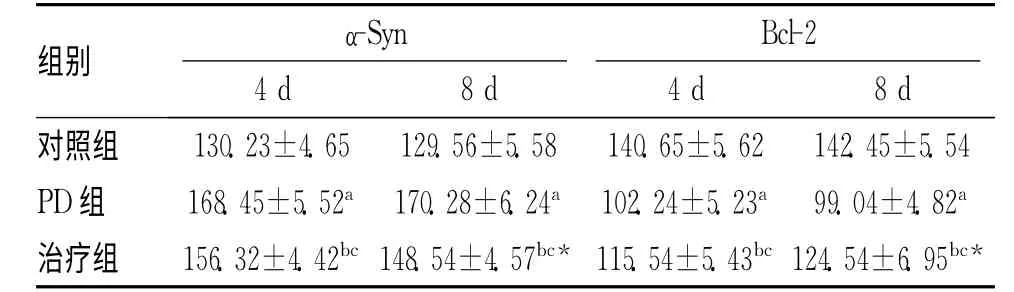
表1 各组大鼠结肠组织中α-Syn及Bcl-2平均光密度比较
注:与对照组比较,aP<0.05;与对照组比较,b P<0.05;与PD 组比较,c P<0.05;8d与4d比较,*P<0.05
组别 4d α-Syn 8d 4d Bcl-2 8d对照组 130.23±4.65 129.56±5.58 140.65±5.62 142.45±5.54 PD组 168.45±5.52a 170.28±6.24a 102.24±5.23a 99.04±4.82a治疗组 156.32±4.42bc 148.54±4.57bc*115.54±5.43bc 124.54±6.95bc*
2.2 Western blotting蛋白印记检测结果 结果显示PD 组与对照组不同时间点比较,α-Syn蛋白表达较对照组明显增加(P<0.05),Bcl-2蛋白表达较对照组明显减低(P<0.05)。司来吉兰治疗后,治疗组与PD 组不同时间点比较,α-Syn蛋白表达较对照组明显降低(P<0.05),Bcl-2蛋白表达较对照组明显增加(P<0.05);但与对照组比较,α-Syn蛋白表达较对照组明显增强(P<0.05),Bcl-2蛋白表达较对照组明显减低(P<0.05)。各组在不同试验时间点,发现治疗组8d时较4d时,α-Syn蛋白表达显著减低(P<0.05),Bcl-2表达显著增强(P<0.05)。见表2。
表2 各组大鼠结肠组织中α-Syn及Bcl-2 Western blotting表达比较
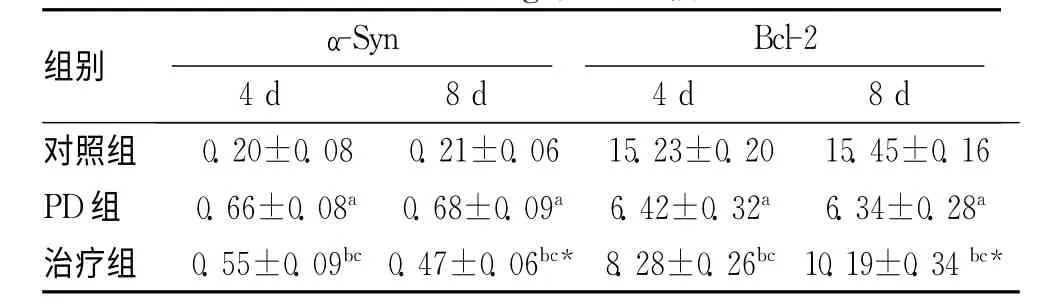
表2 各组大鼠结肠组织中α-Syn及Bcl-2 Western blotting表达比较
注:与对照组比较,aP<0.05,b P<0.05;与PD 组比较,c P<0.05;8d与4d比较,*P<0.05
组别 4d α-Syn 8d 4d Bcl-2 8d对照组0.20±0.08 0.21±0.06 15.23±0.20 15.45±0.16 PD组 0.66±0.08a 0.68±0.09a 6.42±0.32a 6.34±0.28a治疗组 0.55±0.09bc 0.47±0.06bc* 8.28±0.26bc 10.19±0.34 bc*
3 讨论
突触核蛋白(synuclein,syn)存在于突触前末梢和神经元核内的蛋白质,有α、β和γ等类型,其中α-突触核蛋白(αsyn)最初于1988年分离而得[8],研究表明其存在于多种神经退行性疾病的突触末梢以及细胞浆的包涵体中[9-10]。
帕金森病是多巴胺能神经元变性、缺失,从而出现典型嗜酸性包涵体-路易小体。在患者的病变路易小体中,研究发现大量的a-syn寡聚体存在,导致多巴胺在细胞体内累积过多而释放减少,并能产生氧化应激反应加速细胞死亡,在帕金森病的肠神经系统中,肌间神经丛及黏膜下神经丛神经元也存在相同的改变[11],从而引起肠道功能紊乱,研究[12]发现使用6-OHDA 制作PD 大鼠模型,在大鼠胃窦以及结肠肌间神经丛中α-Syn的表达显著增强,表明PD 患者出现胃肠道功能紊乱可能与α-syn增多而引起肠神经系统损害造成的。本实验通过鱼藤酮制作PD 模型,发现在PD 组中α-Syn表达显著强于对照组(P<0.05);但经司来吉兰治疗后,治疗组 的α-Syn 表 达 显 著 低 于PD 组,但 仍 高 于 对 照 组(P<0.05);且治疗8d后,α-Syn的表达显著低于治疗4d时(P<0.05),表明司来吉兰能有效抑制PD 结肠中α-Syn 过度表达,从而减少α-Syn在细胞体内的聚集,并减弱氧化应激反应而延缓细胞死亡的进程,进而缓解胃肠道功能紊乱。
B淋巴细胞瘤-2基因(B-cell lymPhoma-2,Bcl-2)为存在于线粒体、内质网以及连续的核周膜的细胞存活促进因子,能够阻止细胞色素c从线粒体释放到细胞质,从而抑制了细胞凋亡。引起胃肠道机械活动的起搏细胞为Cajal间质细胞,此细胞的凋亡可能与结肠动力障碍相关。Bcl-2的低表达,抑制细胞凋亡的作用可能减弱,从而导致细胞凋亡加快,从而引发诸如便秘等的结肠动力障碍。本研究发现,在PD模型中,Bcl-2的表达较对照组明显降低(P<0.05);经司来吉兰治疗后,治疗组的Bcl-2表达较PD 组明显增强,但较对照组仍为低表达(P<0.05);且经8d的治疗后,较治疗4d时,Bcl-2的表达显著增强(P<0.05)。表明司来吉兰治疗能使Bcl-2的表达增强,从而抑制细胞凋亡,缓解由细胞凋亡引起的结肠功能障碍。
综上可知,PD 引起的肠道能紊乱,可能与α-Syn的高表达以及Bcl-2的低表达有关,司来吉兰治疗PD 能有效缓解肠道功能紊乱,可能与减轻氧化应激反应以及延缓细胞的凋亡有关。但PD 是多种致病因素引起的导致神经元退行性变,从而导致中枢神经系统、自主神经系统以及肠神经系统的改变而引发多系统出现障碍,具体机制有待进一步研究。
[1] Grealish S,Diguet E,Kirkeby A,et al.Human ESC-Derived Dopamine Neurons Show Similar Preclinical Efficacy and Potency to Fetal Neurons when Grafted in a Rat Model of Parkinson's Disease[J].Cell Stem Cell,2014,15(5):653-65.
[2] Sprenger F,Poewe W.Management of motor and non-motor symptoms in Parkinson's disease[J].CNS Drugs,2013,27(4):259-272.
[3] Moccia M,Picillo M,Erro R,et al.Presence and progression of non-motor symptoms in relation to uric acid in de novo Parkinson's disease[J].Eur J Neurol,2014,22(1):93-98.
[4] Martinez-Martin P,Chaudhuri KR,Rojo-Abuin JM,et al.Assessing the non-motor symptoms of Parkinson's disease:MDS-UPDRS and NMS Scale[J].Eur J Neurol,2014,22(1):37-43.
[5] Lauretani F,Saginario A,Ceda GP,et al.Treatment of the motor and non-motor symptoms in Parkinson's disease according to cluster symptoms presentation[J].Curr Drug Targets,2014,15(10):943-7.
[6] 常宇涛,罗晓光,任艳.鱼藤酮损伤大鼠黑质至行为学及黑质多巴胺能神经元损伤[J].解剖科学进展,2011,17(1):60-62.
[7] 陈忻,张楠,赵晖,等.鱼藤酮致帕金森病大鼠行为学与黑质病理损伤的关系[J].中国神经精神疾病杂志,2008,34(4):232-234.
[8] Maroteaux L,Campanelli JT,Scheller RH.Synuclein:a neuron-specific protein localized to the nucleus and presynaptic nerve terminal[J].J Neurosci,1988,8(8):2 804-2 815.
[9] Haaparanta T,Uitto J,Ruoslahti E,et al.Molecular cloning of the cDNA encoding human laminin A chain[J].Matrix,1991,11(3):151-60.
[10] Liu S,Ninan I,Antonova I,et al.Alpha-Synuclein produces a long-lasting increase in neurotransmitter release[J].EMBO J,2004,23(22):4 506-4 516.
[11] Braak H,de Vos RA,Bohl J,et al.Gastric alpha-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology[J].Neurosci Lett,2006,396(1):67-72.
[12] 朱红灿,赵静,张华,等.帕金森病大鼠胃肠功能障碍的机制[J].临床神经病学杂志,2011,24(3):202-205.

