四种酵母甘露聚糖合成与释放特性的比较
刘金龙,倪靖岳,赵国群,*,李志敏(.河北科技大学生物科学与工程学院,河北石家庄050000;2.河北省发酵工程技术研究中心,河北石家庄050000)
四种酵母甘露聚糖合成与释放特性的比较
刘金龙1,2,倪靖岳1,赵国群1,2,*,李志敏1
(1.河北科技大学生物科学与工程学院,河北石家庄050000;2.河北省发酵工程技术研究中心,河北石家庄050000)
比较了产朊假丝酵母、毕赤酵母、面包酵母和啤酒酵母培养过程中细胞壁甘露聚糖的合成与释放特性。结果表明:四种酵母的甘露聚糖合成均为生长偶联型;不同类型酵母的甘露聚糖合成能力差异显著(p<0.05),合成能力最强的啤酒酵母细胞壁甘露聚糖含量最高可达0.62g/L发酵液,而合成能力最弱的毕赤酵母仅为0.47g/L发酵液。四种酵母的甘露聚糖最大释放量均出现对数生长中期,并且不同类型酵母释放效率差异较大,最高值毕赤酵母甘露聚糖释放量达到了0.27g/L发酵液,最低值啤酒酵母仅有0.15g/L发酵液。乙醇显著刺激四种酵母的甘露聚糖释放(p<0.05),其中对产朊假丝酵母的影响最显著且在5%乙醇浓度下,与对照相比,其甘露聚糖释放量和释放率分别大幅提高了152%和120%。
酵母,甘露聚糖,合成,释放
酵母甘露聚糖是酵母细胞壁外包被的一层具有生物活性的多糖聚合物,其主链由甘露糖以α-(1,6)糖苷键形成的糖链组成,主链上连有丰富的由α-1,2或α-1,3连接的支链[1-2]。通常酵母细胞壁的结构类似于三明治,外层为甘露聚糖,内层为β-葡聚糖,内外两层细胞壁多糖均以共价键的形式与中间夹层的蛋白质分子相连。目前市售的甘露聚糖产品通常是由5%~20%蛋白质,80%~90%甘露糖组成,因此又称之为甘露聚糖蛋白[3-6]。
酵母甘露聚糖是迄今发现的免疫功能最强的细胞壁多糖,它能显著增加机体免疫力,刺激肠道益生菌生长、抑制和减少病原菌滋生,并具有抗病毒、抗肿瘤、抗氧化等活性功能,是一种极具潜力的功能性食品与饲用添加剂[7-10]。另外,在葡萄酒酿造过程中,添加酵母甘露聚糖对酒的口感、香气、色泽以及整体结构有很好的改善作用[11-13]。
鉴于显著的生物活性和广泛的应用前景,酵母甘露聚糖制备成为一个研究热点,而掌握酵母甘露聚糖的合成与释放的规律,是合理构建制备工艺的前提。酵母在液态培养过程中,细胞壁多糖-甘露聚糖合成与释放的特性鲜有报道。鉴于此,本文选取广泛应用于食品与饲料工业的产朊假丝酵母、毕赤酵母、面包酵母和啤酒酵母四种菌株作为研究对象,系统比较其酵母甘露聚糖合成与释放的异同点,从中发掘共性规律,为后续制备工艺提供参考。
1 材料与方法
1.1材料与仪器
产朊假丝酵母(Candida utilis)、面包酵母(Saccharomyces cerevisiae)、毕赤酵母(pichia pastoris)和啤酒酵母(Saccharomyces cerevisiae)由河北省发酵工程技术研究中心提供;蛋白胨、酵母浸膏、琼脂粉购自上海国药集团,BR级;硫酸、氢氧化钠、碳酸钡、葡萄糖购自天津江天化工技术有限公司,分析纯;甘露糖购自Sigma,色谱纯。
1220分析型高效液相色谱仪美国安捷伦科技有限公司;液相色谱柱Sugar-Pak I沃特世公司;752型紫外分光光度计上海光谱仪有限公司;ZWY-1102型双层恒温摇床上海智城分析仪器制造有限公司;SW-CJ-2FD型超净工作台苏州安泰空气技术有限公司;YXQ-LS-18SI型自动手提式灭菌器上海博讯实业有限公司医疗设备厂;XS-18型光学显微镜北京发恩科贸有限公司。
1.2实验方法
1.2.1培养基斜面培养基(g/L):葡萄糖20,蛋白胨20,酵母浸膏20,自然pH,琼脂20;种子培养基(g/L):葡萄糖20,蛋白胨20,酵母浸膏20,自然pH;发酵培养基(g/L):葡萄糖12,蛋白胨2,无水硫酸镁0.5,K2HPO40.3,KH2PO40.3,尿素2,自然pH。
1.2.2培养方法
1.2.2.1种子培养将1~2环斜面酵母培养物接种至装有50mL种子培养基的250mL三角瓶中培养,摇床转速180r/min,温度30℃,培养8~10h。
1.2.2.2发酵培养500mL三角瓶添加发酵培养基体积为100mL,接种量为10%,置于温度为30℃转速为180r/min的恒温振荡培养器中,培养3d。
1.2.3发酵液预处理取1mL发酵培养液,8000r/min离心10min,吸取0.1mL上清液,加入3mL的4mol/L硫酸100℃水解10h,甘露聚糖被降解为甘露糖,然后加入过量的碳酸钡中和,离心取上清液,定容至10mL,0.2μm膜过滤,得到滤液1备用;发酵液离心得到的菌体沉淀物采用与上清液相同方式的处理后,得到滤液2备用。
1.2.4甘露聚糖浓度测定以甘露糖为标准品,HPLC法测定滤液1和滤液2的甘露聚糖浓度,采用沃特世公司Sugar-Pak I色谱柱,示差折光检测器(RID)检测,流动相为纯水,流速0.5mL/min,进样量20μL,柱温80℃。标准曲线方程为y=362583x-467.26(R2= 0.9998)。
1.2.5菌体干重测定取1mL发酵培养液,8000r/min离心10min,离心的发酵液沉淀物在80℃烘箱中烘干至恒重为菌体干重。
1.2.6酵母细胞壁甘露聚糖含量的测算酵母细胞壁甘露聚糖含量定义为每毫升发酵液离心菌体沉淀中甘露聚糖的浓度,用M1表征。酵母细胞壁甘露聚糖含量M1=滤液2甘露聚糖浓度×体积稀释倍数,其中滤液2按1.2.3所述方法获得,甘露聚糖浓度按1.2.4方法测定。
1.2.7酵母甘露聚糖释放的测算甘露聚糖释放量定义为每毫升发酵液离心上清中甘露聚糖的浓度,用M2表征。甘露聚糖释放量M2=滤液1甘露聚糖浓度×体积稀释倍数,其中滤液1由1.2.3所述方法获得,甘露聚糖浓度由1.2.4方法测定。

2 结果与讨论
2.1四种酵母细胞壁甘露聚糖含量与生长的关联性
酵母菌产朊假丝酵母、毕赤酵母、面包酵母和啤酒酵母的生长过程曲线如图1所示。从图1可以看出,四种酵母生长过程曲线的整体趋势基本一致:0~6h处于适应期,而6~20h是典型的对数生长期,菌体生长迅速,20h之后菌体生长速度开始明显减缓,第45h后,菌体生长开始停止,菌体浓度呈稳定或下降趋势。四种酵母在生长速率以及最大菌体浓度上存在差异,啤酒酵母最终菌体浓度达到5.6g/L,而毕赤酵母最大菌体浓度只有3.9g/L。
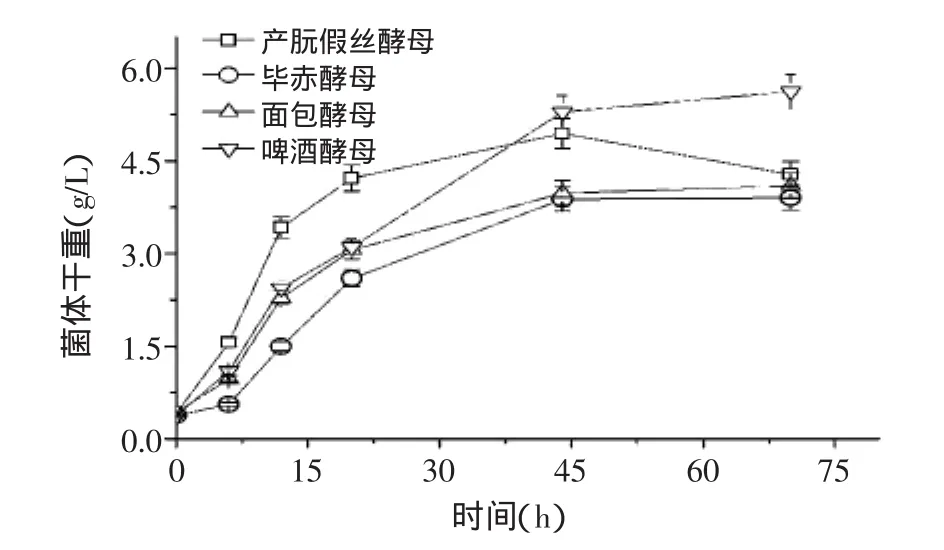
图1 不同类型酵母的生长过程曲线Fig.1 Growth curve of different yeasts
图2为酵母液态培养过程中细胞壁甘露聚糖含量的变化趋势,从图中可以看出,不同类型酵母细胞甘露聚糖含量在生长过程中的变化趋势基本与菌体浓度的变化一致。毕赤酵母细胞甘露聚糖含量最低,菌体细胞中最终含有的甘露聚糖的仅为0.47g/L发酵液;啤酒酵母甘露聚糖含量最高,甘露聚糖含量最终达到了0.62g/L发酵液,比前者高出32%。综合图1和图2的结果,可以看出四种酵母合成甘露聚糖的过程均与菌体生长紧密偶联。
刘媛媛等利用人工神经网络建立了酵母甘露聚糖合成的发酵过程数学模型,通过模型预测得出:酵母的细胞壁甘露聚糖含量在对数期快速积累,之后基本处于停滞状态,这一趋势与本实验结果基本相符,进一步印证了甘露聚糖合成与菌体生长的关联性[14]。
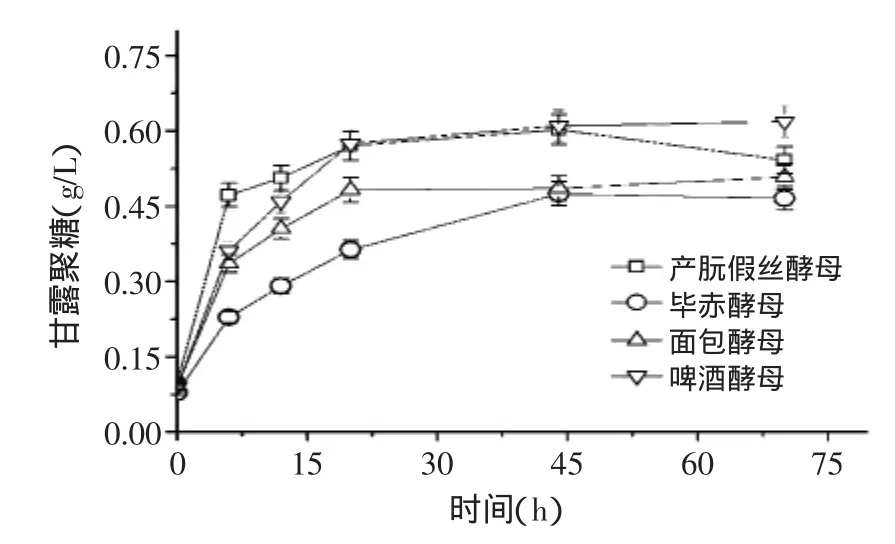
图2 不同类型酵母细胞壁甘露聚糖含量的变化Fig.2 Changes of mannan content in different types of yeasts
2.2四种酵母培养液中甘露聚糖的释放特性
图3所示的四种酵母培养液中甘露聚糖释放量的变化。整体趋势显示出较大的波动性,四种酵母在第12h一致出现一个波峰,但不同类型的酵母峰值差异显著(p<0.05),最高值毕赤酵母甘露聚糖释放量达到了0.27g/L发酵液,最低值啤酒酵母甘露聚糖释放量仅有0.15g/L发酵液。紧接着大约在20~45h范围不同类型酵母甘露聚糖释放量先后出现波谷,数值范围从0.07~0.17g/L不等。在此波谷之后,不同类型酵母甘露聚糖释放量出现不同幅度的回升。将图3与图2数据综合计算,可得到酵母甘露聚糖释放率,最高值毕赤酵母甘露聚糖释放率达到了47.5%,意味着接近一半的甘露聚糖同细胞壁脱离,释放到发酵液中。

图3 不同类型酵母甘露聚糖释放量的变化Fig.3 Changes of releasing amount of mannan in different types of yeasts
甘露聚糖在酵母培养过程中的释放呈现一定规律的波动性,不同类型酵母甘露聚糖释放的最大峰值均出现在对数中期12h左右,此时间点正处于菌体生长速率增加最为显著的阶段,四种酵母的比生长速率此刻基本都处于最高水平,意味着该时间点是酵母细胞出芽繁殖速率最快的时刻。酵母在出芽生殖过程中,子代细胞从母体细胞内部的出芽需要贯穿突破细胞壁,为减少出芽的阻力,细胞壁在此阶段释放大量细胞壁多糖,使厚实致密的细胞壁结构变轻薄疏松,从而使酵母的芽殖得以顺利进行[15]。酵母的这一生理特征可以说明甘露聚糖释放的峰值出现在出芽生殖最为剧烈的对数中期的原因,在该时间节点,甘露聚糖的最高释放率接近50%。
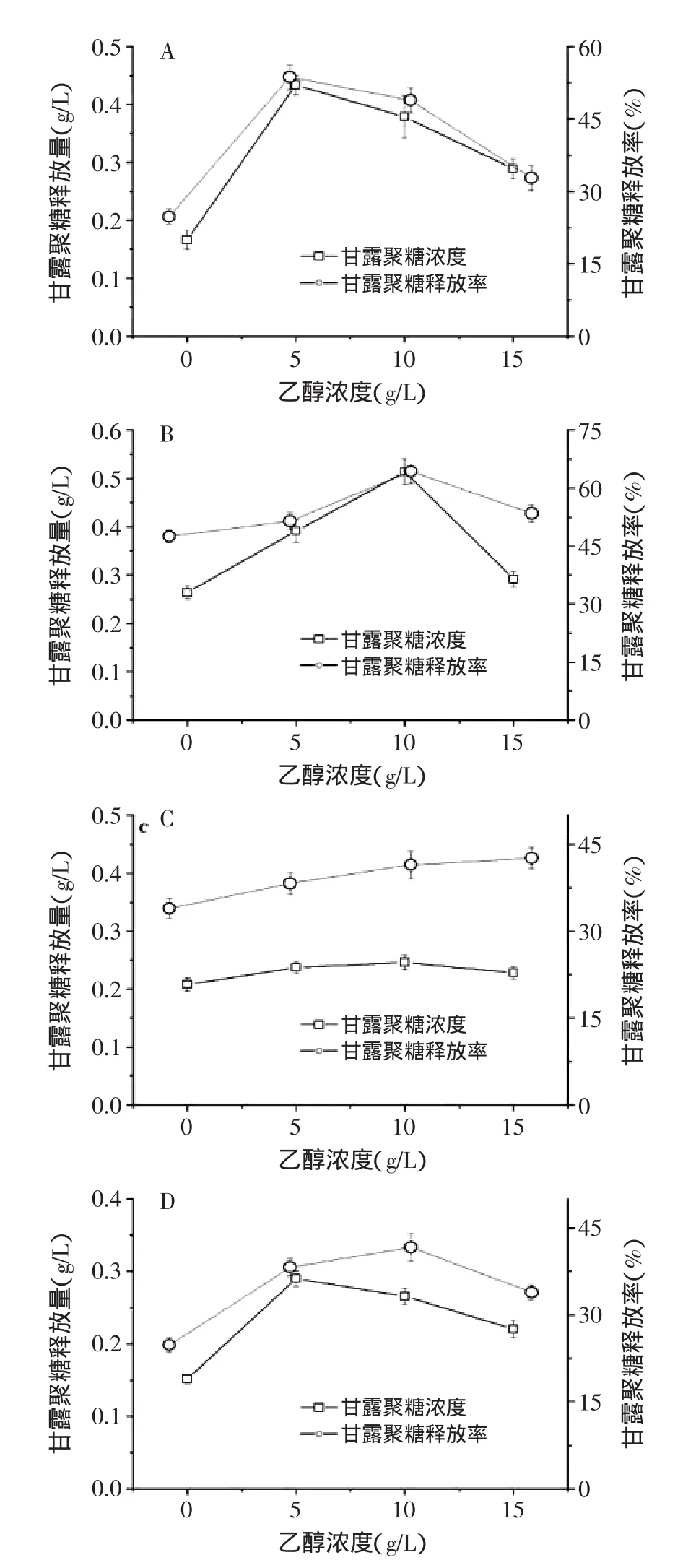
图4 乙醇对不同类型酵母甘露聚糖释放的影响Fig.4 Effect of alcohol on the mannan release in different types of yeast
2.3乙醇对四种酵母甘露聚糖释放的影响
目前关于酵母甘露聚糖的释放的报道大部分集中于葡萄酒酿造的研究中,甘露聚糖的释放伴随酿酒过程的进行,为了研究乙醇是否会对甘露聚糖的释放产生影响,本文进一步考察了乙醇对不同类型酵母甘露聚糖释放的影响。
用初始培养基乙醇分别为0、5%、10%、15%四个浓度梯度进行培养,以对数中期甘露聚糖释放量和释放率为指标进行评测,结果如图4所示。乙醇对四种酵母甘露聚糖的释放率和释放量均有不同程度的促进作用。产朊假丝酵母在5%乙醇浓度下,释放量和释放率最高,分别从空白对照的0.17g/L发酵液和24.7%提高到0.43g/L发酵液和53.7%,大幅提高了152%和120%,这说明乙醇对产朊假丝酵母甘露聚糖的促释放效果十分显著(p<0.05)(图4A);而毕赤酵母在10%的乙醇浓度下,释放量和释放率最高,分别达到了0.513g/L和64.3%,比对照提高了95%和35%(图4B)。乙醇对于面包酵母的释放效果影响明显不如前两种酵母,释放量和释放率最大提高幅度分别仅为18.3%和22.4%(图4C)。当乙醇浓度5%时,啤酒酵母甘露聚糖的释放量最大,达到了0.29g/L,比对照提高了92.1%,当乙醇浓度10%时,啤酒酵母甘露聚糖的释放率最大,达到了41.7%,比对照提高了68.1%(图4D)。
3 结论
不同类型酵母合成甘露聚糖的过程与菌体生长紧密偶联,总体变化趋势平稳。不同类型酵母释放甘露聚糖的释放的最大峰值均出现在对数中期即酵母细胞出芽繁殖最为旺盛的时间节点上,最高释放率接近50%。培养体系中5%~10%浓度的乙醇对四种酵母细胞壁甘露聚糖的释放均有显著促进作用(p<0.05)。
[1]段胜林,王雪,苑鹏,等.采用催化自溶和生物破壁技术提取啤酒酵母细胞壁多糖[J].食品与发酵工业,2012,38(5):138-144.
[2]汪立平,王锡昌,陈有容,等.啤酒废酵母甘露聚糖的制备[J].食品科学,2009,30(2):134-137.
[3]刘红芝.酿酒酵母甘露聚糖的制备、结构鉴定及免疫活性研究[D].北京:中国农科院,2009.
[4]王义华,徐梅珍,江萍,等.酵母蛋白多糖的分离纯化及鉴定[J].微生物学报,2004(8):515-518.
[5]刘红芝,王强,周素梅.酵母甘露聚糖分离提取及功能活性研究进展[J].食品科学,2008,29(5):465-468.
[6]孙建义,李卫芬.啤酒酵母甘露聚糖的提取及其对鸡肠道微生物区系的影响[J].浙江大学学报:农业与生命科学版,2001,27(4):447-450.
[7]温若竹.甘露寡糖对肉仔鸡肠道形态及微生物区系的影响[D].南京:南京农业大学,2010.
[8]Shashidhara R G,Devegowda G.Effect of dietary mannan oligosaccharide on broiler breeder production traits and immunity[J].Poultry Science,2003,82:1319-1325.
[9]Shafey TM,Mufarej AS,Shalaby MI,et al.Effects of mannan oligosaccharides on antibody response to infectious bronchitis,infectious bursal disease and Newcastle disease in chickens[J].J Appl Anim Res,2001,19:117-127.
[10]PontonJ,OmaetxebarriaJ,ElguezabalN,etal. Immunoreactivityof the fungal cell wall[J].Medical Mycology,2001,39:101-110.
[11]Palomero F,Morata A,Benito S,et al.Conventional and enzyme-assisted autolysis during ageing over lees in red wines:Influence on the release of polysaccharides from yeast cell walls and on wine monomeric anthocyanin content[J].Food Chemistry,2007,105:838-846.
[12]Giovani G,Rosi I.Release of cell wall polysaccharides from Saccharomycescerevisiaethermosensitiveautolyticmutants during alcoholic fermentation[J].International Journal of Food Microbiology,2007,116:19-24.
[13]Quirós M,Gonzalez-Ramos D,Tabera L,et al.A new methodologytoobtainwineyeaststrainsoverproducing mannoproteins[J].International Journal of Food Microbiology,2010,139(1),9-14.
[14]刘媛媛.酵母细胞壁多糖制备及流变学性质研究[D].北京:中国农科院,2010.
[15]Guilloux-Benatier M,Guerreau J,Feuillat M.Influence of initial colloid content on yeast macromolecule production and on the metabolism of wine microorganisms[J].American Journal of Enology and Viticulture,1995,46:486-492.
Comparation on synthesis and release of mannan in four yeasts
LIU Jin-long1,2,NI Jing-yue1,ZHAO Guo-qun1,2,*,LI Zhi-min1
(1.Research Center for Fermentation Engineering of Hebei,Shijiazhuang 050000,China;2.College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050000,China)
The synthesis and release rules of mannan on cell walls was compared during the cultivation process of candida utilis,pichia pastoris,bread yeast and beer yeast in this research.It was found that the syntheses of mannan in these four yeasts were all growth coupling type.Synthetic ability of mannan in different types of yeast were significantly different(p<0.05).The synthetic ability of mannan in beer yeast,which had the strongest synthetic ability among these four yeasts,was 0.62g/L fermentation broth,while that in pichia pastoris was only 0.47g/L fermentation broth.It was indicated that all the maximal releasing rates of mannan in four kinds of yeasts appeared in the middle period of logarithmic growth and the maximal releasing rates of mannan in different types of yeasts differed significantly,i.e.,the maximal releasing amount of mannan in pichia pastoris,which was highest among these four kinds of yeasts,reached to 0.27g/L fermentation broth,while the maximal releasing amount of manna in beer yeast,which was the lowest among these four kinds of yeasts,was only 0.15g/L fermentation broth.It was showed that alcohol significantly stimulated the releasing of mannan in four kinds of yeasts(p<0.05).Candida utilis in the alcohol with a concentration of 5%was affected most significantly.The releasing amount and releasing rate of mannan in it were respectively increased by 152%and 120%as compared with the control(p<0.05).
yeast;mannan;synthesis;release
TS201.3
A
1002-0306(2015)02-0199-04
10.13386/j.issn1002-0306.2015.02.034
2014-05-21
刘金龙(1980-),男,博士研究生,讲师,主要从事微生物多糖与农用微生物菌剂的研究与开发。
赵国群(1963-),男,博士研究生,教授,主要从事生化工程方面的研究。

