面向POCT应用的微流控芯片技术综述
李晓琼,杨春华,潘邵武,韩杰,况玉香,施青峰
北京理工大学生命学院,北京 100081
*综 述*
面向POCT应用的微流控芯片技术综述
李晓琼,杨春华,潘邵武,韩杰,况玉香,施青峰
北京理工大学生命学院,北京 100081
即时检测(POCT)以实现快速便捷的临床现场检验为主要目标,具有检测实时性高、综合成本较低、不依赖专业设备等优势,广泛应用于临床监护、检验检疫、家庭保健等领域。微流控芯片技术因其样品消耗量小、检测灵敏度高、易于集成和实现自动检测等特点,已成为实现POCT的重要技术手段。本文根据核酸、蛋白、细胞等检测对象的属性特点,分类综述了面向POCT应用的微流控芯片检测技术研究现状。进而针对POCT临床应用需求,介绍了POCT用微流控芯片在芯片构建技术、系统化、产品化等方面的研究成果。最后,针对该领域的研究难点和发展趋势进行了讨论。
即时检测(POCT);微流控芯片;核酸检测;蛋白质检测;细胞检测;产品化
即时检测(point-of-care testing, POCT)以实现便捷的现场即时医学检测为主要思想[1],旨在借助一体化检测器或便携式仪器,缩减样本运输管理成本,降低检测等待时间,缓解临床应用对高端仪器的依赖[2]。相对于传统的实验室检测机制,POCT不单纯以提高检测精度为目标,而主要通过精简操作流程、集成检测装置、压缩检测成本,实现部分由非专业人员完成、受众和适应性更强的就地检测[3-5]。因其综合成本和可操作性方面的优势,POCT对完善农村边远地区医疗建设[6]、加速检验检疫流程[7]、应对突发疾病灾害、推动个性化医疗和疾病筛查等具有重要意义[8,9],并已广泛应用于临床治疗和监护[10]。20世纪90年代初提出的微流控芯片(microfluidicchip)技术依托现代微加工工艺,可实现采样、稀释、加试剂、分离、检测等实验流程和生化反应在单片平板芯片上的集成,从而减少样品试剂消耗、提高检测灵敏度、缩短反应时间、降低平均成本。其可满足从生物小分子到细胞的不同尺度对象检测需求,并可通过在后端耦合光、电、热等形式的检测器和读数装置,实现检测流程的自动化和检测结果的信息化[11]。微流控芯片微型化、集成化、自动化的特性,高度切合POCT检测技术的发展需求,对优化临床检测具有重要意义,近年来已日趋成为POCT领域的研究热点和核心技术[12],如图1所示。
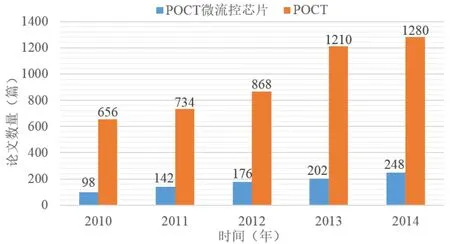
图1 2010年-2014年POCT与微流控芯片研究论文趋势Fig.1 Tendency of Publications on POCT and Microfluidic Chip
本文首先根据核酸、蛋白、细胞等目标物质的检测需求,分类综述了近年来基于微流控芯片的POCT检测技术研究现状。进而针对POCT检测的临床应用需求,介绍了面向POCT的微流控芯片在芯片构建技术、系统化、产品化等关键技术研究方面的成果。最后,针对该领域的主要研究难点和发展趋势进行了讨论。
1 POCT微流控芯片核酸检测
由于核酸是储存、复制和传递遗传信息的基础物质,因此,核酸检测在特定疾病的检测中具有较高的灵敏度和特异性。传统的核酸检测包括样品前处理、核酸扩增(PCR扩增)及扩增产物的检测等多个复杂、耗时的步骤,对操作人员有特殊要求,同时需要使用到昂贵的设备和试剂。核酸芯片可以将这些处理过程微型化、简洁化,并统一集中在一个微小芯片内。由于核酸检测处理过程复杂,不同步骤中需要使用多种试剂,因此核酸芯片的流体控制系统比较复杂。此外,PCR扩增过程中的温度控制系统,以及扩增产物的光学检测系统和最终输出检测结果的用户接口都有较高的整合性要求。对于POCT核酸检测而言,需要对功耗、体积、可靠性和成本等多方面进行考虑。目前,已经发表的多种技术和方法都有各自的优势和缺陷,针对不同的检测目标和应用场合,有的方法注重检测速度,有的注重多重检测、高通量,有的则强调定量检测。总体来说,高功耗和大体积是目前的核酸芯片检测系统面临的主要问题,未来的POCT核酸检测需要进一步完善便携性,并保证核酸检测原有的高灵敏度和高特异性的优势。
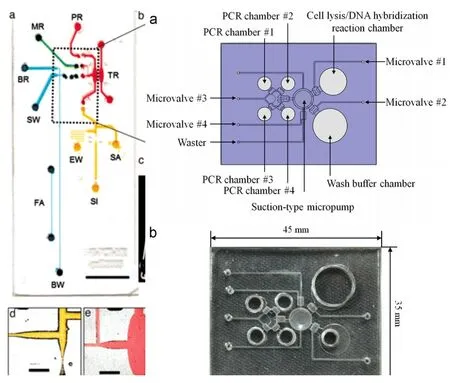
图2 POCT 核酸芯片Fig.2 POCT nucleic acid lab chips (a) Images of the integrated glass lab chip[13](b) Schematic illustration of the HIV-1 microfluidic chip[16]
在芯片制作方面,Easley等人使用蠕动泵和 PDMS阀门制作了集核酸提取、PCR 扩增及毛细管电泳全过程的检测芯片[13],如图2(a)所示。 Zenhausern等人利用电化学泵和石蜡型热力阀制作了用于司法鉴定的DNA图谱微流控检测系统[14,15]。 Lee利用真空抽吸式泵和硅凝胶膜制作的检测芯片实现了对线粒体DNA变异和HIV-1病毒检测,该系统检测HIV感染T细胞的谱带强度达到了台式PCR仪的水平[16,17],如图2(b)所示。 Zhou采用聚苯乙烯替代传统的PDMS作为芯片材料,利用层压技术设计了可以并行检测4种传染性病原体的检测芯片[18,19]。Oblath利用嵌入氧化铝薄膜为PCR 扩增过程提供稳定的温度条件,成功实现唾液中的某些致病菌检测[20]。 Liu在样品前处理阶段利用生物素标记和特定修饰的磁珠捕获目标DNA,极大提高PCR扩增效率[21-13]。
针对POCT核酸芯片扩增产物的检测方法,除了常规的荧光检测和电泳检测外,还有几种新的发展趋势。低密度微矩阵核酸杂交法(low-density microarray)可以实现同时检测多个扩增产物。整合引物延伸方法(integrated primer extension assay)是检测目标基因的单个核苷酸多态性(single-nucleotide polymorphisms,SNPs),这种方法快速、简便、成本低。侧流层析试纸法(lateral-flow strip)的原理与免疫侧流层析试纸条技术相似,采用特异性的寡核苷酸捕捉扩增后的核酸,再与标记有胶体金的特异性的寡核苷酸结合[24],这种方法芯片成本低,结果易于判读,可半定量或定量检测。 Chen等人将样品前处理、PCR及免疫层析试纸条技术检测相结合,用于检测唾液中的HIV RNA含量[25],如图3所示。
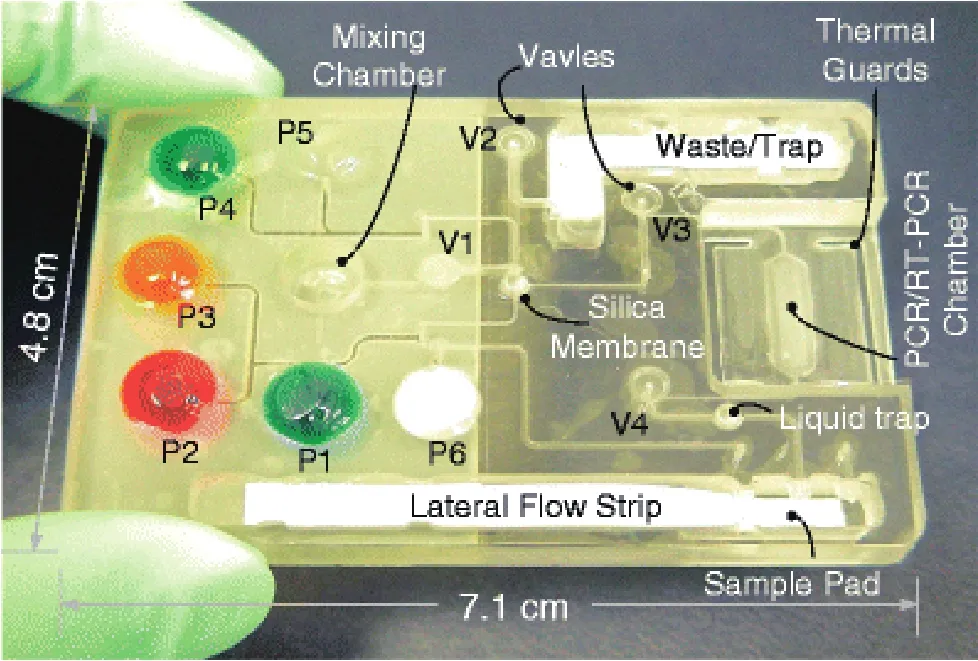
图3 基于侧流层析试纸法的核酸芯片[25]Fig.3 A lateral-fl ow strip based nucleic acid cassette in its storage state[25]
2 POCT微流控芯片蛋白质检测
蛋白质通常可以直接揭示或反映某些确切疾病的表征和状态,因此蛋白质检测是POCT目前研究较多的方面。蛋白质检测不需要对样品进行前处理,可以直接对全血和唾液进行检测。其中以免疫层析法为原理的蛋白质检测较为普遍,该方法具有较高的灵敏度和特异性,而且相比于核酸检测更加简单和快速。综合各类商业应用和学术研究的POCT蛋白质检测,主要特点都是尽量减少样品处理步骤和相关的流路控制,为非专业的操作人群提供操作更简单、重复度更高的检测系统。目前,研究一些新的流路控制方法和新材料,如表面等离子体谐振(SPR)、磁性纳米材料、量子点材料等,改进蛋白质检测的集成度和检测效率是POCT重要的发展方向。

图4 Alere的Triage POCT 系统和检测盒[26]Fig.4 Alere Triage POCT system, cartridge[26]
美国Alere的Triage系统[26]是比较成功的免疫层析POCT商业产品,该系统可直接通过全血高效检测急性心肌梗塞相关标志物,如图4所示。该系统采用聚合物微流控通道代替传统的硝酸纤维膜,使得液体迁移的重复性和稳定性都得到了极大的提高。此外,该系统利用疏水材料控制样品流速,并利用荧光染料替代传统的胶体金作为标记物。基于相同的原理,Wang等人设计的毛细管渗流型微流控芯片主要是通过一些微柱结构和吸水性纸实现液流控制,并在荧光染料标记后增加一个洗脱区以提高检测的噪声水平,对白介素8的检测水平达到了20 pg/mL[27]。磁珠被普遍应用于修饰捕获抗体,Bruls等人利用磁性纳米微粒有效分离出目标蛋白,从而免去了洗脱步骤和相应的流路控制,他们设计的心肌肌钙蛋白检测芯片能在几分钟内完成对血浆样品的检测,检测限达到了72 pg/mL[28]。
除了免疫层析法外,酶联免疫吸附实验法(enzymelinked immunosorbent assay,ELISA)也是近年在蛋白质检测上研究较多的方法。Laksanasopin等人研发的智能手机电子狗(Dongle)复制了实验室ELISA所有的机械,光学和电子功能,由手机提供电量,如图5所示。该系统在15分钟内完成三重免疫检测:同时检测HIV抗体,梅毒螺旋体特异性抗体和针对梅毒的非螺旋体抗体。检测结果与目前临床的算法需求相一致,并且可以直接在手机界面完成显示和存储[29]。

图5 基于ELISA的POCT电子狗[29]Fig.5 An ELISA based POCT Dongle[29]
3 POCT微流控芯片细胞计数与检测
细胞作为生物有机体结构和功能的基本单位,可以直接反映疾病的进行情况,如在口腔癌、艾滋病等的辅助诊断和预后判断方面有重要的临床应用价值。POCT细胞检测是对核酸检测和蛋白质检测技术的重要补充,其分析方法主要是细胞分离和分型计数,即传统的流式细胞仪技术。目前,POCT细胞检测在对操作人员的要求、检测速度和量产成本等方面都有很大的发展空间,研究新的细胞分离技术和检测方法是当前的研究热点。随着物联网技术的兴起,具备远程诊断功能的POCT将会很快成为主要的发展趋势。
Zhu等人设计了一套可安装在手机上的成像组件用于计数红细胞、白细胞和测量血红蛋白浓度。其中白细胞在荧光标记后,用特定激发光和手机的摄像头进行检测;红细胞在全血用PBS按1:1000稀释后,在明场照明下进行检测,如图6(a)所示。该装置的检测效果与Sysmex的KN21血液分析仪的相关系数达到了0.98[30,31]。像这样与手机集成的POCT细胞检测技术利用廉价的光学元件和简单的样品处理流程,就能对血细胞取得很好的计数效果,并且易于通过手机通信实现远程诊断。Shi等人设计了一种可以对四种白细胞进行计数的非鞘流式细胞计数仪,该仪器避免了过多的稀释步骤和鞘流结构,如图6(b)所示。检测效果与Beckman Coulter的Coulter LH750血液分析仪的相关系数达到了0.90-0.98[32]。
除光学检测方法外,电化学阻抗法是POCT细胞检测的另一个研究方向。其原理是通过测量细胞膜的容抗和阻抗,以及细胞质的电导率和电容率,实现对血细胞的计数和区分不同的白细胞。该方法不需要对细胞进行标记,成本低,且易于和IC工艺集成,有利于后期的信号处理。Morgan和他的同事设计的细胞芯片通过两个电极间的交流电压和导通电流的比率来测量单个细胞的阻抗[33,34],如图6(c)所示。
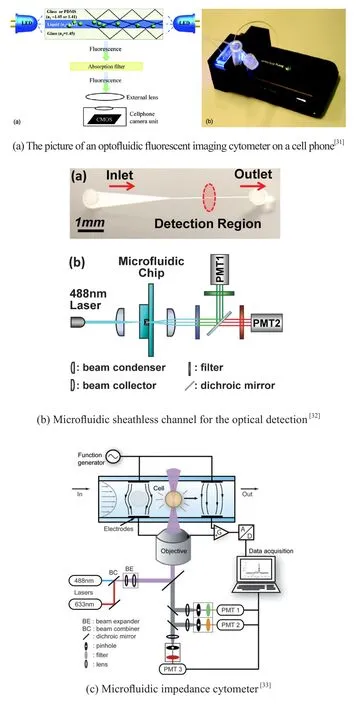
图6 POCT血液分析仪Fig.6 POCT hematology analyzers
由于CD4 + T细胞数量可以反映艾滋病感染者免疫系统的功能水平,目前已经有一些商业型的CD4 POCT诊断系统,但其集成度和成本等还远不能满足发展中国家对HIV监控POCT的迫切需求。CyFlow的miniPOC是台式流式细胞仪的POCT版,可以提供CD4的绝对数量和CD4%,如图7(a)所示。仪器采用干的单克隆CD4抗体试剂用于捕获/净化CD4细胞,保存时间达6个月且无需低温运输。但是该仪器需要操作人员提前对样品进行多步处理后才能完成检测。Alere的Pima CD4分析仪采用一次性检测筒,只需要25 µL指尖血液样本或静脉血样本就可以在20分钟内完成CD4计数,如图7(b)所示。Daktari的CD4分析仪利用固定住的抗体捕获和分离CD4细胞,然后使得细胞裂解,检测细胞内的物质释放出来后引起的阻抗变化。该方法在200,350和500个细胞/µL下灵敏度分别达到了0.86,0.90和0.97,特异性均达到了0.94[12],如图7(c)所示。

图7 POCT CD4计数仪[12]Fig.7 POCT CD4 counting analyzers[12](a) Partec CyFlow miniPOC (b) Alere Pima CD4 analyzer (c) Daktari CD4 analyzer
4 POCT微流控芯片关键技术
4.1微流控芯片POCT仪器构建技术
为方便仪器研制和最大限度地压缩生产成本,面向POCT应用的微流控芯片主要选用PDMS(polydimethylsiloxane)、PMMA(polymethyl methacrylate)、COC(cyclic olefin copolymer)等聚合物材料为基材,通过等离子体键合、牺牲层键合、紫外键合、溶剂键合等工艺[35],实现功能物质的附着。由于具有优良的热塑性和可加工性,PMMA、COC等材料可采用压模或注塑工艺进行低成本的基片加工,成为较流行的微流控芯片材料[36,37]。通过利用PMMA透明的特点,可实现对细胞或生物大分子的直接观察,利于后端微流控芯片光电检测器的设计,如Kurkuri等采用PMMA材料设计了等离子体功能化的微流控芯片,利用其与EpCAM(anti-epithelial-cell adhesionmolecule)的结合,实现对NCI H69肺癌细胞和SK-Br-3胸腺癌细胞的捕捉,并可直观观察内部3D结构的细胞捕获过程[38]。此外,也可利用印制电路板技术成熟、加工精度高、成本较低的特性,设计基于印制电路板的微流控系统[39]。
微流控芯片可满足生物分子和细胞的检测需求,但在临床应用中微流控芯片POCT仪器主要以人体体液为直接检测物质。为实现便捷性操作和定量检测,以微针技术(microneedle)为代表的微创采样技术已成为POCT用微流控芯片的研究重点之一。通过采用X光刻蚀、离子蚀刻、热模压、溅射淀积等工艺,可构建直径仅数十微米的微针,实现表皮穿刺和血液采样[40]。Li等采用光刻工艺构建外径120 、内径60 、长度1800 的微针结构,在分析机械强度和液体采样效果的基础上,通过激光切割倾角的针尖,可在保障穿刺性能的基础上减少血管损伤和神经接触[41]。
此外,随着纳米技术的发展和普及,以纳米金颗粒[42]、纳米磁珠[43]、纳米线[44]等为代表的纳米材料近年来已开始用于微流控芯片POCT检测,对扩大POCT适用检测范围、实现检测物质分离和活体在线监测等具有重要意义。
4.2微流控芯片POCT仪器系统化设计
微流控芯片POCT仪器围绕单个芯片,实现从定量采样到结果输出的全流程测试功能。为同时满足临床实用和便捷操作的需要,需综合考虑各功能单元布局和完善系统可操作性:一方面,需针对前端微流控芯片设计并整合进样、分离、检测等单元;另一方面,需针对用户和市场需求,合理设计后端用户和信息化接口。
对前端微流控芯片,可针对样本和芯片基材的流体特性,选用压力泵驱动、微电机离心驱动、微电极电湿润驱动、纸基芯片毛细驱动等方案,实现进样驱动[45]。对以血液为代表的复杂成分检测样本,可根据目标物质的理化特性,选用介电泳分离、磁分离、水作用力分离、过滤结构分离等方案实现定向提取[35]。其中,由于纳米磁珠的良好分离性能和生物相容性,近年来被广泛应用于细胞POCT检测分离。检测原理方面,通常采用光电检测和电化学检测。其中电化学检测可采用未加工工艺,以光刻蚀、离子沉淀等方式在芯片内部直接加工微电极。光电检测则通常选用激光二极管为光源,采用光电倍增管、CCD(Charge Coupled Device)实现定量检测或目标成像[46,47]。
对后端用户和信息化接口,通常采用低功耗、低成本的单片机或ASIC(application specific integrated circuit)作为中低端POCT仪器优先选择的技术方案[11]。近年来随着低功耗通用处理器和移动计算技术的发展,部分中高端POCT仪器以嵌入式系统为核心组织系统[48]。对于血糖检测等家用、自主式POCT应用,部分研究者采用智能手机、平板电脑等消费电子产品为用户终端,可实现对POCT检测数据的读取、显示、上传、管理[49]。
4.3微流控芯片POCT仪器产品
以血糖仪和血液分析仪为代表,Abbott、Johnson & Johnson、HemoCue、Chempaq、Advanced Liquid Logic、Epocal、TearLab等厂商已陆续推出了若干面向临床的微流控芯片POCT仪器产品。如图8(a)所示,Abbott公司的i-STAT床旁血液监护系统是该领域研发起步较早的代表性产品,20世纪80年代开始即进入FDA(Food and Drug Administration)技术认证阶段。其采用卡式结构设计,支持血液中血气、电解质、血凝、生化及心肌标志物等监测,可在2分钟内输出检测结果。如图8(b)、图8(c)所示,HemoCue公司和Chempaq公司开发的血液分析仪器,仅需10 µL量级的血液样品,即可实现对血液参数的快速精确测定,可满足社区医院和诊所的医学检测需求。从行业发展趋势来看,微流控芯片POCT仪器日趋向着高灵敏度、多功能化、便携化等方向发展,但随着欧美等国对POCT行业监管力度的加大,短期内该领域所面临的主要商业化和产品化问题是如何建立有效的行业规范,并通过日益严苛的资质认证。


图8 部分微流控芯片POCT仪器产品Fig.8 Some Commercial Microfluidic Chip-based POCT Products
5 研究难点与前景展望
微流控芯片由于其集成度高、准确度好、试剂消耗低、反应速度快等先天优势,日趋成为构建POCT系统的核心技术。且受益于微加工技术的迅速发展,其有望提供一体化的复杂检测和诊断功能。然而,受限于系统思维或行业体制,基于微流控芯片的POCT系统研究和产品化仍存在诸多问题亟待解决:(1)系统集成问题,目前该领域研究普遍侧重单一关键技术的突破,而面向复杂应用的系统设计方兴未艾,为满足肿瘤早期筛查、体液多成分检测等临床需求,需在单片微流控芯片上集成样品微量量取、顺序混合反应、分离分析和检测等功能,并合理化设计阀、液路、反应池等单元[53];(2)易用性问题,基于微流控芯片的POCT仪器主要面向初级技术人员或无技术背景人员,需进一步完善其操作的简易性,强化其对使用环境的适应性[54],降低因操作不熟练导致的不精确或错误检测结果,提高仪器检测结果的可靠性;(3)质量控制问题,POCT仪器的临床应用尚缺乏成熟的行业规范和管理体系,检测结果较高的不确定性限制了其推广和用于临床决策[55,56]。
随着新材料技术的发展和信息化水平的提高,微流控芯片POCT仪器在功能深度和应用广度上将会有更大的提高。(1)芯片纸基化,传统的微流控芯片通常采用光刻蚀加工玻璃、硅片、高分子聚合物等基材,制备过程复杂,研发成本高。采用蜡印技术构建微通道的一次性纸基微流控芯片,重量和成本进一步降低,对发展资源匮乏条件下的现场实时诊断具有广阔应用前景[57]。(2)设备信息化:随消费电子产品和无线网络技术的迅速普及,为实现微流控芯片POCT仪器与家用信息系统联用,以及大数据背景下的远程医疗和个性服务,提供了巨大的机遇和挑战。(3)产品多样化,通过利用碳纳米管、量子点、金纳米材料等新材料特性,微流控芯片POCT仪器的检测诊断对象由现有的血糖、肺结核、HIV、心脏标志物等向外大幅延拓,有望覆盖体育竞技、海关口岸、应急辅助医疗等诸多领域[58]。
(References)
[1] 陈寒柏. 体外诊断行业之POCT[J]. 中国医疗器械信息, 2014, 16(10): 4-6, 15.
[2] 张玲. 即时检验(POCT)的应用[J]. 医疗装备, 2015, 28(1): 49-50.
[3] 黄祥芬. 即时检验(POCT)发展现状与应用[J]. 中外医学研究, 2011, 9(25): 154-156.
[4] 陈晓东,周旭一. POCT-检验医学发展的趋势之一[J].放射免疫学杂志, 2008, 21(4): 335-337.
[5] 徐建新,李福刚. POCT对传统医疗模式带来的新机遇[J]. 中华检验医学杂志, 2007, 30(12): 1329-1331.
[6] W. Peeling R, Mabey D. Point-of-care tests for diagnosing infections in the developing world[J]. Clinical Microbiology and Infection, 2010, 16(8):1062–1069.
[7] 徐珊,叶文才,郑正福. POCT在出入境检验检疫中的应用[J]. 检验检疫学刊, 2012, 22(2): 54-57.S
[8] 林丹丹,袁子华,廖军. 一种NT-proBNP(POCT)检测对早期心衰的诊断价值[J]. 广州医药, 2013, 44(6): 12-14.
[9] 孙淑利,张德怀,谭国庆. POCT与社区检验[J]. 中国误诊学杂志, 2009, 9(8): 1815-1816.
[10] 方捷,吴飞,秦保东,等. 心肌标志物的床边检测技术在急性心肌梗死患者中的应用价值[J]. 中国实验诊断学, 2012, 16(3): 444-447.
[11] R S, Z H, P T, et al. Development of a digital microfluidic platform for point of care testing[J]. Lab Chip, 2008, 8(12):2091-2104.
[12] Jung W, Han J, Choi J, et al. Point-of-care testing (POCT) diagnostic systems using microfluidic lab-on-a-chip technologies[J]. Microelectronic Engineering, 2015:46–57.
[13] CJ E, JM K, JM B, et al. A fully integrated microfluidic genetic analysis system with sample-in–answer-out capability[J]. Proceedings of the National Academy of Sciences, 2006, 103(51):19272-19277.
[14] MD E, J Y, B D, et al. Optimization of multiplexed PCR on an integrated microfluidic forensic platform for rapid DNA analysis.[J]. Analyst, 2012, 23(23):5510-5519.
[15] AJ H, C H, J Y, et al. Integrated Microfluidic System ForRapid Forensic Dna Analysis: Sample Collection To Dna Profi le[J]. Anal. Chem., 2010, 82(16):6991-6999.
[16] CM C. Integrated three-dimensional system-on-chip for direct quantitative detection of mitochondrial DNA mutation in affected cells[J]. Biosens Bioelectron, 2013, 48(20):6–11.
[17] JH W, L C, CH W, et al. An integrated chip capable of performing sample pretreatment and nucleic acid amplification for HIV-1 detection.[J]. Biosensors & bioelectronics, 2013, 41(5):484-491.
[18] G S, L Y, R Y, et al. Rheonix CARD ® Technology: An Innovative and Fully Automated Molecular Diagnostic Device[J]. Point Care., 2012, 11(1):: 42–51.
[19] Zhou P, Young L, Chen Z. Weak solvent based chip lamination and characterization of on-chip valve and pump[J]. Biomedical Microdevices, 2010, 12(5):821-832.
[20] EA O, WH H, JP A, et al. A microfl uidic chip integrating DNA extraction and real-time PCR for the detection of bacteria in saliva[J]. Lab on a Chip, 2013, 7(7):1325-1332.
[21] P L, X L, SA G, et al. Integrated DNA purifi cation, PCR, sample cleanup, and capillary electrophoresis microchip for forensic human identifi cation[J]. Lab on a Chip, 2011, 11(6):1041-1048.
[22] Beyor N, Yi L, Seo T S, et al. Integrated capture, concentration, polymerase chain reaction, and capillary electrophoretic analysis of pathogens on a chip[J]. Analytical Chemistry (Washington) 2009 Vol. 81 No. 9 pp. 3523-3528, 2009, 81(9):3523-3528.
[23] NM T, ES D, N T, et al. Integrated microfluidic bioprocessor for single-cell gene expression analysis[J]. Proc Natl Acad Sci U S A, 2008, 105(51):20173-20178.
[24] HH L. Simple amplifi cation-based assay: a nucleic acidbased point-of-care platform for HIV-1 testing[J]. J Infect Dis, 2010, 201(8).
[25] D C, M M, X Q, et al. An integrated, self-contained microfluidic cassette for isolation, amplification, and detection of nucleic acids[J]. Biomedical Microdevices, 2010, 12(4):705-719.
[26] FS A. Simultaneous rapid measurement of whole blood myoglobin, creatine kinase MB, and cardiac troponin I by the Triage Cardiac Panel for detection of myocardial infarction[J]. Clin Chem, 1999, 45(2):199-205.
[27] Wang J. A self-powered, one-step chip for rapid, quantitative and multiplexed detection of proteins from pinpricks of whole blood[J]. Lab on a chip, 2010, 10(22):3157-3162.
[28] DM B. Rapid integrated biosensor for multiplexed immunoassays based on actuated magnetic nanoparticles[J]. Lab Chip, 2009, 9(24):3504-3510.
[29] T L. A smartphone dongle for diagnosis of infectious diseases at the point of care[J]. Science translational medicine, 2015, 7(273): 273re1-273re1.
[30] Zhu H, Mavandadi S, Coskun A F, et al. Optofluidic fluorescent imaging cytometry on a cell phone[J]. Anal Chem, 2011, 83(17):6641-6647.
[31] H Z, I S, J W, et al. Cost-effective and rapid blood analysis on a cell-phone[J]. Lab Chip, 2013, 13(7):1282-1288.
[32] W S, L G, H K, et al. Four-part leukocyte differential count based on sheathless microflow cytometer and fl uorescent dye assay[J]. Lab on a Chip, 2013, 7(7):1257-1265.
[33] D H, D P, CH R, et al. Leukocyte analysis and differentiation using high speed microfluidic single cell impedance cytometry[J]. Lab on a Chip, 2009, 9(20):2881-2889.
[34] C V B, JD G, S D, et al. Integrated systems for rapid point of care (PoC) blood cell analysis[J]. Lab Chip, 2011, 11(7):1249-1255.
[35] 陈宇,靖向盟,朱军,等. 芯片实验室技术在POCT上的最新进展[J]. 微纳电子技术, 2007, 44(12): 1036-1042, 1047.
[36] Wongkaew N, He P, Kurth V, et al. Multi-channel PMMA microfl uidic biosensor with integrated IDUAs for electrochemical detection[J]. Analytical and Bioanalytical Chemistry, 2013, 405(18):5965-5974.
[37] Q P, O O, B T, et al. On-chip micropatterning of plastic (cylic olefin copolymer, COC) microfluidic channels for the fabrication of biomolecule microarrays using photografting methods[J]. Langmuir, 2006, 23(3):1577-1583.
[38] Kurkuri M D, Al-Ejeh F, Shi J Y, et al. Plasma functionalized PDMS microfluidic chips: towards pointof-care capture of circulating tumor cells[J]. Journal of Materials Chemistry, 2011, 24(24):8841-8848.
[39] L L W, L A M, S B, et al. A printed circuit board based microfluidic system for point-of-care diagnostics applications[C]// Proceedings of 15th International Conference on Miniaturized Systems for Chemistry and Life Sciences. Seattle, Washington, USA: MicroTAS 2011, 2011: 1819-1821.
[40] Kim K, Lee J. High aspect ratio tapered hollow metallic microneedle arrays with microfluidic interconnector[J]. Microsystem Technologies, 2007, 13(3-4):231-235.
[41] Li C G, Lee C Y, Lee K, et al. An optimized hollow microneedle for minimally invasive blood extraction[J]. Biomedical Microdevices, 2013, 15(1):17-25.
[42] Arata H, Komatsu H, Han A, et al. Highly sensitive microRNA detection using-gold-nanoparticles on power-free microfluidic chip towards point-of-care early-stage cancer diagnosis[C]//Proceedings of 15th International Conference on Miniaturized Systems for Chemistry and Life Sciences. Seattle, Washington, USA: IEEE, 2011: 491-493.
[43] Herrmann M, Roy E, Veres T, et al. Microfluidic ELISA on non-passivated PDMS chip using magnetic bead transfer inside dual networks of channels[J]. Lab Chip, 2007, 11(11):1546-1552.
[44] Thomas D J, Azmi M A M M, Tehrani Z P. Fabrication of an Integrated 3-Dimensional Printed Polymer Silicon Nanowire–Based Microfluidic Point-of-Care System for Detecting 8-OHdG Cancer Biomarker[J]. Point of Care: The Journal of Near-Patient Testing & Technology, 2014, 13(2):54-65.
[45] 潘建章,方群. 微流控床边检验系统的流体操控方法研究进展[J]. 分析化学, 2012, 40(1): 11-17.
[46] Maleki T, Fricke T, Quesenberry J, et al. Point-ofcare, portable microfluidic blood analyzer system[J]. Microfluidics, BioMEMS, and Medical Microsystems X, 2012, 8251(1):176-182.
[47] S M. Integrating microfluidics and lensless imaging for point-of-care testing[C]//Bioengineering Conference, 2009 IEEE 35th Annual Northeast. IEEE, 2009:1 - 2.
[48] 童超. 一种用于POCT的嵌入式实时图像采集处理系统[D]. 上海: 中国科学院研究生院(上海微系统与信息技术研究所), 2008.
[49] Setty M, Hewlett I. Point of Care Technologies for HIV[J]. AIDS Res Treat, 2014, 2014(10): 1-20.
[50] Abbott. Toward more realistic pathfinding[EB/OL]. 2015-03-08 [2015-03-08]. http://www.abbott.com.cn/forprofessionals/diagnostics/iStat-system.html.
[51] HemoCue. White Blood Cell Count (WBC) - The Right Care Faster [EB/OL]. 2012-03-14 [2015-03-08]. http:// www.hemocue.us/en-us/products/white-blood-cell-count.
[52] Chempaq. Chempaq XBC Blood Analyzer[EB/OL]. 2015-03-08 [2015-03-08]. http://pocd.com.au/POCDpr_ Chempaq_XBC_blood_Analyzer.php.
[53] Sia S K, Kricka L J. Microfluidics and point-of-care testing[J]. Lab on a Chip, 2008, 12(12):1982-1983.
[54] JR P, HM V, HL W, et al. Use of error grid analysis to evaluate acceptability of a point of care prothrombin time meter[J]. Clin Chim Acta, 2010, 411:131–134.
[55] E A. Analytical connotations of point-of-care testing[J]. The Analyst, 2010, 9(9):2220-2232.
[56] 张坚. 医院急救医学装备配置中POCT的应用与管理[J]. 生物医学工程学进展, 2013, 34(3): 191-193.
[57] Yetisen A K, Akram M S, Lowe C R. Paper-based microfluidic point-of-care diagnostic devices[J]. Lab on a Chip, 2013, 12(12):2210-2251.
[58] Luppa P B, Müller C, Schlichtiger A, et al. Point-ofcare testing (POCT): Current techniques and future perspectives[J]. TrAC Trends in Analytical Chemistry, 2011, 30(6):887–898.
Microfl uidic Lab-on-a-chip Technologies for Point-of-care Testing System: A Review
LI Xiaoqiong, YANG Chunhua, PAN Shaowu, HAN Jie, KUANG Yuxiang, SHI Qingfeng
School of Life Science, Beijing Institute of Technology, Beijing 100081, China
Point-of-care testing (POCT) mainly aims at achieving quick and easy medical testing for clinical applications. With advantages of good real-time performance, lower overall costs and independence of expensive equipment, it has been widely used for application areas such as clinical monitoring, inspection and quarantine, home health care and et al. As one of the most important technologies to build POCT instruments, microfl uidic chip is able to fabricate complex system and provide a high testing precision for trace samples. According to different properties of various test objects, the research status of POCT testing technologies based on microfl uidic chip for nucleic acid rest; protein test; cell test was reviewed in this paper. Considering clinical needs of POCT, some basic-research fi ndings of microfl uidic chip for POCT applications were introduced then, which covered microfl uidic chip building techniques, systematization concepts, merchandise design and et al. Finally, research diffi culties and development tendency of POCT microfl uidic chip were discussed.
Point-of-care Testing (POCT); Microfl uidic Chip; Nucleic Acid Test; Protein Test; Cell Test; Productization
V448.15
A doi 10.11966/j.issn.2095-994X.2015.01.01.05
2015-03-12;
2015-03-12
国家重大科学仪器开发专项(2012YQ04014001)
李晓琼(通信作者),副教授,研究方向为生物医学检测仪器,电子信箱:aeople@126.com;杨春华,博士研究生,研究方向为生物医学检测仪器,电子信箱:young.20@qq.com
引用格式:李晓琼,杨春华,潘邵武,等.面向POCT应用的微流控芯片技术综述[J].世界复合医学, 2015 , 1(1): 30-37.