牙龈卟啉单胞菌脂多糖对人牙周膜细胞成骨分化能力的影响
薛 栋,蒋少云,邓嘉胤,董允允,张 蕊
(天津医科大学口腔医院牙周科,天津医科大学口腔医学院,天津300070)
人牙周膜细胞(humanperiodontalliga mentcells,HPDLCs)是包括了成牙骨质细胞、成骨细胞、成纤维细胞以及这些细胞的前体细胞或成体干细胞的特异性细胞群[1],具有成纤维细胞样和成骨细胞样双重特征,能够维持牙周膜功能的稳定,在细胞更新、组织修复以及组织再生中发挥重要的作用,具有干细胞的特性以及多向分化的潜能。牙龈卟啉单胞菌(Porphyromonasgingivalis,P.g)脂多糖(lipopolysaccharide,LPS)是牙周病重要的致病因子,其不仅能够直接作用于牙周组织引起组织的破坏;同时,也是一种潜在的细胞活化因子,诱导细胞分泌多种炎性因子,在牙周病的发生及发展过程中发挥重要作用。本实验通过体外P.gLPS刺激HPDLCs,观察其对HPDLCs成骨分化的影响,同时探讨P.gLPS对HPDLCs成骨分化的调节机制。
1 材料和方法
1.1 主要试剂 DMEM细胞培养基、α-MEM细胞培养基、胎牛血清、青/链霉素、0.25%胰蛋白酶(Gibco公司,美国);I型胶原酶、β-甘油磷酸盐、地塞 米 松 、3 -(4,5 -dimethylthiazol-2 -yl)-2,5 -diphenyltetrazoliumbromide (MTT)、L-抗坏血酸(Sigma公司,美国);PBS缓冲液;Trizol总RNA提取试剂(Invitrogen,美国);cDNA逆转录试剂盒、PCR试剂盒、real-timePCR试剂盒(Promega,美国);P.gLPS(Invivogen,美国);5-Bromo-4-Chloro-3-IndolylPhosphate/nitrobluetetrazolium(BCIP/NBT)溶液(华兴博创生物,中国)。
1.2 HPDLCs体外培养[2-3]经患者知情同意,选取12~18岁因正畸治疗需要拔除的新鲜健康的双尖牙,PBS反复冲洗,刮取根中1/3牙周膜组织剪碎成1mm3小组织块,采用I型胶原酶+组织块法进行HPDLCs的原代培养,待细胞从组织块中爬出并达80%汇合时,进行首次传代,取第3~4代细胞用于实验。
1.3 方法
1.3.1 实验分组 将细胞分为3组进行实验。A组:含5%胎牛血清的α-MEM培养液培养HPDLCs;B组:成骨诱导培养(含10mmol/Lβ-甘油磷酸钠、50 μg/mL维生素 C、1×10-8mol/L地塞米松、5%胎牛血清、α-MEM 培养液)培养 HPDLCs;C 组:1μg/mLP.g LPS+成骨诱导培养。
1.3.2 MTT法检测HPDLSCs的增殖能力 依照上述分组,将HPDLCs接种于每孔2×103个细胞的96孔培养板内。每组分别设5个复孔,隔天换液。用0.5mg/mLMTT检测细胞增殖活性,37℃孵育4h后,于波长490nm测各孔光密度(opticaldensity,OD)值。
1.3.3 碱性磷酸酶染色 将HPDLCs以5×104/孔接种于6孔板,培养24h后,弃原培养液,依照上述分组分别加入培养液。培养7d后,PBS洗涤,4%多聚甲醛固定30min,PBS洗涤2~3遍,每孔加入1mL BCIP/NBT工作液,室温避光放置15min,PBS洗涤2~3遍,观察染色情况。
1.3.4 茜素红染色以及茜素红半定量检测 培养同上,第21天后吸弃培养液,PBS清洗,4%多聚甲醛固定30min,PBS洗涤2~3遍,加入0.1%茜素红(alizarinred-S),室温放置 30min,PBS 清洗 2~3遍,拍照观察。照相后,吸弃PBS,每孔加入1mL氯化十六烷吡啶,室温放置15min,将溶液移入96孔板,150μL/孔,酶联免疫检测仪于波长562nm检测OD值。
1.4 Real-timePCR检测成骨相关基因的mRNA表达 分组同前。分别于第3、7及14天采用Trizol总RNA法提取各组细胞RNA,参照试剂盒说明书合成cDNA模版,用获得的cDNA进行real-timePCR检测成骨相关基因:I型胶原蛋白(collagen1,COL1)、碱性磷酸酶(alkalinephophatase,ALP)、Runt相关转录因子(runt-relatedtranscriptionfactor2,RUNX2)和骨钙素(osteocalcin,OCN)。其引物序列见表1。以GAPDH作为组内对照,所得数据用2-ΔΔCT法进行处理。

表1 合成引物序列及聚合酶链反应产物长度Tab1 Primerse quences and the length of poly merase chainreaction products
1.5 统计学方法 使用SPSS19.0统计分析软件,采用单因素方差分析(one-wayANOVA)对所得数据分别进行方差分析,并用Bonferroni法进行多样本均数的两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 HPDLCs的培养 原代细胞培养5~9d时,组织块周围有细胞爬出,3周左右可达80%汇合。细胞呈长梭形、多边形等,胞质形成的突起向外呈放射状(图1)。

图1 体外培养的人牙周膜细胞(×100)Fig1 Humanperi odontalliga mentcell sculture dinvitro(×100)
2.2 HPDLCs的增殖能力 第3~5天,B组与C组的OD值低于A组,但差异无统计学意义(P>0.05),且B组与C组间无统计学差异(P>0.05)。随后,A、B及C3组间均无统计学差异(P>0.05)(图2)。
2.3 P.gLPS刺激后碱性磷酸酶染色结果 第7天B组与C组的碱性磷酸酶活性均明显强于A组,而且B组的染色最明显(图3)。

图23 组不同培养条件下HPDLCs的增殖能力Fig2 Proliferation of HPDL Csinthreegroups

图3 碱性磷酸酶染色Fig3 Alkaline phosphatas estaining
2.4 P.gLPS刺激后茜素红染色和茜素红半定量检测的结果 21d后茜素红染色,与A组相比,B组与C组均可见茜素红染色阳性矿化结节形成(图4)。茜素红染色定量结果显示,B组与C组的OD值均明显增高(图5),其差异与A组具有统计学意义(P<0.05);但C组的OD值明显低于B组,且差别有统计学意义(P<0.05)。
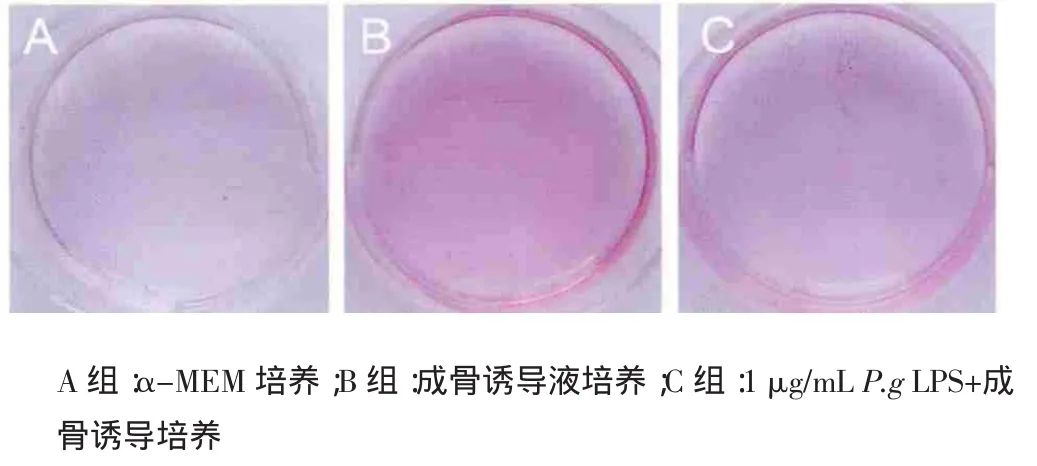
图4 茜素红染色Fig4 Alizarinre dstaining
2.5 P.gLPS刺激后real-timePCR检测成骨相关基因的表达水平
2.5.1 COL1mRNA的表达 在第3、7、14天,与A组相比,B组与C组COL1表达均升高(P<0.05),而C组较B组COL1表达降低,其差异具有统计学意义(P<0.05)(图 6)。

图5 茜素红染色定量检测Fig5 Quantitative detection of alizarinre dstaining

图6 Real-timePCR测定COL1mRNA水平Fig6 The expression of COL1mR NAinHPDLCs
2.5.2 ALPmRNA的表达 在3、7、14d,与 A组相比,B组与C组ALP表达均升高(P<0.05);但在3d时,B组与C组间ALP表达无统计学差异(P>0.05),而在7d及14d时,C组ALP表达明显低于B 组,且具有统计学差异(P<0.05)(图 7)。

图7 Real-timePCR测定ALPmRNA水平Fig7 The expression of ALPmR NAin HPDLCs
2.5.3 RUNX2mRNA的表达 与A组相比,B组与C组RUNX2表达明显升高(P<0.05),且呈时间依赖性,随着时间的延长其表达更明显;同时C组较B组 RUNX2表达显著降低(P<0.05)(图8)。

图8 Real-timePCR测定RUNX2mRNA水平Fig8 The expression of RUNX2m RN Ain HPDL Cs
2.5.4 OCNmRNA的表达 3d时,与A组相比,B组与C组OCN表达升高,但两两比较时C组与A组间无统计学差异(P>0.05),B组与A组间有统计学差异(P<0.05),C组较B组OCN表达明显减少(P<0.05);在7d及14d,B组与C组OCN表达均较A组升高(P<0.05),而且C组较B组OCN表达明显减少(P<0.05)(图 9)。

图9 Real-timePCR测定OCNmRNA水平Fig9 The expression of OCNm RNAin HPDL Cs
3 讨论
牙周膜细胞是牙周及根尖周组织中的主要细胞成分,其在牙周支持组织的发育、修复以及再生的过程中发挥了重要作用。研究表明HPDLCs具有成骨的能力,能表达较高的ALP水平,产生较高的与矿化相关蛋白质及I型胶原等[4],因此牙周膜细胞被认为是研究牙周组织修复重建的重要细胞之一。本研究通过ALP染色、茜素红染色以及成骨相关基因的检测进一步证实了牙周膜韧带细胞具有成骨分化的能力。
张凤秋等[5]研究牙周优势菌内毒素对HPDLCs增殖的影响发现,当P.gLPS浓度小于0.1μg/mL时促进HPDLCs增殖,浓度在1μg/mL时对细胞增殖无明显影响,而当其浓度大于10μg/mL时则可抑制HPDLCs的生长。同时也有研究表明P.gLPS浓度低于0.1μg/mL时对HPDLCs既无增殖也无抑制作用,而浓度达1μg/mL时对HPDLCs有明显抑制作用[6]。笔者前期实验表明,当P.gLPS浓度为10μg/mL可明显抑制HPDLCs的增殖,这与部分学者的报道一致[5-6]。而1μg/mLP.gLPS对细胞增殖无明显影响。为排除细胞增殖的改变对细胞分化结果的影响,本研究以此浓度建立炎症状态下细胞骨向分化模型。
ALP是参与骨等矿化组织代谢以及再生的标志性酶,其表达的增多或降低是决定骨矿化程度是否良好的关键条件[7]。本实验通过ALP染色以及实时定量PCR显示,当P.gLPS刺激后,ALP的mRNA表达较单纯成骨诱导组降低,从而导致ALP活性下降,提示P.gLPS降低了HPDLCs成骨分化的矿化程度,从而影响了牙周组织的修复及改建过程。
COL1是成骨细胞分化过程中的重要基质,为组织的矿化提供基础。从笔者的研究结果显示,P.g LPS降低COL1的表达,使得细胞分化、组织矿化过程中的矿化基质降低,从而干扰矿化过程。茜素红染色结果显示矿化结节在P.gLPS刺激下明显减少,可能是由于矿化基质的减少所致。Viale-Bouroncle等[8]研究结果显示,COL1促进牙囊细胞表达ALP,但是不刺激其矿化过程。因而推测,在本研究中ALP的下降有可能与COL1降低有关,但因细胞的种类不同需要进一步验证。
间充质干细胞细胞的成骨分化是由特定的转录因子调控。在非成骨细胞及成纤维细胞中过表达RUNX2能够诱导成骨相关基因的表达,RUNX2作为成骨特异性激活因子,在成骨细胞发育、分化以及骨形成与重建过程中起到重要的作用[9-11]。在P.g LPS刺激后细胞中RUNX2的表达明显下降,从而干扰了细胞的成骨向分化。
OCN是骨组织中最丰富的非胶原蛋白,能够反映骨形成的速率,是骨细胞活性和骨代谢的特异性指标;其维持骨正常的矿化速率,抑制异常羟基磷灰石结晶的形成,抑制软骨的矿化速率[12-14]。Pacios等[15]研究伴放线杆菌引起的牙周炎症糖尿病动物模型中发现,在使用抗生素治疗后OCN表达升高,说明在炎性状态下,OCN的水平降低,导致牙周骨组织的形成减少,阻碍了正常的骨改建过程。本实验中,P.gLPS刺激能使OCNmRNA的表达较单纯成骨诱导组降低,可见P.gLPS干扰了HPDLCs的成骨矿化过程,降低了其骨形成的速率。
炎性微环境下HPDLCs的成骨分化功能受多方面调控。有研究发现,炎症组织来源的PDLCs成骨分化能力较健康组织来源的PDLCs明显降低[16]。Gilbert等[17]发现,肿瘤坏死因子 α(tumor necrosis factor-alpha,TNF-a)可能通过作用于胰岛素样生长因子(insulin-like growth factor,IGF)I,骨形成蛋白(bonemorphogenic proteins,BMP)-6 或骨骼肌 LIM蛋白(skeletal LIM protein,LMP)-1表达的远端,从而抑制细胞的成骨分化。在我们课题组的前期研究中发现P.g LPS能刺激人牙龈成纤维细胞分泌TNF-α、白细胞介素-1β(interleukin-1β,IL-1β)[18],而且其他学者也证实牙周致病菌及P.g LPS能刺激HPDLCs分泌 TNF-α、IL-1β、IL-6 和 IL-8[19],笔者推测,可能是P.g LPS改变了HPDLCs生存的微环境,产生了过多的炎性细胞因子,这些细胞因子对细胞的成骨分化产生抑制作用。本实验通过研究HPDLCs在炎性状态下成骨分化能力的变化,提出炎性状态下外界刺激可能通过负调节HPDLCs中骨相关基因的表达,从而抑制其成骨分化能力,进一步降低牙周组织的自我修复和重建能力,从而说明了消除炎症是促进牙周组织再生的必需条件。
[1]Seo B M,Miura M,Gronthos S,et al.Investigation ofmultipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149
[2]Ragnarsson B,Carr G,Daniel JC.Isolation and growth of human periodontal ligamentcells in vitro[J].JDentRes,1985,64(8):1026
[3]王祥,张斌,关呈超,等.提高人牙周膜成纤维细胞体外培养成功率的方法总结[J].现代口腔医学杂志,2011,25(6):467
[4]ArceoN,Sauk JJ,Moehring J,etal.Human periodontalcells initiate mineral-likenodules in vitro[J].JPeriodontol,1991,62(8):499
[5]张凤秋,吴织芬,万玲,等.牙周优势菌内毒素对人牙周膜细胞增殖和碱性磷酸酶活性的影响[J].牙体牙髓牙周病学杂志,2003,13(1):27
[6]黄美香,闫福华,姚丽艳,等.环孢素A联合脂多糖对牙周膜成纤维细胞增殖的影响[J].中华口腔医学研究杂志:电子版,2011,5(5):470
[7]Mayer H,Bertram H,Lindenmaier W,et al.Vascular endothelial growth factor(VEGF-A)expression in human mesenchymal stem cells:autocrine and paracrine role on osteoblastic and endothelial differentiation[J].JCell Biochem,2005,95(4):827
[8]Viale-Bouroncle S,Gosau M,Morsczeck C.Collagen Iinduces the expression ofalkaline phosphatase and osteopontin via Independent activationsof FAK and ERK signalling pathways[J].Arch Oral Biol,2014,59(12):1249
[9]Franceschi R T,Xiao G.Regulation of the osteoblast-specific transcription factor,Runx2:responsiveness to multiple signal transduction pathways[J].JCellBiochem,2003,88(3):446
[10]Komori T.Regulation of bone development and maintenance by Runx2[J].FrontBiosci,2008,13(13):898
[11]GreenblattM B,Shim JH,Glimcher LH,etal.Mitogen-activated protein kinase pathways in osteoblasts[J].Annu Rev Cell Dev Biol,2013,29:63
[12]Lian JB,Stein GS,Stein JL,etal.The osteocalcin gene promoter provides a molecular blueprint for regulatory mechanisms controlling bone tissue formation:role of transcription factors involved in development[J].Connect Tissue Res,1996,35(1/4):15
[13]Stein G S,Lian J B,Stein J L,et al.Transcriptional control of osteoblast growth and differentiation[J].Physiol Rev,1996,76(2):593
[14]Kondo A,Tokuda H,Matsushima-Nishiwaki R,et al.Rho-kinase limits BMP-4-stimulated osteocalcin synthesis in osteoblasts:regulation of the p38 MAP kinase pathway[J].Life Sci,2014,96(1/2):18
[15]Pacios S,AndriankajaO,Kang J,etal.Bacterial infection increases periodontalbone loss in diabetic rats through enhanced apoptosis[J].Am JPathol,2013,183(6):1928
[16]Park JC,Kim JM,Jung IH,etal.Isolation and characterization of human periodontal ligament(PDL)stem cells(PDLSCs)from the inflamed PDL tissue:in vitro and in vivo evaluations[J].JClin Periodontol,2011,38(8):721
[17]Gilbert L,He X,Farmer P,et al.Inhibition of osteoblast differentiation by tumor necrosis factor-alpha[J].Endocrinology,2000,141(11):3956
[18]魏丛丛,蒋少云,邓嘉胤.牙龈卟啉单胞菌脂多糖对人牙龈成纤维细胞炎症刺激作用的研究[J].天津医药,2013,41(5):419
[19]Sun Y,Shu R,Li C L,et al.Gram-negative periodontal bacteria induce the activation of Toll-like receptors 2 and 4,and cytokine production in human periodontal ligament cells[J].JPeriodontol,2010,81(10):1488

