新型酰胺类鬼臼毒素衍生物的合成及体外抗肿瘤活性
孙强稳,王 杰,陈守强,牛 聪,曹 波,高 颖,陈 虹(.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津 300070;.武警后勤学院生药学教研室,天津300309)
论著
新型酰胺类鬼臼毒素衍生物的合成及体外抗肿瘤活性
孙强稳1,2,王 杰1,陈守强1,牛 聪2,曹 波2,高 颖2,陈 虹1,2
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津 300070;2.武警后勤学院生药学教研室,天津300309)
目的:通过对鬼臼毒素母核进行结构改造,以获得高效、低毒、抗多药耐药的新型鬼臼毒素衍生物。方法:将4β-氨基-4-脱氧表鬼臼毒素的C-4位经酰胺化分别引入对位取代的苯甲酸和对位取代的肉桂酸化合物,得到4-甲酰基苯甲酸及4-甲酰基肉桂酸的鬼臼毒素类衍生物,通过MTT法筛选,并对K562和Hela细胞进行药理活性评价。结果:合成得到两个系列共8个化合物,所有化合物都经过HR-ESI-MS和1HNMR验证,其中化合物1d、2b具有较强的体外抗肿瘤活性。结论:在C-4位引入4-甲酰基苯甲酸以及4-甲酰基肉桂酸基团可增加鬼臼毒素类衍生物的抗肿瘤活性。
鬼臼毒素衍生物;苯甲酸;肉桂酸;体外抗肿瘤活性
鬼臼毒素(podophyllotoxin)及相关木脂素是一类具有显著细胞毒性的天然活性物质,主要来源于小檗科的八角莲属 (dysosma)、桃儿七属(podophyllum)和山荷叶属(diphylleia)及大麻科和柏科的少数科属中[1]。在我国的青海、甘肃、四川西部、西藏和台湾等地分布较多[2]。鬼臼素类化合物具有良好的抗肿瘤活性,其合成衍生物依托泊苷和替尼泊苷已在临床长期广泛应用。据文献报道,鬼臼毒素类化合物主要有两种细胞毒作用机制:(1)抑制拓扑异构酶Ⅱ的活性;(2)抑制微管组装[3-4]。然而,大量的临床应用显示,这类化合物存在水溶性差、多药耐药、骨髓抑制以及严重的胃肠道反应[5]等缺点。为了获得高效、低毒、抗多药耐药且具有作用于肿瘤细胞的多靶点的新型鬼臼毒素衍生物,本课题组多年来一直致力于新型鬼臼毒素衍生物的研究,大量的构效关系表明,鬼臼类抗肿瘤药物的最佳修饰点在C-4位[6-7],4-甲酰基肉桂酸和4-甲酰基苯甲酸是常见的有机合成中间体,并且存在于许多药物的分子结构中,本课题组在前期研究的基础上,根据药物拼合原理,将4-甲酰基肉桂酸[8-10]和4-甲酰基苯甲酸与氨基鬼臼通过酰胺键连接,设计合成了两个系列,共8个化合物,以期获得抗肿瘤活性优于依托泊苷的新型鬼臼毒素类衍生物。
1 材料与方法
1.1 仪器和试剂 XT显微熔点仪;高分辨质谱仪:Agilent 6210 LC-TOF,Bruker Advance 2B/400 (Bruker,Bremen,Germany),VarianMercuryVx300
(Varian,Palo Alto,CA,USA);98%纯度的鬼臼毒素购自上海金和生物技术有限公司;HOBT,EDCI盐酸盐;DMF(分子筛干燥);无水CH2Cl2(钠块回流干燥);无水甲醇(镁粉回流干燥);其余试剂均为市售的分析纯或化学纯。VP-16:江苏恒瑞医药股份有限公司,产品批号:09090731。
1.2 合成方法
1.2.1 合成路线 (1)相关中间体的合成路线如图1。(2)目标化合物的合成路线如图2。

图1 相关中间体2、3、4化合物的合成路线Fig 1 Schematic route of 2,3,4 compounds
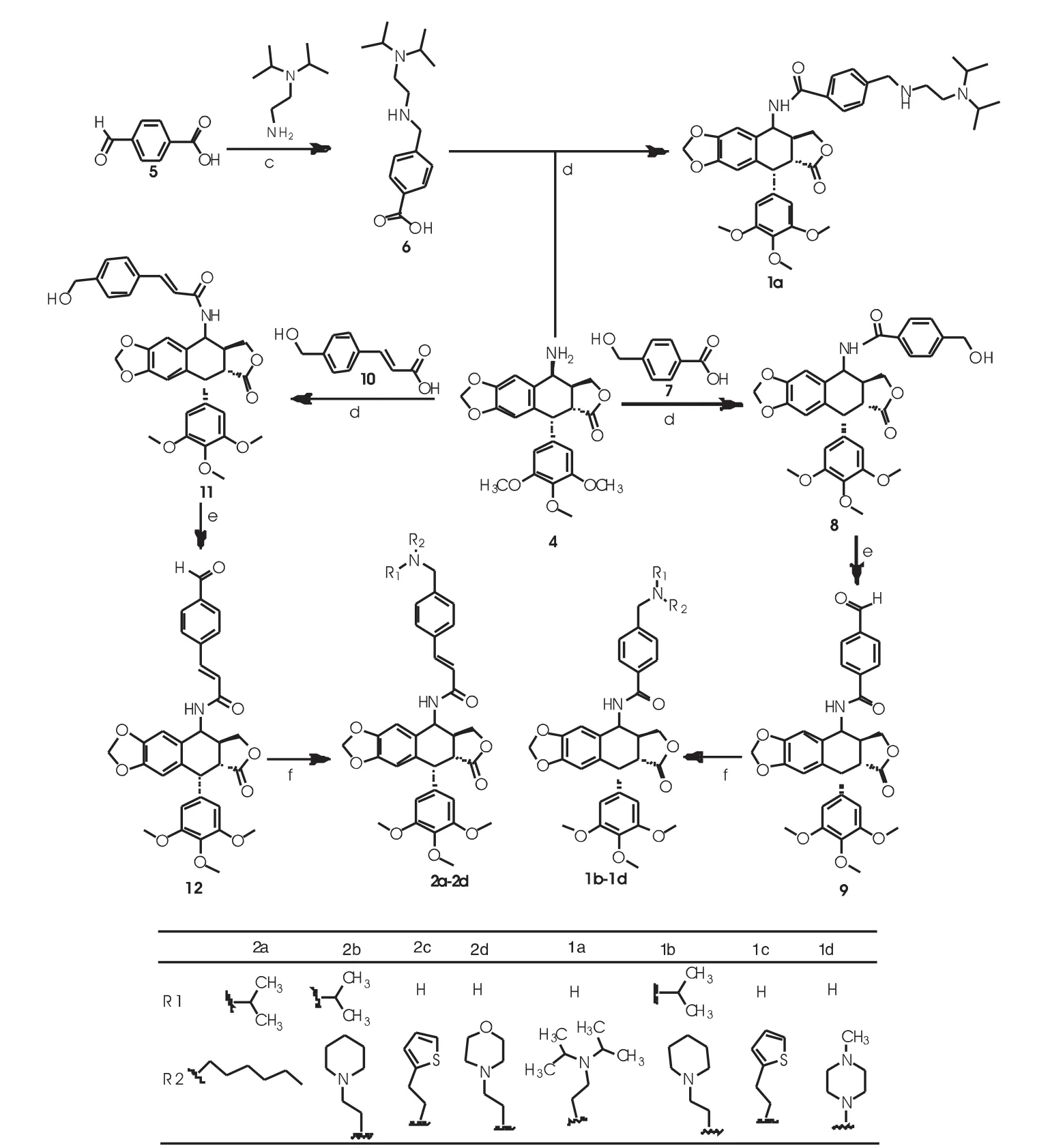
图2 化合物1a-1d,2a-2d的合成路线Fig 2 Schematic route of 1a-1d,2a-2d compounds
1.2.2 4β-叠氮基-4-脱氧表鬼臼毒素的合成 将4β-叠氮基-4-脱氧表鬼臼毒素4.14 g(10 mmol)溶于50 mL干燥CH2Cl2中,加入叠氮钠2.60 g(40 mmol),搅拌使其溶解,于冰浴下缓慢滴加10 mL三氟乙酸,40℃回流4 h。TLC检测反应完毕,冰浴加入饱和碳酸氢钠溶液至无气泡,萃取分出有机层,减压干燥,粗品经CH2Cl2∶CH3COOC2H5(v/v=1∶1)重结晶,得白色晶体3.99 g,收率91%。
1.2.3 4β-氨基-4-脱氧表鬼臼毒素的合成 将4β-叠氮基-4-脱氧表鬼臼毒素4.39 g(10 mmol)溶于50 mL乙酸乙酯中,依次加入10%钯碳400 mg,甲酸铵2.52 g(40 mmol),55℃加热回流,搅拌反应4 h,TLC检测反应完全,过滤,滤液用饱和食盐水洗3次,减压干燥得白色泡沫状粗产物3.63 g,收率83%,粗品可直接用于下一步反应。
1.2.4 化合物1a的合成 将1 mmol 4-甲酰基苯甲酸和1.2 mmol N,N-二异丙基乙二胺溶于20 mL无水CH3OH,滴加7滴冰醋酸,室温反应12 h后,冰浴下加入5 mmol硼氢化钠反应6 h,薄层色谱检测反应完全,调节pH约至2~3,有机溶剂萃取,减压干燥得化合物6(图2)的盐酸盐混合物,直接进入下一步反应;取1 mmol化合物6的粗品溶于20 mL的干燥二氯甲烷中,冰浴下加入1.2倍量的HOBt 和EDCI盐酸盐,反应30 min后,加入1 mmol 4β-氨基-4-脱氧表鬼臼毒素,常温反应8 h,依次用5% HCl溶液、饱和NaHCO3溶液以及饱和食盐水溶液洗涤1次,减压干燥,经柱层析分离得化合物1a。
1.2.5 化合物1b的合成 将1.2 mmol的化合物7(图2)置于20 mL的干燥CH2Cl2中,冰浴下加入1.2倍量的HOBt和EDCI盐酸盐,反应30 min后,加入1 mmol的氨基鬼臼,置于常温反应8 h,依次用5%HCl溶液、饱和NaHCO3溶液以及饱和食盐水溶液洗涤1次,用无水硫酸钠干燥有机层,减压蒸干,经柱层析分离,得化合物8(图2);将1 mmol化合物8溶于20 mL干燥CH2Cl2中,加入10倍量活性MnO2,室温反应0.5 h,反应完毕,抽滤,滤液旋干得白色固体化合物9(图2);将1 mmol化合物9和1.2 mmol1-哌啶-2-乙胺溶于20 mL无水甲醇中,滴加1 mL丙酮和0.5 mL冰醋酸,常温缓慢加入1.5倍量NaBH3CN,反应30 min,薄层色谱检测,待反应完全后,调节pH7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物1b。
1.2.6 化合物1c的合成 将1.2 mmol的化合物9 和1.2 mmol噻唑-2-乙胺溶于20 mL无水CH3OH,滴加0.5 mL冰醋酸,常温缓慢加入 5倍量NaBH3CN,常温反应30 min,薄层色谱检测,待反应完全后,调节pH7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物1c。
1.2.7 化合物1d的合成 将1.2 mmol的化合物9 和1.2 mmol N-甲基哌嗪溶于20 mL无水CH3OH,滴加0.5 mL冰醋酸,常温缓慢加入 1.5倍量NaBH3CN,反应30 min,薄层色谱检测,待反应完全后,调节pH7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物1d。
1.2.8 化合物2a的合成 将1.2 mmol的化合物10(图2)置于20 mL的干燥CH2Cl2溶液中,冰浴下加入1.2倍量的HOBt和EDCI盐酸盐,反应30 min后,加入1 mmol的氨基鬼臼,置于常温反应8 h,依次用5%的HCl溶液、饱和碳酸氢钠溶液以及饱和食盐水洗涤1次,减压蒸干,经柱层析分离,得化合物11(图2);将1 mmol化合物11溶于20 mL无水CH2Cl2中,加入10倍量活性MnO2,室温反应0.5 h,反应完全,抽滤,滤液旋干得白色固体化合物12(图2);将1 mmol化合物12和1.2 mmol己胺溶于20 mL无水甲醇中,滴加1 mL丙酮和0.5 mL冰醋酸,缓慢加入1.5倍量NaBH3CN,室温反应30 min,薄层色谱检测,待反应完全后,调节pH7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物2a。
1.2.9 化合物2b的合成 将1.2 mmol的化合物12(图2)和1.2 mmol 1-胺乙基哌啶溶于20 mL无水CH3OH,滴加0.5 mL冰醋酸,缓慢加入1.5倍量氰基硼氢化钠,室温反应30 min,薄层色谱检测,待反应完全后,调节pH 7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物2b。
1.2.10 化合物2c的合成 将1.2 mmol的化合物12和1.2 mmol 2-胺乙基噻唑溶于 20 mL无水CH3OH,滴加0.5 mL冰醋酸,缓慢加入1.5倍量NaBH3CN,室温反应30 min,薄层色谱检测,待反应完全后,调节pH7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物2c。
1.2.11 化合物2d的合成 将1.2 mmol的化合物12和1.2 mmol N-胺乙基吗啉溶于 20 mL无水CH3OH,滴加0.5 mL冰醋酸,缓慢加入1.5倍量NaBH3CN,室温反应30 min,薄层色谱检测,待反应完全后,调节pH 7,有白色沉淀析出,抽滤,将固体经柱层析分离,得化合物2d。
1.3 MTT法检测体外抗肿瘤活性 取对数生长期的Hela及K562细胞接种于96孔培养板内,每孔约含4 000个细胞,置37℃,5%CO2细胞培养箱中培养。24 h后给药组加入待测药物,每组设3个平行孔,阴性对照组加入与给药组等体积的溶剂,共孵育48 h后弃培养液,每孔加50 μL 1 mg/mL MTT 的PBS溶液,37℃孵育4 h,弃上清,每孔加入150 μL DMSO溶解甲臜颗粒,轻度振荡溶解。以酶标仪490 nm下测定光密度值,用下面公式计算化合物对细胞生长的抑制率,并以SPSS13.0统计软件计算IC50值,实验平行3次。
抑制率=(阴性对照组OD值-加药组OD值)/(阴性对照组OD值-空白对照组OD值)×100%
2 结果
2.1 化合物的表征数据
1a:白色固体,产率 35%,m.p.145~146℃;1HNMR(400MHz,CDCl3)δ7.73(d,J=8.2Hz,2H,H-2″,5″),7.42(d,J=8.2Hz,2H,H-3″,4″),6.81(s,1H,H-5),6.53(s,1H,H-8),6.32(s,2H,H-2′,5′),6.01-5.94(s,2H,H-OCH2O-),5.43(dd,J=6.9,4.4Hz,1H,H-4),4.63(d,J=4.8Hz,1H,H-1),4.50(m,1H,H-11),3.95-3.87(m,1H,H-11),3.86(s,2H,H-Ar-CH2),3.81(s,3H,H-4′),3.76(s,6H,H-3′,5′),3.06 (m,2H,H-2,3),2.68(s,2H,H-2CH-),2.11-1.92 (m,4H,H-NCH2CH2N-),1.06(d,J=6.6Hz,12H,H-2C(CH3)2);HR-ESI-MS:m/z 674.3436 for[M+H]+(calcd for C38H48N3O8+,674.3436)。
1b:白色固体,产率33%,m.p.173~174℃;1HNMR(400MHz,CDCl3)δ7.70(d,J=8.3Hz,2H,H-2″,5″),7.43(d,J=8.2Hz,2H,H-3″,4″),6.82(s,1H,H-5),6.55(s,1H,H-8),6.31(s,2H,H-2′,5′),5.98 (dd,J=7.8,1.2Hz,2H,-OCH2O-),5.43(dd,J=7.0,4.2Hz,1H,H-4),4.62(d,J=4.5Hz,1H,H-1),4.50(dd,J=9.2,6.9Hz,1H,H-11),3.93(dd,J=25.3,15.9Hz,1H,H-11),3.81(s,3H,H-4′),3.76(s,6H,H-3′,5′),3.63(s,2H,Ar-CH2),3.10-2.93(m,2H,H-2,3),2.89(m,1H,N-CH-),2.70-2.51(m,2H,H-2‴′),2.38(dd,J=9.1,6.2Hz,6H,H-2‴,6‴,1‴′),1.66-1.53m,4H,H-3‴,5‴),1.42(s,2H,H-4‴),1.05-0.93(m,6H,-C(CH3)2).HR-ESI-MS:m/z 700.3601 for[M+H]+(calcd for C40H50N3O8+,700.3592)。
1c:白色固体,产率41%,m.p.156~157℃;1HNMR(300MHz,CDCl3)δ7.70(d,J=8.3Hz,2H,H-2″,5″),7.37(d,J=8.2Hz,2H,H-3″,4″),7.13(dd,J=5.1,1.2Hz,1H,5‴),6.92(dd,J=5.1,3.4Hz,1H,4‴),6.82(d,J=3.4Hz,1H,H-3‴),6.81(d,J=3.5Hz,1H,H-5),6.54(s,H,H-8),6.29(s,2H,H-2′,5′),5.98 (dd,J=5.3,1.2Hz,2H,H-OCH2O-),5.41(dd,J=6.8,4.3Hz,1H,H-4),4.62(d,J=4.7Hz,1H,H-1),4.49(dd,J=9.1,7.1Hz,1H,H-11),4.09(m,1H,H-11),3.83(m,3H,H-4′,H-N-CH2-Ar),3.80(s,3H,H-4′),3.75(s,6H,H-3′,5′),3.04(t,J=6.7Hz,2H,H-2,3),2.99-2.85(m,4H,H-NCH2CH2-);HR-ESIMS:m/z657.2279 for[M+H]+(calcd for C36H37N2O8S+,657.2265)。
1d:白色固体,产率42%,m.p.181~182℃;1HNMR(300MHz,CDCl3)δ7.77-7.61(m,2H,Ar),7.37(t,J=7.3Hz,2H,Ar),6.79(s,1H,H-5),6.47(d, J=19.8Hz,1H,H-8),6.29(s,2H,H-2′,5′),5.95(dd,J=6.9,1.0Hz,2H,-OCH2O-),5.42(d,J=3.6Hz,1H,H-4),4.59(d,J=3.2Hz,1H,H-1),4.51-4.38(m,1H,H-11),3.93-3.82(m,1H,H-11),3.81-3.75(m,3H,H-4′),3.74(s,6H,H-3′,5′),3.58(s,2H,N-CH2-Ar),3.02(d,J=9.6Hz,2H,H-2,3),2.77(d,J=36.2Hz,4H),2.59(d,J=18.1Hz,4H),2.54(s,3H,NCH3).HR-ESI-MS:m/z630.2846 for[M+H]+(calcd for C35H40N3O8+,630.2810)。
2a:白色固体,产率37%,m.p.138~140℃;1HNMR(300MHz,CDCl3)δ7.65(d,J=15.5Hz,1H,HHC=),7.40(d,J=8.3Hz,2H,H-2″,5″),7.34(d,J=8.2Hz,2H,H-3″,4″),6.80(s,1H,H-5),6.50(s,1H,H-8),6.40(d,J=15.5Hz,1H,H-CH=),6.27(s,2H,H-2′,5′),5.95(d,J=1.1Hz,1H,-OCH2O-),5.91(d,J=1.1Hz,1H,-OCH2O-),5.37(dd,J=7.2,3.8Hz,1H,H-4),4.55(d,J=4.1Hz,1H,H-1),4.50-4.36(m,1H,H-11),3.88(t,J=9.6Hz,1H,H-11),3.78(s,3H,H-4′),3.72(s,6H,H-3′,5′),3.54(s,2H,Ar-CH2),3.06-2.95(m,2H,H-2,3),2.92(m,1H,H-N-CH-),2.42-2.29(m,2H,H-1‴),1.37(s,2H,H-2‴),1.22 (dt,J=10.5,3.5Hz,6H,H-3‴,4‴,5‴),0.97(dd,J=18.7,7.0Hz,6H,H-(CH3)2),0.84(t,J=6.7Hz,3H,H-6‴).HR-ESI-MS:m/z 684.3159 for[M+H]+(calcd for C40H48FN2O8+,684.3144)。
2b:白色固体,产率39%,m.p.147~149℃;1HNMR(300MHz,CDCl3)δ7.64(d,J=15.6Hz,1H,HHC=),7.40(d,J=8.2Hz,2H,H-2″,5″),7.32(d,J=8.2Hz,2H,H-3″,4″),6.80(s,1H,H-5),6.47(s,1H,H-8),6.42(d,J=15.6Hz,1H,H-HC=),6.27(s,2H,H-2′,5′),5.95(d,J=1.1Hz,1H,H-OCH2O-),5.92 (d,J=1.1Hz,1H,H-OCH2O-),5.37(d,J=3.9Hz,1H,H-4),4.56(d,J=3.5Hz,H,H-1),4.48-4.38(m,1H,H-11),3.8(dd,J=12.4,7.4Hz,1H,H-11),3.77(d,J=3.7Hz,3H,H-4′),3.73(s,6H,H-3′,5′),3.57(s,2H,H-Ar-CH2),2.99(d,J=10.8Hz,2H,H-2,3),2.9(m,1H,N-CH(CH3)2),2.62(dd,J=9.2,5.9Hz,2H,H-2‴′),2.40(dd,J=8.9,5.8Hz,6H,H-2‴,6‴,1‴),1.57(dd,J=10.7,5.4Hz,4H,H-3‴,5‴),1.41(d,J=4.4Hz,2H,H-4‴),1.01(d,J=6.6Hz,6H,H-(CH3)2);R-ESI-MS:m/ z726.3767 for[M +H]+(calcd for C42H52N3O8+,726.3749)。
2c:白色固体,产率38%,m.p.165~167℃;1HNMR(300MHz,CDCl3)δ7.41(d,J=15.6Hz,1H,HHC=),7.34(d,J=7.8Hz,2H,H-2″,5″),7.27(d,J=9.5Hz,2H,H-3″,4′),7.10(d,J=5.0Hz,1H,5‴),6.86 (dd,J=10.4,5.5Hz,3H,H-5,3‴,4‴),6.43(s,1H,H-8),6.44(d,J=15.6Hz,1H,H-HC=),6.27(s,2H,H-2',5),5.89(d,J=12.2Hz,2H,-OCH2O-),5.34(s,1H,H-4),4.55(s,1H,H-1),4.36(s,1H,H-11),3.90(m,3H,H-11,H-NCH2-Ar),3.71(d,J=8.4Hz,9H,H-3′,4′,5′),3.12(m,J=6.4Hz,6H,H-2,3,N-CH2CH2-);HR-ESI-MS:m/z 683.2433 for[M+H]+(calcd for C37H38N2O8+,683.2422)。
2d:白色固体,产率30%,m.p.172~173℃;1HNMR(300MHz,CDCl3)δ7.58(d,J=15.5Hz,1H,HHC=),7.42(d,J=8.1Hz,2H,H-Ar),7.33(d,J=8.1Hz,2H,H -Ar),6.79(s,1H,H -5),6.53-6.45(d,15.5,1H,H-HC=),6.44(s,1H,H-8),6.27(s,2H,H-2″,5″),5.92(d,J=11.9Hz,2H,H-OCH2CH2O-),5.36 (dd,J=7.4,4.4Hz,1H,H-4),4.54(d,J=4.6Hz,1H,H-1),4.39(t,J=8.0Hz,1H,H-11),3.86(d,J=12.1Hz,3H,H-4,-NCH2-Ar),3.74(d,J=4.3Hz,3H,H-4′),3.71(s,6H,H-3′,5′),3.67-3.61(m,4H,-CH2-N-CH2-),3.14-2.99(m,2H,H-2,3),2.77(t,J=5.6Hz,2H,N-CH2CH2-),2.53(t,J=5.7Hz,2H),2.39 (s,4H,H-CH2-O-CH2).HR-ESI-MS:m/z686.3090 [M+H]+(calcd for C38H44N3O9+,686.3072)。
2.2 细胞毒性测定 所测试的8个化合物均显示出不同程度的抑制Hela和抗K562的生长作用,其中1d和2b活性较强,且优于阳性对照药物依托泊苷(VP-16)。见表1。
表1 目标化合物对Hela和K562细胞增殖的抑制活性(±s,n=3)Tab 1 Inhibitory activity of target compounds against Hela celland K562 proliferation(±s,n=3)

表1 目标化合物对Hela和K562细胞增殖的抑制活性(±s,n=3)Tab 1 Inhibitory activity of target compounds against Hela celland K562 proliferation(±s,n=3)
化合物 IC50/(μmol/L)K562 Hela 1a >100 >100 1b 49.26 5.47 1c >100 7.16 1d 10.9 3.36 2a 3.09 82.4 2b 3.01 1.56 2c 5.34 >100 2d >100 4.78 VP-16 19.5 5.98
3 讨论
3.1 合成方法 根据化学合成中的逆推法,计划采用3种合成目标产物的方法,首先,由于4-甲酰基苯甲酸和4-甲酰基肉桂酸类化合物的甲酰基比较活泼,其羧基不能和氨基直接成酰胺,经缩合剂法或酰氯法成酰胺都失败,故选择化合物7和10为原料;其次,考虑如图2所示合成化合物1a的方法,由于中间体6属于氨基酸具有两性(酸性和碱性),既能溶于酸又能溶于碱,另外此类化合物具有溶解性差、不易分离以及反应复杂的特点,因而多次实验失败。最后设计如图2中所示路线,在氰基硼氢化钠的催化下经还原胺化,采用“一锅法”成功地合成仲胺和叔胺,其反应条件温和,后处理简单,产率高。
3.2 构效关系 化合物1d与2b比较,2b的活性较好,推测引入肉桂酰基具有较好的生物活性;化合物1d,2b对Hella和K562均显示较好的活性,提示引入异丙基可能提高细胞毒活性。以上两个系列化合物的构效关系正在进一步研究中。
[1] 刘长军,侯嵩生.抗癌活性物质鬼臼类木脂素的研究进展[J].天然产物研究与开发,1997,9(3):81
[2] 陈毓亨.我国鬼臼类植物资源的研究[J].药学学报,1979,14(2):101
[3] Lautens M,Fang Y Q.Synthesis of novel tetracycles via an intramolecular heck reaction with anti-hydride elimination[J].Org Lett,2003,5(20):3679
[4] Kamal A,Tamboli J R,Vishnuvardhan M V,et al.Synthesis and anticancer activity of heteroaromatic linked 4β -amido podophyllotoxins as apoptotic inducing agents[J].Bioorg Med Chem Lett,2013,23(1):273
[5] Zhang Z H,Zhang L M,Luo G,et al.Synthesis and biological evaluation of novel podophyllotoxin analogs as antitumor agents[J].J Asian Nat Prod Res,2014,16(5):527
[6] Cho S J,Tropsha A,Suffness M,et al.Antitumor agents.163. Three-dimensional quantitative structure-activity relationship study of 4'-O-demethylepipodophyllotoxin analogs using the modified CoMFA/q2-GRS approach[J].Med Chem,1996,39(7):1383
[7] Cheng W H,Cao B,Shang H,et al.Synthesis and evaluation of novel podophyllotoxin derivatives as potential antitumor agents[J]. Eur J Med Chem,2014,85:498
[8] 蒋卫华,崔爱军.肉桂酸合成方法研究进展[J].精细石油化工进展,2013,14(2):34
[9] 段华鑫,张殊佳,周鹏.喜树碱肉桂酸衍生物的合成及其抗肿瘤活性的研究[J].有机化学,2009,29(5):724
[10]卢娟,汪晖,卢方安.肉桂酸对胃腺癌细胞诱导分化的实验研究[J].中国药理学通报,2007,23(2):237
(2014-11-04收稿)
Synthesis and evaluation of novel podophyllotoxin derivatives as potential antitumor agents
SUN Qiang-wen1,2,WANG Jie1,CHEN Shou-qiang1,NIU Cong2,CAO Bo2,GAO Ying2,CHEN Hong1,2
(1.School of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics,Tianjin 300070,China;2.Department of Pharmacognosy,Logistic University of PAPF,Tianjin 300309,China)
Objective:To obtain novel podophyllotoxin derivatives with higher efficiency,lower toxicity and anti-multi-drug resistance.Methods:Derivatives of 4-formyl benzoicacid and 4-formyl-cinnamic acid in C-4 position of 4β-amino-pipodophyllotoxin were introduced;Hela cells and K562 were used to evaluate pharmacological activity in vitro.Results:Eight compounds by different methods were obtained,and all compounds were confirmed by MS and1HNMR validation.The compounds 1b,1d,2a and 2b had a good drug resistance in both Hela and K562 cell line.Conclusion:At C-4 position,podophyllotoxin introduced 4-formyl-benzoyl derivatives and 4-formyl-cinnamic acid derivatives can increase antitumor activities.
podophyllotoxin;benzoic acid;cinnamic acid;antitumor activity in vitro
R9
A
1006-8147(2015)04-0282-05
国家自然科学基金资助项目(30873363);天津市应用基础项目基金资助(08JCYBJC070000)
孙强稳(1990-),男,硕士在读,研究方向:天然产物结构改造;通信作者:陈虹,E-mail:chenhongtian06@163.com。

