加工贮藏对荷叶茶黄酮类总量及香气和色泽的影响
郭 强,刘宏图,覃小丽,刘 雄*
(西南大学食品科学学院,重庆 400715)
加工贮藏对荷叶茶黄酮类总量及香气和色泽的影响
郭 强,刘宏图,覃小丽,刘 雄*
(西南大学食品科学学院,重庆 400715)
分别以黄酮含量、黄酮溶出率及香气和色泽确定荷叶最优制茶工艺及荷叶茶的最佳冲泡条件;将制成的荷叶茶分别在贮藏0、6、12 个月时,联用固相微萃取法和气相色谱-质谱法分析其香气成分变化,并用色差仪测定其色泽变化。结果表明,盛开荷叶的黄酮含量最高,以此荷叶为原料,荷叶茶制作最佳加工工艺为:杀青条件640 W、90 s,烘干条件70 ℃,冲泡条件100 ℃、15 min;3 种贮藏期的荷叶茶共鉴定出102 种香气成分,随贮藏时间延长,主要香气物质种类下降,但相对含量升高。苯乙醇是贮藏中、后期荷叶茶的主要呈香物质,贮藏过程中还产生了异戊醇这种异味物质。贮藏最初6 个月内,荷叶茶L*、b*值显著降低,色泽变暗、变蓝,而至12 个月时有所回升,但a*值不断增大,绿度不断降低。
荷叶茶;黄酮;加工贮藏;气相色谱-质谱法;香气;色泽
荷叶是睡莲植物中国莲的叶片,生长于池塘、湖泊中,在我国大面积栽培,是药食两用植物[1-3]。黄酮类化合物是荷叶的主要功能性成分之一[4-5],具有抗菌、抗炎、抗氧化、抗衰老和清除自由基等功能[6-10]。Zhou Taoying等[11]研究发现荷叶黄酮能够控制血糖,并且能够调节血糖和血脂代谢。McCullough等[12]对美国心脏血管疾病患者研究发现,黄酮类物质摄入量与心脏血管疾病患者死亡风险呈负相关,因此长期摄入黄酮类化合物会有效预防 心脑血管疾病。随着现代人健康意识的提高,荷叶茶黄酮含量已成为荷叶茶品质的重要指标之一。张春花等[13]分析了不同地区原料加工的普洱茶的黄酮含量,发现相较原料,成茶黄酮含量均有不同程度的提高。白喜婷等[14]研究了杜 仲雄花茶加工过程黄酮含量的变化,发现杀青后黄酮含量下降,但初炒、精炒后又逐渐升高。因此,荷叶的黄酮含量受不同的加工工艺影响较大。
香气和色泽是评价茶叶品质的另外两个重要指标。傅水玉等[15]从荷叶中共检测出87 种香气组分,主要香气物质为烯醇类。张灵枝等[16]研究了贮藏时间为当年、6 a和25 a的普洱茶香气成分,发现随着贮藏时间延长,萜烯化合物及其衍生物的含量显著提高,但种类发生了明显的变化。Kuo Pingchun等[17]研究了新鲜乌龙茶和陈化乌龙茶的香气成分,也发现了明显的变化。另外,贮藏过程中,光、热、氧等因素会造成茶叶褪色、褐变等品质劣变[18]。
目前,关于加工工艺对荷叶茶黄酮的影响以及贮藏时间对荷叶茶香气以及色泽的影响未见报道,因此本研究以黄酮含量为指标,探究荷叶茶的最优加工工艺,并以黄酮溶出率为指标探究荷叶茶的最优冲泡条件。本研究还对不同贮藏时间的成品荷叶茶进行香气和色泽的测定,对荷叶茶将来的开发有一定指导意义。
1 材料与方法
1.1材料与试剂
新鲜荷叶,采于西南大学北区文渊湖;荷叶茶 重庆君亲食品有限公司。
芦丁(标准品)、亚硝酸钠、氢氧化钠、硝酸铝、等均为分析纯。
1.2仪器与设备
DHG-9140A型电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;HH-6型数显恒温水浴锅 金坛市富华仪器有限公司;FA2004型电子天平 上海恒丰科学仪器有限公司;1-15PK型离心机 美国Sigma公司;DF8517型冰箱(-80 ℃) 韩国Ilshin公司;722型分光光度计 上海精科科学仪器厂;SHZ-III型循环水真空泵 上海亚荣生化仪器厂;JYL-C012型高速粉碎机九阳股份有限公司;QP2010/PLUS型气相色谱-质谱联用仪 日本岛津国际贸易(上海)有限公司;UltraScan PRO型测色仪 美国HunterLab颜色管理公司。
1.3方法
1.3.1荷叶茶主要制备工艺优化
1.3.1.1原料预处理
采摘不同成熟度、新鲜的且无病虫害、大小均匀的荷叶,通风至表面干燥。测定黄酮含量,含量最高者作为荷叶茶原料。
1.3.1.2微波杀青
考察微波杀青条件(微波功率和时间)对荷叶的黄酮含量及色泽、香气感官评定的影响。
1.3.1.3干燥
荷叶在不同温度(50~80 ℃)条件下烘干,并将其干燥后含水量控制至5%,测定烘干后其黄酮含量,考察烘干温度对荷叶中黄酮含量的影响。
1.3.2荷叶茶冲泡
称取上述最优工艺制成的荷叶茶36 份,每份0.5 g,在温度(100、90、80 ℃)和时间(5、10、15、20 min)的条件下分别进行一次泡制,考察冲泡条件对黄酮溶出率的影响。黄酮的提取与测定参照文献[19]进行。基于一次冲泡的优化条件,考察冲泡次数对黄酮溶出率的影响。
1.3.3贮藏时间对荷叶茶香气成分的影响
制成的荷叶茶于仓库中常温贮藏,分别于0、6、12个月取样,进行香气成分分析。
1.3.3.1样品萃取
精确称取3.000 g荷叶茶样品均匀粉末,置于20 mL 固相微萃取(solid-phase micro-extraction,SPME)采样瓶中,在60 ℃水浴条件下,插入装有2 cm 50/30 μm DVB/CAR/PDMS StableFlex纤维头的固相微萃取仪进行萃取,保持时间为30 min,然后快速取出,脱附2 min后,插入气相色谱-质谱进样口。
1.3.3.2气相色谱-质谱条件
色谱柱:HP-1NNOWAX(25 m×0.25 mm,0.2 μm),柱温40 ℃。色谱条件:进样温度250℃,不分流。升温程序:起始温度40 ℃,以5 ℃/min升温至80 ℃,保持3 min,再以10 ℃/min升温至110 ℃,保持1 min,然后以5 ℃/min升温至128 ℃,保持5 min,最后以10 ℃/min升温至230 ℃,保持5 min。载气为He。
质谱条件:电离方式:电子电离源,电离电压50 eV,接口温度230 ℃,扫描范围为40~400 u。
1.3.3.3样品测定分析
每个样品均测定3 次,通过计算机在图谱库NIST 08.LIB和NIST 08s.LIB中进行相关性的检索和分析,用面积归一化法计算各组分的相对含量百分比。
1.3.4贮藏时间对荷叶茶色泽的影响
取不同贮藏时间(0、6、12 个月)的荷叶茶样品直接在测色仪上测定,记录下L*、a*、b*值,每个样品不同部位测定10 次,采用SPSS 22.0中的单因素ANOVA进行方差分析,Tukey HSD进行显著性分析(P<0.01差异极显著,0.01<P<0.05差异显著)。
2 结果与分析
2.1制茶工艺参数对荷叶茶品质的影响
2.1.1不同成熟度荷叶黄酮含量

表1 不同成熟度荷叶的黄酮含量Table 1 Flavonoids contents of lotus leaves with different degrees of maturity mg/g
由表1可知,黄酮含量随荷叶的成熟不断增加,在盛开时达到顶峰,荷叶开始衰老后,黄酮含量也开始下降。盛开荷叶的黄酮含量最高,达到了44.16 mg/g,未张开荷叶黄酮含量最低,仅为盛开荷叶黄酮含量的59.06%,不同成熟度荷叶的黄酮含量差异均达到极显著水平。因此,选择盛开荷叶作为制茶原材料。
2.1.2杀青条件对荷叶 茶感官评价的影响

表2 不同杀青条件下荷叶茶的感官评价Table 2 Sensory evaluation of lotus leaf tea under different fixation conditions
由表2可知,杀青条件为400 W、90 s的荷叶茶,由于杀青功率小和时间短,致酶失活程度较小,呈现青气、翠绿,评分最低。杀青条件为800 W、180 s的荷叶茶,由于杀青功率大和时间长,杀青程度过高,致使香气呈现高火、黄绿,评分低。因此,选择功率低、时间短和功率高、时间长的杀青条件均会降低杀青叶的感官评价。杀青条件的选择还需结合荷叶杀青后的黄酮含量综合评定。
2.1.3主要制茶工艺及泡制条件的选择
由图1a可知,在一定的微波功率条件下,黄酮含量随着微波时间的延长而下降,640 W、90 s杀青条件下的黄酮含量最高,达到了255.38 mg/g,并且此条件下的杀青荷叶感官评价高达90分,在所有9 组处理当中评分最高(表2),因此选择640 W、90 s的条件进行微波杀青。杀青后的荷叶分别在50、60、70、80 ℃条件下烘干至含水量5%,测得黄酮含量如图1b所示,发现烘干温度为70 ℃时,荷叶黄酮含量最高,比其他温度烘干后的荷叶黄酮含量均高出24%以上,因此选择在70 ℃条件下烘干。
经过以上优化工艺制成的荷叶茶在不同的冲泡条件下冲泡后的黄酮溶出率如图1c和d所示,由图1c可知,冲泡温度一定时,随着冲泡时间的延长,黄酮溶出率不断增加,在15 min时溶出率达到最高,冲泡时间继续延长至20 min,黄酮溶出率下降,这可能是因为长时间处于高温环境中,黄酮稳定性下降,被氧化导致损失[20-21]。由图1d可知,随着冲泡次数的增加,黄酮溶出率增加,但是增加的趋势逐渐放缓,冲泡第3次时仅有1.61%的黄酮溶出,仅为一泡黄酮溶出量的9.76%。因此,荷 叶茶的最佳冲泡条件为100 ℃、15 min,冲泡时间不宜过长,冲泡次数在3 次以内为佳。

图1 制茶及泡茶工艺优化Fig.1 Optimization of processing and brewing conditions for lotus leaf tea
2.2贮藏期间荷叶茶的香气和色泽变化
2.2.1贮藏时间对荷叶茶的香气成分的影响
贮藏时间为0、6、12 个月的荷叶茶的SPME萃取物总离子流图见图2,经仪器谱库检索(匹配度均在90%以上),组分的相对含量按面积归一化法计算得出,其分析结果见表3。

图2 贮藏时间为0(a)、6(b)、12(c)个月的荷叶茶SPME萃取物总离子流图Fig.2 Total ion chromatograms of SPME extracts from lotus leaf tea stored for 0 (a), 6 (b) and 12 (c) months

表3 荷叶茶挥发性组分及相对含量Table 3 Volatile compounds and their relative contents in lotus leaf tea %
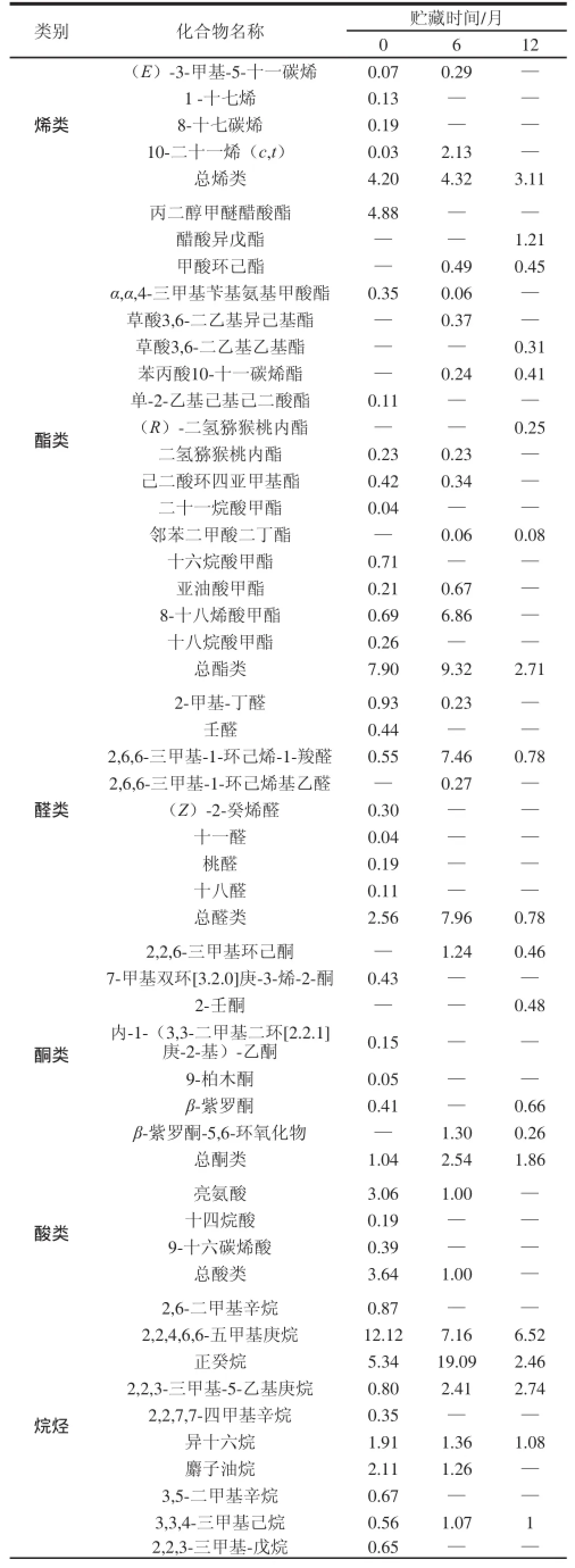
续表3%
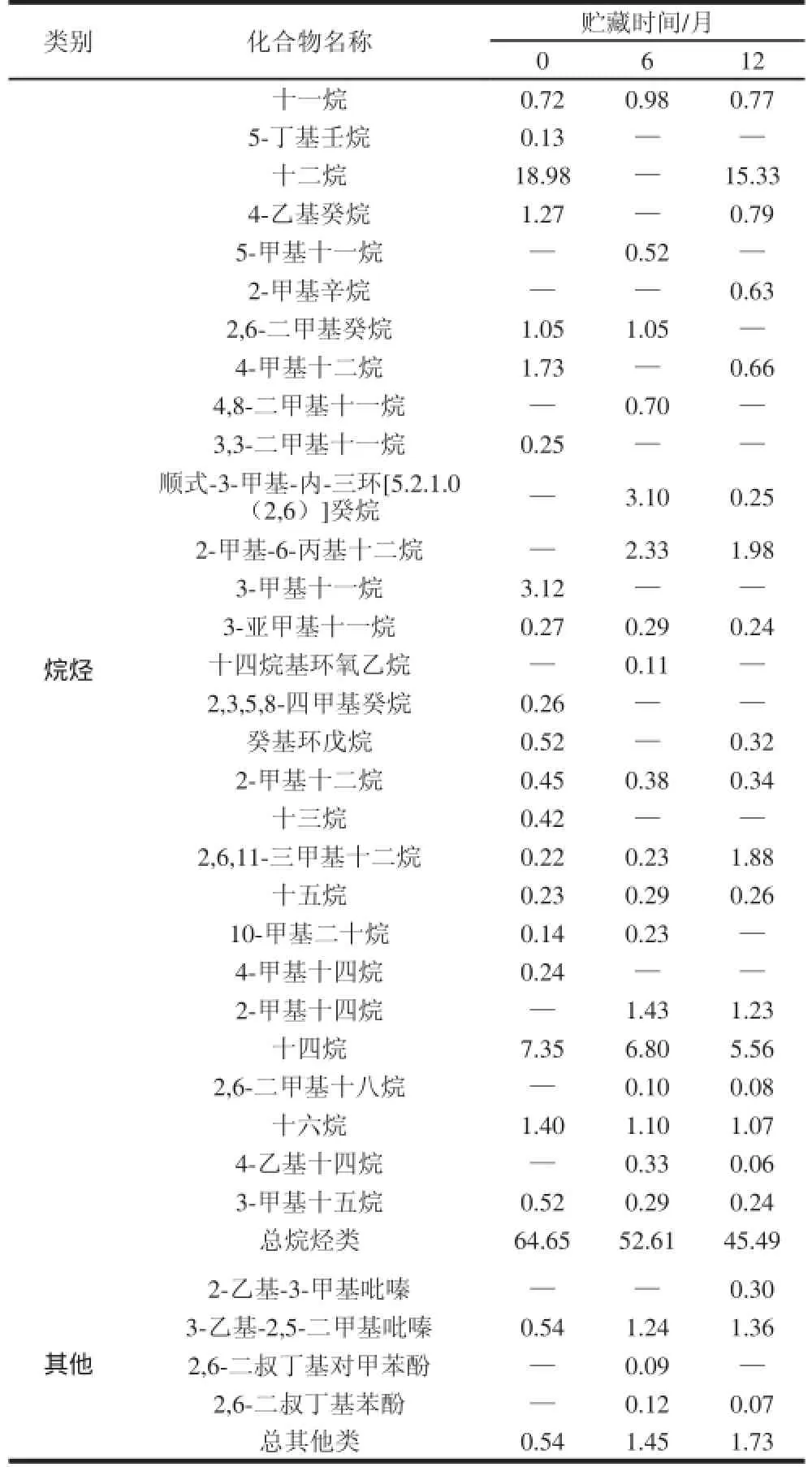
续表3%
由表3可知,3 种不同贮藏时间的荷叶茶共鉴定出102 种化合物,因烷烃类物质对香气的贡献较小,不将其作为重点讨论。除去烷烃类,荷叶茶在贮藏过程中,香气物质种类逐渐下降,分别为39、34、26 种,而香气物质相对含量在0~6 个月内上升,6~12 个月内略有下降,分别为24.71%、38.21%、34.09%。新鲜荷叶茶中醇、醛、酯、烯、酮、酸类含量分布相对平均,无含量较突出的种类,香气较为全面。随着贮藏时间延长至6 个月,醇、酯、醛类相对含量均上升,酸类下降,其他成分变化不显著,香气成分保持全面的同时,强化了醇、酯、醛类的香气。随着贮藏时间延长至12 个月,酯、醛类含量显著下降,酸类继续下降至消失,而醇类含量继续显著上升,因此,贮藏12 个月的荷叶茶香气较为单一,集中在醇类物质中,其他成分贡献较少。
在酯类物质方面,丙二醇甲醚醋酸酯是新鲜荷叶茶中特有的香气成分,含量达到了4.88%,贮藏6、12 个月的荷叶茶中均为检出。醋酸异戊酯是贮藏12 个月荷叶茶独有的香气成分,它有类似于香蕉的香气[22]。8-十八烯酸甲酯在0~6月的贮藏期中显著增加,而到12 个月时消失。在醇类方面,异戊醇、甲基异丙烯基甲醇、苯甲醇、3,4-二甲基环己醇、苯乙醇均随着贮藏时间的延长不断增加,其中,苯甲醇和苯乙醇含量在贮藏12 个月时分别达到最高的3.69%和12.29%,在贮藏12 个月荷叶茶香气中贡献十分突出,苯甲醇和苯乙醇均为玫瑰花赋香成分[23],具有柔和、愉快而持久的玫瑰香,这与感官感受一致。另外,荷叶茶在贮藏过程中也产生了异戊醇这种有不愉快气味的醇类物质,使荷叶茶香气不够纯正。在酸类方面,随着贮藏时间的延长,亮氨酸含量不断下降,12 个月时消失。而亮氨酸是发酵过程中细胞合成异戊醇的关键物质[24],因此荷叶茶在贮藏过程中异戊醇的产生和亮氨酸含量的下降可能与此过程有关,需要对荷叶茶进行良好的杀菌及控制贮藏条件等来防止异戊醇的产生。在醛类方面,β-环柠檬醛是贮藏6个月荷叶茶的重要香气组成物质,在新鲜荷叶茶和贮藏12 个月荷叶茶中含量均非常低,它具有凉香、果香和清香,赋予贮藏6 个月荷叶茶独有的清新香气。烯类、酮类等其他类物质含量低且随着贮藏期的延长,变化不明显,因此对香气的感官感受影响不大。
2.2.2贮藏时间对荷叶茶色泽的影响

表4 不同贮藏时间下荷叶茶色泽的变化Table 4 Color change of lotus leaf tea at different storage times
由表4可以看出,荷叶茶贮藏期从0个月延长至6 个月时,L*值降低,色泽变暗淡,变化显著。贮藏至12 个月时,L*值略升高,亮度有所回升,但变化不显著。a*值随贮藏期的延长不断升高,变化均显著,表明荷叶茶红度不断升高,绿色变浅,这可能是因为贮藏过程中由于光照、氧气和酸等的作用,叶绿素发生分解脱镁,变成褐色物质所致[20]。因此,贮藏初期的荷叶茶褪绿和变暗可能均和叶绿素的分解有关,所以如何保护好叶绿素不被分解对于荷叶茶的护色有重要的意义。对于b*值,最初6 个月贮藏期内显著降低,黄色变浅,蓝色加深,贮藏12 个月时b*值有所升高,黄色回升。
3 结 论
最优制茶工艺为:盛开荷叶的黄酮含量最高,以此荷叶为原料,杀青条件640 W、90 s,烘干条件70 ℃,荷叶茶中的黄酮含量及感 官评价较高;冲泡条件100 ℃、15 min,冲泡3 次以内为佳。
贮藏时间对荷叶茶香气影响较大,随着贮藏时间延长,主要香气种类减少,但相对含量升高,感官香气变浓郁。苯乙醇是贮藏中后期荷叶茶的主要呈香物质。贮藏过程中还产生了异戊醇这种异味物质,需要进一步采取措施进行预防。
贮藏6和12 个月的荷叶茶色泽可观性均不如新鲜荷叶茶,但贮藏后期色泽可观性有微小回升,今后研究中需要采取措施避免叶绿素的分解。
[1] 张蕾, 吴华勇, 邓丹雯, 等. 微波辅助干燥荷叶茶的新工艺研究[J].食品科技, 2011, 36(4): 295-298.
[2] 张婉婷, 王登良. 荷叶茶的研究进展[J]. 广东茶业, 2010(5): 19-22.
[3] 周勇. 荷叶抗氧化活性的研究[D]. 合肥: 安徽农业大学, 2012.
[4] 大西栄子, 山田和雄, 山田俊雄, 等. Comparative effects of crude drugs on serum lipids[J]. Chemical and Pharmaceutical Bulletin, 1984,32(2): 646-650.
[5] la COUR B, MØLGAARD P, YI Z. Traditional Chinese medicine in treatment of hyperlipidaemia[J]. Journal of Ethnopharmacology, 1995,46(2): 125-129.
[6] 宣以巍, 刘英, 江萍, 等. 柑橘类黄酮的生理活性及其研究现状[J].科技通报, 2008, 24(4): 494-497.
[7] KUROWSKA E M, MANTHEY J A. Hypolipidemic effects and absorption of citrus polymethoxylated fl avones in hamsters with dietinduced hypercholesterolemia[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 2879-2886.
[8] JIANG Yihong. Optimum extracting technology of flavonoids in lotus leaves with ethanol[J]. Transactions of the Chinese Society of Agricultural Engineering, 2004, 20( 4): 168-171.
[9] 邓胜国, 邓泽元, 黄丽. 荷叶黄酮体外抗氧化活性的研究[J]. 食品科技, 2006, 31(7): 274-276.
[10] 陈海光, 曾庆孝. 荷叶功能成分的提取及其对自由基清除作用的研究[J]. 食品与发酵工业, 2001, 27(10): 34-38.
[11] ZHOU Taoying, LUO Denghong, LI Xingyuan, et al. Hypoglycemic and hypolipidemic effects of fl avonoids from lotus (Nelumbo nufi cera Gaertn) leaf in diabetic mice[J]. Journal of Medicinal Plants Research,2009, 3(4): 290-293.
[12] McCULLOUGH M L, PETERSON J J, PATEL R, et al. Flavonoid intake and cardiovascular disease mortality in a prospective cohort of US adults[J]. The American Journal of Clinical Nutrition, 2012, 95(2):454-464.
[13] 张春花, 单治国, 周红杰. 云南普洱茶加工中黄酮类化合物的研究[J].贵州茶叶, 2008(1): 7-9.
[14] 白喜婷, 朱文学, 罗磊, 等. 杜仲雄花茶加工过程中总黄酮含量变化分析[J]. 食品科学, 2009, 30(12): 262-265.
[15] 傅水玉, 黄爱今, 刘虎威, 等. 荷叶香气成分的研究(Ⅰ): 荷叶天然香气成分的分析[J]. 北京大学学报: 自然科学版, 1992(6): 699-705.
[16] 张灵枝, 王登良, 陈维信, 等. 不同贮藏时间的普洱茶香气成分分析[J].园艺学报, 2007, 34(2): 504-506.
[17] KUO Pingchun, LAI Yanyu, CHEN Yingjie, et al. Changes in volatile compounds upon aging and drying in oolong tea production[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 293-301.
[18] 马惠民, 王琦, 钱和. 绿茶色泽的影响因素及改进措施[J]. 食品工程,2012(3): 26-28.
[19] 张赟彬, 李彩侠, 李军, 等. 荷叶黄酮提取工艺研究[J]. 食品研究与开发, 2005, 26(5): 92-94.
[20] 王英, 张玉刚, 戴洪义. 苹果果皮中类黄酮的超声波辅助提取及稳定性研究[J]. 食品科学, 2011, 32(16): 178-181.
[21] 熊力夫, 邹亲朋, 叶惠煊, 等. 湘葛一号葛根活性物质提取制备葛根功能饮品研究[J]. 湖南林业科技, 2013, 40(4): 33-38.
[22] 靳通收, 王贵文, 李英. 阳离子交换树脂催化合成醋酸异戊酯的研究[J]. 日用化学工业, 1994(1): 44-45.
[23] 姚卫蓉, 陈军杰, 钱和. 玫瑰花中键合态和游离态组分的分析[J]. 食品科学, 2008, 29(11): 487-492.
[24] ESPINOSA V E, MORAIS M A, FRANÇOIS J M, et al. Biosynthesis of higher alcohol flavour compounds by the yeast Saccharomyces cerevisiae: impact of oxygen availability and responses to glucose pulse in minimal growth medium with leucine as sole nitrogen source[J]. Yeast, 2015, 32(1): 47-56.
[25] 乔吉滨, 白超, 李树永, 等. 绿色蔬菜罐藏食品保色工艺的研究[J].食品工业科技, 1993, 14(2): 9-l1.
Effect of Processing and Storage on Flavonoids Content, Aroma Components and Color of Lotus Leaf Tea
GUO Qiang, LIU Hongtu, QIN Xiaoli, LIU Xiong*
(College of Food Science, Southwest University, Chongqing 400715, China)
Based on the content and dissolution rate of fl avonoids, aroma and color, this study investigated the optimization of processing and brewing conditions for lotus leaf tea. Lotus leaf tea was stored for 0, 6, and 12 months, and their aroma components were extracted by solid-phase micro-extraction (SPME) and analyzed by gass chromatography-mass spectrometry (GC-MS). Color changes of lotus leaf tea were also measured using a color difference meter. The highest content of fl avonoids was found in the full-bloom lotus leaves. The optimized conditions for processing lotus leaf tea were determined as fi xation by microwave irradiation at 640 W for 90 s and drying at 70 ℃; and the optimized brewing conditions were 100 ℃ for 15 min. A total of 102 aroma components were identifi ed in lotus leaf tea after three storage periods. As the storage time prolonged, the number of main aroma components decreased, but their relative contents increased. Benzyl alcohol was the main aroma component in lotus leaf tea stored for 6 and 12 months. Moreover, isoamylol responsible for the unpleasant odor was generated during storage. During the fi rst 6 months of storage, the L* and b* values of lotus leaf tea remarkably decreased, as the color became dimmer and was changed to blue, and the L* and b* values increased slightly at the last stage of storage. While the a* value increased continuously in the whole storage period, the greenness decreased continuously.
lotus leaf tea; fl avonoid; processing and storage; GC-MS; aroma; color
TS207.3
A
1002-6630(2015)18-0272-06
10.7506/spkx1002-6630-201518051
2014-12-18
郭强(1990—),男,硕士研究生,研究方向为食品化学与营养学。E-mail:1024cool@163.com
刘雄(1970—),男,教授,博士,研究方向为碳水化合物功能与利用、食品营养学。E-mail:liuxiong848@hotmail.com

