响应面试验优化丹参中多糖的超声波提取工艺及其抗氧化活性
王燕华,武福华,郭昭涵,彭明星,宋万华,夏 敏,梁子安,张乃群
(南阳师范学院生命科学与技术学院,河南 南阳 473061)
响应面试验优化丹参中多糖的超声波提取工艺及其抗氧化活性
王燕华,武福华,郭昭涵,彭明星,宋万华,夏 敏,梁子安,张乃群
(南阳师范学院生命科学与技术学院,河南 南阳 473061)
以丹参为原料,利用超声波提取丹参多糖。在单因素试验的基础上,应用Box-Behnken试验设计软件对超声时间、超声功率、颗粒大小工艺条件进行分析与优化。同时,以1,1-二苯基-2-三硝基苯肼自由基清除能力、增强内皮细胞内超氧岐化酶的能力评价超声波法提取丹参多糖的抗氧化活性。结果表明:超声波提取丹参多糖的最优提取条件为超声功率212 W、超声时间18 min、颗粒大小55目,此条件下多糖提取率可达4.73%。抗氧化实验结果表明,丹参多糖有一定抗氧化活性。超声波浸提法相对单纯热水浸提法可以有效地缩短多糖提取时间,节约能源成本和时间,同时多糖活性更高。
丹参;超声提取;多糖;响应面优化;抗氧化
随着中国社会经济的迅猛发展,人们对于饮食的要求早已不仅仅满足于温饱。科学的预防保健措施可以有效减少各种慢性病,提高生活质量[1-2]。中医药养生保健理论在我国由来已久,自古便有“药食同源”一说[3]。据1996—2005年间的获批的7 732 个保健食品中,其原材料中属于卫生部公布的药食同源类原料使用频次达9 008 次[4]。丹参(Salvia miltiorrhiza Bunge)又名赤参、紫丹参、红根等,为唇形鼠尾草属植物。其具有祛瘀止痛、活血通经之功效[5]。目前临床中广泛应用在与心血管相关的各种疾病中,如心绞痛、高血压等[6-8]。而日常生活中作为保健食品可以应用在茶饮、药膳、足浴,甚至提取红色素满足人们对于天然健康的食品添加剂的需求[10-11]。
已有研究[12]表明氧化应激是导致心血管系统结构、功能异常的重要原因之一。而氧化应激是氧自由基过量生成或聚集导致的。丹参作为治疗心血管疾病的药物之一,其黄酮类、丹酚酸类物质的抗氧化活性已有研究报道[13-14]。本实验对丹参中多糖类成分进行提取和抗氧化研究,以便进一步开发丹参资源利用的新途径。
1 材料与方法
1.1材料与试剂
丹参药材由南阳张仲景大药房提供,南阳师范学院武福华博士鉴定为为唇形科植物丹参Salvia miltiorrhiza Bge.干燥根茎。
乙醇、丙酮、三氯乙酸、正丁醇、浓硫酸、苯酚(重蒸酚)、30%双氧水均为国产分析纯;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)北京索莱宝科技有限公司;细胞活力检测试剂盒(Cell counting kit-8,CCK-8) 南京建成生物工程研究所。
1.2仪器与设备
FW-200型高速万能粉碎机 北京中兴伟业仪器有限公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司;BS100S型电子天平 北京赛多利斯天平有限公司;KQ-700DE型数控超声波清洗器 昆山市超声仪器;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;KDC-40低速离心机、HC-2516高速离心机科大创新股份有限公司中佳分公司。
1.3方法
1.3.1丹参多糖的提取工艺流程
干燥丹参→粉碎或粉→工业乙醇回流脱脂→干燥脱脂样品→加适量蒸馏水→超声波提取→抽滤→上清液液浓缩→乙醇沉淀→3 000 r/min离心→弃上清液取沉淀→适量水溶解沉淀脱蛋白→3 000 r/min离心→上清液浓缩→冷冻干燥→得丹参多糖。
1.3.2丹参多糖含量的测定
丹参多糖的测定采用改进的苯酚-硫酸法[15]。精确称取105 ℃干至质量恒定的葡萄糖标准品25 mg,用蒸馏水定容至250 mL容量瓶,摇匀,分别吸取0、0.2、0.4、0.6、0.8、1.0 mL置于干燥试管,分别加水至1.0 mL,再分别加入1.0 mL的5%苯酚溶液,再加5.0 mL浓硫酸混合均匀后40 ℃水浴30 min,取出后室温冷却15 min,在485 nm波长处测定吸光度,以蒸馏水按照同样显色操作为空白,绘制标准曲线。得到吸光度A与测试液多糖质量(μg)的线性方程:y=0.009 1x+0.008 1,R2=0.998 1。
1.3.3单因素试验
准确称取丹参粉末10.0 g,置于500 mL烧杯中,用蒸馏水作为提取溶剂进行超声波提取。在其他条件相同的情况下,采用不同的超声时间、超声功率、颗粒大小进行超声波提取试验,以丹参多糖得率为响应值,逐个考察各因素条件对提取效果的影响。
1.3.4丹参多糖提取工艺的响应面优化
根据单因素试验结果,选择超声时间、超声功率、颗粒大小为主要因素,利用Design-Expert 8.0.6软件设计三要素三水平响应面试验,并对试验结果进行回归和优化。
1.3.5抗氧化活性的测定
1.3.5.1DPPH自由基清除率的测定
分别将稀释成5 组不同质量浓度的0.5 mL多糖提取液和VC溶液与1.0 mL 95% DPPH乙醇溶液混匀,以95%乙醇溶液为空白对照,在37 ℃反应60 min后,测定517 nm波长处的吸光度[16]。DPPH自由基清除率按如下公式进行计算:

式中:A0为2.0 mL DPPH溶液和2.0 mL无水乙醇的吸光度;Aa为2.0 mL DPPH溶液和2.0 mL丹参多糖溶液的吸光度;Ab为2.0 mL丹参多糖溶液和2.0 mL无水乙醇的吸光度。
1.3.5.2内皮细胞内超氧化物歧化酶(superoxide dismutase,SOD)活性的测定
采用ELASA法,人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)种于96 孔板中,每组8 个孔,分为4 组:1)对照组:HUVECs培养在不含血清的M199培养液中;2)H2O2处理组:HUVECs培养在含有300 μmol/L的H2O2的M199培养液中4 h;3)多糖处理组:HUVECs培养在加入600 μg/mL多糖的M199培养液中,培养12 h后再加300 μmol/L的H2O2孵育4 h;各组细胞细胞培养处理后,严格按照SOD检测试剂盒说明书操作。每孔细胞加入50 μL裂解液制备细胞裂解液,然后分别吸取20 μL样品,与酶工作液20 μL和200 μL底物应用液,对照管加入50 μL双蒸水。混匀以后,37 ℃孵育20 min,在450 nm波长处SOD的吸光度[17]。按照上述步骤做3 次。
1.4数据分析
采用Excel 2007对单因素试验中的各因素进行比较分析。各组间实验数据以表示。采用Design-Expert 8.0数据处理专家进行响应面试验设计和分析,所有实验均重复3 次。
2 结果与分析
2.1超声时间对多糖得率的影响
在料液比1∶20(g/mL)、超声功率200 W、颗粒大小40目条件下,分别经超声处理10、20、30、40、50 min后,提取多糖,分析超声波处理时间对多糖得率的影响,如图1所示。

图1 超声时间对多糖得率的影响Fig.1 Effect of ultrasonic treatment time on the extraction yield of polysaccharides
由图1可知,随着超声时间的延长,多糖得率呈先升高再下降的趋势,在接近30 min时会有峰值,超声波处理时间大于30 min,丹参多糖的提取得率有下降趋势。这可能和超声时间过长,释放出的热量会使的反应体系的温度升高,引起多糖高温分解有关。同时如果超声波处理时间短,不利于丹参组织细胞的破碎和内容多糖的溶出。考虑时间和成本因素,提取时间选择10~30 min之间。
2.2超声功率对多糖得率的影响
在料液比1∶20(g/mL)、颗粒大小40 目条件下,分别经超声功率为100、200、300、400、500 W处理10 min之后,提取多糖,分析超声功率对多糖得率的影响,如图2所示。

图2 超声功率对多糖得率的影响Fig.2 Effect of ultrasonic power on the extraction yield of polysaccharides
由图2可知,多糖得率随着超声功率的增大呈先逐渐提高而后缓慢降低的趋势,在超声功率低于200 W时,多糖得率随着超声功率增大而提高,在超声功率高于200 W时多糖得率又随着超声功率的增大而略有降低,可能是由于大功率的物理剪切作用使多糖的糖苷键被打断,多糖结构被破坏,在后处理中造成了损失,使多糖得率降低。在试验过程中,随着超声功率的增加,出现多糖糊化的现象[17]。因此响应面软件优化时超声功率选择应以100~300 W为宜。
2.3颗粒大小对多糖得率的影响
在料液比1∶20(g/mL)条件下,颗粒大小为0(未粉碎)、40、80、100、200 目,分别经超声功率200 W处理10 min之后,提取多糖,分析颗粒大小对多糖得率的影响,如图3所示。

图3 颗粒大小对多糖得率的影响Fig.3 Effect of raw material partical size on the extraction yield of polysaccharides
由图3可知,多糖的得率随着颗粒大小的增大呈现出先增大再减小的趋势,在80 目附近有最大值,随着丹参粉碎程度的增大,即丹参粉末颗粒的减小,多糖溶出的更充分,当丹参颗粒大小在80 目以上的时候,多糖的得率有下降的趋势,可能是由于丹参颗粒越细,超声波越易破坏多糖结构,且过细的丹参粉末极易结块,反而阻碍了多糖的溶出。综合实际条件,选择颗粒度为0~80 目最宜。
2.4丹参多糖提取工艺的响应面优化[18]
2.4.1回归模型的建立
由Box-Behnken试验设计,在单因素试验基础上选取超声功率、超声时间和颗粒大小3 个因素进行响应面分析,以丹参多糖得率为响应值,试验结果见表1。

表1 Box-Behnken试验设计方案与结果Table 1 Box-Behnken design and corresponding experimental results
每个组合重复试验3 次,取其平均值作为丹参多糖得率结果,采用Design-Expert 8.0.6.1软件分析试验结果。对表1试验结果进行多元回归拟合,得丹参多糖得率对超声功率(A)、超声时间(B)和颗粒大小(C)的二次多项式回归模型:

对回归模型进行方差分析和系数显著性检验,结果如表2所示。
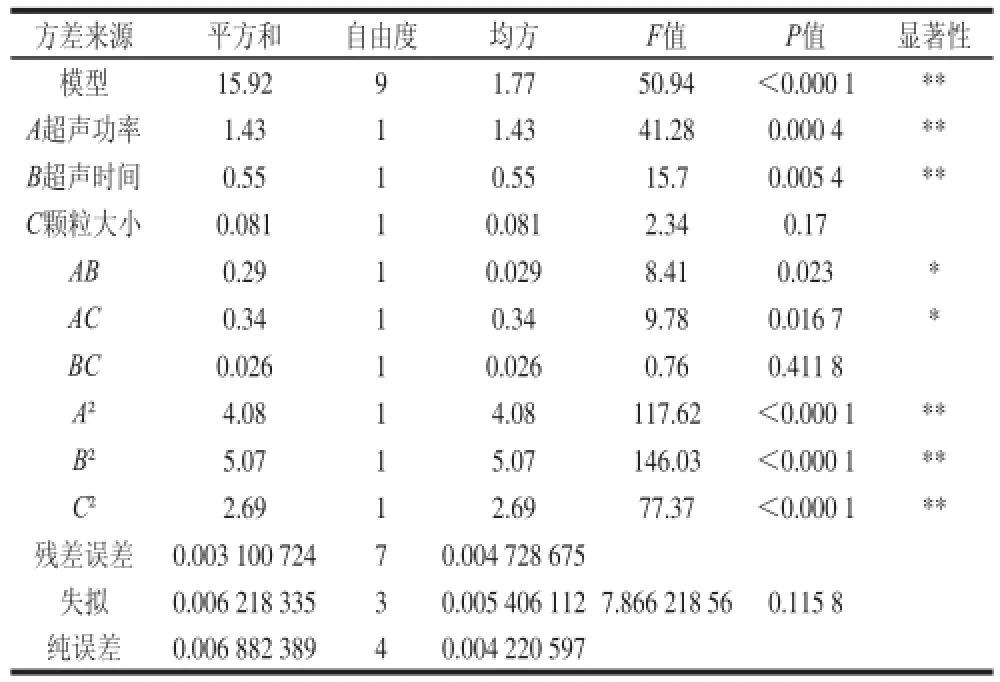
表2 回归模型的方差分析及回归系数的显著性检验Table 2 Analysis of variance for the established regression model
由回归模型方差分析的结果(表2)可以看出,模型显著性极高,失拟项检验P值不显著,表明模型不失拟;同时经显著性检验表明,该模型的相关系数R2=0.985 0,说明该模型与实际试验拟合较好,自变量与响应值线性关系显著[18]。意味着所建立的回归二次模型成立,可用此模型来分析和预测超声波提取丹参多糖的工艺条件。从回归模型系数显著性检验结果可得知:超声功率、超声时间一次项,超声功率、超声时间和颗粒大小的二次项的P值均小于0.01,说明对提取丹参多糖得率的影响极显著,而超声功率和超声时间、超声功率和颗粒大小的交互项P值小于0.05,说明对提取丹参多糖得率的影响显著。对提取丹参多糖得率的影响的主次因素依次为超声功率>超声时间>颗粒大小。
2.4.2模型双因素交互作用分析
由方差分析可知,超声功率与超声时间以及超声功率与颗粒大小的交互作用对多糖得率有显著的影响,用Design-Expert 8.0.6.1软件根据相应绘制AB、AC的响应面分析图,如图4所示。


图4 因素交互作用响应面图Fig.4 Response surface plots showing the interactive effects of factors on the extraction yield of polysaccharides
从表2的P值和图4a可知,超声功率和超声时间交互作用为显著水平(P<0.05)。在当超声功率一定时,随着超声时间的延长,丹参多糖得率呈现先增加后减少的趋势。这可能是由于超声波对于丹参颗粒细胞壁的破碎需要一定的反应时间,随着超声时间的延长,细胞壁破碎到一定程度,组织释放到反应体系中的多糖量随之增加。但超声时间的延长同时带来大量热量的释放,而溶液温度的上升,反而会造成部分多糖的降解,减少最终的多糖提取率[19]。当超声时间一定时,随超声功率的增加,丹参多糖得率也呈现先升高后降低的趋势。这是因为功率的增加,意味着丹参组织细胞壁的破碎程度和细胞内容物释放速率的增加,从而提高多糖得率。但功率增加到一定程度,同样会增加热量的释放,引起多糖的降解,而且超声空化作用的增强,还有可能对大分子质量的多糖产生剪切效应,改变多糖的结构。由图4b同样可以观察到类似的结果,超声时间固定,随着超声功率和颗粒度两个因素水平的增加,多糖得率同样呈现先提高后减小的趋势,当超声功率为212 W、颗粒度为55 目时,反应环境对多糖得率的影响相对较小。
2.4.3验证实验
对试验模型进行分析,得出丹参多糖提取最优工艺参数为超声功率212 W、超声时间18 min、颗粒大小55 目。取10 g丹参粉末,按照上述最优条件,重复5 次实验,结果多糖得率为(4.73±0.38)%,与理论值4.85%相近,验证了响应面设计的准确性。
2.5丹参多糖清除DPPH自由基能力

图5 丹参多糖对于DPPH自由基的清除能力Fig.5 DPPH radical scavenging activity of polysaccharides from Salvia miltiorrhiza Bge.
由图5可知,丹参多糖对DPPH自由基清除的能力随着样品质量浓度的增加而升高。与质量相同浓度的VC对照品相比,丹参多糖对DPPH自由基的清除能力相对较弱。但同等质量浓度情况下,超声提取的丹参多糖的清除能力明显高于用热水提取的丹参多糖,增加幅度约15%。
2.6血管内皮细胞SOD活力测定

图6 丹参多糖对于HUVECs中SOD释放的影响Fig.6 Infl uence of polysaccharides from Salvia miltiorrhiza Bge. on SOD release in HUVECs
各组细胞经处理以后,用细胞裂解液破碎随后按照试剂盒说明测量各组内皮细胞内部SOD释放量,结果如图6所示。与对照组相比,H2O2处理以后,细胞内SOD活力减少(P<0.01)。与H2O2相比,丹参多糖处理组的内皮细胞内SOD活力明显增加(P<0.01)。结果表明丹参多糖,可以明显增加血管内皮细胞中被H2O2所抑制的SOD活力。
3 结 论
超声波在液体中具有分散效应,使液体产生空化作用,通过高强度的剪切力使空腔膨胀、爆炸从而使液体中的固体颗粒或细胞组织破碎[20]。同时超声波在液体中传播时产生的剧烈扰动,也可以让液体中的颗粒加速相互碰撞而击碎。而细胞或组织破碎程度的增加,有助于细胞内容物的流出而溶解在溶剂中。本实验利用超声波提取法提取丹参多糖,在单因素试验的基础上,应用Box-Behnken试验设计软件对超声时间、超声功率、颗粒大小工艺条件进行分析与优化[21]。通过分析各因素的显著性和交互作用,结果表明超声功率、超声时间一次项,超声功率、超声时间和颗粒大小的二次项,超声时间与功率、超声功率和颗粒大小的交互项对丹参多糖得率的影响都为显著水平。在3 个影响因素中,超声功率对多糖 得率的影响最大。同时得到超声波提取丹参多糖的最优工艺参数为为超声功率212 W、超声时间18 min、颗粒大小55 目。工艺验证结果为多糖得率(4.73±0.38)%。
丹参作为药品和保健品已广泛应用于心血管疾病的预防、治疗甚至急救。动脉粥样硬化作为心血管疾病的重要类别,其病理发生起始阶段一个重要影响因素就是患者血浆中脂质过氧化物含量升高,而清除氧自由基的SOD活性下降[22]。过多氧自由基的存在会引起血管内膜上的内皮细胞功能紊乱[23],进而导致动脉粥样硬化斑块的形成。而丹参中存在的多糖可以通过多个途径清除活性氧(reactive oxygen species,ROS),包括直接捕捉脂质过氧化链式反应中产生的活性氧基团、络合产生ROS所必需的金属离子、提高抗氧化酶的活性[24],并且作为天然物质,相对其他抗氧化药物其基本无毒副作用[25]。本实验考察了超声提取的丹参多糖清除DPPH自由基以及提高SOD活性的能力的作用。与VC对照组相比,超声提取的丹参多糖清除DPPH自由基能力相对较弱,但比热水提取的丹参多糖的能力提高约15%。证实超声提取的丹参多糖具有明显的抗氧化活性优势。同时丹参多糖可以在一定程度恢复被H2O2抑制的SOD活性。
与常用的热水提取法相比,超声波提取丹参多糖能显著缩短提取时间,提高多糖提取率,同时保持了多糖的高抗氧化活性。为丹参多糖的开发利用及工艺化生产提供理论依据。
[1] 彭谷兰, 徐继红, 张慧桢, 等. 退行性膝关节炎患者自我保健的健康教育[J]. 现代临床护, 2006, 5(3): 73-74.
[2] 赖丽珍, 何少杜. 健康教育在儿童保健门诊的应用[J]. 当代医学,2013, 19(6): 153-154.
[3] 闻庆, 庞玉新, 杨全, 等. 海南岛药食同源植物资源及其开发利用现状[J]. 广东药学院学报, 2015, 31(1): 126-131.
[4] 杨月欣, 王雷, 王献仁. 1996—2007年中国保健食品原料调查分析[J].卫生研究, 2010, 39(2): 129-132.
[5] 刘伟, 魏莹, 刘大会, 等. 白花丹参抗连作品系植物学及物候期特性研究[J]. 中药材, 2015, 38(1): 5-7.
[6] 杨瑞兰, 余加林. 纳洛酮联合丹参注射液治疗新生儿缺氧缺血性脑病疗效观察[J]. 儿科药学杂志, 2013, 19(8): 20-22.
[7] 曹哲, 李丽, 刘刚, 等. 丹参注射液联合尼莫地平治疗高血压脑出血疗效与血清IL-1β、IL-6、CRP水平变化的相关性分析[J]. 临床合理用药, 2015, 8(3A): 62-63.
[8] 石亚飞, 闫荟, 孙世光, 等. 两种丹参类中药注射剂治疗冠心病心绞痛的系统评价及其药物经济学分析[J]. 中国循证医学杂志, 2014,14(3): 287-291.
[9] 彭向前. 丹参叶保健饮料的研制[J]. 饮料工业, 2010, 13(11): 23-25.
[10] 姜卫卫, 徐颖, 李昊. 丹参的中药保健功效及开发使用[J]. 海峡药学,2014, 26(2): 40-41.
[11] 李永东, 葛智平, 温慧华. 贝那普利对高血压患者内皮祖细胞凋亡及氧化应激的影响[J]. 中国心血管杂志, 2015, 20(1): 52-56.
[12] 朱黎霞, 王利胜, 张英. 丹参总酚酸、山楂总黄酮组分配伍对高脂血症大鼠血脂、超氧化物歧化酶及丙二醛的影响[J]. 中国医药导报, 2014, 11(20): 9-12.
[13] 董顺福, 李亚新, 韩丽琴. 丹参等三种中药总黄酮含量分析及其抗氧化机制研究[J]. 时珍国医国药, 2013, 24(5): 1107-1109.
[14] 李志平, 张弛, 周维清, 等. 巢湖蓝藻酸性多糖的理化性质及其体外抗氧化作用[J]. 食品科学, 2015, 36(5): 7-12. doi: 10.7506/spkx1002-6630-201505002.
[15] 张颖, 曾艳, 张丽姣, 等. 不同食用菌菌糠多糖的组分分析与抗氧化活性评价[J]. 食品科学, 2015, 36(5): 18-23. doi: 10.7506/spkx1002-6630-201505004.
[16] 李广富, 陈伟, 李听听, 等. 灵芝多糖益生菌酸奶抗衰老的研究[J].食品与发酵工业, 2015, 41(2): 41-45.
[17] 陈炼红, 杨丽珠, 索化夷, 等. 响应面法优化松茸多糖酶法提取工艺及其体外抗氧化性分析[J]. 食品科学, 2014, 35(16): 23-28. doi:10.7506/spkx1002-6630-201416005.
[18] ZHU Caiping, ZHAI Xichuan, LI Linqiang, et al. Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J]. Food Chemistry, 2015, 177(15): 139-146.
[19] WU Zhen, LI Hong, YANG Yong, et al. Ultrasonic extraction optimization of L. macranthoides polysaccharides and its physicochemical properties[J]. International Journal of Biological Macromolecules, 2015, 74: 224-231.
[20] 黄小梅, 邓祥, 吴狄. 何首乌中蒽醌类物质的超声波提取工艺优化[J].化学研究, 2015, 26(2): 166-169.
[21] 魏明, 李鸿梅, 马艳秋, 等. 响应面优化罗耳阿太菌胞外多糖提取工艺及其保湿、黏度特性分析[J]. 食品科学, 2015, 36(8): 67-73. doi:10.7506/spkx1002-6630-201508012.
[22] 闫洪娟, 谢悦陶, 刘光, 等. 瑞舒伐他汀对自发性高血压大鼠心肌组织SOD、MDA、NO、ET的影响[J]. 大连医科大学学报, 2015,37(3): 232-236.
[23] WAGHE P, SARATH T S, GUPTA P, et al. Arsenic causes aortic dysfunction and systemic hypertension in rats: augmentation of angiotensin Ⅱ signaling[J]. Chemico-Biological Interactions, 2015,237: 104-114.
[24] LIU Jinliang, ZHENG Shunlin, FAN Qiaojia, et al. Optimisation of high-pressure ultrasonic-assisted extraction and antioxidant capacity of polysaccharides from the rhizome of Ligusticum chuanxiong[J]. International Journal of Biological Macromolecules, 2015, 76: 80-85.
[25] 周凤华, 李丽君, 李杰, 等. 丹参多糖保护H2O2致心肌细胞损伤作用机制[J]. 时珍国医国药, 2011, 22(12): 2889-2891.
Optimization of Ultrasonic-Assisted Extraction and Antioxidant Activities of Polysaccharides from the Roots of Salvia miltiorrhiza Bge.
WANG Yanhua, WU Fuhua, GUO Zhaohan, PENG Mingxing, SONG Wanhua, XIA Min, LIANG Zi’an, ZHANG Naiqun
(College of Life Science, Nanyang Normal University, Nanyang 473061, China)
The ultrasonic-assisted extraction of polysaccharides from the roots of Salvia miltiorrhiza with respect to three process parameters including ultrasonication time, ultrasonic power and raw material particle size was optimized using combination of single factor experiments and Box-Behnken design. Meanwhile the antioxidant activity in vitro of the extracted polysaccharides was evaluated by 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging ability. The ability to repair endothelial injury induced by high sugar content was analyzed by superoxide dismutase (SOD) activity in endothelial cells. The optimum extraction conditions that provided the maximum yield of polysaccharides of 4.73% were determined as follows: ultrasonic power, 212 W; extraction time, 18 min; and raw material particle size, 55 mesh. Antioxidant assays showed that the polysaccharides extracted from Salvia miltiorrhiza possessed antioxidant activity. Compared with hot water extraction, ultrasound-assisted extraction could effectively shorten the extraction time, save energy costs and yield polysaccharides with higher activity.
Salvia miltiorrhiza Bge.; ultrasonic-assisted extraction; polysaccharide; response surface analysis; antioxidant activity
TS201.1
A
1002-6630(2015)18-0007-06
10.7506/spkx1002-6630-201518002
2015-05-18
国家自然科学基金青年科学基金项目(11102092);河南省教育厅自然基金项目(12B130003);河南省生物化学与分子生物学重点学科项目
王燕华(1979—),女,讲师,博士,研究方向为食品药理。E-mail:wanga_yanhua@163.com

