响应面试验优化单半乳糖基甘油棕榈酸酯的酶法合成工艺
齐丹萍,刁明明,陆兆新,吕凤霞,别小妹,张 充,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
响应面试验优化单半乳糖基甘油棕榈酸酯的酶法合成工艺
齐丹萍,刁明明,陆兆新,吕凤霞,别小妹,张 充,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
以实验室自制的单半乳糖基甘油和游离棕榈酸为原料,在有机溶剂中以固定化脂肪酶Novozyme 435为催化剂,研究单半乳糖基甘油棕榈酸酯的合成条件。在单因素试验的基础上,以单半乳糖基甘油棕榈酸酯产率为响应值,确定酶添加量、底物物质的量比和反应时间作为影响合成反应的主要因素,进行响应面优化试验。获得单半乳糖基甘油棕榈酸酯的最佳合成条件为:丙酮为反应溶剂,脂肪酶Novozyme 435添加量12.93 mg/mL、底物物质的量比(单半乳糖基甘油-棕榈酸)1.00∶4.49、反应温度55 ℃、反应时间27.60 h,此时单半乳糖基甘油棕榈酸酯产率为90.17%。
单半乳糖基甘油棕榈酸酯;酶法合成;丙酮;脂肪酶Novozyme 435;优化
甘油糖脂是细胞膜的重要成分[1],广泛存在于植物、微生物和动物的神经组织,具有抗氧化[2]、抗肿瘤[3]、抗菌[4]、抗病毒[5]、抗炎[6]等作用,在化妆品、生物医药、食品等方面有着广泛的应用前景[7]。要深入研究甘油糖脂的生物活性构效关系及其作用机理,必须有大量结构单一的纯品,但是市场售出的高纯度甘油糖脂种类少、价格昂贵,天然提取的甘油糖脂数量有限,纯度也难以满足研究的需要。因此如何正确且高效地获得所需要的甘油糖脂成为目前的研究热点之一。
甘油糖脂的合成方法主要有化学合成和酶法合成。由于酯化反应可逆,加上糖分子和甘油分子上的羟基较多,导致化学合成条件差[8],选择性低,副产物多,难以应用在食品、医药等行业[9]。与化学合成法相比,酶催化合成具有反应条件温和、效率高、选择性强、副产物少等优势[10],且绿色环保,符合可持续发展的要求[11]。由于在非水相中合成糖酯可以增大底物的溶解性,抑制可逆的副反应,提高反应的立体选择性,并消除产物和底物的抑制作用。近年来,越来越多的研究人员利用非水相环境酶法合成糖酯,合成糖酯中所用糖基的种类多为葡萄糖、果糖、蔗糖、麦芽糖和木糖醇等,以半乳糖基甘油作为糖基的研究很少[12]。
本实验以前期合成的单半乳糖基甘油[13]和棕榈酸作为底物,对固定化脂肪酶Novozyme 435在有机溶剂中催化合成单半乳糖基甘油棕榈酸酯进行研究。在单因素试验的基础上,采用响应面法进行优化,以得到最大的产物转化率,为其酶法生产合成提供参考依据。
1 材料与方法
1.1材料与试剂
单半乳糖基甘油(纯度>95%)由本实验室自制;棕榈酸、丙酮(均为化学纯) 上海凌峰化学试剂有限公司;4Å型分子筛 国药集团化学试剂有限公司;固定化脂肪酶Novozyme 435(Candida antarctica) 丹麦Novozyme酶制剂公司;其他试剂和有机溶剂均为化学纯或分析纯。
1.2仪器与设备
电子精密天平 北京赛多利斯天平有限公司;SHZ-88A往复式水浴恒温振荡器 太仓市实验设备厂;1200高效液相色谱(high p erformance liquid chromatography,HPLC)仪 美国Agilent公司;ELSD 2000蒸发光散射检测器 美国Alltech公司。
1.3方法
1.3.1单半乳糖基甘油棕榈酸酯的合成
将一定量的单半乳糖基甘油、棕榈酸、固定化脂肪酶Novozyme 435和5 mL丙酮置于30 mL具塞试管中,密封后放入55 ℃水浴振荡器(转速130 r/min)中反应3 h,加入4Å型分子筛约170 mg继续反应,反应一段时间后,过滤除掉反应液中的酶,取20 μL进行液相检测。所有反应进行3 个平行实验,最终取其平均值。
1.3.2单半乳糖基甘油棕榈酸酯的定量分析
反应结束后取20 μL反应液进行液相检测。色谱柱为ZORBA SB C18色谱柱(4.6 mm×250 mm,5 μm),柱温保持在30 ℃,流动相为甲醇-水(体积比95∶5),流速0.5 mL/min,洗脱时间为25 min。检测器为蒸发光散射检测器(evaporative light scattering detector,ELSD),漂移管温度55 ℃,气流量为2.0 L/min,增益值为1。
单半乳糖基甘油棕榈酸酯的定量采用外标法。标品由实验室自制并进行分离纯化制得,纯度>97%。将纯品半乳糖基甘油棕榈酸单酯和二酯溶解于一定量的色谱纯甲醇中,配成一系列浓度的标准溶液,HPLC-ELSD检测后(图1),绘制ln(峰面积)-ln(单半乳糖基甘油棕榈酸酯浓度)标准曲线,得到方程:y=1.648 7x+8.561 3(单半乳糖基甘油棕榈酸单酯)和y=1.605 5x+6.453 6(单半乳糖基甘油棕榈酸二酯)。根据标准曲线分别计算单酯和二酯物质的量,最终根据下式计算单半乳糖基甘油棕榈酸酯产率:

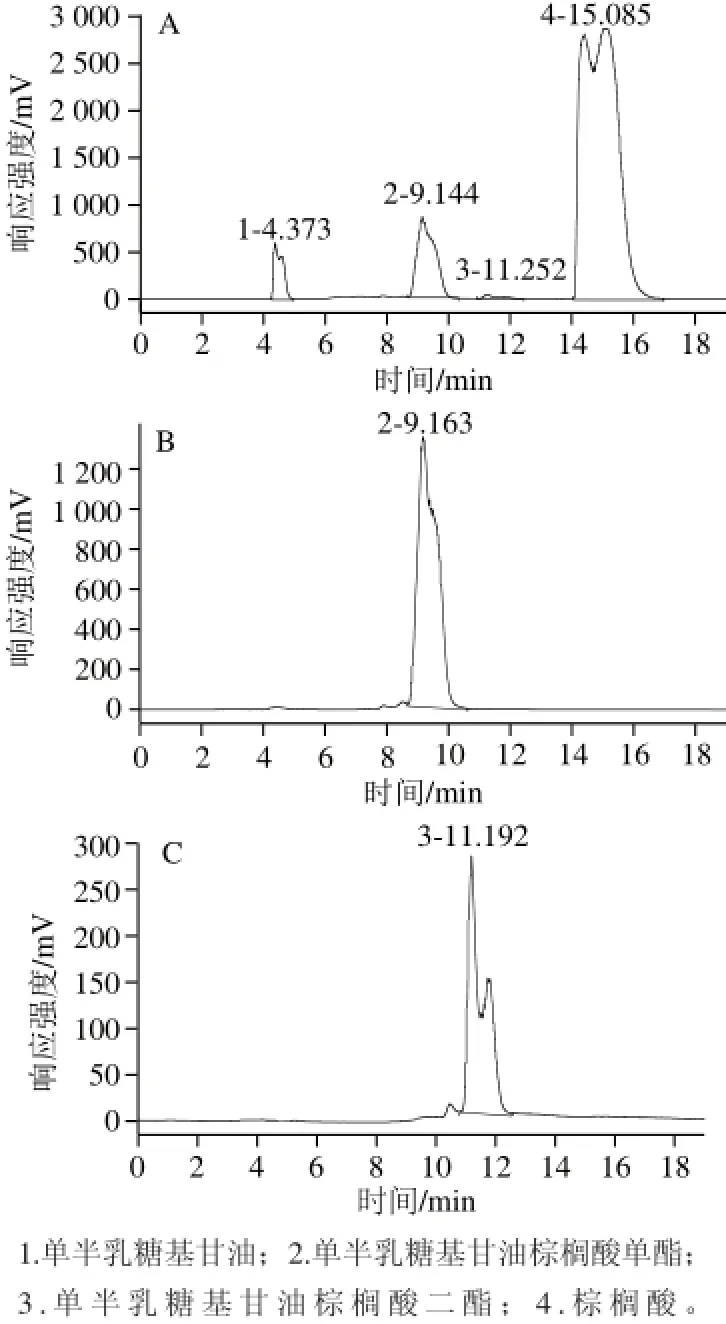
图1 单半乳糖基甘油棕榈酸酯反应液(A)、单半乳糖基甘油棕榈酸单酯(B)和单半乳糖基甘油棕榈酸二酯(C)的HPLC图谱PLCFig.1 HPLC profi les of palmitoyl-monogalactosylglycerol reaction mixture (A), monopalmitoyl-monogalactosylglycerol (B) and dipalmitoylmonogalactosylglycerol (C)
1.3.3单因素试验
选取反应溶剂(丙酮、正己烷、叔戊醇、叔丁醇、乙腈)、酶添加量(4~20 mg/mL)、底物物质的量比(单半乳糖基甘油-棕榈酸1∶1~1∶6)、反应时间(5~84 h)和反应温度(40~55 ℃)5个因素,研究不同因素对单半乳糖基甘油棕榈酸酯产率的影响,从而确定各因素的最适范围。
1.3.4响应面优化试验
根据单因素试验结果,固定丙酮为反应溶剂,反应温度55 ℃,根据中心组合设计原理,选择酶添加量8~16 mg/mL、底物物质的量比1∶3~1∶5、反应时间18~30 h,以单半乳糖基甘油棕榈酸酯产率为响应值进行响应面分析,试验因素和水平见表1。

表 1 响应面试验因素水平表Table 1 Levels and codes of variables used in the experimental design
2 结果与分析
2.1单因素试验结果
2.1.1反应溶剂种类的影响
合适的溶剂对于有机相中进行的脂肪酶催化合成反应必不可少。有机溶剂不仅会影响反应底物的溶解度[14],从而影响酯化率,还影响脂肪酶的稳定性和催化活性[15]。有机溶剂可以直接破坏酶活性中心构型的氢键、疏水作用等而使酶失活,还可以作用于酶的水化层间接影响酶活性[16]。因此选择一种合适的有机溶剂作为反应体系对酶促反应的顺利进行起着至关重要的作用。不同的有机溶剂对同一个反应体系中的底物溶解度和脂肪酶活性产生的影响效果不同,由此导致在不同有机溶剂中脂肪酶催化合成的产物转化率不同。本实验分别以丙酮、正己烷、叔戊醇、叔丁醇和乙腈为反应溶剂,加入单半乳糖基甘油0.1 mmol/5 mL、棕榈酸0.2 mmol/5 mL、脂肪酶4 mg/mL,55 ℃水浴反应48 h,考察溶剂种类对单半乳糖基甘油棕榈酸酯产率的影响,结果如图2所示。

图2 有机溶剂对单半乳糖基甘油棕榈酸酯产率的影响Fig.2 Effect of organic solvents on palmitoyl-monogalactosylglycerol yield
从图2可以看出,以乙腈为溶剂时产率最高,与其他溶剂体系有着显著性差异(P<0.05),其次是丙酮和叔丁醇体系,正己烷体系中产物的量最少。以乙腈为溶剂时产物的产率虽然最高,但是乙腈毒性较强,不允许应用于食品工业,而丙酮的沸点较低,易于产物分离,且被欧共体允许在食品或食品添加剂产业中应用[17],安全性较高,故选用丙酮为单半乳糖基甘油棕榈酸酯合成的反应溶剂。
2.1.2酶添加量的影响
酶催化反应中,酶质量浓度的大小会影响反应进程的快慢,同时也会影响产物的转化率。酶添加量对酯合成转化率在一定条件和质量浓度范围内影响显著,但质量浓度过高会增加反应成本[18]。因此在一定范围内增大酶的质量浓度,可以缩短达到相同转化率所需的反应时间,提高转化率。以丙酮为反应溶剂,单半乳糖基甘油添加量0.1 mmol/5 mL、棕榈酸添加量0.2 mmol/5 mL,分别添加不同质量浓度的脂肪酶Novozyme 435:4、8、12、14、20 mg/mL,55 ℃水浴中进行合成反应,48 h后考察不同酶添加量对单半乳糖基甘油棕榈酸酯产率的影响。
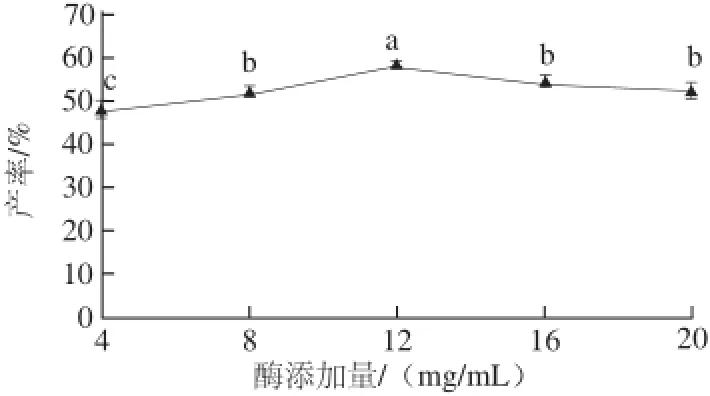
图3 酶添加量对单半乳糖基甘油棕榈酸酯产率的影响Fig.3 Effect of enzyme amount on palmitoyl-monogalactosylglycerol yield
由图3可知,随着酶添加量的增多,单半乳糖基甘油棕榈酸酯的产量逐渐增高,在酶添加量为12 mg/mL时单半乳糖基甘油棕榈酸酯的产量最高,之后产量降低并趋于平衡。主要是由于加酶添加量超过一定范围后,底物的量相对不足,且酶添加量过多使酶发生聚集而不能与底物充分接触,从而降低了酶的催化效率[19]。故选取12 mg/mL为最佳酶添加量。
2.1.3底物物质的量比的影响
脂肪酶催化的酯化反应中,为提高其中一种底物的转化率,使反应向着正方向进行,通常要增大另一种底物的量或在反应中不断除去某种反应产物[20]。本实验固定单半乳糖基甘油物质的量为0.1 mmol,分别在5 mL溶剂中添加0.1、0.2、0.3、0.4、0.5、0.6 mmol棕榈酸,酶添加量12 mg/mL,55 ℃水浴反应48 h,考察底物物质的量比对单半乳糖基甘油棕榈酸酯产率的影响。
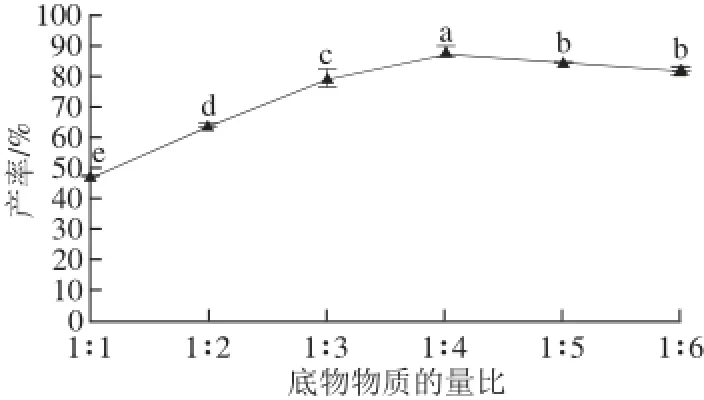
图4 底物物质的量比对单半乳糖基甘油棕榈酸酯产率的影响Fig.4 Effect of molar ratio between substrates on palmitoylmonogalactosylglycerol yield
从图4可以看出,单半乳糖基甘油棕榈酸酯产率随底物物质的量比的变化先升后降。当单半乳糖基甘油与棕榈酸的物质的量比在1∶1~1∶4范围内时,底物的酯化产率随之提高,底物物质的量比为1∶4时产率达到最高。继续增加棕榈酸的浓度,产率不升反降,可能原因是游离棕榈酸浓度过高,与产物混合增加了反应体系的黏度,反应体系的传质阻力增大,从而抑制反应的进行,造成原料的浪费[21]。因此实验选取1∶4为最佳的底物物质的量比。
2.1.4反应时间的影响
在一定范围内延长反应时间可以促进底物的扩散和产物的合成,但当反应达到平衡状态之后,继续延长反应时间也不会进一步提高产物的转化率。本实验固定单半乳糖基甘油添加量0.1 mmol/5 mL、棕榈酸添加量0.4 mmol/5 mL、脂肪酶添加量12 mg/mL,55 ℃水浴中进行合成反应,分别在5、12、24、36、48、60、72、84 h时取样检测,探讨反应时间对单半乳糖基甘油棕榈酸酯产率的影响。

图5 反应时间对单半乳糖基甘油棕榈酸酯合成的影响Fig.5 Effect of reaction time on palmitoyl-galactosylglycerol yield
从图5可以看出,随着反应时间的延长,单半乳糖基甘油棕榈酸酯的产量呈上升趋势,在24 h时达到最大值并趋于平稳。继续延长反应时间,超过60 h后产量开始降低,分析原因可能是经过一段时间的反应后,催化剂活性开始下降[22],另一方面,酯化反应存在逆反应,随着反应的长时间进行,反应生成的酯可能被降解[23]。因此,选取24 h为适宜反应时间。
2.1.5反应温度的影响
在酶促反应过程中,适宜的温度是反应的一个关键因素。一般情况下,随着温度的升高,反应速率加快,但温度超过酶的最适温度后,酶的空间结构和构象会受到影响,从而降低酶活和酶的使用寿命[24]。由于反应溶剂丙酮的沸点为56.53 ℃,反应温度超过56 ℃会导致溶剂挥发,影响反应进行,故实验选取的最高温度为55 ℃。本实验固定单半乳糖基甘油添加量0.1 mmol/5 mL、棕榈酸添加量0.4 mmol/5 mL、脂肪酶添加量12 mg/mL、反应时间24 h,分别在40、45、50、53、55 ℃条件下利用脂肪酶催化单半乳糖基甘油棕榈酸酯的合成,探讨反应温度对单半乳糖基甘油棕榈酸酯产率的影响。

图6 反应温度对单半乳糖基甘油棕榈酸酯合成的影响Fig.6 Effect of reaction temperature on palmitoylmonogalactosylglycerol yield
从图6可以看出,随着反应温度的不断升高,产物的产率也不断升高,在反应温度为55 ℃时达到最大值,再继续升高温度反应溶剂就会挥发,影响反应的正常进行。此外,温度过高还会导致酶活力下降,不利于酯化反应进行[17]。故选取55 ℃为适宜反应温度,此时单半乳糖基甘油棕榈酸酯产率为89.06%。
2.2响应面试验优化
2.2.1响应面试验结果
在单因素试验基础上,选择酶添加量、底物物质的量比和反应时间进行三因素三水平的中心组合设计,共20 组试验。试验设计和结果如表2所示。
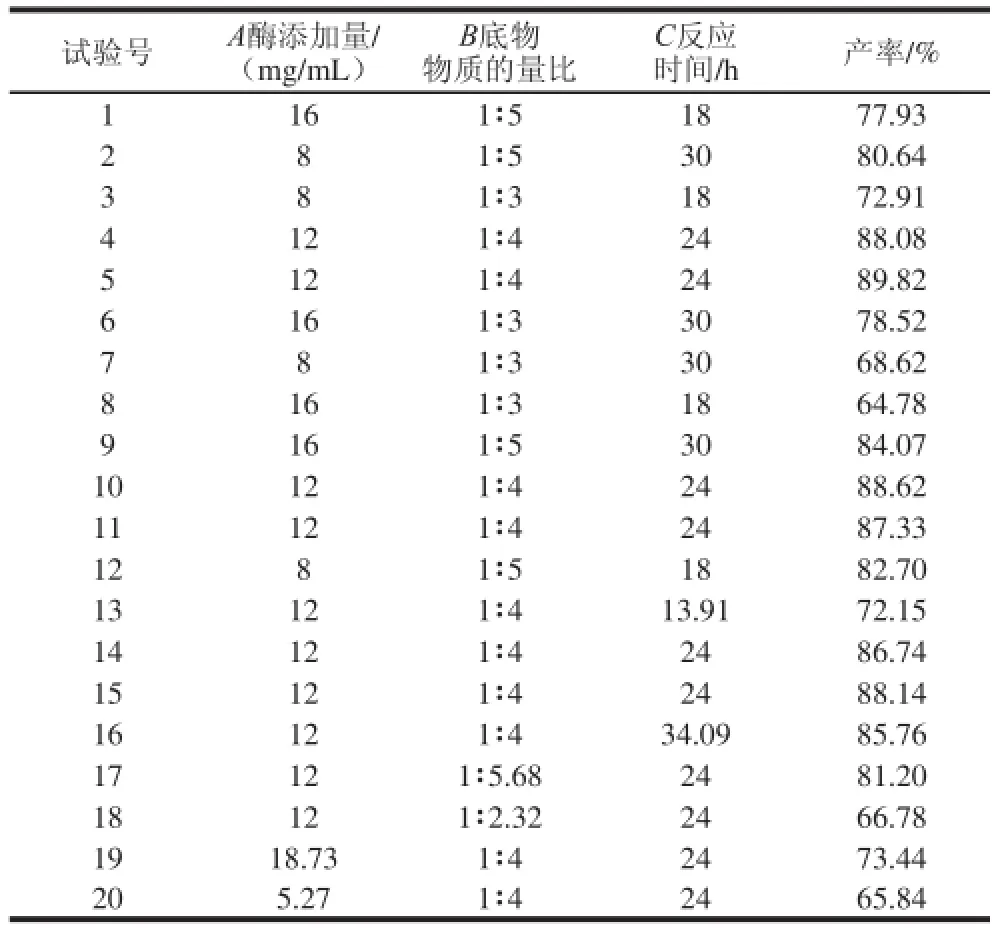
表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
应用Design-Expert 8.0软件对表2中数据进行多元回归拟合,确定了单半乳糖基甘油棕榈酸酯产率(Y)的最佳拟合二次回归方程:
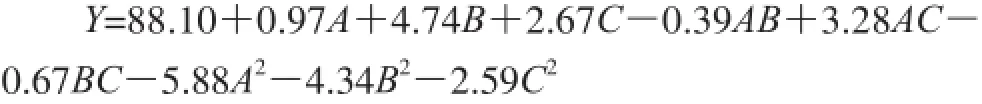
2.2.2模型拟合检验及方差分析
由表3可知,本实验选用的模型回归方程P值小于0.000 1,说明回归方程极显著,且失拟项不显著(P=0.065 1>0.05)。模型的相关系数(R2)为0.965 8,表明观察值与预测值之间相关性较好。变异系数表明不同实验组之间的变异程度,本试验的变异系数为2.97%,处于较低水平,说明试验的重复性较好。由上述分析可知,该模型与试验情况拟合较好,可以在模型设定的范围内分析和预测单半乳糖基甘油棕榈酸酯的产率。回归方程中底物物质的量比(B)对模型的影响极显著(P<0.000 1),反应时间(C)对模型的影响极显著(P<0.01);此外,A2、B2和C2对单半乳糖基甘油棕榈酸酯的产率也有极显著影响(P<0.01);酶添加量与反应时间的交互作用(AC)极显著(P<0.01)。

表3 单半乳糖基甘油棕榈酸酯转化率二项式模型的方差分析Table 3 Analysis of variance (ANOVA) for the experimental results of central composite design (CCD) (palmitoyl-galactosylglycerol yield)
2.2.3响应面分析
图7为脂肪酶催化单半乳糖基甘油棕榈酸酯合成的响应面,直观反映了3个因素两两之间的交互作用对响应值单半乳糖基甘油棕榈酸酯产率的影响。对其响应面曲面以及等高线图进行分析可直观看出最佳范围,并可以在最佳范围内根据单半乳糖基甘油棕榈酸酯合成过程中的实际需要调整各因素大小,从而得到较高的产率。

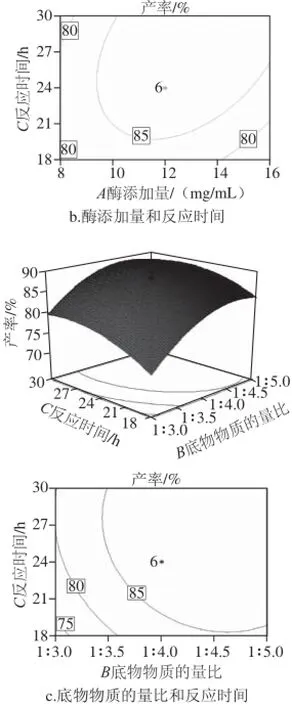
图7 各因素交互影响单半乳糖基甘油棕榈酸酯产率的响应面Fig.7 Response surface plots showing the interactive effects on independent variables the yield of palmitoyl-monogalactosylglycerol
从图7a可以看出,反应时间固定为24 h时,响应面的坡度较平缓,表明响应值(单半乳糖基甘油棕榈酸酯产率)对酶添加量和底物物质的量比的交互作用不敏感。从等高线可以看出,酶添加量的变化对响应值的影响比底物物质的量比的变化影响大,等高线较密。随着酶添加量的增加,产率不断升高,达到一定值后开始下降,在底物物质的量比达到较高水平时,产率趋于平衡。可能原因是当底物物质的量比率比较低时,底物量不足,脂肪酶的活性位点没有被完全结合,造成酶的浪费。底物物质的量比率达到一定范围后,酶的结合位点达到饱和,继续增加底物反而会造成浪费。图7b显示了底物物质的量比为1∶4时,加酶添加量和反应时间的交互作用对单半乳糖基甘油棕榈酸酯产率的影响。从图7b中可以看出,响应面的坡度较陡,表明响应值对酶添加量和反应时间的交互作用敏感。等高线图反映了酶添加量和反应时间的变化对响应值的影响不大。酶添加量较低时,反应时间的延长对产率的影响不大,当酶添加量在较高水平时,随着反应时间的延长产率不断升高,并在27 h时达到平衡,可能是酶添加量已经达到饱和的缘故。图7c显示了在酶添加量为12 mg/mL的条件下,底物物质的量比和反应时间的交互作用对单半乳糖基甘油棕榈酸酯产率的影响。从图7c可以看出,响应面的坡度较平缓,表明响应值对酶添加量和底物物质的量比的交互作用不敏感。从等高线可以看出,底物物质的量比和反应时间的变化对响应值的影响不大。反应开始时,随着反应时间的延长,增大底物物质的量比会使产物产率呈上升趋势,继续增大底物物质的量比率,底物已经达到饱和状态,反应趋于平衡,过高的底物物质的量比率反而会造成反应的抑制和原料的浪费。
2.2.4最优反应条件的确定及模型验证
在选取的各因素范围内,利用Design-Expert统计分析软件,根据回归模型分析,得出丙酮中脂肪酶Novozyme 435催化合成单半乳糖基甘油棕榈酸酯的最佳反应条件,当酶添加量12.93 mg/mL、底物物质的量比1.00∶4.49、55 ℃水浴反应27.60 h时,单半乳糖基甘油棕榈酸酯的产率可达到90.18%。采用上述最佳反应条件,进行3次合成反应实验,得到的实际平均产率为90.17%,与模型预测值基本一致,说明预测值与实际值之间有较好的拟合性,模型可信度高。
3 结 论
3本实验采用实验室自制的单半乳糖基甘油和棕榈酸为原料,在丙酮体系中,以固定化脂肪酶Novozyme 435为催化剂,通过酯化反应合成单半乳糖基甘油棕榈酸酯,确定了反应溶剂、酶添加量、底物物质的量比、反应时间和反应温度等因素对单半乳糖基甘油棕榈酸酯产率的影响。在此基础上,通过响应面法建立了其统计学优化模型,并获得了适宜的酶催化合成条件。验证实验的结果(90.17%)与模型预测值(90.18%)完全吻合,因此该实验中所建立的模型具有实际应用价值。
[1] HOLZL G, DOEMANN P. Structure and function of glycoglycerolipids in plants and bacteria[J]. Progress in Lipid Research, 2007, 46(5): 225-243.
[2] MATSUFUJI M, NAGAMATSU Y, YOSHIMOTO A. Protective effects of bacterial glyceroglycolipid M874B against cell death caused by exposure to heat and hydrogen peroxide[J]. Journal of Bioscience and Bioengineering, 2000, 89(4): 345-349.
[3] HOU C C, CHEN Y P, WU J H, et al. A galactolipid possesses novel cancer chemopreventive effects by suppressing inflammatory mediators and mouse B16 melanoma[J]. Cancer Research, 2007,67(14): 6907-6915.
[4] CATENI F, BONIVENTO P, PROCIDA G, et al. Chemoenzymatic synthesis and antimicrobial activity evaluation of monogalactosyl diglycerides[J]. European Journal of Medicinal Chemistry, 2008,43(1): 210-221.
[5] LOYA S, RESHEF V, MIZRACHI E, et al. The inhibition of the reverse transcriptase of HIV-1 by the natural sulfoglycolipids from cyanobacteria: contribution of different moieties to their high potency[J]. Journal of Natural Products, 1998, 61(7): 891-895.
[6] BERGE J P, DEBITON E, DUMAY J, et al. In vitro antiinflammatory and anti-proliferative activity of sulfolipids from the red alga Porphyridium cruentum[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6227-6232.
[7] 王红亮, 冯光炷, 李和平, 等. 长链脂肪酸淀粉酯合成及应用研究[J].进展化工进展, 2006, 5(7): 760-764.
[8] CAO L, FISCHER A, BOMSCHEUER U T, et al. Lipase-catalyzed solid phase synthesis of sugar fatty acid esters[J]. Biocatalysis and Biotransformation, 1996, 14(4): 269-283.
[9] KENNEDY J F, KUMAR H, PANESAR P S, et al. Enzyme-catalyzed regioselective synthesis of sugar esters and related compounds[J]. Journal of Chemical Technology and Biotechnology, 2006,81(6): 866-876.
[10] CHANG Shuwei, SHAW J. Biocatalysis for the production of carbohydrate esters[J]. New Biotechnology, 2009, 26(3): 109-116.
[11] DUCRET A, GIROUX A, TRANI M, et al. Enzymatic preparation of biosurfactants from sugars or sugar alcohols and fatty acids in organic media under reduced pressure[J]. Biotechnology and Bioengineering,1995, 48(3): 214-221.
[12] 郭艳霞, 胡燚, 王莹, 等. 非水相中酶法合成糖酯的研究进展[J]. 化工进展, 2012, 31(1): 169-175.
[13] WEI Wei, QI Danping, ZHAO Haizhen, et al. Synthesis and characterisation of galactosyl glycerol by β-galactosidase catalysed reverse hydrolysis of galactose and glycerol[J]. Food Chemistry, 2013,141(3): 3085-3092.
[14] KUO S J, PARKIN K L. Solvent polarity infl uences product selectivity of lipase-mediated esterifi cation reactions in microaqueous media[J]. Journal of the American Oil Chemists’ Society, 1996, 73(11): 1427-1433.
[15] DORDICK J S. Enzymatic catalysis in monophasic organic solvents[J]. Enzyme and Microbial Technology, 1989, 11(4): 194-211.
[16] 林君智. 乙二醇葡萄糖苷及其己酸酯的制备与纯化[D]. 无锡: 江南大学, 2008.
[17] ARCOS J A, BERNABE M, OTERO C. Quantitative enzymatic production of 6-O-acylglucose esters[J]. Biotechnology and Bioengineering, 1998, 57(5): 505-509.
[18] 杨天奎. 酶法生产人乳脂替代品的研究[D]. 北京: 中国农业大学, 2003.
[19] 陈茂彬, 黄琴, 吴谋成. 植物甾醇油酸酯产品的合成工艺研究[J]. 中国油脂, 2005, 30(6):63-65.
[20] 孙燕, 夏木西·卡玛尔, 吾满江·艾力. 酶促反应合成棕榈酸VC酯[J].生物技术, 2006, 6(2): 63-65.
[21] ERBELDINGER M, NI X, HALLING P J. Enzymatic synthesis with mainly undissolved substrates at very high concentrations[J]. Enzyme and Microbial Technology, 1998, 23(1): 141-148.
[22] 辛嘉英, 刘铁, 王艳, 等. 脂肪酶催化月桂酸淀粉酯的合成[J]. 食品科学, 2013, 34(6): 52-55.
[23] 陈中华. 酸烯法合成乙酸叔丁酯的工艺研究[D]. 上海: 华东理工大学, 2013.
[24] XU X, FOMUSO L B, AKOH C C. Synthesis of structured triacylglycerols by lipase-catalyzed acidolysis in a packed bed bioreactor[J]. Journal of Agricultural and Food Chemistry, 2000,48(1): 3-10.
[25] 刘振春, 孙慧娟, 耿存花, 等. 脂肪酶催化共轭亚油酸植物甾醇酯合成工艺的优化[J]. 西北农林科技大学学报: 自然科学版, 2014,42(6): 173-179.
Response Surface Optimization of Lipase-Catalyzed Synthesis of Palmitoyl-Monogalactosylglycerol in Organic Solvent
QI Danping, DIAO Mingming, LU Zhaoxin, LÜ Fengxia, BIE Xiaomei, ZHANG Chong, ZHAO Haizhen*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The enzymatic synthesis of palmitoyl-monogalactosylglycerol from monogalactosyl glycerol and free palmitic acid in organic solvent was investigated in present study. Novozyme 435, an immobilized lipase, was used as catalyst. The main factors that influence the yield of palmitoyl-monogalactosylglycerol, including lipase amount, and molar ratio of monogalactosyl glycerol to palmitic acid and reaction time, were selected and optimized by the combined use of single factor experiments and response surface methodology. The optimal synthesis conditions were determined as follows: reaction solvent, acetone; Novozyme 435 amount, 12.93 mg/mL; molar ratio monogalactosylglycero to palmitic acid, 1.00:4.49; reaction temperature, 55 ℃; and reaction time, 27.60 h. Under these conditions, the yield of palmitoylmonogalactosylglycerol was 90.17%.
palmitoyl-monogalactosylglycerol; enzymatic synthesis; acetone; Novozyme 435; optimization
TS202.3
A
1002-6630(2015)18-0001-06
10.7506/spkx1002-6630-201518001
2015-02-03
国家自然科学基金青年科学基金项目(31301558);中央高校基本科研业务费专项(KJQN201427)
齐丹萍(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:2013108027@njau.edu.cn
赵海珍(1975—),女,副教授,博士,研究方向为食品生物技术。E-mail:zhaohz@njau.edu.cn

