鲜食玉米籽粒中主要类胡萝卜素鉴定与含量分析
陈洁琼,宋江峰,何美娟,李大婧,3,*,刘春泉,3,章 园
(1.南京农业大学食品科技学院,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.国家蔬菜加工技术 研发分中心,江苏 南京 210014)
鲜食玉米籽粒中主要类胡萝卜素鉴定与含量分析
陈洁琼1,2,宋江峰2,何美娟1,2,李大婧1,2,3,*,刘春泉2,3,章 园1,2
(1.南京农业大学食品科技学院,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.国家蔬菜加工技术 研发分中心,江苏 南京 210014)
为探讨鲜食玉米中类胡萝卜素组成及含量差异,应用高效液相色谱-二极管阵列检测-大气压化学电离质谱技术对5 个鲜食甜、糯玉米品种籽粒中主要类胡萝卜素进行鉴定与分析。结果表明:甜玉米‘晶甜3号’和‘晶甜5号’籽粒中分别鉴定出14、15 种类胡萝卜素,糯玉米‘苏玉糯11号’、‘京甜紫花糯2号’和‘晶糯8号’中种类较少,其中新色素、花药黄质和13-顺式-5,6-环氧-叶黄素首次在鲜食玉米中报道。甜玉米籽粒中类胡萝卜素含量较高,最高可达39.68 μg/g(以干质量计),但品种间存在差异,主要组分为玉米黄质、叶黄素和α-隐黄质;糯玉米籽粒中类胡萝卜素含量较低(2.10~3.69 μg/g),主要组分为玉米黄质、新黄质和花药黄质。鲜食甜、糯玉米品种类胡萝卜素种类和含量存在明显不同。
甜玉米;糯玉米;类胡萝卜素;高效液相色谱-二极管阵列检测-大气压化学电离质谱
类胡萝卜素是一类重要的天然色素,广泛存在于在水果、蔬菜中,除了具有着色功能,参与光合作用中光能吸收过程外,它对人体心血管有保护作用,能够清除自由基、增强机体的免疫力、对眼类、皮肤类疾病以及胃癌也有很好的预防作用[1-2]。因此,富含天然类胡萝卜素的果蔬资源受到人们普遍重视。
与普通玉米相比,鲜食玉米具有甜、香、糯、嫩等特点,食用和营养品质俱佳。鲜食玉米中含有多种类胡萝卜素,其种类和含量是评价鲜食玉米品质的重要参数之一。目前,国内外对玉米籽粒中总类胡萝卜素的定量研究比较多,少数研究鉴定出叶黄素、玉米黄质、α-胡萝卜素、β-胡萝卜素、β-隐黄质5 种主要的类胡萝卜素[3-4],根据前期研究中的色谱图分析,鲜食玉米中还有大量未鉴定出的类胡萝卜素需要明确。反相高效液相色谱法是分离和鉴定类胡萝卜素的常用方法,其中C18柱虽然可以分离不同种类的类胡萝卜素,但是很难分离类胡萝卜素的几何异构体,且分离结果难以重复,而C30柱不仅可以分离类胡萝卜素的几何异构体,同时也增加了固定相的疏水性,使得非极性类胡萝卜素的保留时间延长,从而大大提高了柱效[5-6]。de Rosso等[7]使用C30-高效液相色谱-二极管阵列检检测串联质谱对6 种水果中的类胡萝卜素进行定性和定量分析,最终分离出60 种不同的类胡萝卜素。因此,本实验拟采用高效液相色谱-二极管阵列检测-大气压化学电离-质谱(high performance liquid chromatography atmosphericdiode array detection-pressure chemical ionization-mass pectrometry,HPLC-DAD-APCI-MS)技术对不同鲜食玉米品种中类胡萝卜素进行定性定量分析,比较不同品种间类胡萝卜素种类和含量的差异,筛选高含量类胡萝卜素品种,为其后续加工利用提供参考。
1 材料与方法
1.1材料与试剂
供试鲜食玉米品种包括甜玉米‘晶甜3号’和‘晶甜5号’,糯玉米‘苏玉糯11号’、‘京甜紫花糯2号’和‘晶糯8号’。
叶黄素(CAS#:X6250)、玉米黄质(CAS#:14681)、β-隐黄质(CAS#:C6368)和β-胡萝卜素(CAS#:PHR1239)标准品 美国Sigma公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)、甲醇(均为色谱级) 美国天地公司;正己烷、乙醇、丙酮、甲苯、无水硫酸钠和氢氧化钾等均为国产分析纯。
1.2仪器与设备
1200 HPLC仪(在线真空脱气机、四元梯度洗脱泵、柱温箱、DAD、6530精确质量数四极杆-飞行时间质谱仪(6530 Q-TOF)) 美国安捷伦科技有限公司;BS224S电子分析天平 北京赛多利斯科学仪器公司;SHZ-D(Ⅲ)循环水式真空泵 上海东玺制冷仪器设备有限公司;RE52CS旋转蒸发仪、B-226恒温水浴锅 上海亚荣生化仪器厂;D10氮气吹扫仪 杭州奥盛仪器有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司。
1.3方法
1.3.1样品前处理
鲜食玉米籽粒经液氮浸渍后冷冻干燥24 h,粉碎过40 目筛后贮藏于-80 ℃超低温冰箱中备用。
1.3.2鲜食玉米中类胡萝卜素提取
准确称取3.00 g玉米粉于磨口锥形瓶中,加入30 mL正己烷-乙醇-丙酮-甲苯(10∶6∶7∶7,V/V)混合提取液,静置3~4 h,加入2 mL 40% KOH-甲醇溶液,摇匀后置于暗处25 ℃皂化16 h,其目的是为了去除玉米中的脂类物质,避免其干扰后续色谱分析[8]。将皂化液转入分液漏斗,加30 mL正己烷,振荡摇匀,再加入38 mL 10%硫酸钠溶液,收集上层溶液。重复处理2 次,混合上层溶液,旋转蒸发,氮气吹干,用2 mL甲醇溶解,待HPLC-DADMS-MS分析。
1.3.3C30-HPLC-DAD-MS-MS分析条件
HPLC条件:色谱柱为YMC-C30(4.6 mm× 250 mm,5 μm)色谱柱;柱温:25 ℃;检测器为DAD,波长450 nm,流动相:A为水-MTBE-甲醇(5∶25∶75,V/V);B为水-MTBE-甲醇(5∶85∶10,V/V);进样量20 μL;线性梯度洗脱,流速为0.6 mL/min,梯度洗脱程序:0~4.5 min(95%~80% A),4.5~12.5 min(80%~50% A),12.5~18 min(50%~25% A),18~24 min(25%~5% A),24~30 min(5% A)。
MS条件:色谱柱流出组分进入质谱仪的流速为10 μL/min;离子源:APCI+;扫描范围:m/z 80~1 000;毛细管电压:2 500 V;干燥气体:5 L;雾化气体:20 psi;气化温度:350 ℃;蒸汽温度:400 ℃;电晕电流:4 μA。
1.3.4类胡萝卜素组分定性定量分析方法
对于有标样的组分,对照标样,利用保留时间的一致性进行鉴定,基于外标法构建的回归方程(表1)对样品类胡萝卜素各组分含量进行定量分析。对于没有标样的组分,利用DAD在波长200~600 nm范围和质谱的扫描结果对照相关文献资料进行鉴定。

表1 4 种类胡萝卜素的标准曲线方程Table 1 Standard curves and limits of detection for four carotenoids
根据文献[9]报道的替换计算方法,对无标品组分进行定量时,叶黄素洗脱前出现的类胡萝卜素组分和叶黄素异构体采用叶黄素标准曲线定量,α-隐黄质及其顺式异构体采用β-隐黄质标准曲线定量,α-胡萝卜素及其顺势异构体采用β-胡萝卜素标准曲线定量。
2 结果与分析
2.1鲜食玉米籽粒主要类胡萝卜素鉴定
本研究利用C30-HPLC-DAD-MS分析方法从‘晶甜3号’和‘晶甜5号’甜玉米籽粒中分别鉴定出14 种和15 种类胡萝卜素,‘苏玉糯11号’、‘晶糯8号’和‘京甜紫花糯2号’糯玉米籽粒中的类胡萝卜素分别为8、9 种和7 种。其中新色素、花药黄质和13-顺式-5,6-环氧-叶黄素首次在鲜食玉米中报道。与前人的研究结果[10]相比,本研究建立的方法分离效果好、鉴定组分多,可为后续鲜食玉米类胡萝卜素加工与利用提供参考。限于篇幅,下面以‘晶甜3号’鲜食玉米籽粒中主要类胡萝卜素鉴定过程进行说明。

图1 ‘晶甜3号’玉米籽粒中类胡萝卜素的HPLC图Fig.1 HPLC profi les of carotenoids in ‘Jingtian No.3’ corn grain
将图1中组分的保留时间与4 种标准品的保留时间进行比较,发现峰6、7、11和14分别与叶黄素、玉米黄质、β-隐黄质和β-胡萝卜素的洗脱时间一致,并且吸收光谱相似;MS分析结果表明峰6主要离子碎片峰为m/z 551.4、569.4、533.4,峰7主要离子碎片峰为m/z 569.4、551.4、533.4,峰11主要离子碎片峰为m/z 553.4、535.4、473.3,峰14主要离子碎片峰为m/z 537.4、477.4,与文献[11]中主要离子碎片峰相符,故根据保留时间、光谱吸收波长、MS信息等,确定峰6、7、11、14分别为叶黄素、玉米黄质、β-隐黄质、β-胡萝卜素。
类胡萝卜素组分鉴定结果如表2所示,其鉴定过程如下。峰1和峰2保留时间分别为7.550 min和8.171 min,由MS信息知两峰的MS分子离子峰均为m/z 601.4,主要碎片离子峰一致,峰2的3 个最大吸收波长为420、442、470 nm,峰1为416、440、470 nm,且峰1在330 nm波长处有一个吸收峰,根据文献[12]报道可以初步判定峰2为全反式新黄质,峰1为顺式-新黄质。顺式异构体的顺式位置主要由顺式双键的位置决定,顺式双键越靠近分子中心,其顺式吸收越强[13],出峰越早,15-和13-顺式异构体在全反式之前出现,结合峰1的顺式吸收波长和3 个最大吸收波长[14],判定其为13-顺式-新黄质。峰3的MS图中,分子离子峰为m/z 601.4,主要离子碎片有m/z 583.4、565.4、547.4、509.4,分别为裂解失去一分子水、两分子水、三分子水、一分子甲苯[15],峰3的3 个最大吸收波长为398、 422、448 nm,比新黄质最大吸收波长小20 nm左右[10],故初步鉴定峰3为新色素。
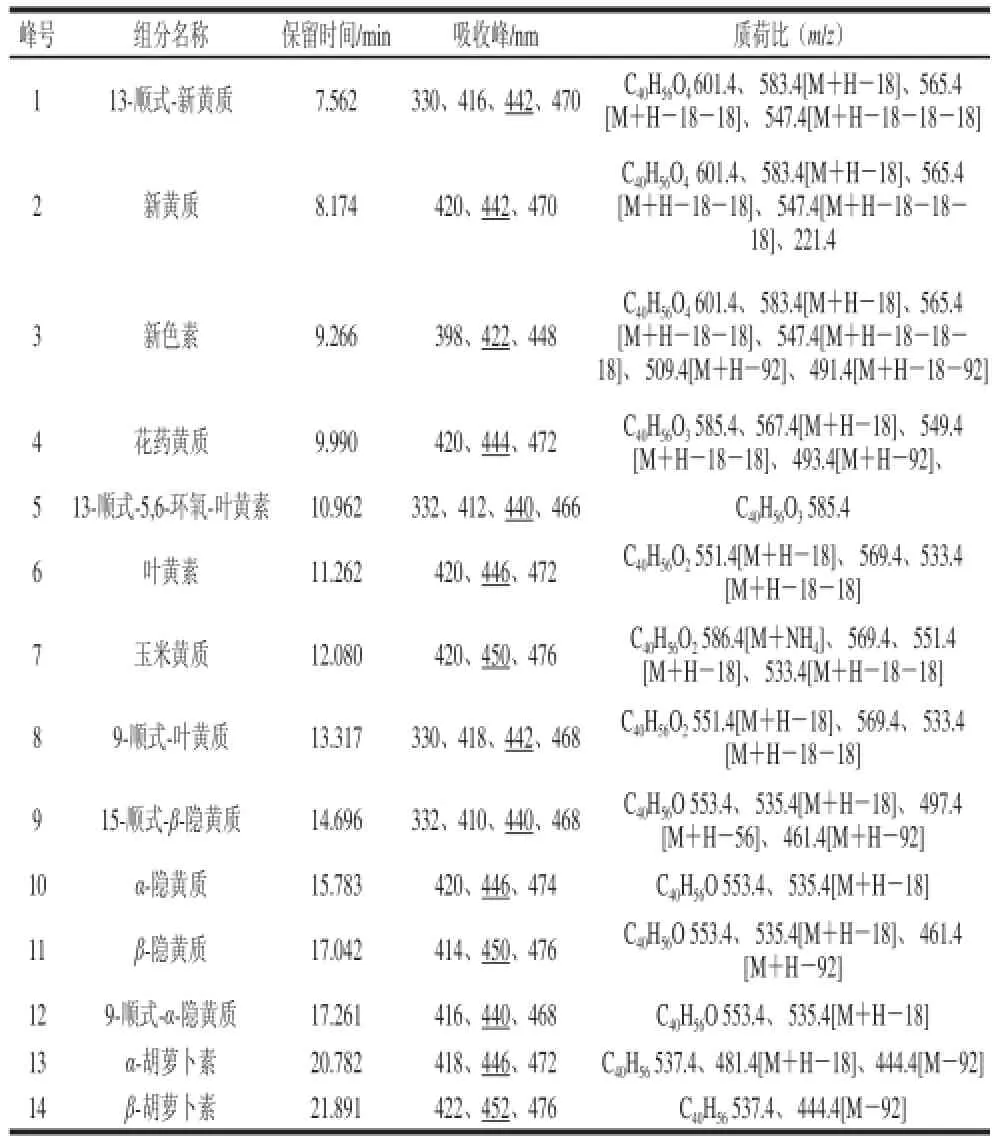
表2 ‘晶甜3号’玉米籽粒中主要类胡萝卜素组分鉴定结果Table 2 Identifi cation of carotenoids in ‘Jingtian No.3’ corn grain rain

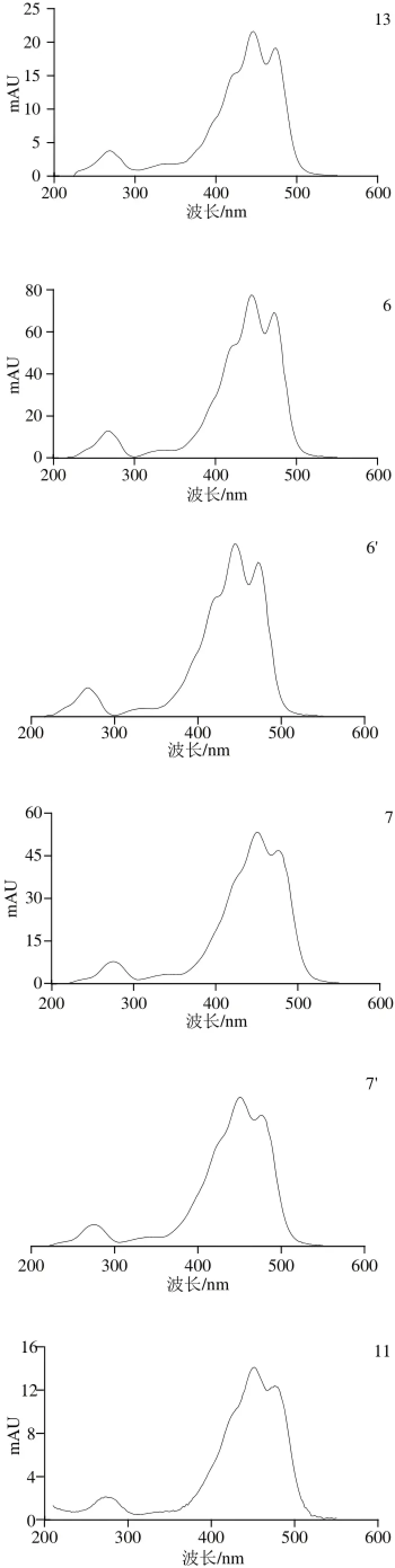
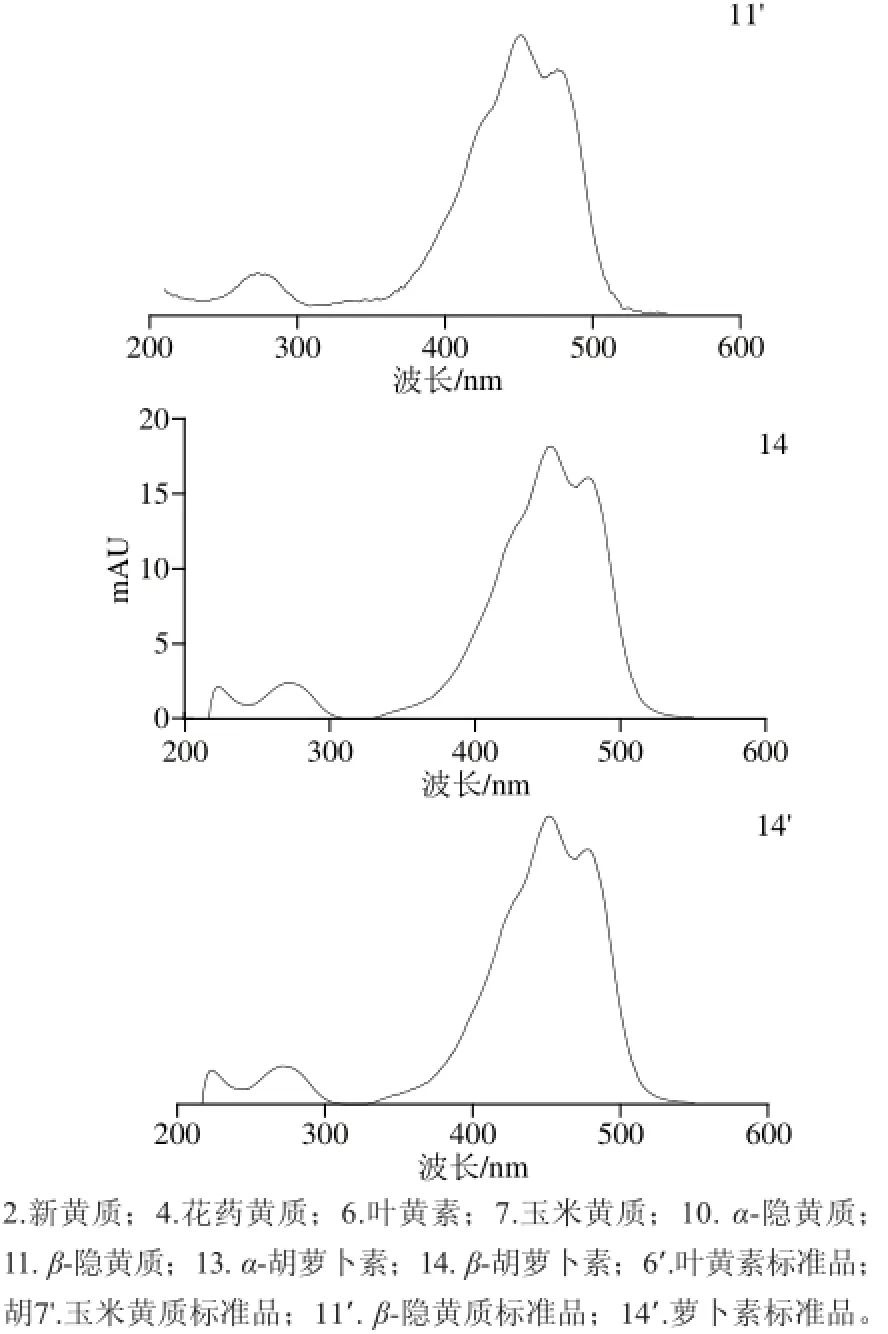
图2 ‘晶甜3号’玉米籽粒中主要类胡萝卜素组分吸收光谱图Fig.2 Absorption spectra of major carotenoids in‘Jingtian No.3’ corn grain

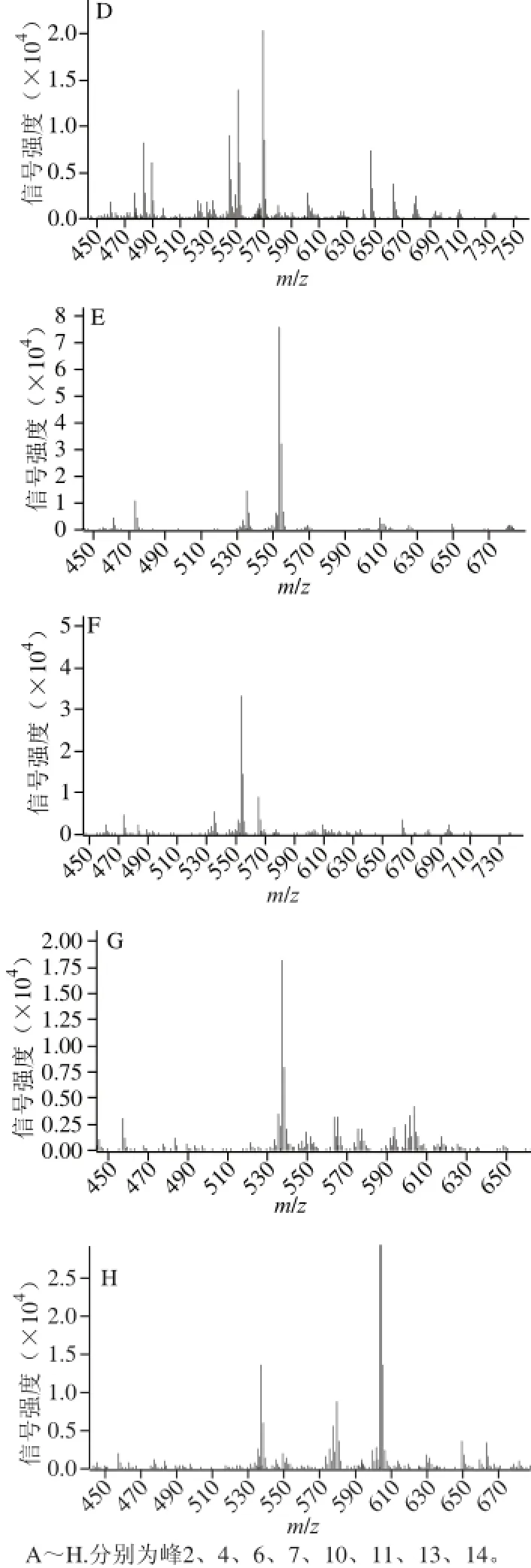
图3 ‘晶甜3号’玉米籽粒中主要类胡萝卜素二级MMSS图Fig.3 MS2spectra of major carotenoids in ‘Jingtian No.3’ corn grain
由图2、3可知,峰4的3 个最大吸收波长为420、444、472 nm,一级MS中的分子离子峰m/z 585.4,二级MS中主要碎片离子峰为m/z 567.4、549.4、493.4,与花药黄质的MS特征相符[16]。峰5的一级MS中分子离子峰为m/z 585.4,主要离子碎片峰为m/z 567.4、549.4、467.4、427.4,与叶黄素的分子离子峰为m/z 569.4以及二级MS中主要碎片峰m/z 551.4、495.4、459.4、429.4比较发现,峰5的主要碎片峰m/z 均比叶黄素m/z的少2 个H,因此推测峰5的部分结构与叶黄素结构相似,峰5的3 个最大吸收波长分别为410、438、466 nm,且在332 nm波长处有个顺式吸收峰,与13-顺式-5,6-环氧-叶黄素[17]相似,故可鉴定峰5为13-顺式-5,6-环氧-叶黄素。
峰8的二级MS图与峰6的相似,均具有共同的离子碎片:[M+H+-H2O](m/z 551.4)、[M+H+-2H2O](m/z 533.4)、[M+H+-H2O-C7H8](m/z 459.4),可以初步判定峰8是叶黄素的顺势异构体,由于类胡萝卜素分子中的羟基引入或修饰对其电子吸收光谱特征的影响不大,而叶黄素与β-胡萝卜素具有相同的异戊二烯结构特性[18],因此在相应位置异构体的洗脱顺序应相同。峰8的吸收峰波长为330、414、442、468 nm,故初步鉴定峰8为9-顺式-叶黄素[19]。同样,对比峰9的MS图,发现其与峰11全反式-β-隐黄质有共同的分子离子碎片,除了3 个最大吸收波长和全反式-β-隐黄质相差0~4 nm外,还有一个顺式吸收波长330 nm,可以初步判定峰9为15-顺式-β-隐黄质[20]。
由图2、3可知,峰10的3 个最大吸收波长分别为420、446、472 nm,分子离子峰为m/z 553.4,离子碎片峰为m/z 535.5、509.5、461.5,与α-隐黄质相似[21],所以鉴定为α-隐黄质。峰12的MS图显示其一级MS中分子离子峰为m/z 553.4,二级MS中主要离子碎片峰为m/z 535.5、509.5、461.5,与α-隐黄质MS特征一致,峰12的3 个最大吸收波长为416、440、468 nm,此外在334 nm波长处有一个顺式吸收峰,根据相关文献[17]报道,可以初步确定峰12为9-顺式-α-隐黄质。由色谱图和MS图可知峰13的3 个最大吸收波长分别为418、446、472 nm,分子离子峰为m/z 537.4,与α-胡萝卜素相符[22],故鉴定峰13为α-胡萝卜素。
2.2不同品种玉米鲜食籽粒中类胡萝卜素含量差异

表3 不同品种鲜食玉米籽粒中类胡萝卜素组分和含量Table 3 Carotenoid contents of fresh corn grains from different cultivars μg/g
由表3可以看出,甜、糯玉米类胡萝卜素种类存在一定差异。‘晶甜3号’和‘晶甜5号’甜玉米籽粒中类胡萝卜素种类相对比较多,分别为14 种和15 种。而‘苏玉糯11号’、‘晶糯8号’和‘京甜紫花糯2号’糯玉米中类胡萝卜素种类较少,分别为8、9种和7 种。在所有鲜食玉米中均能检测到13-顺式-新黄质、新黄质、新色素、花药黄质、叶黄素、玉米黄质。‘晶甜5号’和‘晶甜3号’甜玉米籽粒中α-隐黄质和β-隐黄质含量较高,而在糯玉米品种中均未检测出。
不同品种籽粒间的总类胡萝卜素含量不同,其中‘晶甜5号’玉米籽粒中总类胡萝卜素含量最高,为39.68 μg/g,‘苏玉糯11号’玉米籽粒中总类胡萝卜素含量最低,仅占‘晶甜5号’品种的7.34%。‘晶甜3号’和‘晶甜5号’甜玉米籽粒中的类胡萝卜素以玉米黄质、叶黄素为主,其次为花药黄质和新黄质,其中玉米黄质含量分别占总含量的33.86%和27.24%,为甜玉米品种中含量最高的类胡萝卜素,这与Scott等[23]研究结果一致。甜玉米籽粒中各类胡萝卜素组分含量也存在差异,‘晶甜5号’玉米籽粒中玉米黄质和叶黄素含量较‘晶甜3号’分别高10.28%和31.02%。3 种糯玉米总类胡萝卜素含量较低,与甜玉米相比,糯玉米籽粒中玉米黄质含量最高,其次为新黄质、花药黄质和叶黄素。新黄质和花药黄质在‘苏玉糯11号’品种中含量较高,达到总类胡萝卜素的30%,而在‘晶甜5号’中新黄质和花药黄质仅占总量的13.11%。Hu Qingping等[24]认为不同色系糯玉米之间类胡萝卜素含量有明显不同,黄色糯玉米中类胡萝卜素含量最高,本实验进一步表明不同类型以及同一类型不同品种之间的类胡萝卜素含量也存在明显差异,这可能是因为类胡萝卜素合成受遗传因素的控制,与其代谢合成途径内相关基因的表达有关[25]。
3 结 论
本实验通过建立C30-HPLC-DAD-APCI-MS分析技术对鲜食甜、糯玉米籽粒中类胡萝卜素进行定性和定量测定,分别从‘晶甜3号’、‘晶甜5号’、‘苏玉糯11号’、‘京甜紫花糯2号’和‘晶糯8号’5 个品种中鉴定出了14、15、8、7 种和9 种主要的类胡萝卜素。其中,‘晶甜5号’玉米籽粒中类胡萝卜素总含量最高,为39.68 μg/g,‘晶甜3号’次之,而糯玉米籽粒中类胡萝卜素总含量较低,在2.10~3.69 μg/g范围内。玉米黄质在所有供试品种中的含量均最高,是鲜食玉米籽粒中类胡萝卜素的主要成分,甜玉米籽粒中类胡萝卜素主要组分为玉米黄质、叶黄素和α-隐黄质,而糯玉米籽粒中类胡萝卜素主要组分为玉米黄质、新黄质和花药黄质。这些差异为今后高含量类胡萝卜素鲜食玉米品种筛选与资源开发利用提供了参考。
[1] OLSON J A. Carotenoids and human health[J]. Archivos Latinoamericanos de Nutricion, 1999, 49(Suppl 31): 7-11.
[2] CLINTON S K. Lycopene: chemistry, biology, and implications for human health and disease[J]. Nutrition Reviews, 1998, 56(2): 35-51.
[3] KURILICH A C, JUVIK J A. Quantification of carotenoid and tocopherol antioxidants in Zea mays[J]. Journal of Agricultural and Food Chemistry, 1999, 47(5): 1948-1955.
[4] 冯发强, 王国华, 王青峰, 等. 甜玉米乳熟期籽粒维生素A源和维生素E组分的变异[J]. 作物学报, 2014, 40(7): 1227-1234.
[5] 惠伯棣, 张西, 文镜. 反相C30柱在HPLC分析类胡萝卜素中的应用[J].食品科学, 2005, 26(1): 264-270.
[6] SANDER L C, SHARPLESS K E, PURSCH M. C30Stationary phases for the analysis of food by liquid chromatography[J]. Journal of Chromatography A, 2000, 880(1): 189-202.
[7] de ROSSO V V, MERCADANTE A Z. Identification and quantification of carotenoids, by HPLC-PDA-MS/MS, from Amazonian fruits[J]. Journal of Agricultural and Food Chemistry,2007, 55(13): 5062-5072.
[8] RIVERA S, CANELA R. Infl uence of sample processing on the analysis of carotenoids in maize[J]. Molecules, 2012, 17(9): 11255-11268.
[9] de ROSSO V V, MERCADANTE A Z. HPLC-PDA-MS/MS of anthocyanins and carotenoids from dovyalis and tamarillo fruits[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 9135-9141.[10] PERRY A, RASMUSSEN H, JOHNSON E J. Xanthophyll (lutein,zeaxanthin) content in fruits, vegetables and corn and egg products[J]. Journal of Food Composition and Analysis, 2009, 22(1): 9-15.
[11] LIN C H, CHEN B H. Determination of carotenoids in tomato juice by liquid chromatography[J]. Journal of Chromatography A, 2003,1012(1): 103-109.
[12] CHEN B H, HUANG J H. Degradation and isomerization of chlorophyll a and β-carotene as affected by various heating and illumination treatments[J]. Food Chemistry, 1998, 62(3): 299-307.
[13] TAI C Y, CHEN B H. Analysis and stability of carotenoids in the flowers of daylily (Hemerocallis disticha) as affected by various treatments[J]. Journal of Agricultural and Food Chemistry, 2000,48(12): 5962-5968.
[14] MAMATHA B S, ARUNKUMAR R, BASKARAN V. Effect of processing on major carotenoid levels in corn (Zea mays) and selected vegetables: Bioavailability of lutein and zeaxanthin from processed corn in mice[J]. Food and Bioprocess Technology, 2012, 5(4):1355-1363.
[15] ZEPKA L Q, MERCADANTE A Z. Degradation compounds of carotenoids formed during heating of a simulated cashew apple juice[J]. Food Chemistry, 2009, 117(1): 28-34.
[16] CHEN J P, TAI C Y, CHEN B H. Improved liquid chromatographic method for determination of carotenoids in Taiwanese mango(Mangifera indica L.)[J]. Journal of Chromatography A, 2004,1054(1): 261-268.
[17] BREITHAUPT D E, SCHWACK W. Determination of free and bound carotenoids in paprika by LC/MS[J]. European Food Research and Technology, 2000, 211(1): 52-55.
[18] JACKSON H, BRAUN C L, ERNST H. The chemistry of novel xanthophyll carotenoids[J]. The American Journal of Cardiology,2008, 101(Suppl 10): 50-57.
[19] ACHIR N, RANDRIANATOANDRO V A, BOHUON P, et al. Kinetic study of β-carotene and lutein degradation in oils during heat treatment[J]. European Journal of Lipid Science and Technology,2010, 112(3): 349-361.
[20] KAO T H, LOH C H, JNBARA B S, et al. Determination of carotenoids in Taraxacum formosanum by HPLC-DAD-APCI-MS and preparation by column chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66:144-153.
[21] KURZ C, CARLE R, SCHIEBER A. HPLC-DAD-MS characterisation of carotenoids from apricots and pumpkins for the evaluation of fruit product authenticity[J]. Food Chemistry, 2008, 110(2): 522-530.
[22] GLASER T, LIENAU A, ZEEB D, et al. Qualitative and quantitative determination of carotenoid stereoisomers in a variety of spinach samples by use of MSPD before HPLC-UV, HPLC-APCI-MS, and HPLC-NMR on-line coupling[J]. Chromatographia, 2003, 57(Suppl 1): 19-25.
[23] SCOTT C E, ELDRIDGE A L. Comparison of carotenoid content in fresh, frozen and canned corn[J]. Journal of Food Composition and Analysis, 2005, 18(6): 551-559.
[24] HU Qingping, XU Jianguo. Profiles of carotenoids, anthocyanins,phenolics, and antioxidant activity of selected color waxy corn grains during maturation[J]. Journal of Agricultural and Food Chemistry,2011, 59(5): 2026-2033.
[25] 崔丽娜, 高荣岐, 孙爱清, 等. 不同基因型玉米籽粒类胡萝卜素与花色苷色素积累规律[J]. 作物学报, 2010, 36(5): 818-825.
Identifi cation and Analysis of Carotenoids from Different Fresh Corn Grains
CHEN Jieqiong1,2, SONG Jiangfeng2, HE Meijuan1,2, LI Dajing1,2,3,*, LIU Chunquan2,3, ZHANG Yuan1,2
(1. College of Food and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;3. National Research and Development Center for Vegetable Processing, Nanjing 210014, China)
In order to identify the characteristics of carotenoids in fresh corns from different cultivars, high performance liquid chromatography (HPLC) coupled with diode array detection (DAD) and atmospheric-pressure chemical ionizationmass spectroscopy (APCI-MS) were applied to identify and quantify the major carotenoids of fresh sweet and waxy corn grains from fi ve cultivars. A total of 14 and 15 carotenoids were identifi ed from sweet corn grains ‘Jingtian No.3’ and ‘Jingtian No.5’, respectively, while only a few carotenoids were detected in waxy corn grains ‘Suyunuo No.11’, ‘Jingtianzihuanuo No.2’ and ‘Jingnuo No.8’. Neochrome, antheraxanthin and 13-cis-lutein-5,6-epoxide were first reported in fresh corn. The content of carotenoid in sweet corn was highest, reaching 39.68 μg/g dry weight (DW), but there were differences in different varieties. The major carotenoids were zeaxanthin, lutein and α-cryptoxanthin. The content (about 2.10-3.69 μg/g DW) of carotennoid in waxy corn was lower. The major carotenoids were zeaxanthin, neoxanthin and antheraxanthin. Therefore, it might be concluded that the contents and chemical composition of carotenoids were extremely different among different cultivars of fresh sweet and waxy corns.
sweet corn; waxy corn; carotenoid; C30-HPLC-DAD-APCI-MS
TS201.2
A
1002-6630(2015)18-0108-06
10.7506/spkx1002-6630-201518020
2014-12-28
江苏省农业科技自主创新资金项目(CX (14) 2055)
陈洁琼(1990—),女,硕士研究生,研究方向为食品营养与化学。E-mail:2013108073@njau.edu.cn
李大婧(1976—),女,研究员,博士,研究方向为食品营养化学。E-mail:lidajing@163.com

