正交试验优化葡萄酒泥酵母甘露聚糖提取工艺及其体外抗氧化作用
杨学山,祝 霞,李 颍,杨 婷,韩舜愈
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学食品科学与工程学院,甘肃 兰 州 730070)
正交试验优化葡萄酒泥酵母甘露聚糖提取工艺及其体外抗氧化作用
杨学山1,祝 霞2,李 颍2,杨 婷2,韩舜愈2
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学食品科学与工程学院,甘肃 兰 州 730070)
以诱导自溶的葡萄酒泥酵母细胞壁为试材,通过单因素试验及L9(34)正交试验优化酵母甘露聚糖提取工艺参数,并对其抗氧化活性进行测定。结果表明:在料液比1∶17.5(g/mL)、KOH质量分数3%、浸提时间1.5 h、浸提温度100 ℃的最优条件下,甘露聚糖提取率为18.37%;酵母甘露聚糖清除ABTS+·、羟自由基、1,1-二苯基-2-三硝基苯肼自由基、超氧阴离子自由基和螯合Fe2+的半数有效质量浓度(EC50)分别为1.156、1.550、9.724、2.387、0.669 mg/mL,具有良好的体外抗氧化活性。
葡萄酒泥酵母;甘露聚糖;提取率;抗氧化活性
甘露聚糖由80%~90%甘露糖和5%~20%蛋白质以共价键形式连接,位于酵母细胞壁外侧,占细胞壁干质量的35%~45%,是免疫功能最强的天然多糖之一[1-2]。随着葡萄酒产业的快速发展,我国每年会产生约40 000 t富含功能多糖的葡萄酒泥酵母,利用其开发甘露聚糖,既可大大降低原料生产成本,又可避免直接排放造成环境污染[3-4]。
抗氧化性是多糖生物学活性的重要评价指标之一[5],具有抗氧化功能的多糖在免疫调节、抑制肿瘤、预防食品腐败变质等方面均具有积极效果[6-8]。国内外学者已对植物和真菌来源的多糖抗氧化活性进行了大量研究[9-13],但对酵母多糖,特别是甘露聚糖多见于提取方法、结构表征及免疫学活性方面[14-18],对其抗氧化性评价尚未见报道。本研究以诱导自溶后的葡萄酒泥酵母细胞壁为试材,以甘露聚糖提取率为评价指标,优化甘露聚糖提取工艺,并对甘露聚糖抗氧化活性进行研究,旨在为拓展甘露聚糖用途和促进葡萄酒泥酵母资源化开发提供技术支持。
1 材料与方法
1.1材料与试剂
葡萄酒酵母泥 甘肃祁连葡萄酒业有限公司;甘露糖标准品(纯度≥99%)、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、菲洛嗪、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度≥98%) 上海源叶生物科技有限公司;醋酸、三氯乙酸、无水乙醇、抗坏血酸、过氧化氢、水杨酸钠、氯化亚铁、乙二胺四乙酸等试剂均为国产分析纯。
1.2仪器与设备
TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;HH-6数显恒温水浴锅 国华电器有限公司;TDZ5-WS湘仪离心机 长沙湘仪离心机仪器有限公司;SL-1001电子天平 上海民桥精密科学仪器有限公司;PHS-3C pH计 上海雷磁有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.3方法
1.3.1酵母甘露聚糖提取工艺流程
葡萄酒泥→预处理→酵母细胞诱导自溶→KOH提取→脱蛋白精制→乙醇醇析(2∶1,mL/g)→丙酮、乙醚洗涤(2∶1,mL/g)→透析→干燥→甘露聚糖样品
1.3.2操作要点
葡萄酒泥预处理:收集葡萄酒酒泥,与蒸馏水以1∶1(g/mL)混合,用80目筛筛分,4 000 r/min离心15 min,重复上述步骤,直至上清液无色透明为止,收集湿酵母备用[3]。诱导自溶:参照本实验室建立的方法,取酵母细胞悬浮于30 mL pH 4.5、添加质量分数2%NaCl的醋酸-醋酸钠缓冲液中,47.5 ℃诱导自溶33 h。甘露聚糖提取:取2.5 g酵母自溶后细胞壁,以料液比1∶15(g/mL)、添加质量分数为3%的KOH混悬,100 ℃浸提2.0 h。脱蛋白精制:向含有甘露聚糖的上清液中加入质量分数9%的三氯乙酸溶液调节pH 3,4 ℃静置12 h除去蛋白质[19],上清液加入无水乙醇醇析12 h,丙酮、乙醚洗涤后沉淀用蒸馏水溶解,所得溶液依次用自来水透析48 h,蒸馏水透析24 h,透析完成后,将透析袋(8 000~14 000 D)内溶液进行冷冻干燥即得甘露聚糖。
1.3.3单因素试验设计
参照文献[1 4]及预实验结果,固定其他因素水平,分别考察料液比(1∶10、1∶12.5、1∶15、1∶17.5、1∶20)、KOH质量分数(1%、2%、3%、4%、5%)、浸提时间(1.0、1.5、2.0、2.5、3.0 h)和浸提温度(80、90、100、110、120 ℃,温度超过90 ℃使用高压灭菌锅)对甘露聚糖提取率的影响。
1.3.4正交试验优化
根据单因素试验结果确定葡萄酒泥酵母甘露聚糖提取的正交试验因素和水平,采用L9(34)正交试验设计,优化甘露聚糖提取工艺,重复3次。
1.3.5甘露聚糖含量的紫外分光光度法[20]测定
1.3.5.1标准曲线制作
准确配制甘露糖质量浓度分别为25、50、75、100、125、150、175、200 μg/mL的系列溶液,在280 nm波长条件下,分别测定甘露糖在90% H2SO4溶液中不加NaCl-H3BO3(A1)或加NaCl-H3BO3(A2),70 ℃水浴25 min 条件下的吸光度(A),甘露糖含量与ΔA值(A1-A2)呈线性相关。实验所得标准曲线回归方程为y=0.001 3x+0.002 1,相关系数R2=0.999 4,表明甘露糖在所取质量浓度范围内吸光度呈良好线性关系。
1.3.5.2样品处理
称取2 0 m g甘露聚糖,不断碾磨使其溶解于2.5 mL 72% H2SO4溶液中,室温放置3 h,加蒸馏水使硫酸的最终浓度为4 mol/L左右,然后100 ℃酸水解4 h,取出冷却至室温,用NaOH调pH值至中性,再用0.2 mol/L pH 7.0磷酸缓冲液定容至100 mL。
1.3.5.3甘露糖样品质量浓度测定
取0.2 mL样液,按1.3.5.1节方法测吸光度,求得ΔA,根据标准曲线计算甘露糖质量浓度。
1.3.6甘露聚糖提取率计算

1.3.7甘露聚糖抗氧化活性测定
1.3.7.1抗氧化物制备
在上述优化条件下提取甘露聚糖,参照文献[16]方法,采用活性炭脱色法去除甘露聚糖中的色素成分。浓缩、干燥后配制质量浓度为0.1、0.6、1.1、1.6、2.1、2.6、3.1 mg/mL的甘露聚糖测定液,并分别配制相同质量浓度的阳性对照VC和EDTA溶液。
1.3.7.2ABTS+·清除能力测定
参照文献[21]方法。按式(3)计算甘露聚糖对ABTS+·清除率,用同等质量浓度的VC做阳性对照,重复3 次。

式中:A0为ABTS工作液和乙醇的吸光度;A1为ABTS工作液和甘露聚糖的吸光度。
1.3.7.3羟自由基清除能力测定
参照文献[21]方法。按式(4)计算甘露聚糖对羟自由基清除能力,以VC为阳性对照,重复3 次。
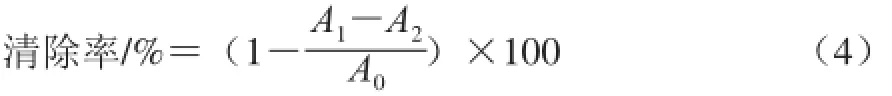
式中:A0为羟自由基吸光度;A1为加入甘露聚糖溶液的吸光度;A2为只含甘露聚糖溶液的吸光度。
1.3.7.4DPPH自由基清除能力测定
参照文献[22]方法。按式(4)计算甘露聚糖对DPPH自由基清除率,以VC为阳性对照,重复3 次。

式中:A0为DPPH自由基和磷酸钠盐缓冲液的吸光度;A1为DPPH和甘露聚糖溶液的吸光度;A2为甘露聚糖和磷酸钠盐缓冲液的吸光度。
1.3.7.5超氧阴离子自由基清除能力测定
参照文献[22]方法。按式(6)计算甘露聚糖对超氧阴离子自由基清除率,对VC为阳性对照,重复3 次。

式中:ΔA0为邻苯三酚自氧化速率;ΔA1为加入甘露聚糖水解液后邻苯三酚的氧化速率;A2为只含甘露聚糖时溶液的吸光度。
1.3.7.6Fe2+螯合能力测定
参照文献[23]方法。按式(7)计算甘露聚糖对Fe2+螯合能力,以EDTA为阳性对照,重复3 次。

式中:A0为不含甘露聚糖溶液吸光度;A1为在甘露聚糖存在时溶液吸光度。
1.4数据统计分析及半数有效浓度(median effective concentration,EC50)计算
实验所得数据均采用SPSS 18.0进行分析处理。
EC50是指清除率为50%时甘露聚糖、VC或EDTA的质量浓度,采用Logit回归计算。EC50可作为评价抗氧化能力的重要参数,如某种物质的EC50低于10 mg/mL,则表明其具有很好的抗氧化活性[12]。
2 结果与分析
2.1单因素试验结果
2.1.1料液比对甘露聚糖提取率的影响

图1 料液比对甘露聚糖提取率的影响Fig.1 Effect of solid/liquid ratio on the extraction yield of mannan
由图1可知,料液比为1∶15(g/mL)时,甘露聚糖提取率达到最大值12.57%,因此选择其为较佳料液比。料液比在1∶15(g/mL)之前时,甘露聚糖提取率随溶剂用量的增加而增加,说明在料液比较低时,影响细胞壁分散,提取剂作用不彻底;料液比在1∶15(g/mL)之后时,提取率有所下降,可能是增大溶剂用量时,增加了后续提取处理的难度,引起提取物的损失[15]。
2.1.2KOH质量分数对甘露聚糖提取率的影响
随着近几年服务行业的迅猛发展,服务供应链的研究逐渐受到了学者们的重视。服务供应链包括各个不同的节点,一般是服务提供商、服务集成商和客户等,各个企业在自身经营过程中,由于逐利性会导致各个节点企业在空间、时间等方面产生矛盾,不易实现整体的协调,而服务供应链各节点企业的协调与否与服务供应链绩效有着莫大的关系。因此,服务供应链上下游关系的有效协调至关重要。服务供应链是由服务各方因共同合作而产生的供应链,由于服务的特性使然,与传统的产品供应链相比,服务供应链中各参与方之间的关系有较大的不同。这些差异的特征逐渐引起了学者的兴趣。
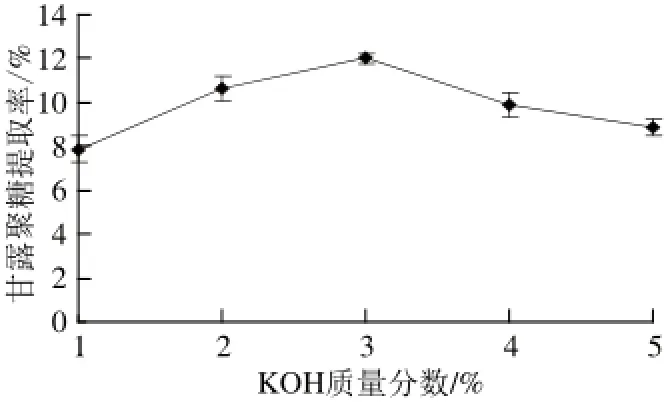
图2 KOH质量分数对甘露聚糖提取率的影响Fig.2 Effect of KOH concentration on the extraction yield of mannan
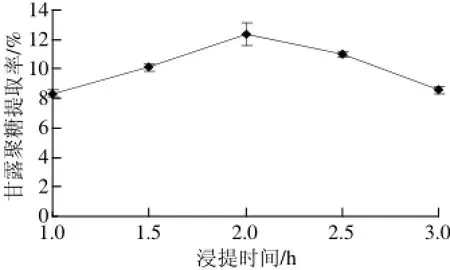
图3 浸提时间对甘露聚糖提取率的影响Fig.3 Effect of extraction time on the extraction yield of mannan
由图2可知,当KOH质量分数为3%时,甘露聚糖提取率为12.02%,提取效果好,所以选择3%为KOH作用质量分数。KOH质量分数小于3%时,低质量分数KOH对细胞壁作用不充分;反之,高质量分数的KOH对甘露聚糖的结构破坏较大,导致提取率降低[19]。
2.1.3浸提时间对甘露聚糖提取率的影响
由图3可知,浸提时间为2 h时,甘露聚糖提取效果最好,提取率为12.36%,所以选择2 h为较佳浸提时间。浸提时间小于2 h 时,由于时间较短,提取不充分;当浸提时间大于2 h时,随着浸提时间延长,甘露聚糖降解,使其提取率降低。
2.1.4浸提温度对甘露聚糖提取率的影响
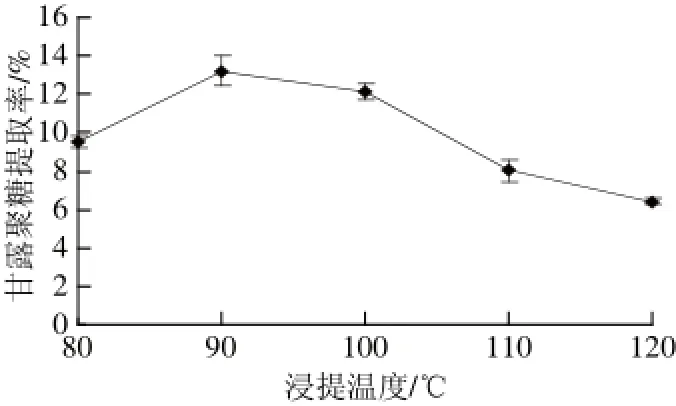
图4 浸提温度对甘露聚糖提取率的影响Fig.4 Effect of temperature on the extraction yield of mannan
由图4可知,浸提温度不同,甘露聚糖提取率不同。甘露聚糖在90 ℃时,提取率达13.19%,所以选择90 ℃为较佳浸提温度。当温度小于90 ℃时,提取率随温度的升高呈上升趋势,说明较高的温度有利于浸提反应进行;过高的浸提温度会在一定程度破坏甘露聚糖结构,使提取率呈现下降趋势[17]。
2.2正交试验结果
根据单因素试验结果,以甘露聚糖提取率为考察指标,进行了L9(34)正交试验,试验结果见表1。通过直观分析和极差分析得到最优组合,确定葡萄酒泥酵母甘露聚糖的最优提取工艺条件。
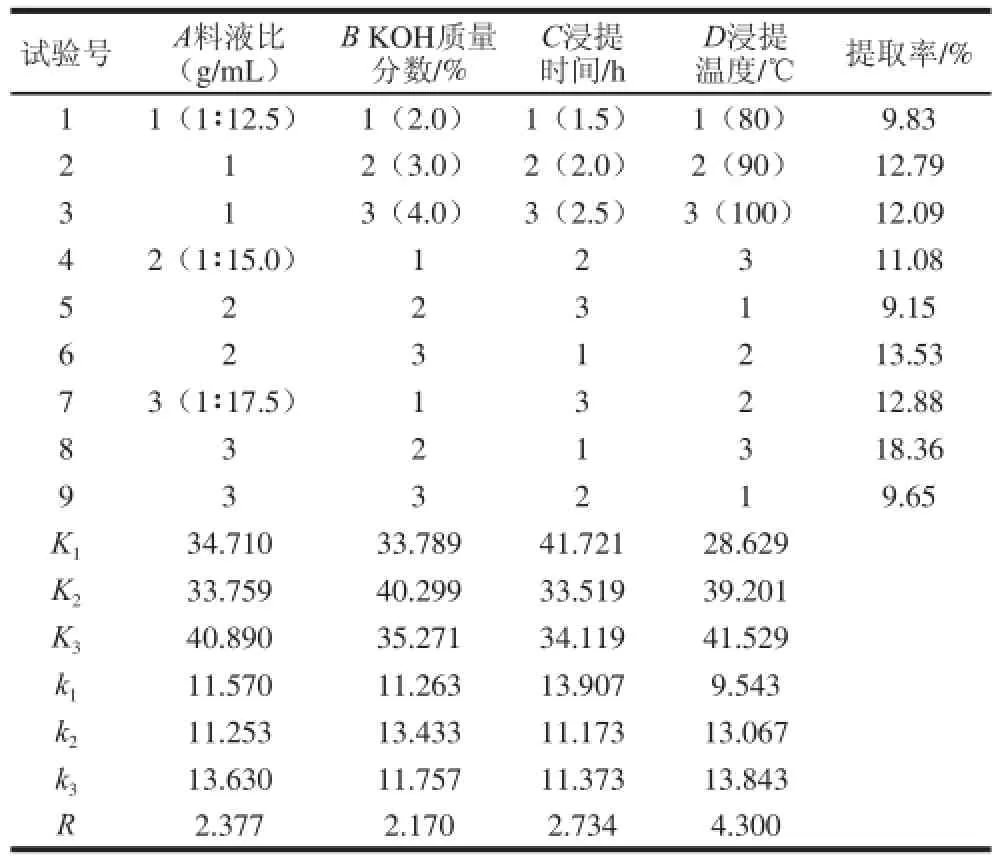
表1 L 1 L9(334)正交试验设计及结果Table 1 Le 1 L9(3 34) orthogonal array design and experimental results) orthogonal array design and experimental results
由表1可知,影响甘露聚糖提取效果因素的主次顺序为:D>C>A>B,由K值可以确定其正交试验的最优组合为A3B2C1D3,即料液比1∶17.5(g/mL)、KOH质量分数3%、浸提时间1.5 h、浸提温度100 ℃。

表2 正交试验方差分析结果Table 2 Analysis of variance for the orthogonal array design
为了验证工艺条件的可靠性,在最优条件下提取甘露聚糖3 次,提取率平均值为18.37%。与梁新乐等[15]使用质量分数6%的KOH,甘露聚糖提取率4.65%相比,碱用量降低了3%,提取率提高了4 倍左右;与朱红蕾等[16]使用质量分数5%的NaOH溶液,甘露聚糖提取率4.4%相比,碱用量降低了2%,提取率提高了4 倍左右。由此可见,采用正交优化试验得到提取甘露聚糖最佳条件的数据可靠,具有使用价值。
用SPSS 18.0统计软件对试验结果进行方差分析,由表2可知,因素C和D在P<0.05的水平上有显著性差异,因素A和B不显著。
2.3甘露聚糖的抗氧化性
2.3.1甘露聚糖对ABTS+·清除能力

图5 甘露聚糖及VC对ABBTTSS+·清除作用Fig.5 Scavenging effects of mannan and VC on ABTS+radical
测定生物样品ABTS+·清除能力是评价其总抗氧化能力的一种常用方法[21]。由图5可知,甘露聚糖清除ABTS+·能力存在质量浓度相关性,甘露聚糖在0~3.1 mg/mL范围内清除率增加趋势较稳定,VC在0~1.6 mg/mL范围内清除率增加明显,1.6~3.1 mg/mL范围内增加趋势平缓。甘露聚糖和VC质量浓度达到3.1 mg/mL时,对ABTS+·清除率分别为84.85%和98.17%,甘露聚糖和VC对ABTS+·的EC50值分别为1.156 mg/mL和0.134 mg/mL。
2.3.2甘露聚糖对羟自由基清除能力

图6 甘露聚糖及VC对羟自由基清除作用Fig.6 Scavenging effects of mannan and VC on hydroxyl radical
清除羟自由基对保护生物膜系统、预防组织破坏和细胞凋亡十分重要[24]。由图6可知,甘露聚糖具有一定的羟自由基清除能力,清除率随质量浓度的增加而增大。在质量浓度为0~0.6 mg/mL时,甘露聚糖及VC对自由基清除率都迅速增加,之后趋势变缓;甘露聚糖由质量浓度由0.6 mg/mL增加至3.1 mg/mL时,羟自由基清除率只增加了14%,低于VC增加值(28.02%)。甘露聚糖和VC的EC50值分别为1.550 mg/mL和0.347 mg/mL。

图7 甘露聚糖及VC对DPPH自由基清除作用Fig.7 Scavenging effects of mannan and VC on DPPH radical
2.3.3甘露聚糖对DPPH自由基清除能力待测样品清除DPPH自由基能力可评价其阻断脂质过氧化链反应的水平[21,24]。由图7可知,当质量浓度达到3.1mg/mL时,甘露聚糖和VC对DPPH自由基清除率分别为39.86%和97.88%。甘露聚糖和VC清除DPPH自由基的EC50值分别为9.724 mg/mL和0.316 mg/mL,甘露聚糖清除DPPH自由基能力低于VC。
2.3.4甘露聚糖对超氧阴离子自由基清除能力

图8 甘露聚糖及VC对超氧阴离子自由基清除作用Fig.8 Scavenging effects of mannan and VC on superoxide anion radical

图9 甘露聚糖及EDTA对Fee2+螯合作用Fig.9 Chelating effects of mannan and EDTA on Fe2+
超氧阴离子自由基尽管氧化作用较弱,但其能够转化成具有更强氧化能力的单线态氧(1O2)和羟自由基诱导脂质过氧化作用,因此清除超氧阴离子自由基十分必要[23]。由图8可知,甘露聚糖具有一定的超氧阴离子自由基清除能力,VC在0~1.6 mg/mL范围内时,自由基清除率增加较快;甘露聚糖在质量浓度0~3.1 mg/mL范围内,清除率变化趋势平缓;当质量浓度达到3.1 mg/mL时,甘露聚糖对超氧阴离子自由基清除率为54.76%,而VC的清除率为98.52%。甘露聚糖和VC的EC50值分别为2.387 mg/mL和0.496 mg/mL。
2.3.5甘露聚糖对Fe2+螯合作用
Fe2+极易催化脂质、蛋白质和其他细胞组分氧化,引起组织氧化损伤,对Fe2+螯合能力测定也是评价抗氧化剂抗氧化性能的常用方法[23]。如图9所示,甘露聚糖具有较强的Fe2+螯合能力,质量浓度达到3.1 mg/mL时,甘露聚糖对Fe2+螯合率为82.18%,EDTA对Fe2+螯合率为90.37%,EC50值分别为0.669 mg/mL和0.481 mg/mL。
3 结 论
以葡萄酒泥酵母为原料,通过单因素试验及正交优化试验,对影响酵母甘露聚糖提取率的因素料液比、KOH质量分数、浸提时间、浸提温度进行了研究,通过L9(34)正交试验优化确定的最优工艺参数为料液比1∶17.5(g/mL)、KOH质量分数3%、浸提时间1.5 h、浸提温度100 ℃,在此最佳条件下,甘露聚糖提取率为18.37%。
体外抗氧化活性结果显示,甘露聚糖抗氧化活性呈较为明显的量效关系,对清除ABTS+·、羟自由基、DPPH自由基、超氧阴离子自由基和螯合Fe2+的EC50值分别为1.156、1.550、9.724、2.387、0.669 mg/mL,均小于10 mg/mL,具有良好的抗氧化活性。甘露聚糖可作为天然抗氧化剂应用于食品、保健品等行业,有关甘露聚糖的抗氧化机理及构效关系有待进一步探讨。
[1] LIU Hongzhi, WANG Qiang, LIU Yuanyuan, et al. Statistical optimization of culture media and conditions for production of mannan by Saccharomyces cerevisiae[J]. Biotechnology and Bioprocess Engineering, 2009, 14(5): 577-583.
[2] HUANG Ganglin, YANG Qin, WANG Zhongbin. Extraction and deproteinization of mannan oligosaccharides[J]. Zeitschrift fur Naturforschung. C, A Journal of Biosciences, 2010, 65(5): 387-390.
[3] 杜娜, 杨学山, 韩舜愈, 等. 超声波辅助酶法分离提取葡萄酒泥酵母SOD工艺条件的优化[J]. 食品科学, 2014, 35(2): 13-16. doi: 10.7506/ spkx1002-6630-201402016.
[4] 徐宝国, 许引虎, 邬善远. 葡萄酒多糖的研究与利用现状[J]. 酿酒,2010, 37(3): 13-15.
[5] 张佳艳, 熊建文. 多糖抗氧化能力体外测定方法研究进展[J]. 粮食科技与经济, 2013, 38(6): 26-29.
[6] 艾自明, 任慧霞. 酿酒酵母胞壁多糖研究概述[J]. 中南药学, 2009,7(10): 762-765.
[7] YE Chunlin, HU Weilian, DAI Dehui. Extraction of polysaccharides and the antioxidant activity from the seeds of Plantago asiatica L.[J]. International Journal of Biological Macromolecules, 2011, 49(4): 466-470.
[8] SAKANAKA S, ISHIHARA Y. Comparison of antioxidant properties of persimmon vinegar and some other commercial vinegars in radicalscavenging assays and on lipid oxidation in tuna homogenates[J]. Food Chemistry, 2008, 17(2): 739-744.
[9] 李洋, 马文平, 倪志婧. 宁夏枸杞体外抗氧化机理研究[J]. 食品科学,2014, 35(1): 79-84. doi: 10.7506/spkx1002-6630-201401015.
[10] 戴喜末, 熊子文, 罗丽萍. 响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J]. 食品科学, 2011, 32(8): 93-97.
[11] 罗建平, 徐学玲, 潘利华, 等. 菠萝皮渣多糖的提取与体外抗氧化活性研究[J]. 食品科学, 2009, 30(18): 172-175.
[12] LEE J, KOO N, MIN D B. Reactive oxygen species, aging, and antioxidative nutraceuticals[J]. Comprehensive Reviews in Food,Science and Food Safety, 2004, 3: 21-33.
[13] WANG Yanping, LIU Yi, HU Yuhong. Optimization of polysaccharides extraction from Trametes robiniophila and its antioxidant activities[J]. Carbohydrate Polymers, 2014, 34(11): 324-332.
[14] 刘红芝, 王强, 周素梅. 酵母甘露聚糖分离提取及功能活性研究进展[J]. 食品科学, 2008, 29(5): 465-468.
[15] 梁新乐, 王俊虎. 红法夫酵母甘露聚糖的提取[J]. 食品研究与开发,2012, 33(7): 60-64.
[16] 徐韧博. 松塔多糖的分离纯化、结构鉴定及抗氧化活性研究[D]. 哈尔滨: 哈尔滨工业大学, 2013.
[17] LIU Xiaoyong, WANG Qiang, LIU Hongzhi, et al. A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae[J]. Food Hydrocolloids, 2008, 22(2): 239-247.
[18] MACHOVA E, BYSTRICKY S. Antioxidant capacities of mannans and glucans are related to their susceptibility of free radical degradation[J]. International Journal of Biological Macromolecules,2013, 61(27): 308-311.
[19] 杜丹, 赵春燕. 啤酒酵母残渣提取甘露聚糖的研究[J]. 食品工业,2006, 27(4): 6-8.
[20] 张运涛, 谷文英. 紫外分光光度法测定啤酒酵母中甘露糖[J]. 食品与发酵工业, 2009, 25(5): 32-36.
[21] 郑善元, 陈填烽, 郑文杰, 等. 单丛茶水提物清除DPPH和ABTS自由基的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(9): 2417-2423.
[22] 张强, 周正义, 储俊, 等. 大蒜、生姜、洋葱醇提物抗氧化活性的比较[J]. 食品与发酵工业, 2010, 46(1): 93-96.
[23] 王晓宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报, 2012, 31(3): 247-252.
[24] 李春阳, 许时婴, 王璋. DPPH法测定葡萄籽原花青素清除自由基的能力[J]. 食品与生物技术学报, 2006, 25(2): 102-106.
Optimization of Extraction Process and in Vitro Antioxidant Activities of Mannan from Waste Wine Yeast
YANG Xueshan1, ZHU Xia2, LI Ying2, YANG Ting2, HAN Shunyu2
(1. College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China;2. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Single factor experiments and an orthogonal array design L9(34) were used in combination to optimize process parameters for the extraction of mannan from the autolyzed cell wall of waste wine yeast. Antioxidant activities of the extracted mannan were also measured in this study. The results showed t hat under the optimum conditions: 1:17.5 (g/mL),3%, 1.5 h and 100 ℃ for solid-to-liquid ratio, KOH concentration, extraction time and extraction temperature, respectively,the extraction yield of mannan was 18.37%. The mannan from wine yeast displayed excellent antioxidant activ ities with half maximal effective concentration (EC50) values of 1.156, 1.550, 9.724, 2.387 and 0.669 mg/mL for scavenging 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS+), hydroxyl, 2,2-diphenyl-1-picrylhydrazyl (DPPH),superoxide anion radicals and chelating Fe2+, respectively.
waste wine yeast; mannan; extraction yield; antioxidant activities
TS261.9
A
1002-6630(2015)18-0069-06
10.7506/spkx1002-6630-201518012
2015-01-27
甘肃省农业生物技术研究与应用开发项目(GNSW-2013-21)
杨学山(1977—),男,副教授,硕士,研究方向为生物化学与生物产品开发。E-mail:yangxs@gsau.edu.cn

