香鳞毛蕨有效部位对糠秕马拉色菌的体外抗真菌作用研究
王 洁, 唐春萍*, 江 涛,2, 沈志滨, 陈艳芬, 黄奕曦
(1.广东药学院中药学院,广东 广州 510006;2.广东药学院实验动物中心,广东 广州 510006)
香鳞毛蕨有效部位对糠秕马拉色菌的体外抗真菌作用研究
王 洁1, 唐春萍1*, 江 涛1,2, 沈志滨1, 陈艳芬1, 黄奕曦1
(1.广东药学院中药学院,广东广州510006;2.广东药学院实验动物中心,广东广州510006)
目的 研究香鳞毛蕨Dryopteris Fragrans有效部位对糠秕马拉色菌的体外抗真菌作用,进一步明确香鳞毛蕨有效部位的抗菌谱。方法 用纸片法、试管内药基法、微量液基稀释法测定香鳞毛蕨有效部位对糠秕马拉色菌2株标准株和4株临床分离菌株的抑菌圈及最低抑菌质量浓度(MIC)。结果 不同质量浓度香鳞毛蕨有效部位贮备液对糠秕马拉色菌标准菌株和临床分离菌株抑菌圈的大小分别为6.7~19.6 mm、6.8~17.1 mm;试管内药基法测定香鳞毛蕨有效部位对糠秕马拉色菌的MIC,对标准菌株MIC为10 mg生药/mL,对临床分离株MIC为5~10 mg生药/mL;微量液体稀释法测定香鳞毛蕨有效部位对糠秕马拉色菌的MIC,对标准菌株MIC为1.56~3.13 mg生药/mL,对临床分离株MIC为3.13 mg生药/mL。结论 香鳞毛蕨有效部位对糠秕马拉色菌有抑菌作用。
香鳞毛蕨;糠秕马拉色菌;最低抑菌质量浓度;体外抑菌
马拉色菌(Malassezia)又称为糠秕孢子菌(Pityrosporum),是人体或者其他动物皮肤上可分离出的正常菌群,可分为7种:糠秕马拉色菌(M.furfur)、球形马拉色菌(M. globosa)、合轴马拉色菌(M.sympodialis)、限制马拉色菌(M.restricta)、斯洛菲马拉色菌(M.slooffiae)、钝性马拉色菌(M.obtusa)、厚皮马拉色菌(M.pachydermatis),其中除了厚皮马拉色菌外,其余都是嗜脂性的真菌。糠秕马拉色菌(M.furfur)为马拉色菌的一种,是一种条件致病菌,可引起花斑癣、脂溢性皮炎、糠秕孢子菌性毛囊炎、糠秕孢子菌性真菌血症、甲真菌病及银屑病等疾病[1]。随着抗生素、皮质激素等药物的长期滥用以及器官移植、慢性感染、营养不良等因素的影响,与糠秕马拉色菌有关的疾病呈上升趋势,而治疗这类疾病的药物非常有限[2-3]。民间验方利用香鳞毛蕨治疗皮癣等皮肤病已有几十年的历史。也有学者证实了香鳞毛蕨对皮肤病治疗方面的作用[4-5]。范华倩等[7]对香鳞毛蕨有效部位进行了研究,证明了香鳞毛蕨有效部位对红色毛癣菌、须癣毛癣菌、犬小孢子菌等均有抑菌作用,但尚未有香鳞毛蕨有效部位对糠秕马拉色菌抑菌作用的研究,本实验采用3种体外抑菌试验方法,旨在研究香鳞毛蕨有效部位对M.furfur的抑菌作用。
1 材料与仪器
1.1菌株 菌株购自中国医学科学院皮肤病研究所真菌科。糠秕马拉色菌(M.furfur)共6株,其中标准株2株(菌株编号分别为CBS1878、CBS7019),临床分离株4株(菌株编号分别为3750、3796、3809、3808);近平滑念珠菌标准株1株(编号ATCC22019)。
1.2药物与试剂 香鳞毛蕨采自黑龙江省五大连池,由哈尔滨商业大学药学院张德连教授鉴定为鳞毛蕨属类植物香鳞毛蕨。
氟康唑纯度为99.4%,寿光富康制药有限公司,批号A-10511211001。
麦芽浸膏(北京奥博星生物技术有限公司)、酵母浸膏(北京奥博星生物技术有限公司);吐温80(天津市富宇精细化工有限公司);单硬脂酸甘油酯(江苏永华精细化学品有限公司);葡萄糖(国药集团化学试剂有限公司);蛋白胨(MBCHEM);玉米油(丰益贸易私人有限公司);琼脂(广州瑞舒生物科技有限公司)。
1.3主要仪器 电热恒温培养箱(上海一恒科学仪器有限公司);超净工作台(苏净集团安泰公司);电热手提式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);XSP-10C生物显微镜(上海永享光学仪器制造有限公司);pH计(赛多利斯股份有限公司);微波炉(美的微波炉公司广州分公司)。
2 方法
2.1香鳞毛蕨有效部位的制备 香鳞毛蕨有效部位由广东药学院中药化学教研室制备,通过取香鳞毛蕨地上部分经乙醇提取并富集纯化后制得,其主要物质成分为间苯三酚类化合物,经紫外测定,总间苯三酚含有量达到50%以上,香鳞毛蕨有效部位贮备液质量浓度:2 g生药/mL。
2.2琼脂扩散法[6]
2.2.1马拉色固体培养基的配制 取20 g麦芽浸膏,2 g酵母浸膏,2 m L吐温80,2.5 g单硬脂酸甘油酯,40 g葡萄糖,10 g蛋白胨,20 mL玉米油,20 mL琼脂,加入1 000 mL蒸馏水,将其pH调至5.6,加热溶解,分装后121℃高压灭菌15 min。
2.2.2菌液制备 将受试的菌株接种于马拉色固体培养基斜面,32℃连续传代培养2次。第2次传代培养2 d后,用无菌生理盐水洗脱纯化的菌落,制成菌悬液,用麦氏比浊管调整为0.5个麦氏单位,其菌悬液浓度大致为1× 106~5×106cfu/mL,备用。
2.2.3含药纸片的制备 取中速滤纸,用打孔器打出直径为6 mm滤纸片,经高压蒸汽灭菌后烤干用。将纸片在2 g生药/mL、1 g生药/mL、0.5 g生药/mL的香鳞毛蕨有效部位药液中浸泡30 min后取出。
2.2.4抑菌活性的测定 用无菌棉棒将“2.1.1”项制成的菌液均匀涂布在马拉色固体培养基平板上,将不同浓度药液的药片贴于培养基表面,轻压纸片使其接触良好。置于32℃温箱培养2 d,用刻度尺测量抑菌圈直径的大小。各株糠秕马拉色菌按以上操作平行重复测定3次,并计算抑菌圈平均直径与标准差。
2.3试管内药基法[7]用马拉色固体培养基将香鳞毛蕨有效部位贮备药液倍比稀释,质量浓度依次为1 600、800、400、200、100、50、25、12.5、6.25、3.125生药mg/mL。取编号为1~12号的无菌试管12支,将上述各质量浓度含药培养基分别加入1~10号试管中,每支0.3 mL,再分别加入2.7 mL培养基,混合摇匀。11~12号试管中各加无药培养基3 mL。然后向1~10支试管分别加入菌液50μL。11号管不加菌液,为阴性对照;12号管不加药液,为生长对照。然后将1~12号试管置于32℃温箱中培养2周。以无糖秕马拉色菌生长的最低药物质量浓度的试管为香鳞毛蕨有效部位的MIC值。
2.4微量液基稀释法[8]
2.4.1马拉色液体培养基配制 取麦芽浸膏20 g,酵母浸膏2 g,葡萄糖20 g,蛋白胨20 g,玉米油20 mL,加入蒸馏水1 000 mL,调整其pH至5.6,加热溶解。分装后,121℃高压灭菌15 min。
2.4.2药液的制备 将香鳞毛蕨有效部位贮备液用马拉色液体培养基稀释10倍,质量浓度为200 mg生药/mL。
2.4.3菌液的制备 将“2.1.1”项的菌液用马拉色液体培养基稀释100倍,备用。糖秕马拉色菌的菌液浓度为1× 104~5×104cfu/mL。
2.4.4药液加样及结果判读 参照美国临床实验室标准化协会(CLSI)制定的M27-A方案中酵母菌微量稀释法。取96微量孔板,第1列加入200μL药液,第2列至第11列加入马拉色液体培养基100μL;按照倍比稀释的方法,从每一行第1孔吸出100μL药液加入相应的第2孔,混合均匀后,从第2孔吸出100μL药液加入相应的第3孔,以此类推,至第10孔混合均匀后,将吸出的100μL药液舍弃。每孔第1列至第11列加“2.3.3”项的菌液100μL。每排第11列为生长对照,第12列作为阴性对照。将96微量孔板置32℃温箱中培养2 d。取无糖秕马拉色菌生长的最低药物质量浓度即为DF有效部位的MIC值。在每次测定时进行质量控制,质控(QC)株采用近平滑念珠菌(ATCC 22019),质控阳性药物为氟康唑,在平行操作条件下,QC株的MIC应在0.12~0.5μg/mL范围内,则视为测定结果有效可信。
3 结果
3.1纸片法 香鳞毛蕨有效部位对糖秕马拉色菌标准菌株和临床分离菌株纸片法抑菌圈结果见表1,表2。从表1可见,香鳞毛蕨有效部位高、中、低剂量均出现抑菌圈,表明香鳞毛蕨有效部位对糖秕马拉色菌标准菌株、临床分离株均有抑菌作用。
表1 香鳞毛蕨有效部位对糖秕马拉色菌标准菌株抑菌圈直径(mm)(±s)
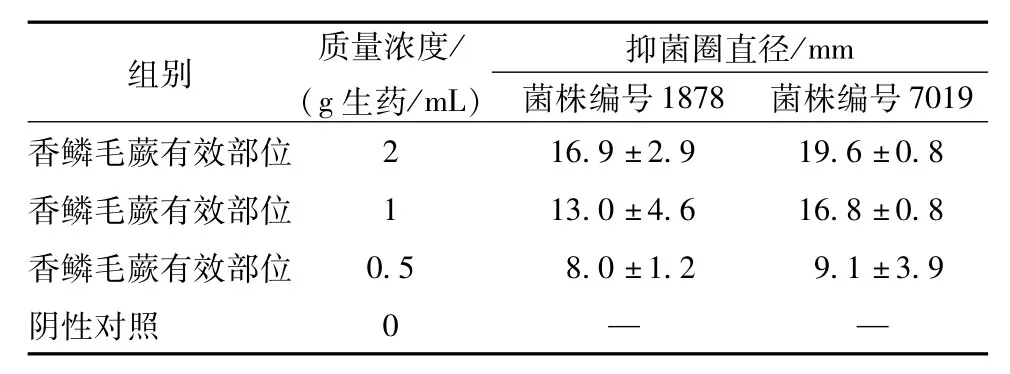
表1 香鳞毛蕨有效部位对糖秕马拉色菌标准菌株抑菌圈直径(mm)(±s)
注:“-”表示无抑制作用
7019香鳞毛蕨有效部位组别质量浓度/(g生药/mL)抑菌圈直径/mm菌株编号1878菌株编号16.9±2.9 19.6±0.8香鳞毛蕨有效部位1 13.0±4.6 16.8±0.8香鳞毛蕨有效部位0.5 8.0±1.2 9.1±3.9阴性对照0 2——
表2 香鳞毛蕨有效部位对糖秕马拉色菌临床分离菌株抑菌圈直径(mm)(±s)

表2 香鳞毛蕨有效部位对糖秕马拉色菌临床分离菌株抑菌圈直径(mm)(±s)
注:“-”表示无抑菌作用
3808香鳞毛蕨有效部位组别质量浓度/(g生药/mL)抑菌圈直径/mm菌株编号3750菌株编号3796菌株编号3809菌株标号14.6±1.9 10.5±2.7 14.9±3.6 17.1±2.7香鳞毛蕨有效部位1 8.6±2.3 9.3±1.9 10.3±1.9 14.5±1.7香鳞毛蕨有效部位0.5 8.6±2.5 9.0±1.8 7.9±1.7 6.8±1.2阴性对照0 2————
3.2试管内药基法 采用试管内药基法测定香鳞毛蕨有效部位对糖秕马拉色菌的MIC值,结果见表3、表4。试管内药基法的体外敏感试验中,糖秕马拉色菌标准菌株在第6管开始有菌落生长,糖秕马拉色菌临床分离株在第6管至第7管有菌落生长。所以糖秕马拉色菌标准菌株MIC值:10 mg生药/mL;糖秕马拉色菌临床分离菌株MIC值范围在5~10 mg生药/mL。

表3 香鳞毛蕨有效部位对糖秕马拉色菌标准菌株的M IC

表4 香鳞毛蕨有效部位对糖秕马拉色菌临床分离株的M IC值
3.3微量液基稀释法 香鳞毛蕨有效部位对糖秕马拉色菌的MIC值如表5、表6所示。标准菌株在第8列开始有菌落生长;临床分离株在第7列开始有菌落生长。所以,糖秕马拉色菌标准菌株MIC:1.56mg生药/mL,糖秕马拉色菌临床分离株MIC:3.13mg生药/mL。标准菌株的MIC值较临床分离株的MIC值低。

表5 香鳞毛蕨有效部位对糖秕马拉色菌标准菌株的M IC值

表6 香鳞毛蕨有效部位对糖秕马拉色菌临床分离菌株的M IC值
4 讨论
糖秕马拉色菌为一种腐生寄生菌,为马拉色菌的一种,可引起花斑癣、糖秕马拉色菌毛囊炎、脂溢性皮炎、银屑病等,在马拉色菌属中属于重要的致病菌。与糖秕马拉色菌相关的疾病中常存在区别感染的问题,感染不同的部位会引发出不同的疾病,如花斑癣易发于全身、脂溢性皮炎易发于面部、躯干上部、毛囊炎易发于躯干上部、颈部、双臂等[9];且同一种疾病可以分离出两种以上马拉色致病菌;糖秕马拉色菌感染的疾病亦存在地域的差异,在国内,李志瑜等[10]调查表明导致花斑癣的菌种主要为M.sympodialis及糖秕马拉色菌,而在国外,Grespo等[11]从花斑癣中分离的菌种主要为糖秕马拉色菌;这些都为糖秕马拉色菌相关疾病的治疗带来了许多问题。目前治疗这些疾病的方法主要是使用化学合成药物,其中特异性抗真菌药物包括唑类药物最常用,但这些化学药物复发率高,易产生耐受且毒副作用大。因此,寻找作用安全,疗效满意,且价格合理的抗糖秕马拉色菌药物的任务仍然很艰巨[12]。中药副作用小,很少出现耐药有利于疾病的长期和预防治疗;且利用现代化工艺从天然中草药中分离有效的抗真菌成分的技术越来越成熟,使中药的开发应用有良好的前景。
1992年美国国家临床实验室标准化委员会(NCCLS)推出了M27(酵母菌液体培养基稀释法抗真菌药敏感试验)系列方案,规范酵母菌的药敏试验。也有学者[13-14]通过试管内药基法、微量液体稀释法测定中药对马拉色菌的MIC值,但目前国内外关于马拉色菌的研究仍没有标准化的实验方案,所以实验结果也受到争议。本实验参照了其中的M27-A(酵母菌微量稀释法抗真菌敏感试验)的实验方法,并对其进行改进,用马拉色液体培养基代替RPMI1640以提供糖秕马拉色菌生长所需的油脂,结果表明糖秕马拉色菌可以在马拉色培养基上良好的生长。
纸片法操作简便,结果清晰易读,成本较低,但此方法易受许多因素干扰[15]。试管内药基法属于大量稀释法的一种,准确性较佳,重复性也较好,但是由于真菌的生长部分受抑制出现的拖尾现象,可能会导致某些药物的终点判断困难[16]。NCCLS颁布的一系列微量稀释法,可以用微量的液体准确地测定出药物的MIC值。此法在微量孔中进行,操作方便,实验结果准确性高。有文献报道采用多量法与微量法实验时,所得的MIC在两个浓度梯度内,都认为结果一致[17]。本实验结果显示,通过试管内液基法与微量液体稀释法测得6株糠秕马拉色菌的MIC值,其中糖秕马拉色菌标准菌株的MIC值分别为10 mg生药/mL、1.56~3.13 mg生药/mL;临床分离株的MIC值分别为5~10 mg生药/mL、3.13 mg生药/mL,两种方法测得的6株糖秕马拉色菌菌株MIC值均在两个浓度梯度内,具有一致性,一致率达100%。本实验3种实验方法结果都证明了香鳞毛蕨有效部位对糖秕马拉色菌有抑菌作用。因此,本实验采用的3种方法均可用来作为评价香鳞毛蕨有效部位对糠秕马拉色菌抑菌作用,为马拉色菌体外抑菌试验的标准化提供了参考,也为深入进行香鳞毛蕨有效部位对糖秕马拉色菌的抑菌机制、整体动物实验和临床研究提供依据。
[1] 黄 欣,温 海,施伟民,等.马拉色菌属主要相关皮肤病治疗的研究进展[J].国外医学·流行病学传染病学分册,2005,32(3):171-173.
[2] 朱 敏.中草药及其单体抗马拉色菌作用的研究[D].上海:复旦大学,2003.
[3] 刘涛峰,刘小平,张虹亚,等.中药水煎剂对马拉色菌分离株的体外抑菌试验[J].中国皮肤性病学杂志,2011,25(1):62.
[4] 李国树,徐成东.药用蕨类植物的研究进展[J].楚雄师范学院学报,2009,24(9):66-68.
[5] 李红枝,沈志滨,赵 英,等.香鳞毛蕨软膏对大鼠实验性体癣的治疗作用[J].中药材,2005,28(10):941-942.
[6] 向梅先,苏汉文,严子焱,等.血三七有效部位抗真菌活性的初步研究[J].中药材,2010,33(9):1463-1465.
[7] 范华倩,沈志滨,陈艳芬,等.香鳞毛蕨不同提取液体抗真菌作用研究[J].中药材,2012,12(35):1981-1984.
[8] National Committee for Clinical Laboratory Standards.Referencemethod for broth dilution antifungal susceptibility testing of yeasts:Approved Standard.NCCLS documents M27A[S]. Wayne Pennsylvania:NCCLS,1997.
[9] 骞 强,姜文成,章强强,等.马拉色菌相关疾病研究症状[J].中国微生态学杂志,2013,25(10):1222-1224.
[10] 李志瑜,冉玉平,熊 琳,等.从花斑癣患者的皮损区及非皮损区分离和鉴定马拉色菌[J].中华皮肤科杂志,2003,36(8):430-432.
[11] Crespo Erchiga V,Ojeda Martos A,Vera Casano A,et al. Malassezia globosa as the causative agent of pityfiasis vcrsicolor[J].Br JDermatol,2000,143(4):799-803.
[12] 刘科峰.微生物和中药对马拉色瑟菌的抑菌性研究、临床效果分析及流行病学调查[D].开封:河南大学,2012.
[13] 郑晓辉,高 进,郑 义,等.9种中药对马拉色分离菌株的抑菌试验研究[J].中国中西医结合皮肤病学杂志,2003:24(1):16-18.
[14] 郑晓辉,许爱娥,魏晓冬,等.39种中草药对马拉色菌抑菌实验研究[J].中国中西医结合皮肤性病学杂志,2005,4(3):178-179.
[15] 孙万里,高昆山,官旭俊,等.纸片法和微量稀释法临床分析[J].中国中医药现代远程教育,2010,8(2):155-156.
[16] 蔡 晴.曲古霉素A对三唑类药物体外抗白念珠菌活性的增效作用及作用机制[D].北京:北京协和医学院,2013.
[17] 张晓东.体外抗真菌药敏试验多量与微量稀释法对比研究[J].北华大学学报,2000,1(4):321-322.
R285.5
B
1001-1528(2015)03-0642-04
10.3969/j.issn.1001-1528.2015.03.041
2014-05-15
科技部“十二五”重大新药创制(2011ZX09102-007-03);广东省科技厅科技计划项目(2010B030700044,2011A030100013);2010年广东省教育厅高层人才资助项目;广州市科技局科技计划项目(12A062131631)
王 洁(1989—),女,硕士生,从事中药有效成分研究和新药开发。E-mail:296885242@qq.com
唐春萍(1966—),女,教授,从事中药药效与安全性评价研究。E-mail:tchp66@163.com

