注采水样微生物群落与高凝原油的相互作用
何延龙,张 凡,柴陆军,蒲春生,董 浩,韩春春,佘跃惠
(1.中国石油大学石油工程学院,山东青岛266580;2.中国地质大学能源学院,北京100083;3.中国石油大学化学工程学院,北京102249;4.长江大学化学与环境工程学院,荆州湖北434023)
注采水样微生物群落与高凝原油的相互作用
何延龙1,张 凡2,柴陆军2,蒲春生1,董 浩3,韩春春4,佘跃惠4
(1.中国石油大学石油工程学院,山东青岛266580;2.中国地质大学能源学院,北京100083;3.中国石油大学化学工程学院,北京102249;4.长江大学化学与环境工程学院,荆州湖北434023)
在高凝油藏开发过程中,原油易在孔隙中析蜡、发生胶质和沥青质沉积等。研究不同水驱环境中内源微生物群落及其与高凝油的相互作用关系,以河南魏岗油田高凝油藏产出水样为研究对象,优选最佳激活体系;通过微生物驱油物理模拟实验考察内源微生物提高采收率情况,研究激活前后内源微生物的群落变化以及原油组分、性质的变化。结果表明:注采水样中微生物群落差异明显,内源微生物被激活后优势菌为芽胞杆菌(Bacillus sp)和梭菌(Clostridium ultunense)等,原油乳化分散等级最高可达5级,微生物提高采收率最高为12.51%;凝点最多降低5℃,蜡含量降低3.95%以上,同时多环芳烃萘、菲及其同系物等降解较为明显;不同水驱环境中内源微生物在驱油、原油降解等过程中发挥着重要的作用。
注采水;原油降解;色谱质谱联用;气相色谱;物理模拟
高凝油油藏注水易受“冷伤害”而直接影响油藏的开发效果。河南魏岗油田属于典型高凝油油藏,同时具有胶质沥青质含量高(15%以上)的特点,注水井井底易形成低温区而导致原油在油层孔隙中析蜡、胶质和沥青质沉积,导致近井地带堵塞,造成注水压力升高。注入水与采出水中内源微生物群落的结构差异会造成驱油过程中群落结构、原油组分以及最终采收率的变化;来自不同油井的采出水进入联合站后,经过水质处理(加入絮凝剂、杀菌剂等),再通过一个半开放的系统循环注入到注水井中,期间会在地面带入一些外源微生物,循环过程中形成若干微生物群落的复合生态系统[1-5]。注入水注入地层后,好氧菌主要在近井地带的地层水中生长繁殖;当水驱到油水井之间的中间过渡带以后,水中的氧气已被微生物大部分消耗,该区域属于低氧区,兼性厌氧菌主要在该区域生长繁殖;水驱到油层深部和油井周边地带,氧气几乎被消耗殆尽,厌氧菌主要在该区域生长繁殖,导致注入水和采出水的微生物群落结构产生较大的差异,同时微生物群落对原油的作用也有一定差异[6-7]。笔者针对注入水和采出水样中微生物群落结构的差异,利用特定的微生物激活体系,以河南魏岗高凝原油以及对应的采出水、注入水样为研究对象,通过摇瓶和高温微生物驱油模拟实验,分析微生物驱油物理模拟实验前后注、采水样中内源微生物的群落特征,并结合模拟驱油采收率及原油组分变化等情况,说明注入水和采出水中的内源微生物群落与高凝原油的相互作用关系。
1 实 验
1.1 实验材料
油水样品分别来自河南魏岗油田V149采出水以及河南魏岗油田注入水;魏岗油田四区Ⅴ断块平均孔隙度为24.31%,平均有效渗透率为0.223 μm2,含油饱和度67%;原油密度0.863 g/cm3,地面黏度为12.55 mPa·s,含蜡量46.27%,凝固点45℃,含硫量0.13%;地层水矿化度16456 mg/L,水型为碳酸氢钠型,pH值为7.8,注入水pH值为7.2。
(NH4)2HPO4和KNO3(分析纯)为北京化学试剂公司生产,JHAR和JHM为北京百奥赛科技研究中心生产,玉米浆干粉(蛋白质含量高于42%)为上海西王淀粉糖有限公司生产。
实验用岩心均为石英砂环氧胶结人造均质胶结岩心。
1.2 激活体系的筛选
结合室内研究及现场情况,激活剂筛选过程取4 g V149井原油,以V149采出水以及河南魏岗油田注入水为内源微生物水样,分别以(NH4)2HPO4和KNO3各0.4 g为氮源和磷源,利用玉米浆干粉和不同的辅助生长因子JHAR和JHM,设计实验研究不同浓度配比的营养体系对内源微生物的激活情况。在高温灭菌后的500 mL三角烧瓶中加入200 mL分别用注入水样或采出水样配制的激活体系(表1),在60℃、180 r/min下恒温动态培养15 d后,以原油乳化分散等级、菌体浓度和pH值3个指标[8],通过2个轮次的激活培养优选出适合该油藏的激活体系,并确定物模实验激活剂配方;将培养后的发酵液用四氯化碳萃取,收集有机相,挥干溶剂,将收集到的残余油样品进行检测分析[9]。

表1 激活体系配方Table 1 Mixture of nutrients for stimulation g·mL-1
1.3 微生物驱物理模拟
在驱替速度为1.0 mL/min时,将饱和油水后的岩心在恒温箱中模拟地层温度69℃恒温放置12 h后水驱油至岩心出口含水率超过98%,计算水驱采收率;一组注入0.3VP(VP为孔隙体积)的激活剂,培养15 d,水驱油至岩心出口含水率超过98%,计算微生物驱采收率;一组不注激活剂培养15 d,水驱油至岩心出口含水率超过98%,计算空白组二次水驱采收率,并分离收集残余油样放于4℃冰箱中,备分析检测用[10]。
1.4 激活前后内源微生物群落结构
1.4.1 总DNA的提取
每个样品取30 mL、1200 r/min的条件下离心5 min收集菌体细胞。根据TIANGENamp Bacteria DNA Kit(TianGen Biotech,Beijing,China)试剂盒中说明提取基因组DNA。用1%的琼脂糖凝胶电泳检测提取的总DNA样品。
1.4.2 16S rRNA基因的全长扩增
用通用引物1492R(5'-GGC TAC CTT GTT ACG ACTT-3')和27f(5'-AGAGTTTG ATCCTGGCTCAG-3')扩增16S rRNA基因片段。
1.4.3 克隆文库的建立
利用Agarose Gel DNA PurificationKit(TianGen Biotech,Beijing,China)对16S rRNA片段进行纯化。将纯化的16S rRNA片段用PGEM-T Easy Vector(Promega,Madison,WI,USA)连接到Trans1-T1感受态细胞(TransGen Biotech,Beijing,China),加入到250 μL LB培养基中37℃过夜培养,取菌液涂布在含Amp(100 mg/mL)的LB平板上,37℃培养12 h,每个样品挑取150个白斑克隆,用T7(5'-GGCCGCGGGAATTCGATT-3')/SP6(5'-GCGAATTCACTA GTGATT-3')引物进行PCR扩增,克隆验证,将阳性克隆PCR产物用限制性内切酶HaeⅢ和Hinf玉进行核糖体DNA扩增片段限制性内切酶分析将克隆分类,选取代表克隆进行测序分析[11-12]。
1.5 原油分析方法
气相色谱检测过程执行的标准为SY/T 5779-2008;芳香烃色谱质谱分析检测执行标准为GB/T 18606-2001;原油含蜡量、凝析点的测定分别按照SY/T 0537-2008《原油中蜡含量的测定》和SY/ T0541-2009《原油凝点测试法》中的方法进行[13-16]。
2 结果分析
2.1 激活体系的筛选评价
第一轮培养以河南油田魏岗V149井原油为油样,分别以V149井采出水和注入水内源微生物做好氧和限氧培养后,得到原油乳化分散等级、菌体浓度和pH值如表2所示。

表2 激活体系第一轮的激活效果Table 2 Stimulation of the first period
由表2看出,利用注入水内源微生物配制的激活体系的pH值的变化范围为7.82~8.95,在好氧培养的条件下,激活体系A的乳化分散等级最高可以达到5,同时菌体浓度可以达到1×107cfu/mL。在限氧的条件下,乳化分散等级可以达到4,菌体浓度可达到1×107cfu/mL;激活体系C在好氧和限氧的条件下,乳化分散等级均可达到4,菌体浓度1× 106cfu/mL以上;对于采出水而言,激活剂体系的pH值变化明显,其中利用激活体系C激活后的pH值最高达到9.79,这有利于与原油中的有机酸反应产生天然表面活性剂而有利于原油的乳化。故第二轮选择A和C两组激活体系进行培养,好氧和限氧培养后得到的原油乳化、菌体浓度和pH值如表3所示。
经过A和C激活体系第二轮次的激活培养,注入水的pH变化不明显,而采出水样的pH值最高可以达到9.61;注入水样中的菌体浓度可以超过1× 106cfu/mL,在限氧的条件下,A激活体系的乳化分散等级可以达到5,而对于采出水,在C激活体系的作用下,原油乳化分散等级基本可以达到4,菌体浓度超过1×106cfu/mL,故优选A激活体系和C激活体系分别作为注入水和采出水微生物驱油物理模拟实验的最佳激活配方。实验中分别将注入水内源微生物利用A、C激活剂激活及物理模拟驱油得到的原油样品分别用A1、C1和S1表示,将采出水内源微生物利用A、C激活剂激活及物理模拟驱油得到的原油样品分别用A2、C2和S2表示。

表3 激活体系第二轮的激活效果Table 3 Stimulation of the second period
2.2 内源微生物被激活前后群落分析
对注采出水样内源微生物及利用注采水样内源微生物进行物理模拟实验后的转化子各挑取135个阳性克隆子,通过HaeⅢ和Hinf玉双酶切分析得到14、25、10和10个OTUs。选取代表性克隆进行基因测序和比对,得到激活前后微生物群落如图1~4所示。
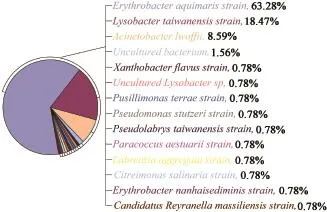
图1 注入水样中内源微生物群落分布Fig.1 Microbial community distribution of injected water

图2 注入水样内源微生物驱模拟实验微生物群落分布Fig.2 Microbial community distribution of sample after physical simulation experiment by injection water
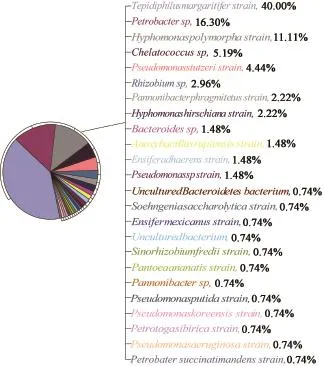
图3 采出水样中内源微生物群落分布Fig.3 Microbial community distribution of production water

图4 采出水样内源微生物驱模拟实验微生物群落分布Fig.4 Microbial community distribution of sample after physical simulation experiment by production water
注入水样中共有14种菌,好氧菌居多,其中优势菌为好氧菌长赤细菌(Erythrobacter aquimaris)63.28%、溶杆菌(Lysobacter taiwanensis)18.47%和不动杆菌(Acinetobacter lwoffii)8.59%,与GenBank中已有的16S rRNA基因序列的同源性分别达到98%、95%和99%;注入水样微生物驱模拟实验激活得到的菌群共有10种,厌氧菌和兼性厌氧菌种类增多,其中优势菌为好氧和兼性厌氧菌芽胞杆菌(Bacillus sp)56.06%、专性厌氧菌梭菌(Clostridium ultunense)19.7%和厌氧菌Thermoflavimicrobium dichotomicum 9.09%,与GenBank中已有的16S rRNA基因序列的同源性分别达到96%、98%和95%。
采出水样中共有25种菌,其中优势菌为好氧菌硫杆状菌(Tepidiphilus margaritifer)40%、兼性厌氧菌油杆菌(Petrobacter sp)16.3%和好氧菌多形生丝单胞菌(Hyphomonas polymorpha)11.11%,与Gen-Bank中已有的16S rRNA基因序列的同源性分别达到99%、98%和98%。采出水样微生物驱模拟实验中激活得到的菌群共有10种,其中优势菌为专性厌氧菌梭菌(Clostridium ultunense)55.31%和好氧和兼性厌氧菌芽胞杆菌(Bacillus sp)25%,与GenBank中已有的16S rRNA基因序列的同源性分别达到96%和98%。
2.3 微生物驱油物理模拟实验
由微生物驱油模拟实验得到不同水样配制的激活体系对采收率的影响,如表4所示。

表4 微生物驱油岩心模拟实验结果Table 4 Results of physical simulation experiment
由表4可以看出,两组对照实验的二次水驱采收率较低;采出水和注入水内源微生物激活配方激活后的二次采收率分别为12.51%和7.04%;而注入水经过絮凝剂、杀菌剂等注水水质处理后,群落结构发生了剧烈变化,处理后的菌群结构相对简单,优势菌群与其他菌群的竞争性关系减弱,优势菌为长赤细菌、不动杆菌和溶杆菌,其中长赤细菌是一种光合细菌,具有营养、净化水体等作用,是重要的生防细菌,而溶杆菌具有很强的溶菌抑菌效果,这两种菌都在注入水的水质处理过程中发挥着重要的作用;同时不动杆菌能够在代谢过程中产生生物表面活性剂,有助于原油的乳化和采收率的提高。在激活剂的作用下群落结构发生了变化,优势菌梭菌和芽胞杆菌均是烃降解菌种比较常见的菌属,梭菌能够在无氧条件下利用碳水化合物产生氢、乙酸等其他的小分子有机化合物,这些小分子化合物对提高采收率具有重要意义。芽胞杆菌能够在原油中进行生物氧化,可代谢产生大量的生物表面活性剂(糖肽类、脂肽类等微生代谢产物),采油过程中发挥降黏、解蜡和乳化的作用[15-16]。采出水主要是取自V149井,其中优势菌群为硫杆状菌、油杆菌和多形生丝单胞菌,硫杆状菌能氧化硫和硫化合物,解除硫化物堵塞,而油杆菌具有降解原油的作用。加入激活剂后,内源菌群在激活剂的作用下被激活,优势菌同样为梭菌和芽胞杆菌,同时所包含的不动杆菌、施氏假单胞菌等采油功能菌虽然含量不高,但在驱油过程中也发挥着重要作用[17-19]。
2.4 原油族组分分析
由原油族组分检测得到静态实验和物理模拟实验内源微生物被激活前后河南魏岗原油的变化情况,如表5所示。
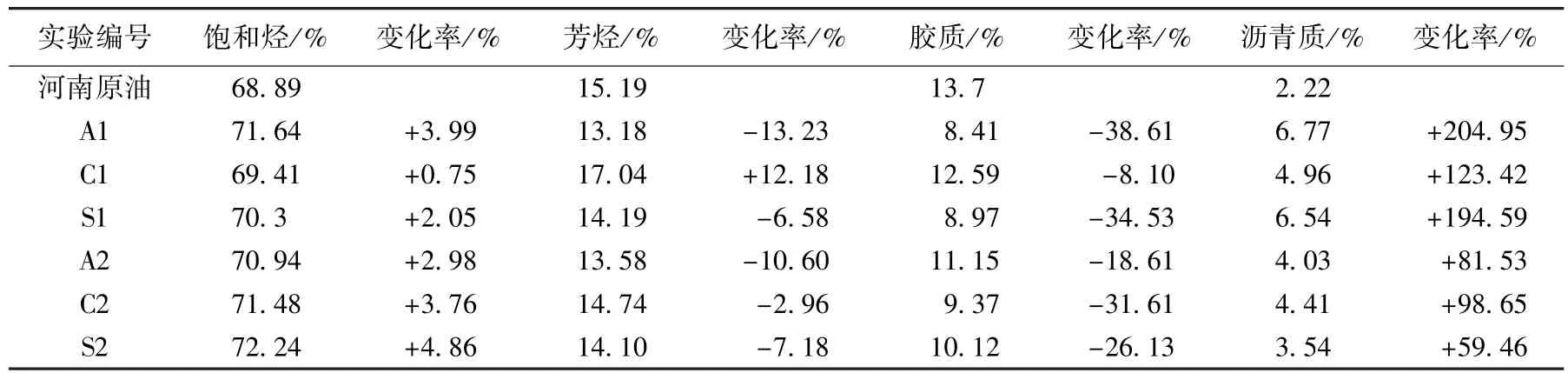
表5 河南魏岗原油各样品的组分分析Table 5 SARA of samples from Henan Weigang Oilfield
河南魏岗高凝原油中,轻质组分含量高,饱和烃和芳烃的含量达到84.08%。内源微生物被激活后,A1样品饱和烃含量增幅为3.99%,C2样品中饱和烃含量增幅为3.76%。同时,各个激活后的样品中,芳烃和胶质含量降低较为明显,其中降低幅度最高的A1样品中,芳烃降幅为13.23%,胶质降幅为38.61%;而A2样品中芳烃降幅为10.6%,C2样品中胶质降幅为18.61%。沥青质含量在内源微生物被激活后含量均不同程度增加,主要是因为激活后微生物代谢旺盛,芽胞杆菌、不动杆菌等能够以芳烃和胶质等大分子为降解对象,将胶质等大分子石油烃降解为小分子石油烃,由于胶质和沥青质在原始油样中处于相对稳定的状态,当微生物降解部分胶质之后,胶质一部分转化为芳烃,一部分转化为沥青质,同时使沥青质从原有的稳定状态中分散开,打破了原油的原始状态。
2.5 正构烷烃的气相色谱分析
通过气相色谱法对河南魏岗原油及其他几组内源微生物被激活后的原油进行检测,由原始的气相色谱分析结果可以得到河南魏岗各组原油归一后正构烷烃的百分含量数据如图5所示。
由原油气相色谱分析可以看出,内源微生物被激活后,A1样品中低碳数的nC9-nC27的正构烷烃的含量上升,且随着碳数的增大增幅降低,而nC28-nC38的正构烷烃随着碳数的增加降低程度增大;C2样品中nC9-nC25的正构烷烃的含量上升,而nC28-nC38的正构烷烃随着碳数的增加降低程度增大,说明高碳数的正构烷烃易于受到内源微生物的作用而发生分子链的断裂生成部分低碳链的正构烷烃。内源微生物被激活后改善了原油的品质,增加了原油中轻质组分的含量;内源微生物被激活前后的河南魏岗原油各样品的降解对比参数如表6所示。

图5 微生物被激活前后河南魏岗各组原油正构烷烃含量的对比Fig.5 Comparison of n-alkanes in samples from Henan Weigang Oilfield
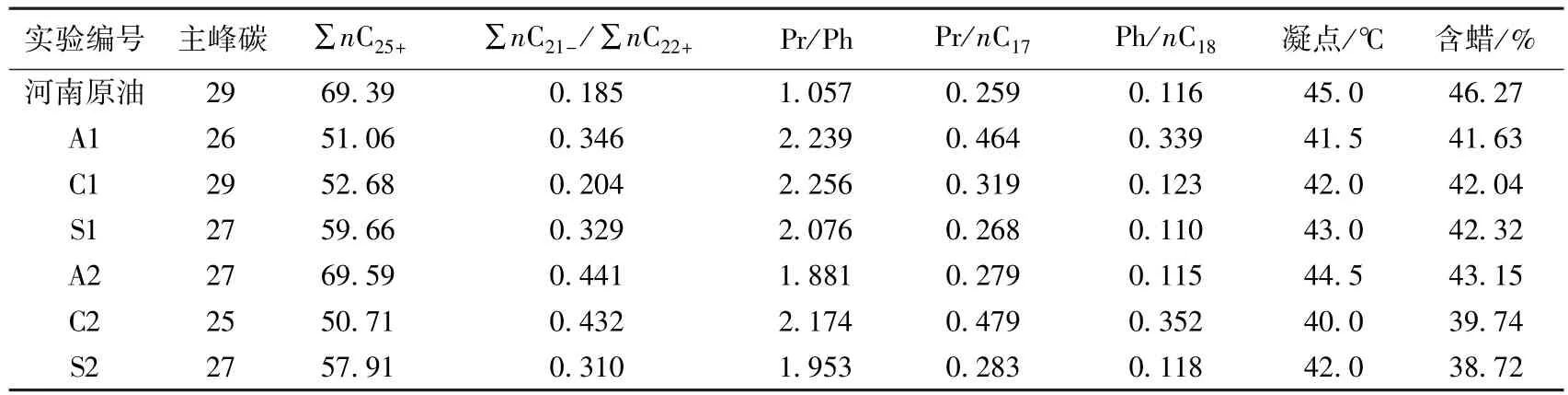
表6 河南魏岗原油内源微生物降解特征分析结果Table 6 Characteristics of degradation of oil from Henan Weigang Oilfield
由表6看出,内源微生物被激活后各组原油的Pr/Ph值均有所上升,其中A1、C1和C2样的Pr/Ph值增大到2以上。由于内源微生物在代谢过程中优先利用正构烷烃作为生长繁殖的碳源,对于在生物降解的早期阶段以及微生物降解作用较弱的原油而言,其Pr/Ph值保持不变,同时A1和C2样的Pr/ nC17和Ph/nC18值增大较为明显,其中C2样中Pr/ nC17和Ph/nC18值分别增加到0.479和0.352。Pr/ nC17和Ph/nC18值可以很好的反映生物降解作用程度,且随生物降解作用的不断深入,Pr/nC17和Ph/ nC18值均不断增大,所以说明几组内源微生物激活后的原油都发生了较明显的生物降解作用[20-21]。经过静动态培养后,河南魏岗原油的∑nC21-/∑nC22+值增加最为明显的是C2样和A1样两组原油,分别由原始的0.185增加到0.432和0.346。内源微生物作用后原油的正构烷烃的主峰碳也发生了变化,其中C2样的主峰碳由原始的29降为25。原油中的石蜡组分主要为碳原子数n=17~36的正构烷烃,除A2样,内源微生物被激活后碳数大于25的正构烷烃组分含量下降。随着低碳数的正构烷烃含量增加,原油的凝固点及含蜡量均有所降低,其中C2样中碳数大于25的正构烷烃含量降幅达68.66%,凝点降低5℃,蜡含量由原始的46.27%降低为39.74%。注采水样激活后的优势菌芽胞杆菌和梭菌都具有降解正构烷烃的作用,不动杆菌能够降解长链烷烃,对典型的生物标志物Pr和Ph也有一定的降解作用,同时注采水样中的铜绿假单胞菌也能够降解石蜡而产生表面活性物质,说明内源微生物激活后能够有效地降解石蜡组分从而改善原油的含蜡量状况[22-23]。
2.6 芳香烃的气相色谱质谱联用分析
通过气相色谱质谱联用技术对河南魏岗原油以及其他几组内源微生物被激活后的原油进行检测,得到芳烃气相色谱质谱数据如图6所示。
由气相色谱质谱联用分析结果可以得到内源微生物被激活前后河南魏岗各组高蜡原油芳香烃的分析测试数据如表7所示。

图6 注入水采出水激活前后原油降解气相色谱质谱联用谱图Fig.6 GC/MS spectrum of biodegradation by injection and production water
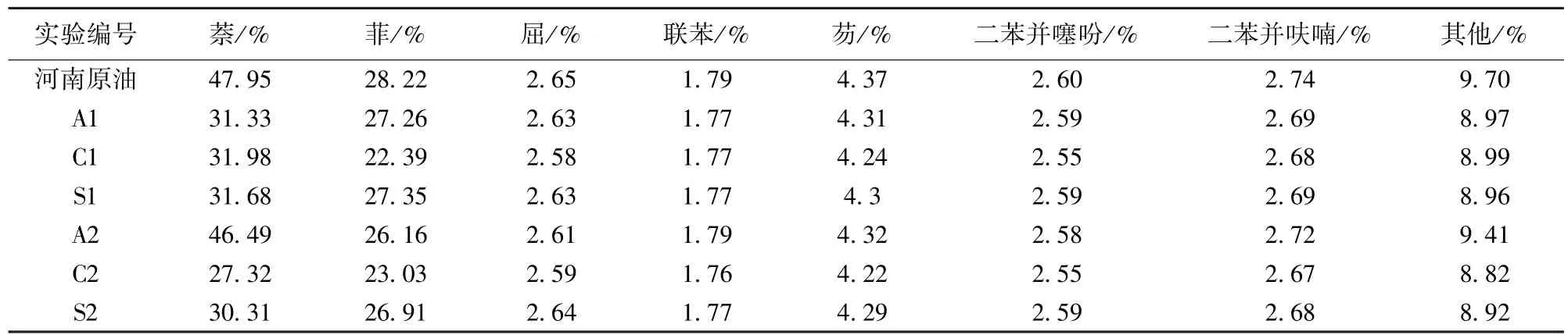
表7 河南魏岗高蜡原油中芳烃化合物的相对含量Table 7 Aromatic hydrocarbons of oil from Henan Weigang Oilfiled
多环芳烃萘、菲、蒽、芘等是构成重稠油中胶质、沥青质的基本结构。河南魏岗高凝原油中萘系列化合物和菲系列化合物是组成芳烃化合物的主要组成部分,占到了芳烃化合物总量的75%以上,萘系列化合物的含量达到47.95%,“三芴”系列化合物(芴、二苯并呋喃和二苯并噻吩)的含量为9.71%。内源微生物被激活后,原油的芳烃化合物都发生了不同程度的降解,除A2样中多环芳烃萘降解不明显外,其他几组油样中萘系列化合物总量降解幅度超过33.3%,萘系列化合物平均降幅超过72.87%,其中C2样萘系列化合物总量降幅达43.03%,平均降幅超过90.99%。由微生物的作用顺序顺序可知,微生物一般优先降解带有较长支链的多环芳烃,使支链断裂,在作用初期,同系物中热力学最稳定的同系物含量上升,其余的都有不同程度的降低。这也可从A2样品中看出,其中四甲基萘、五甲基萘及其同系物在微生物的作用下降幅较大,同时由于支链的断裂使得甲基萘、乙基萘和二甲基萘及其同系物的含量都有所上升,对于热力学最稳定的2,3,6-三甲基萘,由于其3个甲基均为β取代,所以不容易被微生物所降解。相比其他几组样品中50%以上的降解幅度,A2样品中2,3,6-三甲基萘的含量幅度仅为10.9%,说明内源微生物对该组油样的作用较弱,这与之前芳烃化合物、正构烷烃和四组分变化情况相一致[24-25]。菲系列化合物总量的降解幅度最大的是C1样和C2样,分别由原始的28.22%下降为23.03%和22.39%,各原油降解样品菲系列化合物的平均降解幅度都超过20.11%,同时可以由热力学较为稳定的β位甲基取代菲系列化合物的降解情况看出各组油样的降解情况。对于2-甲基菲、3-甲基菲以及2,3-二甲基菲来说,A1样品的降幅均高于其他几组原油降解样品的降解效果;而A2样品中2-甲基菲、3-甲基菲则分别由原始的1.54%和1.59%变化为1.52%和1.65%。注采水样群落中的铜绿假单胞菌对萘、菲都有一定的降解作用,注入水样中的pusillmonas terrae strain能够降解荧蒽、菲和芘等多环芳烃化合物。随着环数的增加原油中的多环芳烃不易被降解,系列化合物的含量变化低于1.9%。“三芴”系列化合物的含量变化较小,其中仅二苯并噻吩的降解幅度较大,其中A2样品中的平均降幅达86.80%。注入水内源微生物激活前后都含有施氏假单胞菌(Pseudomonas stutzeri),该菌能够降解重质组分中常见的二苯并噻吩(DBT)成水溶性硫化物[26-27]。
3 结 论
(1)激活剂体系A和C对注采水样中内源微生物的激活效果明显,注入水样中的菌体浓度可以达到1×108cfu/mL。在限氧的条件下A激活体系的乳化分散等级可以达到5,而采出水的乳化分散等级基本可以达到4,菌体浓度超过1×106cfu/mL;在加入激活配方后,注采水样中的内源微生物群落被有效激活,采出水和注入水内源微生物注入配伍激活配方激活后采收率分别提高为8.39%和14.63%。
(2)微生物作用后原油的族组分变化明显,除C1样品外,其他各组原油饱和烃含量上升,而芳烃和胶质含量降低;随生物降解与原油相互作用程度的增加,Pr/Ph值由原始的1.057增加到2左右,∑nC21-/∑nC22+值分别由原始的0.185增加到A1样和C2样的0.432和0.346。除A2样,内源微生物被激活后碳数大于25的正构烷烃组分含量下降,而随着低碳数的正构烷烃含量增加,原油的凝固点及含蜡量都有所降低。
(3)多环芳烃化合物是稠油中胶质和沥青质的基本结构,河南魏岗原油中萘系列化合物和菲系列化合物的含量占到了芳烃化合物含量的75%以上,内源微生物群落对多环芳烃萘、菲等系列化合物的降解较明显,破坏了沥青质和胶质的稳定结构,其中胶质组分下降。
[1] 李习武,刘志培.石油烃类的微生物降解[J].微生物学报,2002,6(42):764-767. LI Xiwu,LIU Zhipei.Microbial biodegradation of petroleum hydrocarbons[J].Acta Microbiologica Sinica, 2002,42(6):764-767.
[2] HEAD I M,JONES D M,LARTER S R.Biological activity in the deep subsurface and the origin of heavy oil[J].Nature,2003,426:344-352.
[3] DAHLE H,GARSHOL F,MADSEN M,et al.Microbial community structure analysis of produced water from a high-temperature North Sea Oilfield[J].Antonie van Leeuwenhoek,2008,93:37-49.
[4] ORPHAN V J,TAYLOR L T,HAFENBRADL D,et al. Culture-dependent and culture-independent characterization of microbial assemblages associated with high-temperature petroleum reservoirs[J].Applied and Environmental Microbiology,2000,66:700-711.
[5] PHAM V D,HNATOW L L,ZHANG S,et al.Characterizing microbial diversity in producted water from an A-laskan mesothermic petroleum reservoir with two independent molecular methods[J].Environmental Microbiology,2009,11:176-187.
[6] ZHANG F,SHE Y H,MA S S,et al.Response of microbial community structure to microbial plugging in a mesothermic petroleum reservoir in China[J].Appl Microbiol Biotechnol,2010,88:1413-1422.
[7] LI H,YANG S,MU B.Phylogenetic diversity of the archaeal community in a continental high-temperature,water-flooded petroleum reservoir[J].Current Microbiology,2007,55:382-388.
[8] 高配科.油藏内源微生物高效激活剂筛选与评价[D].天津:南开大学生命科学学院,2011. GAO Peike.Activator Screen,optimization and effect evaluation of indigenous microorganisms from oil reservoir[D].Tianjin:College of Life Sciences of Nankai University,2011.
[9] 张凡,佘跃惠.排油圈法对生物表面活性剂的定性与定量[J].化学工程师,2005,112(1):13-15,38. ZHANG Fan,SHE Yuehui.Quantitative and qualitative analysis of biosurfactant by oil spreading method[J]. Chemical Engineer,2005,112(1):13-15,38.
[10] 谷峻,石成芳,吴晓磊,等.油藏微生物群落研究的方法学[J].生态学报,2007,27(1):323-328. GU Jun,SHI Chengfang,WU Xiaolei,et al.Progress in methodological research of microbial community in oil fields[J].Acta Ecologicai Sinica,2007,27(1):323-328.
[11] SUN Y,CHEN Z,XU S,et al.Stable carbon and hydrogen isotopic fraction of individual nalkanes accompanying biodegradation:evidence from group of progressively biodegraded oils[J].Org Geochem,2005,36:225-238.
[12] ZHANG F,SHE Y H,LI H M,et al.Impact of an indigenous microbial enhanced oil recovery field trial onmicrobial community structure in a high pour-point oil reservoir[J].Microbiol Biotechnol,2012,95(3):811-21.
[13] 胥元刚,何延龙,张凡,等.厌氧微生物对新疆六中区稠油的降解特性[J].西安石油大学学报:自然科学版,2012,27(3):67-71. XU Yuangang,HE Yanlong,ZHANG Fan,et al.Degradation characteristics of oil from Middle Block NO.6 of Xinjiang Oilfield degraded by the anaerobic microorganism[J].Journal of Xi'an Shiyou University(Natural Science Edition),2012,27(3):67-71.
[14] 窦启龙,陈践发,薛燕芬,等.实验室条件下微生物降解原油的地球化学特征研究[J].沉积学报,2005,23(3):542-547. DOU Qilong,CHEN Jianfa,XUE Yanfen,et al.A comparative study of the geochemical characters of crude oil after microbe degradation in laboratory[J].Acta Sedimentologica Sinica,2005,23(3):542-547.
[15] 谭田丰.海洋石油降解菌的分离鉴定及其在海洋石油污染生物修复中的应用研究[D].厦门:厦门大学生命科学学院,2006. TAN Tianfeng.Isolation and classification of marine oil degrading bacteria and their application in bioremediation of marine oil pollution[D].Xiamen:School of Life Science of Xiamen University,2006.
[16] LOU L L,CHEN H T,CERRY R L,et al.Unusual activities of the thioesterase domain for the biosynthesis of the polycyclic tetramate macrolactam HSAF in lysobacter enzymogenes C3[J].Biochemistry,2012,51(1):4-6.
[17] 赵玲侠,高配科,曹美娜,等.大庆聚驱后油藏内源微生物群落结构解析与分布特征研究[J].环境科学,2012,33(2):625-632. ZHAO Lingxia,GAO Peike,CAO Meina,et al.Research on population structure and distribution characteristic of indigenous microorganism in post-polymer-flooding oil reservoir[J].Chinese Journal of Environmental Science,2012,33(2):625-632.
[18] 王海峰,刘俊强,包木太.原油生物降解过程研究[J].油田化学,2011,28(4):451-453,471. WANG Haifeng,LIU Junqiang,BAO Mutai.Studies on the biodegradation process of the crude oil[J].Oilfield Chemistry,2011,28(4):451-453,471.
[19] 聂麦茜,张志杰,雷萍.优势短杆菌对多环芳烃的降解性能[J].环境科学,2001,22(6):83-85. NIE Maiqian,ZHANG Zhijie,LEI Ping.Biodegradation of polycyclic aromatic hydrocarbons by a preponderant brevibacterium[J].Chinese Journal of Environmental Science,2001,22(6):83-85.
[20] 王大威,张健,齐义彬,等.稠油降解菌的筛选及其对胶质降解作用[J].微生物学报,2012,52(6):353-359. WANG Dawei,ZHANG Jian,QI Yibin,et al.Isolation of viscous-oil degrading microorganism and biodegradation to resin[J].Acta Microbiologica Sinica,2012,52(6):353-359.
[21] 路璐,向廷生,黑花丽.本源微生物降解原油的饱和烃色谱分析[J].油气地质与采收率,2008,15(1):77-79,116. LU Lu,XIANG Tingsheng,HEI Huali,et al.Gas chromatographic analysis of the saturated hydrocarbon in the crude oil degradated by indigenous microorganisms[J]. Petroleum Geology and Recovery Efficiency,2008,15(1):77-79,116.
[22] JANEO R L,CORRE V L,SAKATA T.Water quality and phytoplankton stability in response to application frequency of bioaugmentation agent in shrimp ponds[J]. Aquacultural Engineering,2009,40(3):120-125.
[23] 周庆,陈杏娟,许玫英.微生物菌剂在难降解有机污染治理的研究进展[J].微生物学通报,2013,40(4):669-676. ZHOU Qing,CHEN Xingjuan,XU Meiying.Recent research progress in microbial agents for treatment of refractory organic contaminants[J].Microbiology,2013,40(4):669-676.
[24] MA J,XU L,JIA L.Degradation of polycyclic aromatic hydrocarbon by Pseudomonas sp.JM2 isolated from active sewage sludge of chemical plant[J].Journal of Environmental Science,2012,24(12):2141-2148.
[25] 张兰英,刘娜,孙立波.现代环境微生物技术[M].北京:清华大学出版社,2005.
[26] 姚瑶,刘兆普,郑青松,等.胜利油田土壤中石油降解菌分离和鉴定及代谢产物的研究[J].南京农业大学学报,2013,36(1):65-71. YAO Yao,LIU Zhaopu,ZHENG Qingsong,et al.Isolation and identification of oil-degrading bacteria in Shengli Oilfield soil and analysis of metabolites[J]. Journal of Nanjing Agricultural University,2013,36(1):65-71.
[27] 孔瑛,赵金生,史德青,等.石油生物脱硫菌Pseudomonas stutzeri UP-1的筛选[J].微生物学通报,2004,31(3):36-41. KONG ying,ZHAO Jinheng,SHI Deqing,et al.Isolation of biodesulfurization bacteria Pseudomonas stutzeri UP-1 for petroleum[J].Microbiology,2004,31(3):36-41.
(编辑 刘为清)
Interaction between high-wax crude oil and the microorganism inhabiting injection and production water
HE Yanlong1,ZHANG Fan2,CHAI Lujun2,PU Chunsheng1,DONG Hao3,HAN Chunchun4,SHE Yuehui4
(1.School of Petroleum Engineering in China University of Petroleum,Qingdao 266580,China;2.School of Energy Resources in China University of Geosciences,Beijing 100083,China;3.College of Chemical Engineering in China University of Petroleum,Beijing 102249,China;4.College of Chemistry and Environmental Engineering in Yangtze University,Jingzhou 434023,China)
The wax,resin,and asphaltene in the high-wax crude oil can be easily precipitated in the pores during the development of this crude oil.The interaction between the indigenous microorganisms in different water floodings and high-wax crude oil was investigated.The injection and production water was collected from Weigang Oilfield(Henan)and the activation system was optimized.The oil recovery enhancement with the indigenous microbe was studied using physical simulation experiment of oil displacement by microorganism.And the changes of the microbial community,as well as the composition and properties of crude oil before and after activation were characterized.It is found that the difference of the microbial community in injection and production water is significant.The dominant bacteria after activation in indigenous microbe are Bacillus sp and Clostridium ultunense.The dispersion grade of the oil emulsion is reached up to 5.And the enhanced oil recovery by microbe is increased up to 12.51%.The freezing point of the oil is reduced down to 5℃,and the wax content is decreased more than 3.95%.Meanwhile,the degradation of naphthalene,phenanthrene and its homologue in crude oil is pro-nounced.The indigenous microbes in different water floodings play an important role of oil recovery and oil degradation.
injection and production water;oil degradation;GC/MS;gas chromatography;physical simulation
TE 357
A
1673-5005(2015)04-0131-09
10.3969/j.issn.1673-5005.2015.04.018
2015-02-10
国家“863”重大项目(2006AA06Z204);国家自然科学基金项目(50974022,51074029,51104173)
何延龙(1987-),男,博士研究生,研究方向为复杂油气藏物理-化学强化开采技术。E-mail:stpnet@126.com。
佘跃惠(1965-),男,研究员,研究方向为生物采油。E-mail:sheyuehui@163.com。
引用格式:何延龙,张凡,柴陆军,等.注采水样微生物群落与高凝原油的相互作用[J].中国石油大学学报:自然科学版,2015,39(4):131-139.
HE Yanlong,ZHANG Fan,CHAI Lujun,et al.Interaction between high-wax crude oil and the microorganism inhabiting injection and production water[J].Journal of China University of Petroleum(Edition of Natural Science),2015,39(4):131-139.

