复合催化剂在油酸豆甾醇酯合成中的应用
张硕,杨亦文,邢华斌,苏宝根,张治国,鲍宗必,杨启炜,任其龙
复合催化剂在油酸豆甾醇酯合成中的应用
张硕,杨亦文,邢华斌,苏宝根,张治国,鲍宗必,杨启炜,任其龙
(浙江大学生物质化工教育部重点实验室, 化学工程与生物工程学院,浙江杭州310027)
以油酸和豆甾醇为原料,研究了以硫酸氢钾-金属氧化物为组合的复合催化剂在酯化合成中的应用。首先,通过与其他硫酸盐的酯化效果进行比较,筛选出KHSO4是适用于酯化合成中高效且安全的催化剂,并将其和不同的金属氧化物进行组合作为复合催化剂进一步探究酯化效果。通过实验结果比较,得到KHSO4-ZnO作催化剂的酯化率最高。然后,将KHSO4-ZnO作为复合催化剂,针对催化剂用量、反应温度、反应时间、酸醇摩尔比等因素进行考察,探究油酸和豆甾醇的最佳酯化条件。得到最佳工艺条件为:在通高纯氮气条件下,选用3.0%KHSO4+1.0%ZnO(以豆甾醇的质量分数计)为催化剂,油酸和豆甾醇的摩尔比为1.8:1,反应的温度为 150℃,反应的时间为7 h,酯化率达到92.17%。本工艺利用KHSO4-ZnO作为复合催化剂,得到较高的酯化率,实现了一条合成油酸豆甾醇酯的新工艺路线。
复合催化剂;金属氧化物;硫酸氢钾;酯化合成;甾醇酯
引 言
植物甾醇是一种存在于植物中的天然活性物质[1],主要有-谷甾醇、豆甾醇、菜籽甾醇和菜油甾醇等[2-3]。植物甾醇主要通过抑制小肠中胆固醇的吸收,从而降低人体胆固醇和低密度脂蛋白胆固醇的含量[4-7]。同时,植物甾醇还能够抗氧化、防癌[2,8]、抗动脉粥样硬化[9]和消炎退热、抗病毒[10]等,也具有保健美容[11]等功效,被广泛应用于医疗品、食品加工和化妆品等行业[12-14]。但是,植物甾醇的水溶性和脂溶性较差,在人体内不易溶解,难以被吸收,从而使用范围受到限制[15-16]。此外,不饱和脂肪酸有利于软化血管,在人体的新陈代谢过程中也起着重要作用[17-18]。不饱和脂肪酸植物甾醇酯具有良好的脂溶性,成功地解决了植物甾醇难以溶解的问 题[19-20],又兼有植物甾醇和不饱和脂肪酸的生物功效。例如,植物甾醇油酸酯、植物甾醇亚油酸酯等可以替代植物甾醇,添加到食品中,能同时增加食品的生物活性[21-23]。
目前,植物甾醇酯的合成主要有化学合成法和酶促反应法[24-29]。酶促反应法产率较低、成本高,因此化学合成法仍是主要方法[30]。化学合成法常采用强酸(H2SO4、H3PO4等)、强碱(NaOH、甲醇钠、乙醇钠等)作为催化剂,但是强酸会引起甾醇的羟基脱水,强碱则会引起皂化反应造成损失。此外,强酸强碱等催化剂具有强腐蚀性且不易分离,对于食品安全问题影响严重[31-33]。已有研究表明,相较于强酸强碱类催化剂,金属氧化物及盐类作为催化剂,添加少量就可以获得高酯化率[34-39]。常见的硫酸盐,如NaHSO4、ZnSO4、CuSO4•5H2O、Al2(SO4)3等和金属氧化物,如MgO、ZnO、Al2O3等,都是温和高效的催化剂,也易于处理。如郭涛等[35]报道,用金属氧化物Al2O3催化植物甾醇酯化,酯化率最高能达到99.5%,但需190℃的高温,反应时间也较长需10 h,易发生副反应产生杂质,且经济成本较高。HigginsⅢ[37]报道,用0.1%的硫酸盐NaHSO4催化油酸和植物甾醇的酯化反应时,酯化率能达到98%以上,但反应需在真空条件下进行。
为了方便探究酯化规律,考虑到不饱和脂肪酸和植物甾醇都是混合物,研究不便,本文选择油酸和豆甾醇为模型化合物进行酯化反应的条件研究,以期得到对人体有利的不饱和脂肪酸植物甾醇酯。本文研究了一种在无溶剂体系中,经济、安全、高效的不饱和脂肪酸植物甾醇酯制备过程,结合了硫酸盐和金属氧化物的催化优点,探讨了复合催化剂催化油酸、植物甾醇酯化的可行性,并对影响酯化率的因素进行了研究。
1 实验部分
1.1 试剂与仪器
试剂:豆甾醇(西安海斯夫生物科技有限公司 99%)、油酸(国药集团化学试剂有限公司,AR)、氧化镁(阿拉丁化学试剂有限公司,AR)、中性氧化铝(阿拉丁化学试剂有限公司,AR)、氧化锌(阿拉丁化学试剂有限公司,AR)、氧化钙(阿拉丁化学试剂有限公司,AR)、硫酸氢钠(阿拉丁化学试剂有限公司,AR)、硫酸氢钾(阿拉丁化学试剂有限公司,AR)、硫酸铝(阿拉丁化学试剂有限公司,AR)、硫酸铁(阿拉丁化学试剂有限公司,AR)、硫酸锌(阿拉丁化学试剂有限公司,AR)、硫酸镁(阿拉丁化学试剂有限公司,AR)等。
仪器:气相色谱仪(岛津2010)、色谱柱DB-5ht(30 m×0.25 mm×0.10 μm,美国Agilent公司)、IKA磁力搅拌器和恒温油浴锅、分液漏斗、旋转蒸发器等。
1.2 实验步骤
1.2.1 油酸豆甾醇酯的合成方法 在装有磁子、温度计、通气管的50 ml三口烧瓶中,加入经70℃预干燥过夜的0.03 mol豆甾醇原料和一定比例的油酸,将三口烧瓶置于超声波清洗器中超声10~20 min以赶走油酸液体中的空气,然后再将通气管接高纯氮气。在通氮气条件下搅拌并油浴加热,待温度上升到指定温度后,加入少量催化剂(添加量以豆甾醇的质量百分比计)并开始计时,定时采样分析。产物用GC分析,计算豆甾醇转化率和酯化率。
1.2.2 转化率和酯化率的测定 气相色谱条件为:DB-5ht型石英毛细管色谱柱(30 m×0.25 mm×0.10 μm),FID检测器:进样量为1.0 μl,进样温度350℃,检测器温度350℃,载气为高纯氮气,柱温从180℃以5℃·min-1升温至300℃,保持5 min;再以10℃·min-1升温至350℃,并保持10 min。
通过GC图谱中各组分的峰面积计算豆甾醇的转化率(DC)、酯化率(DE)和选择性(),如式(1)~式(3)
其中,以纯豆甾醇为标准品,利用外标法计算反应后体系中豆甾醇的量。
其中,以纯油酸豆甾醇酯为标准品,利用外标法计算实际生成的油酸豆甾醇酯的物质的量;理论生成的油酸豆甾醇酯的物质的量即为反应初始时原料中豆甾醇的物质的量。
其中,DE和DC为通过计算得到。
2 结果与讨论
2.1 催化剂的筛选
首先,通过与其他硫酸盐等酸式盐的酯化效果进行比较,筛选出最优的硫酸盐催化剂。然后,再通过不同含量的该硫酸盐作为催化剂,来确定该硫酸盐作为催化剂时的最合适的量。由于硫酸盐催化效率较高[37-39];金属氧化物选择性较高,减少甾醇脱水等副反应[34-36],故将硫酸盐和4种不同的金属氧化物(MgO、Al2O3、ZnO、CaO)进行组合,筛选出酯化率最高的硫酸盐和金属氧化物作为复合催化剂。将这组复合催化剂应用于油酸和豆甾醇的酯化反应得到油酸豆甾醇酯。
2.1.1 硫酸盐的筛选 首先,以不同的硫酸盐为催化剂进行酯化反应。在通氮气保护条件下,油酸和豆甾醇的酸醇摩尔比为2:1,反应温度为150℃,反应时间为5 h 的条件下,选用3%(以豆甾醇的质量分数计,下同)的硫酸氢钠、硫酸氢钾、硫酸铝、硫酸铁、硫酸锌、硫酸镁为不同催化剂添加到反应体系中,测定转化率和酯化率。结果见表1。

表1 以不同硫酸盐为催化剂的酯化率
Note: Reaction temperature is 150℃. Reaction is with the substrate ratio of 2:1 for 5 h. Catalysts are NaHSO4, KHSO4, Al2(SO4)3·18H2O, FeSO4·7H2O, ZnSO4·7H2O, MgSO4·7H2O.
从表1的数据中可以看出,在相同条件下,硫酸氢钾作催化剂时得到的油酸和豆甾醇的酯化率最高,为59.92%。所以,选用硫酸氢钾作为催化剂,进一步进行研究。
2.1.2 以硫酸氢钾-金属氧化物为催化剂的筛选 分别选取2%、5%的硫酸氢钾和0.2%的4种不同金属氧化物MgO、Al2O3、ZnO、CaO组成8种不同的复合催化剂,在通氮气条件下,油酸和豆甾醇的酸醇摩尔比为2:1,反应温度为 150℃,反应时间为5 h,进行酯化反应,测定转化率和酯化率。结果见表2。
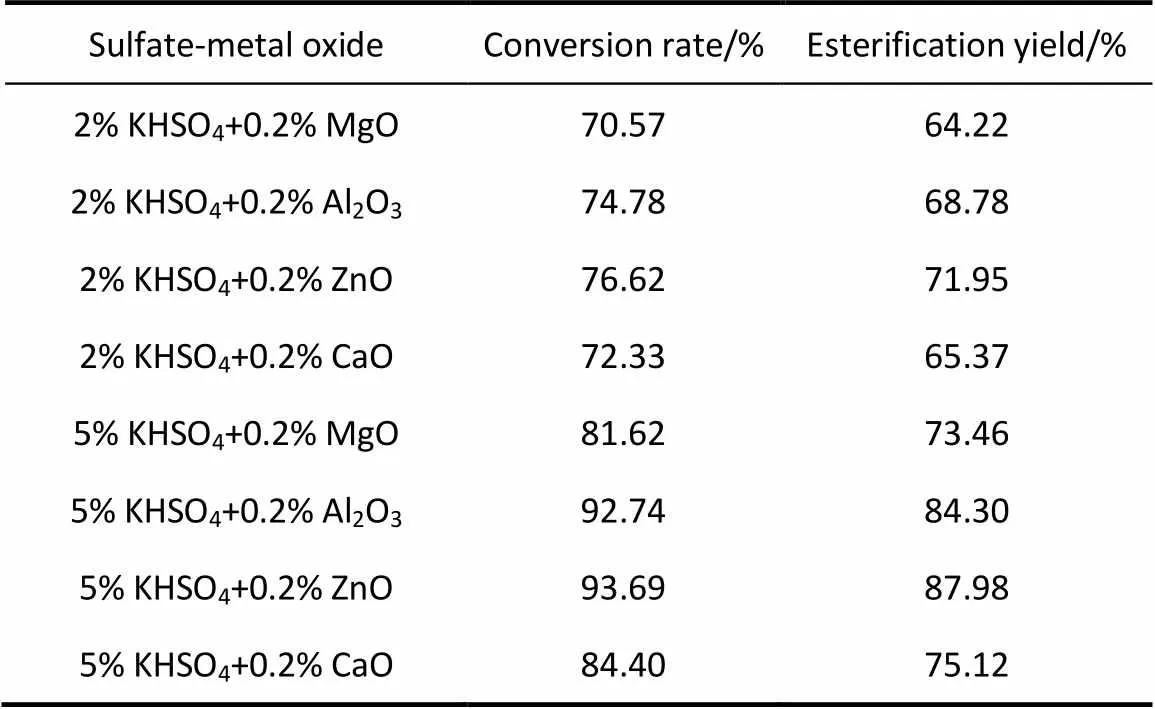
表2 不同硫酸氢钾-金属氧化物为催化剂的酯化率
Note: Reaction temperature is 150℃. Reaction is with the substrate ratio of 2:1 for 5 h. Composite catalysts are KHSO4(2%, 5%) and MgO, Al2O3, ZnO, CaO (0.2%).
从表2的数据中可以看出,在相同条件下,5%硫酸氢钾+0.2%氧化锌的组合作复合催化剂时得到的油酸和豆甾醇的酯化率最高,为87.98%。所以,选用硫酸氢钾+氧化锌的组合作为复合催化剂。
根据以上结果,可以看到硫酸氢钾和金属氧化物有良好的催化酯化效果,其反应机理可能为:硫酸氢钾能够给出H+为质子酸,催化酯化的机理同质子酸,即将H+转移至羧酸的羰基氧上,增强了羰基碳原子的正电性;而氧化锌等金属氧化物,其金属原子由于价电子层的d轨道或s、p轨道是空轨道,是缺电子体系,它们可以和羧基上的羰基氧配位结合,从而也增大了羰基碳的亲电性。所以,硫酸氢钾和氧化锌等氧化物在催化过程中协同增加了羰基碳的正电子性,从而使得与羰基碳相连的羟基的电子云密度降低,羰基氧原子显负性易于与H+结合。再经过电子重排,使羰基碳带更高的正电性,有利于亲核试剂醇的进攻,加速酯化速度。
2.2 单因素实验
以豆甾醇的酯化率为指标,在通氮气的条件下,选用硫酸氢钾+氧化锌的组合作为复合催化剂,针对催化剂的用量、反应的温度、反应的时间、酸醇摩尔比(油酸:豆甾醇,下同)4个合成工艺的影响变量做单因素实验,从而确定各变量的合适范围。
2.2.1 催化剂用量对酯化反应的影响 根据以上结果,选取1.0%、3.0%、5.0%的硫酸氢钾和0.1%、0.5%、1.0%、1.5%的氧化锌,组成12种不同的复合催化剂,在通氮气条件下,油酸和豆甾醇的酸醇摩尔比为2:1,反应的温度为 150℃,反应的时间为5 h,进行酯化反应,测定转化率和酯化率。结果见表3。

表3 不同含量的KHSO4-ZnO为催化剂的酯化率
Note: Reaction temperature is 150℃. Reaction is with the substrate ratio of 2:1 for 5 h. Composite catalysts are KHSO4(1.0%, 3.0%, 5.0%) and ZnO (0.1%, 0.5%, 1.0%, 1.5%).
从表3的数据中可以看出,在相同条件下,3.0% KHSO4+1.0% ZnO的组合作复合催化剂时得到的油酸和豆甾醇的酯化率最高,为90.12%。随着复合催化剂硫酸氢钾和氧化锌的用量增加,转化率一直增加,酯化率先增加后有所降低。当催化剂用量过多时,影响了主反应的选择性,产品颜色变深。硫酸氢钾和氧化物分别催化植物甾醇油酸酯合成时,也都呈现了相似的规律[34-36,39]。所以,根据实验结果,复合催化剂的适宜用量为3.0% KHSO4+1.0% ZnO。
2.2.2 反应温度对酯化反应的影响 在通氮气条件下,选取2.0%硫酸氢钾和0.5%氧化锌的组合作复合催化剂,油酸和豆甾醇的酸醇摩尔比为2:1,反应时间为5 h,改变反应温度进行酯化反应,测定转化率和酯化率。结果见图1。

图1 反应温度对酯化反应的影响
从图1的数据中可以看出,在相同条件下,随着反应温度升高,转化率一直增加,酯化率先明显增加后降低。反应温度为160℃时,得到的油酸和豆甾醇的酯化率最高,为66.17%。反应温度过高时,油酸、豆甾醇易发生氧化、脱水等副反应,从而引起了酯化率的下降。所以,根据实验结果,反应温度应该控制在160℃以下。160℃较150℃的酯化率相差不大,综合考虑节约能源经济因素,反应的适宜温度为150℃。
2.2.3 反应时间对酯化反应的影响 在通氮气条件下,选取2.0%硫酸氢钾和0.5%氧化锌的组合作复合催化剂,油酸和豆甾醇的酸醇摩尔比为2:1,反应温度为150℃,改变反应时间进行酯化反应,测定转化率和酯化率。结果见图2。
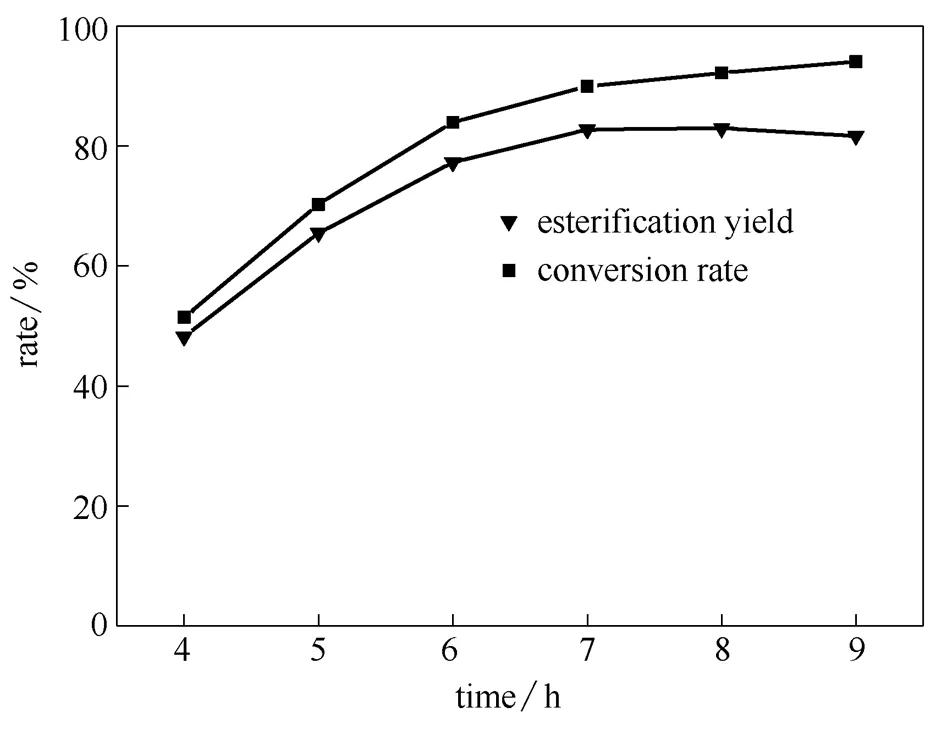
图2 反应时间对酯化反应的影响
从图2的数据中可以看出,在相同条件下,随着反应时间的增加,转化率一直增加,酯化率先明显增加后变化不大。在反应开始的7 h以内酯化率升高趋势显著,但在较短的7 h时,酯化反应就接近了平衡,酯化率达到82.73%。继续延长反应时间酯化率变化不大,趋于平缓。从经济角度考虑,反应时间应控制在一定的范围内;同时,反应时间过长有可能引起副反应的发生,降低主反应选择性,所以最佳反应时间选择7 h。
2.2.4 酸醇摩尔比对酯化反应的影响 油酸与豆甾醇的酯化反应为等摩尔反应,但由于甾醇比油酸价格昂贵,所以实验中选用过量的油酸,让反应向生成酯方向移动,提高酯化率。在通氮气条件下,选取2.0%硫酸氢钾和0.5%氧化锌的组合作复合催化剂,油酸和豆甾醇的酸醇摩尔比为2:1,反应时间为5 h,改变油酸和豆甾醇的酸醇摩尔比进行酯化反应,测定转化率和酯化率。结果见图3。
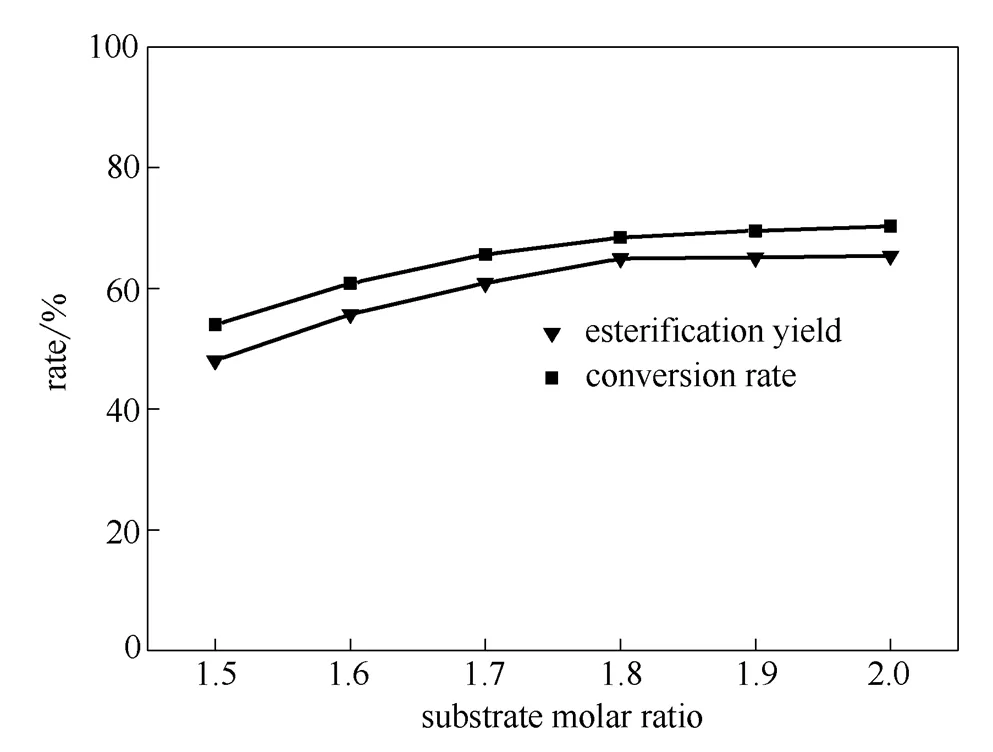
图3 酸醇摩尔比对酯化反应的影响
从图3的数据中可以看出,在相同条件下,随后油酸的量增加,转化率一直升高,酯化率先增加后变化不大。当油酸和豆甾醇的摩尔比从1.5:1提高到1.8:1时,酯化率增加明显,在1.8:1时酯化率达到64.95%。但随后油酸的量继续增加,酯化率趋于平缓。综合考虑到实际生产中,油酸过量对最终产品的分离提纯不利,增加难度和成本,反应中油酸和豆甾醇适宜的酸醇摩尔比为1.8:1。
2.3 验证实验
通过实验,分别确定了催化剂的用量、反应温度、反应时间、酸醇摩尔比的最佳选择。所以,反应最优工艺条件为:通氮气条件下,以3.0% KHSO4+1.0% ZnO的组合作复合催化剂,反应温度为150℃,反应时间为7 h,油酸与豆甾醇的摩尔比为1.8:1。在最佳反应条件下,进行实验,得到反应的转化率为96.82%±3.38%,酯化率为92.17%±2.65%,选择性为95.19%。
3 结 论
(1)本实验以油酸和豆甾醇为原料直接酯化合成油酸豆甾醇酯。采用在通高纯氮气条件下进行酯化,一方面可以用氮气隔绝空气,防止油酸和豆甾醇以及产物的氧化;另一方面,氮气可以在高温(>100℃)下带走酯化反应生成的水,使反应向酯生成方向进行,提高酯化率。
(2)通过实验,反应最优工艺条件为:通氮气条件下,以3.0% KHSO4+1.0% ZnO(以豆甾醇的质量分数计)的组合作复合催化剂,反应的温度为150℃,反应的时间为7 h,油酸与豆甾醇的摩尔比为1.8:1。在最佳反应条件下,酯化率为92.17%。在整个合成过程中,以KHSO4和ZnO为复合催化剂,结合了KHSO4和ZnO的催化优点。相较于单一催化剂KHSO4和ZnO[34,37-39],本实验操作条件更为温和易操作,降低了反应温度,缩短了反应时间,得到了较高的酯化率。整个反应过程中,无有毒有害物质的引入,是一种经济、安全、无污染的绿色工艺。这证明,以硫酸氢钾和氧化物为组合的复合催化剂可能是一种有前途的催化剂,可以取代强腐蚀性催化剂用于在工业中不饱和脂肪酸植物甾醇酯的合成。
符 号 说 明

DC——豆甾醇的转化率 DE——豆甾醇的酯化率 mA,0,mA,g——分别为反应前、后体系中豆甾醇的质量,g nB,1,nB,2——分别为实际生成、理论生成的油酸豆甾醇酯的物质的量,mol S——反应的选择性
[1] Fernandes P, Cabral J M S. Phytosterols: applications and recovery methods [J]., 2007, 98: 2335-2350.
[2] Berger A, Jones P J H, Abumweis S S. Plant sterols: factors affecting their efficacy and safety as functional food ingredients [J].., 2004, 3: 5-23.
[3] Kritchevsky D, Chen S C. Phytosterol-health benefits and potential concerns: a review [J]..., 2005, 25: 413-428.
[4] Institute of Food Science & Technology Trust Fund Information Statement. Phytosterol Esters (Plant Sterol and Stanol Esters). [ER/OL]. [2005-01]. http://www.ifst.org.
[5] Vuorio A F, Gylling H, Turtola H,. Stanol ester margarine alone and with simvastatin lowers serum cholesterol in families with familial hypercholesterolemia caused by the FH-North Karelia mutation [J]...., 2000, 20 (2): 500-506.
[6] Mattson F H, Grundy S M, Crouse J R. Optimizing the effect of plant sterols on cholesterol absorption in man [J]....., 1982, 35: 697-700.
[7] Kim J C, Kang B H, Shin C C,. Subchronic toxicity of plant sterol esters administered by gavage to Sprague-Dawley rats [J]., 2002, 40: 1569-1580.
[8] Choi Y H, Kong K R, Kim Y A,. Induction of bax and activation of caspases during beta-sitosterol-mediated apoptosis in human colon cancer cells [J]...., 2003, 23: 1657-1662.
[9] Nashed B, Yeganeh B, Hayglass K T,. Antiatherogenie effects of dietary plant sterols are associated with inhibition of proinflammatory cytokine production in Apo E-KO mice [J]..., 2005, 135: 2438-2444.
[10] Okoli C O, Akah P A. Mechanisms of the anti-inflammatory activity of the leaf extracts ofP. Beau (Araceae) [J]..., 2004, 79: 473-481.
[11] Karppanen,. Food seasoning, food ingredients and food item compositions and methods for their preparation [P]: US, 6136349. 2000.
[12] David K, Shirley C C. Phytosterols-health benefits and potential concerns: a review [J]., 2005, 25: 413-428.
[13] Moreau R A, Whitaker B D, Hicks K B. Phytosterols, phytostanols, and their conjugates in foods:structural diversity, quantitative analysis, and health-promoting uses [J]., 2002, 41: 457-500.
[14] He W S, Jia C S, Yang Y B,. Cholesterol-lowering effects of plant steryl and stanyl laurate by oral administration in mice [J]., 2011, 59: 5093-5099.
[15] Engel R, Schubert H. Formulation of phytosterols in emulsions for increased dose response in functional foods [J]..., 2005, 6 (2): 233-237.
[16] Kevin B H, Robert A M. Phytosterols and phytostanols: functional food choleste rol busters [J]., 2001, 55 (1): 63-67.
[17] Ryan C M ,Wilson M A , Slavin J,.Associations between liver histology and severity of the metabolic syndrome in subjects with nonalcoholic fatty liver disease [J]., 2005, 28: 1222-1224.
[18] Richieri G V, Kleinfeld A M.Unbound free fatty acid levels in human serum [J]...., 1995, 36 (2):229-40.
[19] Moruisi K G, Oosthuizen W, Opperman A M. Phytosterols/ stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis [J]., 2006, 25: 41-48.
[20] He W S, Jia C S, Yang Y B,. Cholesterol-lowering effects of plant steryl and stanyl laurate by oral administration in mice [J]., 2011, 59: 5093-5099.
[21] Villeneuve P, Turon F, Caro Y,. Lipase-catalyzed synthesis of canola phytosterols oleate esters as cholesterol lowing agents [J]., 2005, 37: 150-155.
[22] Kim B H, Akoh C C. Modeling and optimization of lipase-catalyzed synthesis of phytosteryl esters of oleic acid by response surface methodology [J]., 2007, 102: 336-342.
[23] van Horn L, McCoin M, Kris-Etherton P M, Burke F, Carson J A S, Champagne C M,. The evidence for dietary prevention and treatment of cardiovascular disease [J]., 2008, 108:287-331.
[24] Plat J, Mensink R P. Plant stanol and sterol esters in the control of blood cholesterol levels: mechanism and safety aspects [J]., 2005, 96:15-22.
[25] Duchateau E A, G S M J E, Lin Y, Mel’nikov S M,. Proposed mechanisms of cholesterol- lowering action of plant sterols [J]....., 2003, 105:171-185.
[26] Rozner S, Garti N. The activity and absorption relationship of cholesterol and phytosterols [J]., 2006, 282/283: 435-456.
[27] Moghadasian M H, McManus B M, Godin D V, Rodrigues B, Frohlich J J. Proatherogenic and antiatherogenic effects of probucol and phytosterols in apolipoprotein E-deficient mice: possible mechanisms of action [J]., 1999, 99: 1733-1739.
[28] Bouic P J D. The role of phytosterols and phytosterolins in immune modulation: a review of the past 10 years [J]., 2001, 4 (6): 471-475.
[29] van Rensburg S J, Daniels W M U, van Zyl J M, Taljaard J J F. A comparative study of the effects of cholesterol, beta- sitosterol, beta- sitosterol glucoside, dehydroepiandrosterone sulphate and melatonin onlipid peroxidation [J]., 2000, 15: 257-265.
[30] Yang Y B, He W S, Jia C S,. Efficient synthesis of phytosteryl esters using the Lewis acidic ionic liquid [J].:, 2012, 357:39-43.
[31] Flickinger B D, Grabiel R, Poppe G. Methods for producing sterol ester-rich compositions [P]: US, 20050038270. 2005-02-17.
[32] Comelis W V O, Marnix P V A,Lourus C L. Method of manufacturing a sterol eater mixture [P]: US, 6492538. 2002-12-10.
[33] Mazzuca M, Miscoria S A, Rost E,. Fatty acids and sterol in seeds from wild species of berberis in argentine patagonia [J]....., 2005, 93: 241-246.
[34] Meng X G, Pan Q Y, Yang T K. Synthesis of phytosteryl esters by using alumina-supported zinc oxide (ZnO/Al2O3) from esterification production of phytosterol with fatty acid [J]....., 2011, 88: 143-149.
[35] Guo Tao (郭涛), Jiang Yuanrong (姜元荣), Wang Yong (王勇),. Preparation of phytosterolesters from phytosterol and fatty acid [J].(中国油脂), 2011, 36 (1): 53-55.
[36] Pan Qiuyue (潘秋月), Zhou Xiaohong (周晓红), Meng Xianghe (孟祥河). Synthesis of phytosterol esters using solid green catalyst [J].(中国粮油学报), 2009, 24 (5): 115-118.
[37] Higgins Ⅲ J D. Preparation of sterol and stanol-esters [P]: US, 5892068. 1999-04-06.
[38] Higgins Ⅲ J D. Preparation of sterol and stanol-esters [P]: US, 6147236. 2000-11-14.
[39] Deng Q C, Zhang P, Huang Q D,. Chemical synthesis of phytosterol esters of polyunsaturated fatty acids with ideal oxidative stability [J]., 2011, 113 (4): 441-449.
Synthesis of phytosteryl oleate using composite catalysts
ZHANG Shuo, YANG Yiwen, XING Huabin, SU Baogen, ZHANG Zhiguo, BAO Zongbi,YANG Qiwei, REN Qilong
Key Laboratory of Biomass Chemical Engineering of Ministry of EducationCollege of Chemical and Biological EngineeringZhejiang UniversityHangzhouZhejiangChina
Phytosteryl oleate synthesized from stigmasterol and oleic acid using the composite catalysts of potassium bisulfate and metal oxide was investigated. By comparing with other sulfates, potassium bisulfate was proved to be more suitable for the esterification of oleic acid and stigmasterol in an efficient and safe way. Taking into account the high catalytic efficiency of metal oxide, the combination of potassium bisulfate and different metal oxides as a kind of composite catalyst may be promising. The catalyst comparative experiments suggested that the composite catalyst of KHSO4-ZnO was the best catalyst in terms of the esterification yields. When the esterification reaction was carried out at 150℃ for 7 h with oleic acid and stigmasterol in a molar ratio of 1.8:1 and 3.0% KHSO4+ 1.0% ZnO catalyst (based on the mass of stigmasterol) under the protection of nitrogen, the highest esterification yield was 92.17%. In the presence ofthe composite catalyst of KHSO4-ZnO, a new process for the synthesis of stigmasterol oleate with high esterification yield is acquired.
composite catalyst; metal oxide; potassium bisulfate; esterification; phytosteryl oleate
2013-05-24.
Prof.YANG Yiwen, ceywyang@zju.edu.cn
10.11949/j.issn.0438-1157.20150552
TQ 645.9+8
A
0438—1157(2015)08—3078—06
杨亦文。
张硕(1990—),女,硕士。
国家自然科学基金项目(21222601);教育部新世纪优秀人才支持计划(NCET-13-0524);浙江省重点科技创新团队计划(2011R50002)。
2015-05-04收到初稿,2015-05-30收到修改稿。
supported by the National Natural Science Foundation of China (21222601), Program for New Century Excellent Talents in University of Ministry of Education of China (NCET-13-0524), and Zhejiang Key Scientific and Technological Innovation Team (2011R50002).

