基于R-藻红蛋白及硫酸多糖提取的次等紫菜综合利用技术
冯建华, 牛建峰 , 黄爱优 , 王广策
(1. 天津科技大学 海洋科学与工程学院, 天津 300457; 2. 中国科学院海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 3. 南通中国科学院海洋研究所海洋科学与技术研究发展中心, 江苏 南通 226006)
藻类多糖是构成藻类的主要成分之一, 包括具有微细纤维状结构的细胞壁多糖、无定形的细胞壁间黏多糖以及细胞内的储存多糖。海藻硫酸多糖(sulfated polysaccharide form seaweed, SPS )是普遍存在于海藻中的一种大分子多糖, 硫酸基通过取代糖分子链中某些羟基而形成功能性活性分子。现有研究均表明SPS在抗氧化、抗肿瘤、提高机体免疫力、降血脂等方面显示出特有的生物活性[1-2]。海藻硫酸多糖还具有类似肝素的特性, 能通过肝素辅酶 II发挥抗凝血作用。此外, SPS还具有抗血栓及溶解血栓的作用, 性能优于目前临床应用的抗凝剂和溶栓剂。因此, 某些海藻硫酸多糖已表现出巨大的临床应用前景[3-4]。
紫菜多糖是其细胞主要组分之一, 具有抗凝血、降血脂、抗衰老及免疫调节等作用[5-8]。南非紫菜多糖能够通过降低小鼠MDA水平, 直接清除体内自由基而提高其抗氧化能力[9]。Yoshizawa等[10-11]从条斑紫菜中分离到具有激活巨噬细胞、增强免疫功能的两种多糖组分。因而紫菜多糖是一种比较理想的可被开发成抗衰老食品和药品的重要组分。另外, 多糖分子中存在大量羟基或羧基等极性基团, 可以与水分子形成氢键, 表现出良好的吸湿和保湿性能[12],所以在医药、化妆品、农业等方面也具有广阔的应用前景[13]。
藻胆蛋白是一种水溶性色素蛋白, 具有独特的吸收光谱和荧光发射光谱, 它的存在补充了叶绿素的光吸收范围, 拓宽了藻类对可见光的吸收, 有利于藻类对水生环境的适应。条斑紫菜藻红蛋白为 I型 R-藻红蛋白, 由于其独特的光谱特性、稳定性以及较高的吸收系数和量子产额, 可作为生化研究的荧光探针而运用于细胞和生物大分子的标记[14]。还可以用作肿瘤治疗的光敏剂[15-16], 也有报道称其具有免疫调节的作用[17]。此外, 藻胆蛋白还可作为天然色素用于食品、化妆品的添加[18-19], 避免了化学合成色素可能带来的毒性危害。
紫菜是一类具有重要经济价值的大型海藻, 目前有几个种广泛栽培于东南亚沿海各国[20]。据统计,2006年紫菜年产量约 1.8×104t干品, 年产值估计约13亿美元[21]。我国紫菜产业发展迅速, 从分布区域来看, 长江以南以坛紫菜为主, 主要集中在福建省和广东省; 长江以北以条斑紫菜为主, 主要集中在江苏省和山东省。江苏省的紫菜栽培业发展迅速, 全省栽培面积2.2 ha(33万亩)左右, 从业人员8万左右, 在南通、盐城和连云港海区形成了我国条斑紫菜的主产区,年产量40亿枚标准制品, 行业总产值20亿元左右。生产的紫菜在当地一次和二次加工后形成产品, 销往世界各地, 成为我国出口创汇的重要组成部分。然而,在紫菜的采收和加工过程中, 一些次等紫菜以及加工过程中产生的废弃紫菜, 往往作为垃圾处理, 一方面是巨大的浪费, 另一方面也可能造成环境的污染。因此, 这些次等紫菜的高值化加工及其高附加值物质的提取已经成为紫菜产业可持续发展的关键。本文利用这些次等紫菜相继提取藻胆蛋白和紫菜多糖, 有望实现对紫菜生物质的综合、高值化利用, 对进一步促进我国相关产品的开发与应用具有重要意义。
1 材料与方法
1.1 材料
末水条斑紫菜(Pyropia yezoensis)2014年5月由南通海达水产食品有限公司提供。去除杂藻简单清洗后, –20℃冷冻备用。
Phenyl-Sepharose(StreamlineTMPhenyl), DEAESepharose, 及StreamlineTM层析柱 (StreamlineTM25,100×2.5 cm)购自美国阿玛西亚公司(Amersham Biosciences Corp.)。
1.2 方法
1.2.1 藻红蛋白及硫酸多糖提取步骤
将15 g末水条斑紫菜叶状体与300 mL蒸馏水混合, 组织捣碎机粉碎, 经反复冻融 3次后, 筛绢过滤,收集上清液, 用于藻红蛋白纯化。残渣再次加水, 用于紫菜多糖的提取。重复3次, 以保证数据准确可信。
1.2.2 藻红蛋白的纯化
藻红蛋白提取缓冲液为10 mmol/L磷酸盐缓冲液(pH 6.8), 1 mmol/L 蛋白酶抑制剂PMSF, 依据公式 Kursar[22]测定粗提液中藻红蛋白浓度后, 加入固体硫酸铵至终浓度为 0.5 mol/L, 采用反向上样的膨化床吸附法(EBA色谱)进行分离纯化, 具体操作步骤参照文献[23]。洗脱液透析除盐后进行扫描光谱测定, 计算藻红蛋白得率及光谱纯度(OD565/OD280)。分离得到的藻红蛋白溶液再经DEAE-Sepharose离子交换柱层析进行藻红蛋白的纯化, 具体实验步骤参照文献[24]。洗脱之前, 首先用 4 mmol/L醋酸钠溶液(pH 4.5)去除藻蓝蛋白污染, 依次采用及 1 mmol/L醋酸钠(pH 4.2)及50 mmol/L磷酸盐缓冲液(pH 6.8)去除杂蛋白污染。洗脱液经透析, 体积测量后进行扫描光谱的测定。
1.2.3 藻红蛋白光谱测定
吸收光谱采用岛津紫外-可见分光光度计(SHIMADZU UV-1800, 中国)测定, 狭缝设定为2 nm; 荧光发射光谱使用日立荧光光谱仪F-4500(HITACHI, 日本)测定,狭缝设定为0.5 nm。所有光谱测定均在室温下完成。
1.2.4 电泳分析
SDS-PAGE参照 Schägger等[25]的方法进行。各步骤得到的样本经浓缩, 与等体积电泳缓冲液混合后沸水浴处理 5 min, 聚丙烯酰胺凝胶分离, 浓缩胶浓度为 5%, 分离胶浓度为 12.5%, 各含质量分数为 0.1%SDS。上样量30 μL, 常温下50 V恒压电泳。电泳完毕后, 用含0.2%的考马斯亮蓝R-250染色, 脱色, 拍照。
1.2.5 条斑紫菜多糖提取条件筛选
收集藻胆蛋白提取后的残渣, 分别加入10倍体积的pH 分别为6、7、8的磷酸盐提取缓冲液 (1%),于105, 110及121℃提取1, 2和3 h。筛绢过滤, 收集各提取液, 采用蒽酮硫酸法测定总糖含量[26]。
标准曲线的绘制: 参考张杰等[26]的方法, 分别准确配制葡萄糖系列标准溶液, 浓度从 0开始至200 mg/L, 梯度20 mg/L, 体积2.0 mL。混匀后各管分别加0.2%的蒽酮-硫酸试剂1.0 mL, 迅速摇匀, 冰浴放置10 min后, 于沸水浴中加热8 min (从水浴沸腾算起), 取出, 自来水冷却, 625 nm处测定吸收度。得回归方程为y=0.0172x+ 0.2305,R2=0.9817。
样品测定: 按实验结果将各样本稀释至合适浓度。参照上述步骤测定各样本多糖含量。
1.2.6 硫酸基含量的测定
将同一提取条件获得的多糖粗提液合并, 加入适量活性炭, 摇床震荡过夜脱色。旋转蒸发浓缩至原体积的 1/3, 加入 8倍体积的乙醇, 冰箱静置过夜,离心收集沉淀, 用乙醇洗涤 1次后冷冻干燥, 称质量。称取一定量的沉淀用于硫酸基含量的测定。
标准曲线的绘制: 参照Verma报道的比浊法[27], 准确配制0.00, 0.03, 0.06, 0.12, 0.24 g/L的SO42–标准硫酸基系列溶液, 各取2 mL 于1, 2, 3, 4 号试管中, 在0号试管中加2 mL蒸馏水作空白。依次加入2.5 mL浓度为4 mol/L的山梨醇, 0.5 mL 6mol/L盐酸, 最后加入0.5 g BaCl2.2H2O固体粉末, 震荡5~10 min。紫外可见分光光度计于470 nm处测它们的吸光度, 得标准曲线。回归方程:y= 2.0317x–0.0956; 回归系数:R2= 0.9765。
样品测定: 各样品加入盐酸至终浓度 2 mol/L,于 100~105℃下密闭水解 2 h, 活性炭脱色, 滤液加固体BaCl2.2H2O粉末, 比浊法测定。
1.2.7 微波辅助抽提及超声辅助抽提
高压锅提取前, 先以微波或超声仪进行前处理,微波处理选择适当功率, 使样本呈轻度煮沸状态,处理时间为 30 min; 超声处理功率设定为 120 W,30min; 其余步骤同上述优选得到的最佳热提取法。
2 结果
2.1 R-藻红蛋白的提取
如图 1a所示, 条斑紫菜藻红蛋白粗提液吸收光谱中, 565 nm处藻红蛋白特征吸收峰明显低于280 nm处总蛋白吸收值, 说明粗提液中杂蛋白含量较高。根据 R-藻红蛋白得量公式 R–PE=155.8A498.5–40.0A614–10.5A651及测得的体积[22], 计算可得粗提液藻红蛋白得率为5.3 mg/g条斑紫菜(湿质量)。
粗提液经膨化柱分离, 梯度硫酸铵洗脱, 浓度得率见表1。扫描光谱如图1b 至1d所示, 藻红蛋白3个特征峰(498、545和565 nm)明显, 与此同时, 紫外区蛋白吸收峰明显降低, 说明藻红蛋白得到了有效提纯。但在620 nm 和 650 nm处可见小的吸收峰,意味着藻蓝蛋白及别藻蓝蛋白没有被有效地去除。此外, 光谱纯度(A565/A280)虽然得到了显著提高, 但依然低于藻红蛋白光谱纯度标准( 3.2 )。

表1 不同硫酸铵浓度洗脱的藻红蛋白得率及纯度Tab.1 Quantity and purity of the eluates from the streamline column eluted with 0.20, 0.10 and 0.05 mol/L ammol/Lonium sulfate

图1 藻红蛋白提取过程中吸收光谱Fig.1 Spectra of the fractions collected during R-PE isolation from leafy gametophyte of P. yezoensis
疏水色谱得到的藻红蛋白提取液使用 DEAESepharose树脂进行离子交换色谱层析, 用4 mmol/L醋酸钠(pH 4.5)缓冲液去除大部分藻蓝蛋白及其他杂蛋白污染后, 藻红蛋白可通过含 NaCl梯度(0~0.2 mol/L)的磷酸盐缓冲液(pH 6.8)洗脱得到。纯化得到的藻红蛋白吸收光谱和荧光发射光谱如图2。吸收光谱中, 位于620 nm处的肩峰已经不存在, 说明藻蓝蛋白已经和藻红蛋白得到了分离。其最大荧光发射峰值位于580 nm。这些数据与以往报道的结果完全一致[24]。光谱纯度达到了4.2, 符合藻红蛋白光谱纯度标准(3.2)。

图2 藻红蛋白经离子交换柱纯化后的吸收光谱与荧光发射光谱Fig.2 The absorption and fluorescence spectrum of purified R-PE from DEAE-Sepharose column
2.2 电泳分析
SDS-PAGE的结果显示, 纯化的藻红蛋白可呈现两条明显的蛋白条带。分别位于33 kDa和20 kDa处, 其中33 kDa的强度明显弱于20 kDa处, 分别代表了γ亚基和α、β亚基。 30 kDa 及 45 kDa 可见的隐约条带可能为几个亚基组成的复合体(图3)。
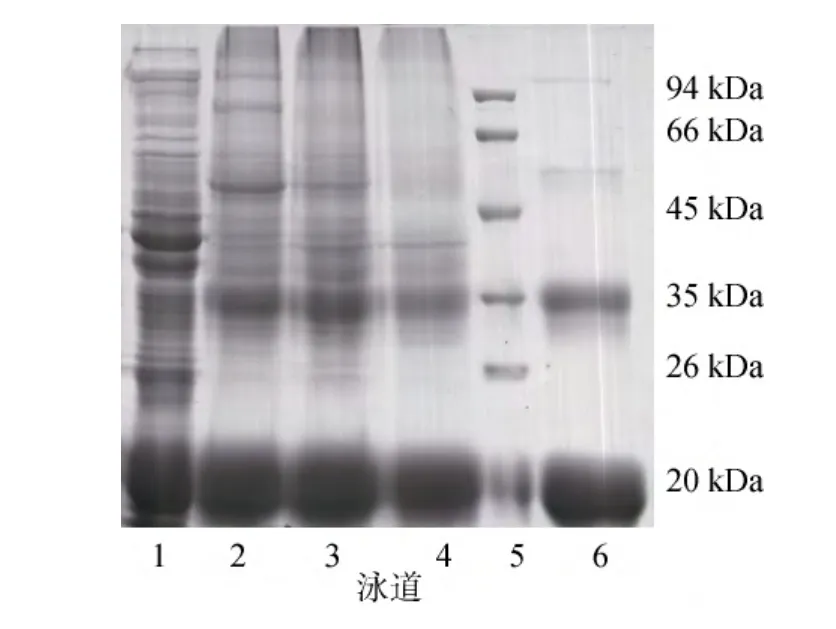
图3 藻红蛋白分离纯化过程中各洗脱液的电泳分析Fig.3 SDS-PAGE analysis of the fractions collected during the purification steps
2.3 藻红蛋白回收率及纯度分析
藻红蛋白的回收率, 以每步提取纯化步骤得到的藻红蛋白的量与粗提液中藻红蛋白的量的比值表示, 其结果见表2, 用膨化柱分离藻体中的藻红蛋白,其回收率可达 16.96%, 而接下来的纯化步骤使回收率变得更低, 离子交换色谱纯化后, 只有12.3%的藻红蛋白得到纯化。显然, 纯化步骤的增加使得率降低,但纯度则会升高。
565 nm处的光吸收是藻红蛋白的特征吸收值,而280 nm的吸收值则对应于总蛋白质的浓度。因此,A565/A280被认为是藻红蛋白纯度的一个很好的指标。粗提液中, 此比值仅为0.52。经过膨化柱的疏水层析操作, 此纯度值上升到了 2.65~4.27, 表明绝大部分非藻红蛋白的物质已经被去除。接下来的离子交换色谱, 使得藻红蛋白的纯度值均高于3.2这一普遍接受的纯度标准。
2.4 多糖提取条件筛选
如表3所示, 提取液pH是影响条斑紫菜多糖提取量的主要因素, 在同一pH条件下, 多糖得率与提取温度呈正相关; 与提取时间呈正相关, 但不同的pH和不同的提取温度下, 提取时间对条斑紫菜多糖得率的影响大小不等。为此我们做了三因素四水平正交试验, 实验结果如下:
从极差结果分析来看, 本实验因素存在显著性顺序, 初步得出对条斑紫菜硫酸多糖提取效率影响最大的因素是 pH, 其次是提取温度, 提取时间影响相对较小。根据单因子实验结果, 采用 pH 6, 温度121℃, 提取 2次, 每次 1h, 为最优的紫菜多糖提取条件, 在此条件下, 多糖提取率相对较高, 且提取时间较短。故在实际生产中, 可使用此方案, 这样可以达到高产且缩短生产周期、减少能耗的要求。

表2 R-藻红蛋白的纯化Tab.2 Purification of R-phycoerythrin from P. yezoensis

表3 L9(34)的正交实验设计及极差分析结果Tab.3 L9(34)orthobonal experiment design and result of extremely difference analysis
天然提取的硫酸多糖组分复杂, 分子较大, 外观呈灰白色, 易溶于水, 均一性差, 常含有较多的蛋白质, 称为粗多糖。表4所示为不同提取温度及pH值下多糖的提取结果。多糖回收率用提取得到的多糖占使用的新鲜条斑紫菜质量百分比来表示, 硫酸基得率为提取单位新鲜条斑紫菜所能得到的硫酸基的质量, 粗提物得率为每次提取得到的固形物质量与新鲜的条斑紫菜质量的比值。结果如表4所示, 硫酸基得率及多糖回收率在pH为6时均明显高于pH 7和pH 8时的值。同一pH下, 随着提取温度的升高,多糖回收率及硫酸基得率均增加。采用 pH 6, 温度121℃, 提取2次, 每次1 h的条件, 每克条斑紫菜可以回收到30.5 mg的多糖, 硫酸基得率为6.66 mg/g, 约占多糖质量的21.8%。但各条件下总粗提物得率无明显规律, 固形物中多糖含量约占10%~25% , pH 6提取条件下多糖含量相对较高, pH 8下的多糖含量较低。
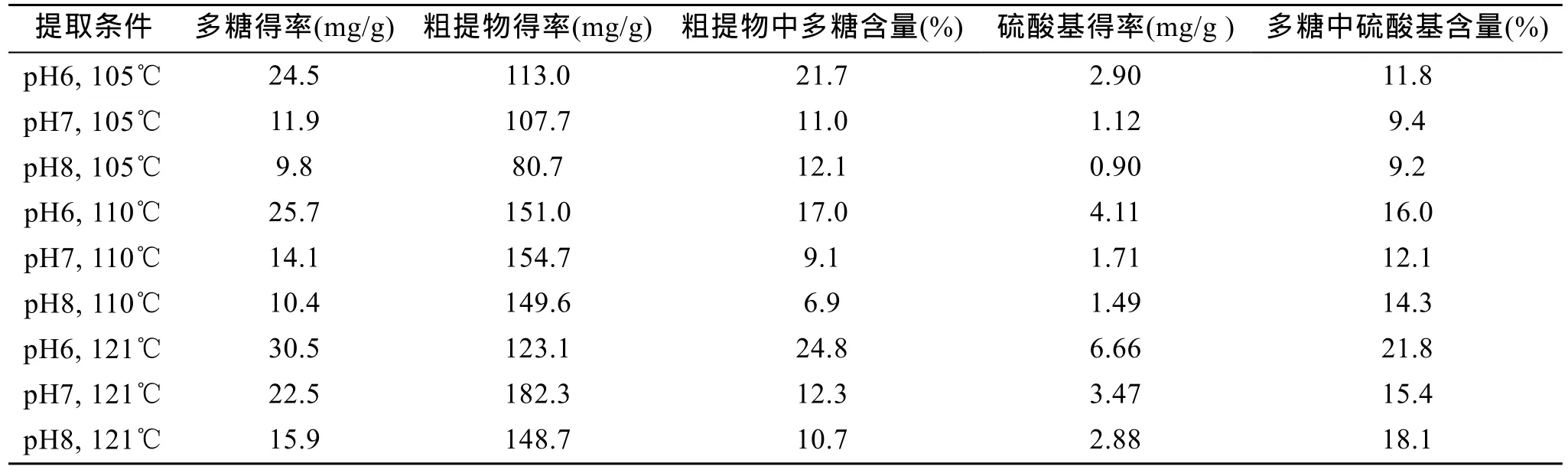
表4 不同pH和温度下紫菜多糖得率与硫酸基含量测定Tab.4 The determination of polysaccharides yield and sulfate content at different pH and temperature
2.5 微波辅助抽提与超声辅助抽提
结果显示, 高压锅提取之前的微波处理, 可以提高第一次热提取的多糖得率, 但后续得率降低,因此, 微波处理可以起到加速多糖提取及缩短热提时间的作用。超声波处理与对照组无明显差异。
3 讨论
3.1 藻红蛋白分离与纯化
藻胆蛋白可以作为荧光探针用于生物、医学研究以及疾病的诊断与治疗, 也可以作为肿瘤光动力治疗的光敏剂、食品着色剂等。国外的许多公司已相继投资开发藻胆蛋白产品, 且售价可观。目前, 疏水层析色谱(HIC)技术已经被广泛应用于血清蛋白、核蛋白、激素、重组蛋白及酶等生物大分子的纯化[28]。这种层析方法机制复杂, 对生物大分子的损害小,活性保持良好。与离子交换色谱、亲和层析、或反向色谱等技术相比较而言, HIC是一种温和的分离纯化方法[28-29]。它最突出的优点是纯化速度快、产量大、不需要常规色谱方法所要求的填料的平衡及粗提液的预处理[30], 是一种仅需一步操作就可以从粗提液回收目的蛋白的技术, 适合于从细胞裂解液或匀浆中直接分离目标物质。使用此技术, 目标蛋白直接被膨化柱内的树脂吸附而得到分离和浓缩, 简化了后续的纯化程序, 极大地减少了分离纯化的步骤和时间[31], 与此同时, 得率和纯度则相应提高, 这同时也降低了藻胆蛋白分离纯化的成本。因此, 我们将疏水层析运用于膨化床分离, 可以规模化的分离纯化藻胆蛋白。粗略计算显示, 运用文中报道的方法,每天可分离得到克级的藻胆蛋白。而且一个完整的分离过程仅需要3.5 h, 包括柱的平衡, 30 min, 上样,60 min, 清洗, 50 min, 洗脱60 min。因而是一种有效且快速的纯化藻胆蛋白的方法。
疏水层析利用的是填料分子与蛋白分子间的相对较弱的疏水键的作用而进行的, 不同的分子与填料间形成的疏水键不同[23], 通过改变溶液的离子强度, 就可以将不同的分子加以区分。如果藻胆蛋白发生变性, 则其分子内部疏水基团外露, 因而引起与树脂间作用力的增加, 导致难于从树脂洗脱。这样,我们就可以利用此性质将变性的与天然态的分子加以分离。结果显示, 只需一步膨化柱分离操作, 就可以分离得到满足食品及化妆品添加剂纯度要求的藻胆蛋白。
关于藻红蛋白纯度的评价, 普遍接受的的标准是 A565/A280大于 3.2[32], 如果藻红蛋白发生了解离,565 nm处的光吸收就会降低从而引起光谱纯度比值A565/A280的下降。A565/A498≤1.5, A620/A565≤0.005 也被广泛使用。R-藻红蛋白在498 nm处有强烈的吸收值而B-藻红蛋白则仅有很弱的吸收。如果A565/A498≤1.5,则表明R-藻红蛋白中没有B-藻红蛋白污染。A620/A565表示 R-藻红蛋白溶液中 C-藻蓝蛋白的含量。本实验中用离子交换法纯化的 R-藻红蛋白 A565/A498=1.16,A620/A565<0.005, 达到了试剂级的纯度标准。
3.2 多糖提取
浸提是影响多糖收率、产品质量的主要环节。水提醇沉法是使用最为广泛的一种多糖提取工艺。其中, 提取温度是与多糖得率密切相关的一个因素,提高温度, 多糖提取率也随之增加, 但某些多糖结构会被破坏, 能耗也随之增加。延长提取时间, 同样可以增加多糖得率, 但会使多糖水解的比率增多。提高料液比, 在一定程度上可以增加多糖的提取量,而过多的水分使得后续粗提液浓缩工作变得困难,大幅度增加能耗的同时降低了多糖的提取效率。提取液pH对条斑紫菜多糖得率有较大影响, pH值越高,多糖得率相对则越低。本文设计了这三个因子不同组合的提取条件, 开展了使用藻胆蛋白提取后的残渣为原料提取紫菜硫酸多糖最适提取条件的正交筛选实验, 确定了pH 6, 121℃下提取2次, 每次1小时为最适宜提取条件。相较于完整藻体, 残渣为破碎的藻体,体积小, 因而与提取液相对接触面积增大, 客观上加速了对多糖的提取。另一方面, 提取藻红蛋白时,细胞内可溶性蛋白、淀粉或其他一些物质已被移除,因而, 有利于硫酸多糖的提取。
3.3 关于硫酸基的讨论
对于硫酸多糖的提取, 条件不能过分强烈, 以免天然结构被破坏或硫酸基团脱落而失去生物活性。提取硫酸多糖一般不用碱溶液, 因为碱性条件下,多糖中6-硫酸基组分更容易转变为3, 6-内醚半乳糖,而导致硫酸基团脱落。吴永沛[33]使用0.1 mol/L盐酸提取了海带的岩藻聚糖, 提取率为 2.1%, 产品中SO42–含量为 20%。本文使用次等条斑紫菜提取藻红蛋白后的残渣为原料, 多糖得率为 3.05%, 其中SO42–含量为 21.8%。
3.4 微波与超声辅助提取
传统的长时间高温水提法不仅能耗大, 而且易造成多糖的部分降解及活性的降低, 微波和超声波是近年来逐渐被人们所采用的两种提供能量的形式,在多糖的提取方面也有不少尝试[34-35]。微波协同提取具有比水溶液加热提取植物有效成分效率高, 易控制, 提取成本低的特点[34], 王娟等[36]认为微波能够激发极性分子使其处于不稳定的状态, 不稳定的极性分子在回归到稳定状态的过程中会迅速释放能量并传递给其他分子, 使得其他分子的热运动增加,由此增加了单位时间内从物料内部到溶剂的分子数量, 有效地缩短了多糖提取的时间。另一方面, 微波释放的能量使得溶剂的温度升高, 水分子汽化产生的压力在细胞壁和细胞膜表面形成很多易于胞内物质溶出细胞内部的小孔, 降低了多糖提取的能耗[37]。但微波功率过大容易加快多糖的水解或引起爆沸。超声波辅助提取是近年来中药提取分离研究应用较多的方法, 具有提取效率高、提取时间短、能耗低的特点[38]。超声波通过破坏细胞膜、细胞壁而增加了内容物溶出和传输的能力, 从而大幅提高了有效成分的提取率, 缩短了提取时间, 更重要的是, 超声提取在常温条件下进行, 避免了高温对多糖有效成分的破坏。然而, 我们的结果显示, 超声辅助并没有有效增加紫菜多糖的得率, 这可能是因为条斑紫菜为单层细胞, 而且已经是充分溶胀的组织材料, 传统的热提法已经足以将其多糖成分快速彻底地溶出。
综上所述, 利用次等紫菜同时提取藻红蛋白和硫酸多糖, 使得不宜作为食品加工的藻类资源得到了综合、高值化的利用, 提取的物质可被应用于食品、药品研发, 对促进我国经济的发展也具有重要意义。
[1]Tang J, Hu Z Y, Chen X W. Free radical scavenging and antioxidant enzymes activation of polysaccharide extract fromNostoc sphaeroides[J]. Am J chin Med,2007, 35: 887-896.
[2]Drozd N N, Tolstenkov A S, Makarov V A, et al.Pharmacodynamic parameters of anticoagulants based on sulfated polysaccharides from marine algae [J]. Bull Exp Biol Med, 2006, 142: 591-593.
[3]孙惠洁, 吴永沛. 海藻硫酸多糖的制备及其抗凝血活性的研究进展[J]. 食品与药品, 2007, 9(08A): 54-56.
[4]Witvrouw M , De C1ercq E. Sulfated polysaccharides extracted from sea algae as potential antiviral drugs [J].Gen Pharmacol, 1997, 29: 497-515.
[5]周慧萍, 陈琼华. 紫菜多糖的抗凝血和降血脂作用[J].中国药科大学学报, 1990, 21(6): 358-360.
[6]Ichihara T, Wanibuchi H, Taniyama T, et a1. Inhibition of liver glutathione S-transferase placental form-positive foci development in the rat hepatocarcinogenesis byPorphyra tenera(Asakusa-nori)[J]. Cancer Lett, 1999,141: 211-218.
[7]Zhang Q, Yu P, Li Z, et a1. Antioxidant activities of sulfated polysaccharide fractions fromPorphyra haitanesis[J]. J Appl Phycol, 2003, 15(4): 305-310.
[8]Zhang Q, Li N, Liu X, et a1. The structure of a sulfated galactan fromPorphyra haitanensisand its in vivo antioxidant activity[J]. Carbohyd Res, 2004, 339(1):105-111.
[9]张诗山, 张虹, 牛锡珍, 等. 南非紫菜多糖抗衰老作用的研究[J]. 海洋科学, 2013, 37(9): 68-71.
[10]Yashizawa Y, Enomoto A, Todoh H, et al. Activation of murine macrophages by polysaccharide fractions from marine alga (Porphyra yezoensis)[J]. Biosci Biotech Biochem, 1993. 57: 1862-l866.
[11]Yashizawa Y, Ametani A, Tsunehiro J, et al. Macrophage stimulation activity of the polysaccharide fraction from a marine alga (Porphyra yezoensis): structure-function relationships and improved solubility[ J].Biosci Biotech Biochem, 1995, 59: 1933-1937.
[12]Khor E, Lim L Y. Implantable applications of chitin and chitosan[J]. Biomaterials, 2003, 24(13): 2339-2349.
[13]周裔彬, 汪东风, 杜先锋, 等. 酸化法提取海带多糖及其纯化的研究[J]. 南京农业大学学报, 2006, 29(3):103-107.
[14]Isailovic D, Li H W, Yeung E S. Isolation and characterization of R-phycoerythrin subunits and enzymatic digests[J]. Chromatogr A , 2004, 1051(1): 119-130.
[15]Huang B, Wang G C, Zeng C K, et al. Experimental research of R-phycoerythrin subunits on cancer treatment: a new photosensitizer in PDT[J]. Cancer Biother Radio, 2002, 17(1): 35-42.
[16]Li G W, Wang G C, Li Z G, et al. Biological effect of R-phycoerythrin mediated photosensitization on DNA.Prog Biochem Biophys, 2000, 27(6): 621-624.
[17]Román R B, Alvárez-Pez J M, Fernández F G A, et al.Recovery of pure B-phycoerythrin from the microalgaPorphyridium cruentum[J]. J Biotechnol , 2002, 93(1):73-85.
[18]Akhilender K, Sarada R, Manoj G, et al. Toxicity assessment of phycocyanin-A blue colorant from blue green algaSpirulina platensis[J]. Food Biotechnol,1999, 13(1): 51-56.
[19]Bermejo R, Tobaruela D, Talavera E M, et al. Fluorescent behaviour of B-phycoerythrin in microemulsiones of aerosol OT/water/isooctane[J]. J Colloid Interface Sci, 2003a, 263(4): 616-624.
[20]Masahiro Y, Keisuke, T, Yumi T, et al. Production of new antioxidant compound from mycosporine-like amino acid porphyra-334 by heat treatment[J]. Food Chem, 2008, 113(4): 1127-1132.
[21]FAO Fisheries Department. State of world aquaculture 2006[C]//FAO Fisheries Technical Paper. No. 500.Rome: FAO, 2006: 134.
[22]Kusar T A, Vander M J, Alberte R S. Light-harvesting system of the red algaGracilaria tikvahiaeI. Biochemical analysis of pigment mutations[J]. Plant Physiol, 1983, 73(2): 353-360.
[23]Niu J F, Wang G C, Tseng C K. Method for large-scale isolation and purification of R-phycoerythrin from red algaPolysiphonia urceolataGrev[J]. Protein Expres Purif, 2006, 49(1): 23-31.
[24]NIU J F, CHEN Z F, WANG G C, et al. Purification of phycoerythrin fromPorphyra yezoensisUeda (Bangiales, Rhodophyta)using expanded bed absorption[J]. J Appl Phycol, 2010, 22: 25-31.
[25]Schägger H , Jagow von G . Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa Anal[J]. Biochem, 1987, 166(2): 368-379.
[26]张杰, 李春艳, 李劲平, 等. 蒽酮硫酸法与苯酚硫酸法测定竹节参多糖含量的比较研究[J]. 中南药学,2012, 10(6): 421-424.
[27]Verma B C, Swaminathan K, Sad K C. An improved turbidimetric procedure for determination of sulfate in plants and soils[J]. Talanta, 1977, 24: 49-50.
[28]Queiroz J A, Tomaz C T. Cabral JMS Hydrophobic interaction chromatography of proteins[J]. J Biotechnol , 2001, 87(2): 143-159.
[29]Ghosh R, Wang L. Purification of humanized monoclonal antibody by hydrophobic interaction membrane chromatography[J]. J Chromatogr A , 2006, 1107(1):104-109.
[30]Jobby M K, Sharma Y. Rapid purification of recombinant β B2-crystallin using hydrophobic interaction chromatography[J]. Protein Expr Purif, 2003, 28:158-373.
[31]Chase H A. Purification of proteins by adsorption chromatography in expanded beds[J]. Trends Biotechnol, 1994, 12: 296-303.
[32]Galland-Irmouli AV, Pons L, Luçon M , et al. One-step purification of R-phycoerythrin fromthe red macroalga Palmaria palmata using preparative polyacrylamide gel electrophoresis[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2000, 739(1): 117-123.
[33]吴永沛, 邱晓燕, 张 东, 等. 海带提取岩藻聚糖的研究[J]. 食品科学, 2003, 24(10): 78-80.
[34]边清泉, 杨振萍, 红车轴草中刺芒柄花素的微波法提取工艺[J]. 化学研究与应用, 2005, 17(3): 431-432.
[35]Hromadkova Z, Ebringerova A. Ultrasonic extraction of plant materials-investigation of hemicelluloses release from buckwheat hulls[J]. Ultrason Sonochem,2003, 10 (3): 127-133.
[36]王娟, 沈平穰, 沈永嘉. 微波辅助萃取葛根和刺五加微观机制的研究[J]. 中草药, 2004, 35(1): 31-33.
[37]马长雨, 杨悦武. 微波萃取在中药提取和分析中的应用[J]. 中草药, 2004, 35(11): 7-10.
[38]钟玲, 尹蓉莉. 超声提取技术在中药提取中的研究进展[J]. 西南军医, 2007, 9(6): 84-87.

