2012年6月份桑沟湾褐潮期间浮游植物和浮游纤毛虫群落结构特征
郭术津, 丰美萍, 张瑞峰, 于 莹, 张武昌, 肖 天, 孙 军
(1. 天津科技大学 海洋科学与工程学院, 天津 300457; 2. 中国科学院海洋研究所, 海洋生态与环境科学重点实验室, 青岛海洋科学与技术国家实验室, 海洋生态与环境科学功能实验室, 山东 青岛 266071; 3. 华东师范大学 河口海岸科学研究院, 上海 200062; 4. 天津渤海水产研究所, 天津 300457)
浮游植物和浮游纤毛虫分别是海洋生态系统中的初级生产者和初级消费者, 前者通过光合作用吸收太阳能将 CO2转化为有机物[1], 后者是连接微食物网和经典食物链的重要传递者[2], 两者在海洋生态系统的物质循环和能量流动中扮演重要角色。作为海洋食物链的低营养阶层, 浮游植物和纤毛虫是鱼、虾和贝类等多种渔业生物的饵料, 其种类组成及生物量状况直接影响海区的渔获产量[3]。因此, 相关的群落调查对于估算海洋水产的潜在产量及合理开发利用的展开具有重要参考价值。另外, 浮游植物和纤毛虫都具有细胞个体小、生命周期短的特性, 可以迅速地对生存环境的变化作出反应, 因此其群落结构的变化也常被作为指示水体生态环境变化的指标[4]。
桑沟湾是位于山东半岛东端的一个总面积为133.3 km2的半封闭型海湾, 由于自然环境条件良好,海底平坦且基础生产力较高, 适合水产养殖业的发展[5]。桑沟湾的水产养殖业可以追溯到20世纪60年代的海带筏式养殖试验, 随后逐渐发展了扇贝、鲍鱼等的挂笼养殖和鱼类网箱养殖等新型养殖方式, 已成为中国北方重要的规模化海水养殖区[6]。关于桑沟湾浮游植物群落的调查, 目前已积累了相当多的资料。早期的调查多关注于水产养殖业的发展对桑沟湾浮游植物群落结构的影响。张莉红等[7]调查发现,由于扇贝对甲藻物种的选择性摄食, 桑沟湾的扇贝养殖业改变了当地海域的浮游植物群落;宋洪军等[8]对桑沟湾 1983~2004年的浮游植物多样性调查也表明, 扇贝养殖可一定程度降低浮游植物的多样性;慕建东等[9]对桑沟湾 2003~2005年浮游植物群落的分析表明, 桑沟湾浮游植物个体分布不均匀, 多样性一般。可以看出, 经过30多年的水产养殖业发展,桑沟湾的浮游植物群落已经受到明显的影响。但由于早期桑沟湾养殖区的环境质量相对较好, 水体中营养盐浓度基本保持平衡, 浮游植物类群以硅藻和甲藻为主, 鲜有藻华记录[8-10]。关于桑沟湾浮游纤毛虫的群落调查, 目前资料较少。于莹等[11]调查发现,桑沟湾纤毛虫的丰度在春季最高, 冬季最低, 其生物量与蓝细菌和异养细菌的丰度关系密切。
2011年5月份, 桑沟湾海域开始爆发大规模藻华,时间持续近 3个月, 面积覆盖整个桑沟湾海域[6]。经初步光学显微镜镜检和流式细胞仪分析, 藻华原因种为一种直径为2 μm左右的超微型球形藻类, 水体中细胞丰度可高达109个/L[12]。藻华发生期间水体透明度明显降低, 并伴随养殖贻贝和牡蛎等双壳生物的大量死亡, 给当地水产养殖业带来巨大的经济损失[13]。孔凡洲等[12]通过浮游植物色素的分析发现,藻华原因种可能属于海金藻类(Pelagophytes)、定鞭藻类(Haptophytes)或硅鞭藻类(Silicoflagellate)中的一种。由于缺乏分子的证据, 目前该藻华原因种并没有确定到种。值得引起注意的是, 该藻华原因种的细胞形态、大小和色素组成特征与近年来在秦皇岛沿岸海域频繁引发藻华的物种相似, 后者被疑似为一种与美国东海岸褐潮原因生物相类似的金藻类—抑食金球藻(Aureococcus anophagefferens)[14]。
2012年 6月初, 桑沟湾海域再次爆发该物种形成的藻华, 作者于藻华爆发期间采集了桑沟湾的海水样品, 并对浮游植物和浮游纤毛虫群落进行了分析。本文首次详尽报道桑沟湾该超微型褐潮原因物种藻华期间的浮游植物和纤毛虫群落, 以期对桑沟湾该藻华防治工作提供参考。
1 材料与方法
1.1 样品采集和分析
2012年6月8日, 在桑沟湾设置了6个调查站位 (37°02′N~37°06′N, 122°28′E~122°37′E)进行 调 查(图1), 用SeaBird SBE-25测定各站位从底层到表层的温度和盐度, 在各站位采表层水1 L置入样品瓶中,用Lugol溶液固定(终体积浓度为1%)。

图1 调查海区和站位Fig.1 Study area and sampling stations
样品带回实验室后对浮游植物和浮游纤毛虫群落进行分析。藻华原因种由于个体微小且丰度很高,采用血球计数板进行计数。其他浮游植物和纤毛虫样品静置24~48 h后用虹吸法浓缩至100 mL, 然后采用 Utermöhl方法分析[15]。具体操作为: 摇匀后取亚样品置于25 mL沉降杯中, 静置12~24 h后置于倒置显微镜 Olympus IX71下进行测定(200×或 400×),观察计数并鉴定浮游植物和纤毛虫。浮游植物和纤毛虫的鉴定参照分类学专著进行[16-18]。
1.2 数据处理
浮游植物和纤毛虫群落结构分析采用香农-威纳多样性指数和Pielou均匀度指数, 计算公式参考[19]。物种优势度指数(Y)计算公式如下:
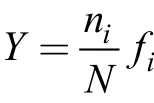
式中,ni为第i个种在所有样品中的细胞丰度总和;N为所有物种在所有样品中的细胞丰度总和;fi为该物种在各站位出现的频率。
CTD剖面资料显示站位间存在明显的水体垂直混合程度差异: 18号、15号和10号站位存在温度跃层, 而6号、4号和1号站位则表、底层垂直混合均匀。考虑到水体稳定度可能对藻华形成具有影响, 文中引入水体层化系数来进行分析。层化系数计算方法为: 先通过温度、盐度和压强计算出水体密度, 然后表、底层水体密度差除以水深即为层化系数[20]。层化系数越高, 说明水体越稳定; 层化系数越低, 说明水体垂直混合越强烈。
2 结果
2.1 环境特征
各站位表层的温度和盐度见图2。温度从湾内向湾外逐渐降低, 最高值19.65℃出现于18号站, 最低值11.78℃出现于1号站。站位之间较大的温度差异,可能跟各站位在一天内的不同时段进行调查有关。站位1于上午9点左右进行调查, 其他站位的调查时间依次推延, 站位18于下午3点左右完成调查。受阳光辐射的变化影响, 调查站位从站位 1到站位 18的水温逐渐升高。盐度呈现相反的变化规律, 从湾内向湾外逐渐升高, 最高值31.23出现于4号站, 最低值 30.77出现于18号站。相较温度, 盐度在各站位间的差异较小。
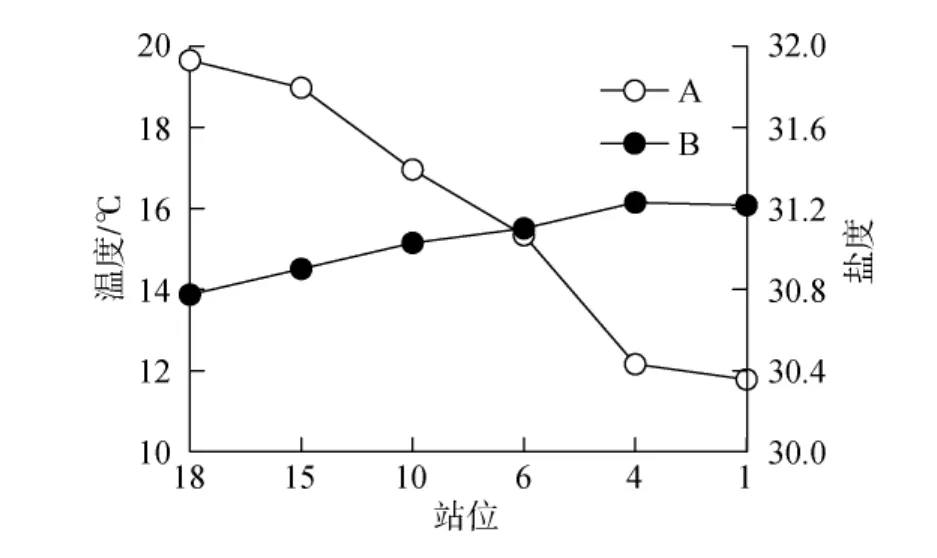
图2 调查站位表层温度(A)和盐度(B)Fig.2 Sea-surface temperature (A)and salinity (B)at the sampling stations
2.2 浮游植物
经镜检发现, 一种直径约2 μm的金色小球型藻类细胞丰度很高, 在部分站位细胞丰度已超过 109个/L(图 3)。由于光学镜检无法对其鉴定到种, 在此暂将该物种称为藻华原因种(Algae bloom causative species, ABCS)。无论是细胞形态还是尺寸, 该物种均与近年来在中国秦皇岛海域频繁引发藻华的超微型浮游植物相似[14]。其他浮游植物共鉴定3门23属38种,其中硅藻门16属29种, 甲藻门6属7种, 金藻门1属2种。浮游植物物种以微、小型浮游植物为主, 其中硅藻中物种数较多的为圆筛藻属(Coscinodiscus)、菱形藻属(Nitzschia)和曲舟藻属(Pleurosigma); 甲藻中物种数较多的为裸甲藻属(Gymnodinium)和原多甲藻属(Protoperidinium)。大多数物种为温带近岸型和广布型。对除去藻华原因种后的其他浮游植物物种进行了优势度分析(表 1), 可以看出, 具槽帕拉藻(Paralia sulcata)和裸甲藻(Gymnodiniumsp.)优势度明显高于其他物种, 剩余优势物种以硅藻为主。
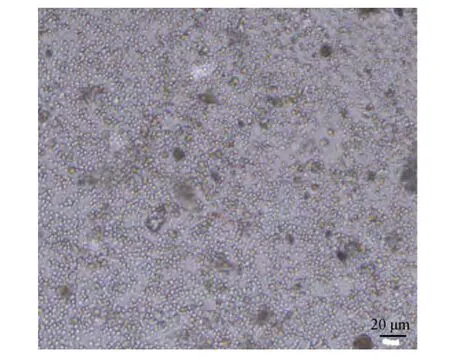
图3 2012年6月份桑沟湾藻华原因种细胞光学显微镜图片Fig.3 Photograph of the species causing an algal bloom in the survey area白色小点为藻华原因种细胞ABCS, white dots in the photo
调查区藻华原因种细胞丰度分布见表2。可以看出, 湾内侧的18号、15号、10号和6号站位的细胞丰度均超过了109个/L, 湾外侧的4和1号站位细胞丰度较低, 但仍高于 106个/L。总体来看, 藻华原因种的细胞丰度从湾内向湾口和湾外逐渐降低。其他浮游植物细胞丰度则从湾内向湾外呈先增加后减少的趋势, 最高值出现于湾口位置的6号站位; 硅藻细胞丰度分布趋势与浮游植物一致; 甲藻细胞丰度则从湾内向湾外呈逐渐降低的趋势(图4)。硅藻中的具槽帕拉藻很大程度上刻画了浮游植物总体(藻华原因种除外)的细胞丰度分布, 而裸甲藻则刻画了甲藻的细胞丰度分布。
2.3 纤毛虫
共发现砂壳纤毛虫 3属 5种(表 3), 断面外侧4号站位出现的砂壳纤毛虫种类数最多, 为4种; 其次湾口处的1和6号站位砂壳纤毛虫种类数分别为3种和2种; 湾内站位均为1种, 种类数沿断面自湾内向湾外递增。百乐拟铃虫(Tintinnopsis beroidea)出现在所有站位,丰度最大, 占绝对优势; 巴西拟铃虫(Tintinnopsis brasiliensis)与运动类铃虫(Codonellopsis mobilis)出现在两个站位; 妥肯丁拟铃虫(Tintinnopsis tocantinensis)与黏粘筒壳虫(Tintinnidium mucicola)仅出现在一个站位。

表1 调查区优势度排名前10的物种Tab.1 Top 10 dominant phytoplankton species in the survey area

表2 调查区各站位藻华原因种细胞丰度Tab.2 ABCS cell abundance at the sampling stations

图4 调查区浮游植物细胞丰度表层分布Fig.4 Distribution of phytoplankton cell abundance in the survey area surface waters
纤毛虫丰度为289~9917个/L。砂壳纤毛虫占绝对优势, 丰度为 289~9917个/L, 占总丰度的 37.58%~100%; 无壳纤毛虫丰度为0~1469个/L。纤毛虫总细胞丰度与砂壳纤毛虫丰度变化基本一致(图 5), 整体上从湾内到湾外呈降低趋势, 最高值出现在18号站位。湾内的18号、15号、10号和6号站位丰度均超过5000个/L; 断面外侧4号站位则低于1000个/L。无壳纤毛虫丰度沿断面无明显变化, 最高值出现在1号站位。砂壳纤毛虫中优势种为百乐拟铃虫, 丰度最高值出现在 18号站位约 104个/L, 整体丰度沿断面自湾内向湾外递减。

表3 调查区砂壳纤毛虫物种Tab.3 Tintinnid ciliate species in the survey area
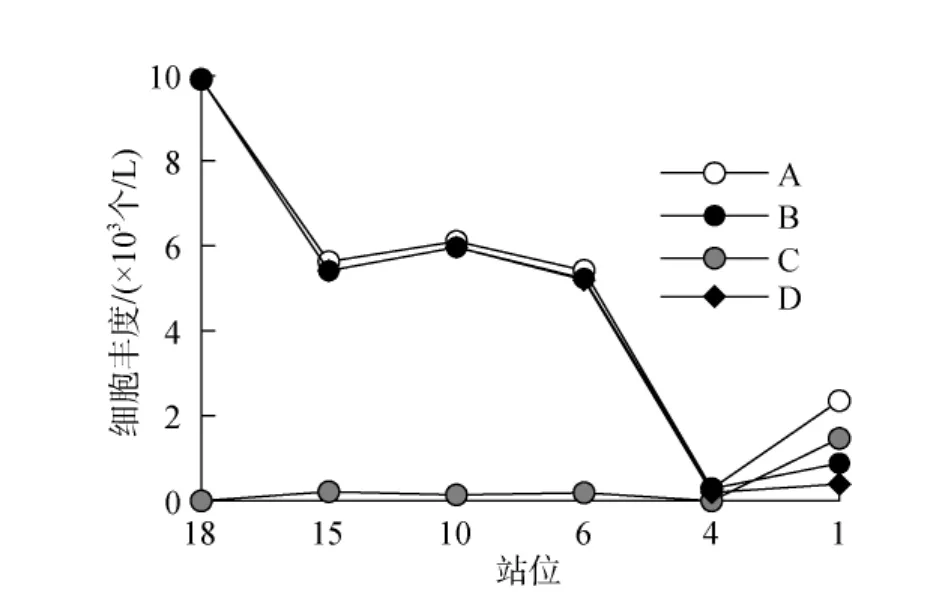
图5 调查区表层纤毛虫丰度分布Fig.5 Distribution of ciliate abundance in the survey area surface waters
2.4 藻华原因种与环境因子的关系
调查站位藻华原因种与温度、盐度和层化系数的关系见图6。从图6可以看出, 细胞丰度与温度呈正相关性; 细胞丰度与盐度呈负相关性; 细胞丰度与水体层化系数呈正相关性, 但相关性不是很显著。另外, 将藻华原因种的细胞丰度与调查区甲藻优势种裸甲藻和纤毛虫优势种百乐拟铃虫的细胞丰度进行了分析, 发现裸甲藻和百乐拟铃虫的细胞丰度均和藻华原因种的细胞丰度呈良好的正相关性(图 7)。
3 讨论
3.1 藻华原因种
一直以来, 桑沟湾的浮游植物以硅藻和甲藻为主, 鲜有藻华记录[8-10]。超微型浮游植物在该海域形成的藻华于2011年6月份首次出现, 并给当地的水产养殖业带来巨大经济损失[6]。事实上, 自 2009年起, 中国的秦皇岛沿岸海域每年5到6月份就连续发生超微型浮游植物藻华, 当地的扇贝养殖产业蒙受了巨大经济损失[21]。藻华原因种被怀疑是一种超微型浮游植物, 也有研究组认为是一种被称为抑食金球藻的超微型金藻引起的[14]。

图6 调查区温度、盐度和层化系数与藻华原因种细胞丰度的对数的散点关系图Fig.6 Scatter plot of temperature, salinity, and the stratification index with ABCS cell abundance at the sampling stations

图7 调查区裸甲藻细胞丰度和百乐拟铃虫细胞丰度(B, ind·L–1)与藻华原因种细胞丰度(×103 cells·L–1)的对数的散点关系图Fig.7 Scatter plot of Gymnodinium sp. and T. beroidea cell abundance with ABCS cell abundance at the sampling stations
据报道, 近岸海域发生的抑食金球藻藻华多集中于美国东海岸和南非沿岸海域[22-23]。由于这类藻华发生期间水体颜色呈褐色, 因此又被称为“褐潮”(Brown tide), 特点是对养殖贝类的摄食和生长有明显的抑制作用[24]。2009年秦皇岛发生后, 中国也成为继美国和南非之后第三个遭受“褐潮”危害的国家; 2011年桑沟湾“褐潮”的爆发, 也使其成为中国第二个遭受“褐潮”危害的海域。通过与世界其他海域的报道对比发现, 此次桑沟湾藻华原因种的生态特征与抑食金球藻非常相似, 如细胞个体小(~2 μm)、细胞丰度高(>108个/L)和对养殖贝类具有抑制生长作用等(表 4)。因此, 桑沟湾和秦皇岛海域的藻华原因种很有可能为同一物种, 而藻华原因种的来源不得而知。

表4 本次藻华与世界范围内抑食金球藻藻华特征比较Tab.4 Global comparisons of algal blooms and A. anophagefferens blooms
藻华原因种细胞丰度与海水的温度、盐度和层化系数的分析表明, 藻华原因种的细胞丰度与海水温度和层化系数呈正相关性, 与盐度呈负相关性(图6)。大量研究表明, 水温偏高和较平静的海域容易发生赤潮, 水温的适当升高往往可以加快浮游植物的生长速度, 而稳定的水体则有利于藻华细胞的斑块状聚集[26]。据报道, 2011年桑沟湾藻华的始发区域位于湾底[6], 本次调查藻华原因种的细胞丰度也是在湾底的 18号站位最高(表 2)。桑沟湾湾内水交换比较迟缓, 自净能力偏低[27]; 湾口处的大范围养殖的海带, 很大程度上也对湾内和湾外的水体交换起到屏障作用[28]。这种相对封闭的水体, 不利于浮游植物细胞的扩散, 容易造成生物量的累积。营养盐方面, 虽然本次调查没有获得营养盐资料, 但根据报道, 2011年桑沟湾的无机氮、磷和硅营养盐的浓度分别为2006年的5.6倍、1.3倍和3.2倍[6], 揭示了近几年桑沟湾水域富营养化程度的加剧, 使藻华爆发的可能性增加。温度方面, 资料显示, 褐潮藻生长的有利温度在 15 ℃以上(表 4), 这也与本次调查藻华程度严重的18号、15号和10号站位温度均高于15 ℃相吻合。另外, 2011年桑沟湾藻华爆发于6月3日, 6月1日和2日当地海域水温分别为13.20 ℃和13.18 ℃, 6月3日水温骤升至15.38 ℃, 迅速的升温伴随着叶绿素的爆发, 由8.77 mg/m3升至19.28 mg/m3[6]。因此,温度的升高(尤其是 15 ℃以上), 可能也是诱发藻华爆发的一个重要因子。总体来看, 桑沟湾相对封闭的水体、充足的营养盐以及水温的升高, 为此次6月份藻华的爆发提供了有利条件。但是, 鉴于调查资料及研究的匮乏, 近两年来桑沟湾藻华爆发的具体诱因,如营养盐结构的改变和藻华原因种对溶解有机物的吸收利用程度等都不清楚, 值得进一步探索。
3.2 藻华对浮游植物和纤毛虫群落的影响
将本次调查区藻华期间与历史同期未发生藻华期间的浮游植物群落进行了对比(表 5)。结果发现,藻华期间浮游植物群落的多样性指数和均匀度指数明显低于往年同期, 说明藻华的发生已经明显影响到调查区浮游植物的群落稳定性。另外, 甲藻优势种裸甲藻和纤毛虫优势种百乐拟铃虫的细胞丰度都与藻华原因种的细胞丰度呈正相关性(图 7)。在 2011年的桑沟湾藻华中也发现, 一种裸甲藻属物种优势度明显[12], 徐娜等通过分子手段将其鉴定为剧毒卡尔藻(Karlodinium veneficum)[31]。这次发现的裸甲藻是否与其为同一物种, 尚不确定。而关于百乐拟铃虫,2011年的调查中并没有作为优势种出现[11], 本次调查发现其在藻华中成为优势种。研究发现, 裸甲藻和纤毛虫均具有直接吞噬摄食小粒径浮游植物细胞的能力[32-34]。室内培养实验也发现, 在将抑食金球藻作为唯一食物来源时, 甲藻物种Oxyrrhisspp.和纤毛虫物种Uronemaspp.和Euplotesspp.都可以保持较好的生长[35]。因此, 本次调查两种物种在藻华站位丰度较高, 不排除其能够摄食藻华原因种细胞的可能, 两种异养微型浮游生物对藻华原因种的摄食能力及在藻华动力学过程中的摄食贡献值得探索。

表5 调查区浮游植物群落数据(不含藻华原因种)与历史同期资料的比较Tab.5 Historical data comparisons of the phytoplankton community (not including ABCS)in the survey area
百乐拟铃虫与藻华藻的关系比较复杂。本次调查中, 18号站和15号站藻华藻的丰度差别不大, 但是这2个站的纤毛虫总丰度差异很大(图 5); 15号站、10号站和6号站的藻华藻丰度相差较大, 但是纤毛虫总丰度却相差不大。因此, 除了藻华藻的丰度对纤毛虫有影响外, 其他因素(例如水温、盐度)对纤毛虫丰度可能也会影响, 纤毛虫丰度的变化是多种因素影响叠加的结果。
4 结语
美国东海岸的褐潮自1985年开始出现, 造成当地的扇贝等水产养殖产业受到严重影响; 南非的萨尔达尼湾自1996年也开始出现褐潮, 当地水产养殖业几乎完全没落[36]。桑沟湾作为我国北方重要的浅海养殖示范基地, 湾内5300余公顷养殖区年产10万余吨养殖产品, 是当地居民赖以生存的“母亲湾”。2011年和2012年的褐潮已对当地的水产养殖业带来了巨大的经济损失。从美国和南非的经验来看, 常年的褐潮爆发最终会导致水产养殖业的崩溃, 如果这发生在桑沟湾, 后果不堪设想。除了直接导致水产生物的死亡外,褐潮对整个生态系统的影响也不容忽视。鉴于目前的危机形势, 桑沟湾褐潮的研究和治理工作需尽快展开,桑沟湾海域的环境保护和生态修复迫在眉睫。
[1]Field C B, Behrenfeld M J, Randerson J T, et al. Primary production of the biosphere: integrating terrestrial and oceanic components [J]. Science, 1998, 281: 237-239.
[2]张武昌, 张翠霞, 肖天. 海洋浮游生态系统中小型浮游动物的生态功能[J]. 地球科学进展, 2009, 24(11):1195-1201.
[3]康元德. 黄海浮游植物的生态特点及其与渔业的关系[J]. 海洋水产研究, 1986, 7: 103-107.
[4]沈国英, 施并章. 海洋生态学(第二版)[M]. 北京: 科学出版社, 2002: 191-192.
[5]方建光, 孙慧玲, 匡世焕, 等. 桑沟湾海水养殖现状评估及优化措施[J]. 海洋水产研究, 1996, 17(2): 95-102.
[6]张继红, 王巍, 韩婷婷, 等. 桑沟湾春季营养盐分布特征及赤潮爆发诱因[J]. 水产学报, 2012, 36(1): 132-139.
[7]张莉红, 张学雷, 李瑞香, 等. 桑沟湾扇贝养殖对甲藻数量的影响[J]. 海洋科学进展, 2005, 23(3): 342-346.
[8]宋洪军, 李瑞香, 王宗灵, 等. 桑沟湾浮游植物多样性年纪变化[J]. 海洋科学进展, 2007, 25(3): 332-339.
[9]慕建东, 董玮, 陈碧鹃, 等. 桑沟湾浮游植物生态特征[J]. 渔业科学进展, 2009, 30(3): 91-96.
[10]刘慧, 方建光, 董双林, 等. 莱州湾和桑沟湾养殖海区浮游植物的研究Ⅱ[J]. 海洋水产研究, 2003, 24(3): 20-28.
[11]于莹, 张武昌, 蒋增杰, 等. 桑沟湾浮游纤毛虫丰度和生物量分布的季节变化[J]. 海洋学报, 2013, 35(3): 215-224.
[12]孔凡洲, 于仁成, 张清春, 等. 对桑沟湾海域一次藻华事件原因种的初步分析[J]. 海洋环境科学, 2012,31(6): 824-829.
[13]荣成信息港. 桑沟湾缘何频频“受伤”. [2012-9-10].http: //www.darongcheng.com/Article/rcnews/20129/11629.html.
[14]Zhang Q C, Qiu L M, Yu R C, et al. Emergence of brown tides caused byAureococcus anophagefferensHargraves et Sieburth in China [J]. Harmful Algae,2012, 19: 117-124.
[15]孙军, 刘东艳, 钱树本. 一种海洋浮游植物定量研究分析方法—Utermöhl方法的介绍及其改进[J]. 黄渤海海洋, 2002, 20(2): 105-112.
[16]金德祥, 陈金环, 黄凯歌. 中国海洋浮游硅藻类[M].上海: 科学技术出版社, 1965: 1-230.
[17]山路勇. 日 本プランクトン 図 鑑(增补修订版)[M].东京: 保育社, 1979: 1-158.
[18]张武昌, 丰美萍, 于莹, 等. 砂壳纤毛虫图谱[M]. 北京: 科学出版社, 2012.
[19]孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用[J]. 海洋学报, 2004, 26(1): 62-75.
[20]Simpson J, Hunter J. Fronts in the Irish sea [J]. Nature,1974, 250: 404-406.
[21]中国科学报. 褐潮来袭: 危害大 待破解[N]. [2012-7-25]. http: //news.sciencenet.cn/htmlnews/2012/7/267336.shtm.
[22]Bricelj V M, Lonsdale D J.Aureococcus anophagefferens: Causes and ecological consequences of brown tides in U.S. mid-Atlantic coastal waters [J]. Limnology and Oceanography, 1997, 42(5): 1023-1038.
[23]Probyn T, Pitcher G, Pienaar R, et al. Brown tides and mariculture in Saldanha Bay, South Africa [J]. Marine Pollution Bulletin, 2001, 42(5): 405-408.
[24]Bricelj V M, MacQuarrie S P, Schaffner R A. Differential effects ofAureococcus anophagefferensisolates(“brown tide”)in unialgal and mixed suspensions on bivalve feeding [J]. Marine Biology, 2001, 139: 605-615.
[25]Probyn T A, Bernard S, Pitcher G C, et al. Ecophysiological studies onAureococcus anophagefferensblooms in Saldanha Bay, South Africa [J]. Harmful Algae, 2010, 9: 123-133.
[26]Smayda T J. Harmful algal blooms: Their ecophysiology and general relevance to phytoplankton blooms in the sea [J]. Limnology and Oceanography, 1997, 42(5):1137-1153.
[27]孙耀, 赵俊, 周诗赉, 等. 桑沟湾养殖海域的水环境特征[J]. 中国水产科学, 1998, 5(3): 69-75.
[28]魏皓, 赵亮, 原野, 等. 桑沟湾水动力特征及其对养殖容量影响的研究—观测与模型[J]. 渔业科学进展,2010, 31(4): 66-71.
[29]Yuan M L, Zhang C X, Jiang Z J, et al. Seasonal variations in phytoplankton community structure in the Sanggou, Ailian, and Lidao Bays[J]. Journal of Ocean University of China, 2014, 13(6)1012-1024.
[30]李超伦, 张永山, 孙松, 等. 桑沟湾浮游植物种类组成、数量分布及其季节变化[J]. 渔业科学进展, 2010,31(4): 1-8.
[31]徐娜, 逄少军, 刘峰. 一株桑沟湾赤潮藻的分子鉴定[J]. 海洋科学, 2012, 36(4): 13-18.
[32]Jakobsen H H, Hansen P J. Prey size selection, grazing and growth response of the small heterotrophic dinoflagellateGymnodiniumsp. and the ciliateBalanion comatum—a comparative study [J]. Marine Ecology Progress Series, 1997, 158: 75-86.
[33]孙军, 郭术津. 甲藻的异养营养型[J]. 生态学报,2011, 31(20): 6270-6286.
[34]Mehran R. Effects ofAureococcus anophagefferenson microzooplankton grazing and growth rates in the Pe-conic Bays system, Long Island, NY [M]. State University of New York, Stony Brook, 1996.
[35]Caron D A, Gobler C J, Lonsdale D J, et al. Microbial herbivory on the brown tide alga,Aureococcus anophagefferens: results from natural ecosystems, mesocosms and laboratory experiments [J]. Harmful Algae,2003, 3: 439-45.
[36]Gobler C J, Lonsdale D J, Boyer G L. A review of the causes, effects, and potential management of harmful brown tide blooms caused byAureococcus anophagefferens(Hargraves et Sieburth)[J]. Estuaries, 2005,28(5): 726-749.

