高等海洋植物海神草营养器官的组织学特点
王林桂,赵 博,黄 勃
(海南大学 海洋学院, 海南大学海洋生物实验教学中心, 海南 海口 570228)
在所有的被子植物中, 只有大约 0.02 %能够在海洋中进行沉水生活并能够在海水中完成开花、结果和发芽这一过程, 这部分高等植物通常被称为“海草”(seagrass)[1]。海草不是严格的分类学名词, 而是一个生态类群的总称。全世界共有 4科 12属约 60种海草, 迄今中国已发现有 10属约 20种海草[2-3]。海草从较高的潮间带到较矮的潮下带柔软底部区域都有分布, 如沙湾、泥滩、泻湖区和河口区, 并形成广泛的单种和多种草场。在热带和亚热带地区, 海草与红树林和珊瑚礁是三大典型海洋生态系统[5]。
海神草(Cymodocea rotundata)属于海神草科(Cymodoceaceae), 海神草属(Cymodocea), 为典型的热带海草。在中国主要分布于台湾, 广东徐闻, 海南的琼海、文昌、陵水和三亚。国内对海神草的研究主要集中在地理分布[4-5]、分类[6-7]和生态学[8-9]等方面, 有关海神草营养器官的组织学特点国内尚未见报道。本文采用常规石蜡切片技术, 系统地研究了海神草营养器官的组织学, 并阐明其对海洋沉水生活的适应性结构特征, 为海草的生物学、生态学和生理学等方面的研究提供理论基础。
1 材料与方法
1.1 材料
实验材料于2009年8月采自海南省陵水黎安港海草特别保护区。
1.2 方法
挑选健康的海草植株用海水洗净, 将其根、茎、叶切成长度约为0.5 cm的小段并分别放入广口瓶中,倒入FAA(75%酒精90 mL+冰醋酸5 mL+甲醛5 mL)固定液, 然后用真空泵抽气15~30 min至材料完全下沉到瓶底。更换FAA固定液后即可长期保存备用。石蜡切片步骤参照李和平的方法[10], 切片厚度6~10 μm, 番红—固绿双重染色法染色, 中性树胶封片。Olympus BH-4型显微镜下观察并拍照。观察叶表皮细胞使用直接撕取法制备了临时装片同时对叶片进行了冻干、喷金制备了电镜样品, 使用S-3000N扫描电镜观察、拍照。
2 实验结果
2.1 根
从根的根毛区作横切面, 从外至内可分为表皮、皮层和中柱三个部分(图 1-1)。表皮是根最外面的一层细胞, 表皮细胞呈砖形, 在生长过程中表皮会逐步被破坏, 部分细胞已变形或脱落。皮层位于表皮之内维管柱之外, 由多层薄壁细胞组成, 可分为外皮层、中皮层和内皮层。皮层占根组织的相当大部分,中柱与皮层的半径之比约为1∶27, 外皮层是表皮之下的一到几层细胞, 其第一层细胞的紧接表皮的那面细胞壁增厚, 表皮被破坏之后将形成保护组织代替表皮起保护作用。中皮层主要由薄壁细胞和通气组织组成, 通气组织非常发达, 是由薄壁细胞收缩解体并由残留的细胞壁形成的车轮样辐射状气腔结构; 薄壁细胞胞间隙明显(图 1-2)。内皮层是皮层最里面的一层细胞, 排列紧密而整齐, 具有凯氏带且细胞壁六面加厚, 未发现通道细胞。中柱由中柱鞘、初生木质部和初生韧皮部组成。中柱鞘紧接内皮层,由一层薄壁细胞组成, 中柱中韧皮部较发达, 木质部退化, 只可见4个大型导管, 韧皮部与木质部的导管相间排列(图1-3)。
2.2 茎
茎由表皮、基本组织和维管组织三个部分构成(图 1-4)。表皮是位于茎最外面的一层细胞, 表皮细胞较小, 壁厚, 排列紧密无胞间隙, 表皮细胞外均匀覆盖有角质层, 没有气孔器分布。表皮以内, 除了维管束之外的所有区域皆为基本组织, 基本组织由薄壁细胞组成, 细胞较大, 近圆形, 胞间隙发达, 随茎的生长胞间隙逐渐裂生形成发达的通气组织, 与根中通气组织不同的是茎中的通气组织是由许多薄壁细胞相互联接而形成的网状结构。维管组织分布于基本组织中, 有1束中央维管束和数束外环维管束。中央维管束较外环维管束大, 位于茎的中央部分。而外环维管束呈环状散布于基本组织外侧(图 1-5)。维管束为有限外韧维管束, 有气隙分布(图1-6)。
2.3 叶
叶片由表皮、叶肉和叶脉三部分构成(图 1-7)。叶片的上下表皮均由单层细胞构成, 排列规则而紧密, 其外壁覆盖一层连续的角质层。表皮细胞富含叶绿体, 未见气孔分布, 但叶片上下表皮均发现一特殊结构被番红染为红色, 细胞壁较其他表皮细胞薄,无规则散布, 具有大液泡(图 1-12), 因其结构与禾本科植物叶表泡状细胞相似, 故命名为类泡状细胞。叶肉由薄壁细胞组成。细胞较大, 层次少, 没有栅栏组织和海绵组织的分化, 仅含有少量叶绿体, 通气组织非常发达(图 1-8)。从叶片的横切面观察可发现在通气组织中有一特殊结构, 该结构由许多具有叶绿体的薄壁细胞组成, 胞间隙大(图1-13)。而从叶片的纵切面观察发现通气组织并非直接纵贯于叶片中,而是由多个气腔排列而成, 相邻气腔由这一特殊结构连接而成的, 故将其命名为气道横隔(图1-12)。叶脉由初生木质部、初生韧皮部和维管束鞘组成。相邻叶脉间有 2~4个气道分布。叶脉内的维管束为有限外韧维管束, 束中有气隙分布(图1-11)。在叶脉两侧及叶缘处都分布有厚壁细胞(图1-9)。
通过观察叶表水装片, 发现叶表皮细胞排列十分规则, 细胞边界明显, 无气孔分布, 有类泡状细胞分布(图1-13)。通过扫描电镜, 也观测到同样结构(图1-14)。
3 讨论
关于海草的起源有两种不同的观点, 其中以Arber为代表的学者认为海草由很早以前适应水生生活的祖先演化而来, 从淡水环境逐步过渡到咸淡水环境, 最后适应海洋环境。以den Hartog[3]为代表的学者认为海草是由第三纪中新世(大约 2400万年前)的耐盐性陆生植物演化而来, 这种观点主要源于化石资料的记载。现在仍以第一种观点占主导。相对于陆生单子叶植物而言, 海草营养器官的形态结构发生了很多特化, 如具有发达的通气组织; 机械组织不发达; 叶表皮细胞富含叶绿体; 叶表无气孔器分布等等; Arber等[2]认为这些变化也出现在淡水生植物中, 通常被认为是适应水生环境的结构特征。
从海神草营养器官的显微结构可看出通气组织是贯穿整个植株的一种结构(图1-2, 图1-5, 图1-8),从而使气体可以在植株的内部流通。通气组织是植物薄壁组织内的一些气道或空腔的集合。通气组织通常有溶生性和裂生性两类[12]。在海神草的营养器官中同时出现了这两类通气组织, 根的通气组织属于溶生性, 而茎和叶的通气组织则属于裂生性。这是否与海草的科属的特异性有关, 有待进一步研究。
从叶片的显微结构观察发现气道并非直接纵贯整个叶片, 而是由多个气腔通过一特殊结构连接而成, 这一特殊结构本文命名为气道横隔(图 1-12, 图1-13), 该结构未见报道。气道横隔位于气腔与气腔的连接处, 组成横隔的细胞个体很小, 细胞间隙很大, 可以在支撑气道的同时便于气腔间气体的流通。在气道横隔细胞中也发现有少量叶绿体存在, 故该结构也可进行光合作用。
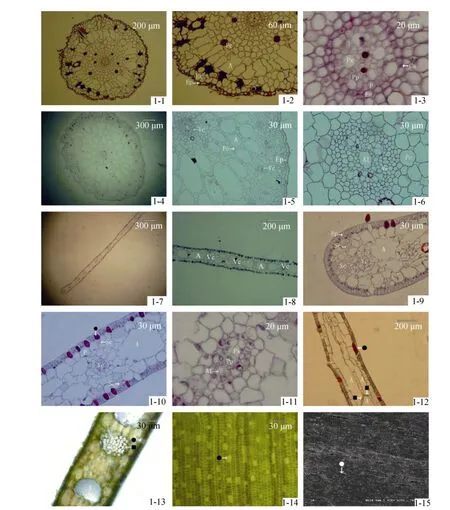
图1 海神草营养器官的组织结构Fig.1 Histological structure of Cymodocea rotundata vegetative organs
陆生单子叶植物的叶绿体主要存在于叶肉细胞中, 表皮细胞一般不含叶绿体, 叶肉细胞是光合作用的主要场所。而海神草的表皮细胞几乎完全被叶绿体充满(图1-14), 叶肉细胞中仅有零星叶绿体分布,因此, 表皮细胞是海神草光合作用的主要场所。这是海神草对海水中低光照强度的适应性特征。
海神草的叶表皮上无气孔分布。叶春江等人认为, 这一方面说明海草对海水中的O2和CO2的需求较少; 另一方面说明, 气体交换的功能主要是由通气组织或其他途径实现的[13]。光合作用产生的O2会在叶片的气道里富集, 而根、茎部呼吸作用产生的CO2会在根、茎处的气道里积累, 遍布植株的气道使得海草仅通过无需能量消耗的自由扩散即可在叶片与根、茎间进行O2与CO2的互补。海神草的这种结构使其对海水中的氧气和无机碳源的依赖性降低,是其对海洋沉水生活的适应。
仅仅利用自身呼吸作用产生的 CO2作为无机碳源显然是不够的, 海水中的无机碳有三种存在形式,即自由CO2、离子态的重碳酸盐(HCO3–)以及碳酸盐(CO32–), 在PH为8.2水温15℃条件下, 海水中HCO3–浓度分别是 CO2和 CO32–浓度的 150倍和 6倍[14],Sven Beer等人的研究证实了海神草属的Cymodocea nodosa、喜盐藻属的Halophila ovalis以及大叶藻属的Zostera marina可以利用海水中的 HCO3–作为无机碳源[14-15]。研究发现海草可利用碳酸酐酶(carbonic anhydrase, CA)将HCO3–催化为CO2扩散进入细胞内,CA主要存在于细胞膜附近, 细胞外也有分布, 胞外的 CA 加速了 HCO3–向 CO2的转化, 可使海草在低CO2条件下得到充足的无机碳源[16]。
海神草叶的表皮细胞外壁覆盖一层连续的角质层, 导致其高度的不通透, 对营养元素的吸收必然局限于某些特定位点。叶春江等人对大叶藻的研究认为叶片是海草重要的营养吸收部位。但叶表皮细胞与海水接触面的细胞壁非常厚而且质地致密, 具有高度不通透性。由于这一结构的不通透性, 在叶表的特定位点上进行物质交换, 有利于对物质的选择性吸收[13]。在海神草叶的显微结构中发现叶表有一特殊结构——类泡状细胞, 细胞壁较表皮细胞壁薄,具有大液泡(图1-10, 图1-14, 图1-15)。作者认为类泡状细胞正是这一可进行物资交换的特定位点。
海神草的叶呈带形, 在叶脉两侧及叶缘处均分布有少量的厚壁细胞(图 1-9), 这些厚壁细胞共同构成整个叶片的机械组织。机械组织不发达, 叶片仍较为柔软, 但机械组织能够维持叶片形状, 同时使叶片具有较好的韧性。因此, 叶片可随着海流摆动, 是其对海洋环境的适应。
海神草根的内皮层中具有凯氏带且细胞壁六面加厚, 未发现通道细胞(图 1-3), 表明海神草的根对溶质的筛选更为严格。大多数的单子叶植物和部分双子叶植物, 其内皮层细胞壁在发育的早期为凯氏带形式, 之后进一步发育形成五面加厚的细胞, 仅外切向壁仍保持薄壁状态, 并留有通道细胞, 以此控制物质的转运, 个别植物有六面加厚的情况。对于内皮层既有凯氏带且细胞壁六面加厚, 又没有通道细胞的现象未见报道, 该种结构的内皮层如何控制水分和溶质进入中柱, 有待进一步研究。
[1]Hemming M A, Duarte C M. Seagrass Ecology[M].Cambridge: Cambridge University Press, 2008: 20-21.
[2]Anthony W D L, Robert J O, Carlos M D. Seagrasses:Biology Ecology and Conservation[M]. Netherlands:Springer, 2006: 19-22.
[3]范航清, 石雅君, 邱广龙. 中国海草植物[M]. 北京:海洋出版社, 2009.
[4]杨宗岱. 中国海草植物地理学的研究[J]. 海洋湖沼通报, 1979, 2: 41-46.
[5]杨宗岱, 吴宝玲. 中国海草场的分布生产力及其结构与功能的初步探讨[J]. 生态学报, 1981, 1(1): 84-89.
[6]陈汉斌. 山东植物志(上卷)[M]. 青岛: 青岛出版社,1990: 69-71.
[7]杨宗岱. 支序分类在海草分类划分中的应用[J]. 黄渤海海洋, 1993, 11(2): 56-67.
[8]杨宗岱. 中国海草生态学的研究[J]. 海洋科学, 1982,2: 34-37.
[9]Huang X P, Huang L M, Li Y H, et al. Main seagrass beds and threats to their habitats in the coastal sea of South China[J]. Chinese Science Bulletin, 2006, 51(2):136-142.
[10]李和平. 植物显微技术: 第2版[M]. 北京: 北京科学出版社, 2009.
[11]郑文菊, 王勋陵, 沈禹颖. 几种盐地生植物同化器官的超微结构研究[J]. 电子显微学报, 1999, 18(5):507-512.
[12]樊明寿, 张福锁. 植物通气组织的形成过程和生理生态学意义[J]. 植物生理学通讯, 2002, 38(6): 615-618.
[13]叶春江. 海洋盐生植物大叶藻耐盐机理研究[C]//济南: 山东师范大学, 2002: 9-21.
[14]Beer S, Rehnberg J. The acquisition of inorganic carbon by the seagrass Zostera marina[J]. Aquat Bot, 1997,56: 277-283.
[15]Durako M J. Photosynthetic utilization of CO2and HCO3–inThalassia testudinum(Hydrocharitaceae)[J].Marine Biology, 1993, 115: 378-380.
[16]Siltemeyer D, Schmi C, Fock H P. Carbonic abhydrase in higher plants and aquatic microorganisms [J]. Plant Physiology, 1993, 88: 179-190.

