温度胁迫对掌状海带幼苗生长、抗氧化系统及叶绿素荧光的影响
凌晶宇 , 梁洲瑞, 王飞久, 孙修涛, 汪文俊, 刘福利, 姚海芹
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国水产科学研究院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 山东 青岛 266071)
掌状海带(Laminaria digitata(Hudson)J.V.Lamouroux)[1]属于褐藻门(Phaeophycophyta)、海带目(Laminariales)、海带科(Laminariaceae)、海带属(Laminaria)[2-4]。掌状海带分布于北大西洋沿岸, 主要包括格陵兰岛南部、冰岛沿岸、爱尔兰西北部、英国南海岸、法国西北部、挪威北海岸[5-8]。作为一种大型海藻, 掌状海带参与调节近岸海域生态环境[9-10],同时也具有重要的经济价值, 国外大量使用掌状海带生产褐藻胶, 提炼碘, 且有多种矿物质、维生素,可作为食品添加剂, 用于家禽、家畜养殖饲料[11-14]。目前对于掌状海带的研究主要集中在生物活性物质的提取与研究[15-17]、生态资源调查[18-20]、繁殖生物学研究[21-23]、分子标记以及遗传多样性研究[24-26], 而对环境因子的生理响应研究较少[27-30]。
由于叶绿素荧光技术在测定植物光合作用具有不损伤植物组织、测定指标多样化和指示更灵敏等优点, 现已被广泛应用于植物光合作用机理的研究[31-32]。植物进行光合作用所吸收的光能主要用于光化学反应, 仅有少部分能量以热和荧光耗散掉,而胁迫条件会导致植物以热和荧光耗散能量的增加,因此调制荧光技术可以评估植物受胁迫的情况[33]。目前对于大型海藻(如鼠尾藻、龙须菜、条斑紫菜等)理化因子胁迫机制的研究已有报道[34-37]。
不同植物都有其最适宜生长温度, 温度高于或低于各自最适宜生长温度都有可能成为胁迫, 导致细胞膜结构遭到破坏, 抑制生长, 引起个体损伤甚至死亡[38]。研究认为高温胁迫下植物体抗氧化防御系统能够通过抑制由高温产生的活性氧(ROS)的生成, 或缓解活性氧引起的损伤等途径来缓解生物体内的氧化胁迫[39]。逆境胁迫将会导致活性氧在藻体内大量的积累, 从而干扰细胞内膜脂、核酸以及蛋白质的代谢, 且自由基作用于脂质, 发生过氧化反应并产生丙二醛, 引起蛋白质、核酸等生命大分子的交联聚合, 且具有细胞毒性[40]。SOD、CAT是植物清除体内多余 O2–和 H2O2等活性氧的重要酶类, 统称为植物保护酶系统, 对抵御多种理化因子胁迫、减少活性氧积累、维护膜结构完整等起着重要作用[41]。
本实验选用掌状海带为材料, 研究了温度胁迫对其幼苗生长及抗氧化系统的影响, 以期为完善掌状海带人工养殖技术提供理论依据。
1 材料与方法
1.1 实验材料
本实验所用掌状海带幼苗(2~3 cm)由配子体克隆育苗培育而来, 培养条件: 白色日光灯, 光强2100~3500 lx, 温度 13℃, 光周期 12L: 12D, 培养液为灭菌天然海水, 营养盐以 NaNO3溶液作为氮源,KH2PO4作为磷源。NO3–-N 质量浓度 3 mg/L, PO4–-P质量浓度0.3 mg/L, 充气悬浮培养。每周换水2次。
1.2 实验方法
1.2.1 不同温度胁迫下掌状海带幼苗生长测定
设置 3 个温度组(3、8、18℃)和对照组(13℃), 每组3个平行。培养条件为: 光照培养箱培养, 光周期12L: 12D, 光强 3500 lx, NO3–-N 质量浓度 3 mg/L,PO4–-P质量浓度 0.3 mg/L。在不同条件处理下持续培养10 d, 3 d换水一次。实验开始前挑选藻体完整、无损伤腐烂的掌状海带幼苗, 平均鲜质量为(0.020±0.003)g, 各处理组之间的鲜质量差异性不显著(P>0.05)。第5天和第10天后各称量一次鲜质量, 计算相对生长速率(RGR, relative growth rate), 相对生长率的计算公式如下: RGR=[Ln(Wt/W0)/t]×100%,其中W0为初始藻的鲜质量(g),Wt为实验结束时藻的鲜质量(g),t为实验持续的时间(d)。
1.2.2 不同温度胁迫下掌状海带幼苗抗氧化酶系测定
设置 3 个温度组(3、8、18℃)和对照组(13℃), 每组3个平行, 分别于培养4、12、24、36、48 h后取样测定。培养条件为: 光照培养箱培养, 光周期12L:12D, 光强 3500 lx, NO3–-N 质量浓度 3 mg/L, PO4–-P质量浓度0.3 mg/L。称取0.1g左右掌状海带幼苗材料, 用1.5 mL提取液(0.1 mol/L磷酸缓冲液 pH=7.0;1 mol/L EDTA; 1% PVP)在冰浴条件下研磨匀浆。4℃,10000 r/min离心10 min, 取上清液待测。可溶性蛋白测定采用考马斯亮蓝蛋白测定试剂盒(A045-2);超氧化物歧化酶(SOD)测试盒(A001-1)、过氧化氢酶(catalase CAT)测定试剂盒(A007-1)和丙二醛(MDA)测定试剂盒(A003-1)均购自南京建成公司。实验过程严格按照试剂盒说明书操作。
1.2.3 不同温度胁迫下掌状海带幼苗叶绿素荧光参数测定
设置 3 个温度组(3、8、18℃)和对照组(13℃), 每组9个平行, 分别于培养4、12、24、36、48 h后取样测定。培养条件为: 光照培养箱培养, 光周期12L:12D, 光强 50 μmol/(m2·s), NO3–-N 质量浓度 3mg/L,PO4–-P质量浓度0.3 mg/L。叶绿素荧光参数的测定均采用DUAL-PAM-100(WALZ, Germany)。幼苗进行暗适应20 min后再测Fv/Fm; 测定快速光曲线时,设置的光合有效辐射(PAR)分别为 59、79、123、181、281、352、553、777 μmol/(m2·s), 每个 PAR照射10 s。
1.3 数据分析
采用Origin绘制图形, SPSS进行单因子方差分析、多重比较, 以P<0.05作为差异显著。数据用平均值±标准差(Mean±SD)形式表示。用Statistica7.0软件, 采用最小二乘法对快速光曲线进行拟合[42], 以求出rETRmax(最大潜在相对电子传递速率)。
2 结果
2.1 温度胁迫对掌状海带幼苗生长的影响
温度从 3℃升高到 18℃时, 掌状海带幼苗 RGR在5、10 d均呈先上升后下降趋势, 在对照组(13℃)培养条件下时, 幼苗 RGR最大, 分别为 10.9%和11.0%(图1)。经单因素方差分析表明, 对照组与其他实验组的RGR相比均呈显著性差异(P<0.05)。
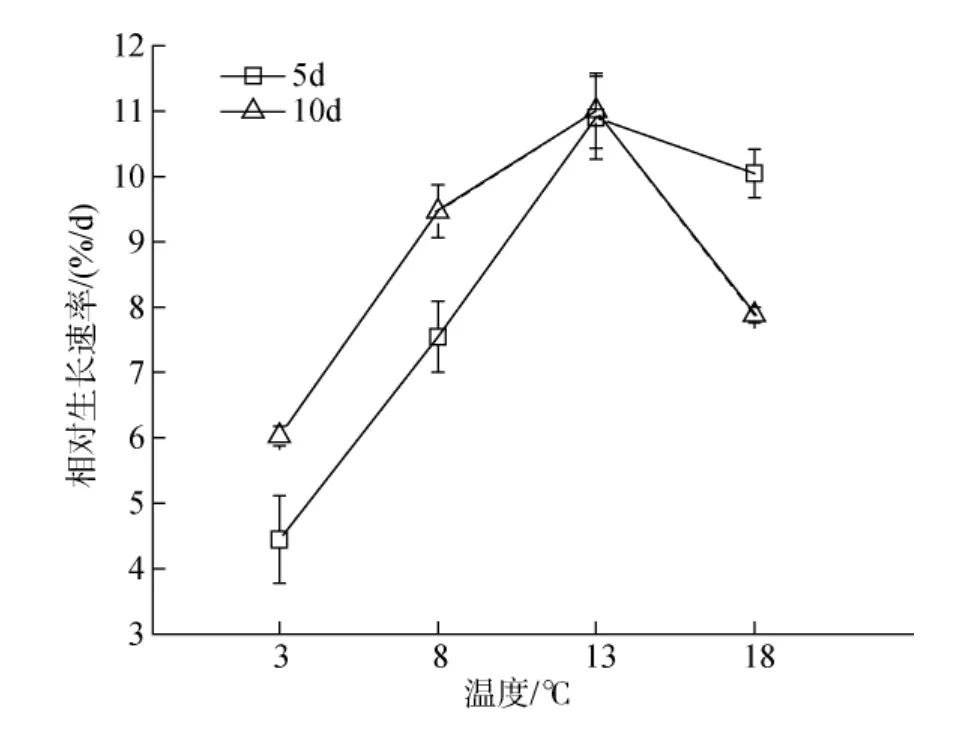
图1 温度胁迫对掌状海带幼苗相对生长速率的影响Fig.1 Effect of temperature stress on the relative growth rates of L.digitata sporophytes
2.2 温度胁迫对掌状海带幼苗可溶性蛋白含量、丙二醛(MDA)含量的影响
处理4h后, 18℃组可溶性蛋白含量显著高于13℃组(P<0.05), 且达到最大值(图2); 处理12 h后,3℃组可溶性蛋白含量较初始值上升 27.9%并达最大值; 处理24 h后, 13℃组可溶性蛋白含量较初始值上升 16.4%且达到最大值(P<0.05), 18℃组值较初始值下降 5.8%, 达最小值(P<0.05)。8℃组的可溶性蛋白随着处理时间的推移呈现小幅度波动,24h后较初始值上升 19.1%, 达最大值且差异性不显著。

图2 温度胁迫对掌状海带幼苗可溶性蛋白含量的影响Fig.2 Effect of temperature stress on thesoluble proteins contentof L.digitata sporophytes
随着时间推移, 各实验组的MDA值均呈先上升后下降的趋势(图3)。处理4 h, 各组MDA含量达最大值, 且 3、18℃组 MDA含量高于 8℃组和对照组(13℃), 18℃组差异性显著(P<0.05)。处理 24 h, 3、8℃组和对照组MDA含量达最小值, 与初始值对比, 分别下降19.9%、31.2%、32.6%, 而18℃组在处理12 h后出现最小值且下降了24.1%。在处理时间24~48 h内, 各温度组MDA含量均上升, 且3、18℃组MDA含量高于8℃组和对照组。在48 h处理后, 各组MDA含量与初始值对比无差异性。

图3 温度胁迫对掌状海带幼苗丙二醛含量的影响Fig.3 Effect of temperature stress on the malondialdehyde(MDA)content of L.digitata sporophytes
2.3 温度胁迫对掌状海带幼苗酶促抗氧化系统活性的影响
处理时间36 h内, 18℃组和对照组(13℃)CAT活性呈先上升后下降趋势(图4), 均在24 h处达最大值,且对照组差异性显著(P<0.05), 在 36 h处 18℃组CAT活性达最小值; 3℃和8℃组CAT活性先下降后上升, 均在12、36 h处达极值。在36~48 h内, 各组CAT活性均随时间推移而下降, 且与初始值对比无差异性。

图4 温度胁迫对掌状海带幼苗过氧化氢酶活性的影响Fig.4 Effect of temperature stress on the catalase (CAT)activity of L.digitata sporophytes

图5 温度胁迫对掌状海带幼苗超氧化物歧化酶活性的影响Fig.5 Effect of temperature stress on the superoxide dismutase (SOD)activity of L.digitata sporophytes
在处理时间24h内, 18℃组和对照组(13℃)SOD活性呈上升趋势(图5), 均在24h处达最大值且差异性显著(P<0.05), 与初始值对比, 增加量分别为64.2%、57.1%; 3℃和8℃组SOD活性在处理4 h后下降并随着时间推移在24 h处达最大值。在24~48 h内, 各组 SOD活性出现不同程度下降, 18℃组在处理后36 h达最小值。
2.4 温度胁迫对掌状海带幼苗叶绿素荧光各参数的影响
3℃组处理 4 h后的Fv/Fm值显著低于对照组(P<0.05), 为对照组的89.1 % (图6)。8℃组处理24 h后的Fv/Fm值达最大, 为0.76; 处理36 h,Fv/Fm值显著低于对照组(P<0.05), 为对照组的91 %。18℃组的Fv/Fm值随着处理时间延长而下降, 在 36 h和 48 h处达显著程度(P<0.05)。

图6 温度胁迫对掌状海带幼苗Fv/Fm的影响Fig.6 Effect of temperature stress on the optimal chlorophyll fluorescence quantum yields (Fv/Fm)of L.digitata sporophytes

图7 温度胁迫对掌状海带幼苗rETRmax的影响Fig.7 Effect of temperature stress on the maximum relative electron transport rate (rETRmax)of L.digitata sporophytes
3℃组处理 4 h后的 rETRmax值显著低于对照组(13℃,P<0.05), 为对照组的 86.2 %(图 7)。18℃组处理12 h后的rETRmax值与对照组间差异显著(P<0.05)。8℃组的 rETRmax值呈先上升后下降的趋势, 在 24 h处达最大值, 且与对照组间差异显著(P<0.05)。
3 讨论
Bolton在其实验中发现掌状海带幼苗在 10~15℃具有较高的生长速率[43], 随着温度升高RGR逐渐降低, 在 23℃时, 幼苗几乎完全分解。本试验中,掌状海带幼苗在13℃具有最高的RGR, 18℃条件下幼苗培养10 d后的相对生长速率明显低于5d所测,下降21.5%。有研究表明, 随着温度升高, 植物叶绿体结构受到损伤, 光合色素降解, 导致净光合速率下降, 物质积累率下降[44]。Havaux发现高温胁迫对PSII中心有瞬时钝化作用, 使富含不饱和脂肪酸的类囊体膜脂降解, 进一步降低光合反应速率[45]。因此高温条件下, 掌状海带幼苗的生长势必会受到影响。
植物体内的抗氧化防御系统是一个立体的结构,其所含许多的成分在植物抗逆性中具有重要作用。在酶促抗氧化系统中, 包括CAT、SOD等抗氧化酶,SOD是主要的活性氧(ROS)清除酶类; CAT可以保护细胞免受羟过氧化物的胁迫, 使H2O2歧化产生H2O和 O2, 当细胞产生胁迫的适应反应时, CAT对于细胞获得抗性十分重要[46], 它们在保护细胞免受氧化胁迫方面具有重要意义。关于高温对植物机体的影响, 有证据表明, 植物受高温胁迫引起叶绿素分解、可溶性蛋白含量下降、膜透性加大等, 可能是机体内O2–等活性氧产生和清除平衡遭到破坏的结果, 高温可从促进 O2–等活性氧形成、钝化 SOD等抗氧化酶活性两方面破坏这种平衡[47-48]。实验中, 处理 24 h后, 掌状海带幼苗的CAT、SOD在13、18℃保持着较高的活性, 而低温组3、8℃酶活性则相对较低, 表现在掌状海带幼苗生长为具有较低的 RGR。高质量浓度的 ROS可引起蛋白质肽链断裂和交联, 导致蛋白质分子中碱性氨基酸含量降低, 而高的保护酶活性能有效清除过量积累的 ROS, 使植物免受活性氧的毒性作用, 这对于植物的抗逆性具有重要意义。ROS学说在高等植物中研究比较多[49-50], 在低等藻类植物中相关研究比较少。植物的总抗氧化能力是由酶促抗氧化系统和非酶促抗氧化系统两部分的抗氧化能力共同组成, 而对于掌状海带非酶促抗氧化系统在逆境中对 ROS、羟过氧化物等有害物质的清除作用有待进一步研究。
叶绿素荧光技术能够实时准确地反映植物自身光合特性以及环境适应能力[51]。在正常的生理状态下, 暗适应20 min后所测出PSII的Fv/Fm是一个稳定的值, 藻类约为0.65, 当受到胁迫时, 该值显著下降。相对电子传递速率(rETR)是快速光曲线测定过程中反映实际光强下的表观电子传递速率[32,52]。本实验中, 3℃处理下, 掌状海带幼苗的Fv/Fm值明显下降,rETRmax值在处理 4h后达最小, 同时其 CAT、SOD酶活性均处于较低水平, MDA含量较高, 说明低温可能使掌状海带幼苗光合能力和光合活性下降。研究表明, 光合色素和电子传递链是植物细胞类囊体膜的重要组成部分, 高温可导致其结构改变, 势必会影响光合作用[53]。本次实验中, 18℃组的掌状海带幼苗Fv/Fm、rETRmax值整体呈下降趋势, 且该条件下抗氧化酶活性波动较大, 表明该条件下掌状海带幼苗光合电子传递过程受抑制。有研究指出, 温度高于32℃时鼠尾藻幼苗会受到光抑制和损伤; 铜藻幼苗在30℃高温胁迫下也对其PSII造成不可逆损伤[34,54]。
可溶性蛋白在抵御温度逆境胁迫过程中起重要作用。研究表明, 细菌、植物及动物体在受到高温胁迫时其机体内热激蛋白含量均会升高, 从而抵御高温胁迫[50]。本实验胁迫初期掌状海带可溶性蛋白含量明显升高, 可能是幼苗对温度变化做出的积极反应, 使其体内产生了一些热激蛋白; 随着胁迫时间的延长, 18℃组在24 h含量显著降低, 可能是海带防御体系遭到破坏, 细胞膜结构受损, 蛋白质合成受到抑制而分解加速导致可溶性蛋白含量降低。细胞膜系统是热损伤和抗热中心, 细胞膜的热稳定性与脂肪酸饱和程度有关, 高度饱和的脂肪酸有利于提高细胞膜的相变温度, 而高温会加剧膜脂过氧化作用[38]。丙二醛(MDA)是脂类过氧化物之一, 是指示植物体膜过氧化程度的一个重要指标。从本实验结果来看, 处理4h各组MDA含量均有所上升, 随着处理时间延长, 13、18℃组均在12 h处达最小值且显著低于低温组(3、8℃); 48 h后各组MDA含量较初始值相比无差异。实验结果说明, 在合适的生长温度下,掌状海带幼苗细胞内抗氧化酶活性较高, 使得 MDA含量保持在较低水平, 表现为具有较高生长速率。
[1]Lamouroux J V F. Essai sur les genres de la famille des thalassiophytes non articulées [J]. Annales du Muséumd′Histoire Naturelle, 1813, 20(1): 21-47.
[2]Hoek V D. The distribution of benthic marine algae in relation to the temperature regulation of their life histories [J]. Biological Journal of the Linnean Society,1982, 18(2): 81-144.
[3]Adl S M, Simpson A G, Lane C E, et al. The revised classification of Eukaryotes [J]. The Journal of Eukaryotic Microbiology, 2012, 59(5): 429-514.
[4]MarinsB V, Amado-FilhoG M, BarretoM B, et al. Taxonomy of the southwestern Atlantic endemic kelpLaminaria abyssalisandLaminaria brasiliensis(Phaeophyceae, Laminariales)are not different specie [J].Phycological Research, 2012, 60(1): 51-60.
[5]Raybaud V, Beaugrand G, Goberville E, et al. Decline in kelp in West Europe and Climate[J].PLoS One, 2013,8(6): 1-10.
[6]Gaspard D, Dominique D, Dominique M, et al. Insituphotosynthetic performance ofLaminaria digitata(Phaeophyceae)during spring tides in Northern Brittany[J]. Cahiers De Biology Marine, 2011, 52(1): 1-6.
[7]Potin P, Bouarab K, Salaun J P, et al. Biotic interactions of marine algae [J]. Current Opinion in Plant Biology,2002, 5(4): 308-317.
[8]Gaspard D, Dominique D, Dominique M, etal.Influence of local environmental conditions on the seasonal acclimation process and the daily integrated production rates ofLaminaria digitata(Phaeophyta)in the English Channel[J].Marine Biology, 2013, 160(3): 503-517.
[9]Gevaert F, Janquin M A, Davoult D. Biometrics in Laminariadigitata: A useful tool to assess biomass,carbon and nitrogen contents [J]. Journal of Sea Research, 2008, 60(3): 215-219.
[10]Gauthier S, Pascal R, Cédric L. Trophic ecology in a Northern Brittany (Batz Island, France)kelp (Laminaria digitata)forest, as investigated through stable isotopes and chemical assays[J]. Journal of Sea Research, 2010, 63(1): 24-35.
[11]Enowmbi R A, Udo N, Ciaran M, et al.Coastal Iodine Emissions. 1. Release of I2 byLaminaria digitatain Chamber Experiments [J]. Environmental Science &Technology, 2012, 46(19): 10413-10421.
[12]Davoult D, Engel A R, Arzel P, et al. Environmental factors and commercial harvesting: exploring possible links behind the decline of the kelpLaminaria digitatain Brittany, France [J]. Cahiers De Biology Marine,2011, 56(2): 1-6.
[13]Udo N, Albert A R, Sophie D, et al.Molecular iodine emission rates and photosynthetic performance of different thallus parts ofLaminaria digitata(Phaeophyceae)during emersion [J]. Planta, 2011, 233(4):737-748.
[14]Fleurence J. Seaweed proteins biochemical, nutritional aspects and potential uses [J]. Trends in Food Science& Technology, 1999, 10(1): 25-28.
[15]Vauchel P, Leroux K, Kaas R, et al. Kinetics modeling of alginate alkaline extraction fromLaminaria digitata[J]. Bioresource Technology, 2009, 100(1):1291-2196.
[16]Udo N, Albert A R, Sophie D, et al. Molecular iodine(I2)emission from twoLaminariaspecies(Phaeophyceae)and impact of irradiance and temperature on I2emission into air and iodide release into seawater fromLaminaria digitata[J].Marine Environmental Research, 2013,92(2): 102-109.
[17]Blanco P N, Montero M P, Gómez M C. Antioxidant film development from unrefined extracts of brown seaweedsLaminaria digitataandAscophyllum nodosum[J].Food Hydrocolloids, 2014, 37(1): 100-110.
[18]Kuppers U, Kremer B P. Longitudinal profiles of carbon dioxide fixation capacities in marine macroalgae [J]. Plant Physiology, 1978, 62(1): 49-53.
[19]Mann K H. Ecological energetics of the sea-weed zone in a marine bay on the Atlantic coast of Canada. II.Productivity of the seaweeds [J]. Marine Biology, 1972,14(3): 199-209.
[20]Maier I, Muller D G. Antheridium fine structure and spermatozoid release inLaminaria digitata(Phaeophyceae)[J]. Phycologia, 1982, 21(1): 1-8.
[21]Harries R. An investigation by cultural methods of some of the factors influencing the development of the gametophytes and the early stages of the sporophytes ofLaminaria digitata,L.saccharinaandL.cloustoni[J].Annals of Botany, 1932, 46(184): 893-937.
[22]Destombe C, Oppligeri L V. Male gametophyte fragmentation inLaminaria digitata: a life history strategy to enhance reproductive success [J]. Cahiers De Biology Marine, 2011, 52(4): 385-394.
[23]Liu F L, Yao J T, Wang X L, et al.Genetic diversity and structure within and between wild and cultivatedSaccharina japonica(Laminariales, Phaeophyta)revealed by SSR markers[J].Aquaculture, 2012, 358-359: 139-145.
[24]Valero M, Destombe C, Mauger S, et al.Using genetic tools for sustainable management of kelps: a literature review and the example ofLaminaria digitata[J]. Cahiers De Biology Marine, 2011, 52(4): 467-483.
[25]Crépineau F, Roscoe T, Kaas R, et al. Characterisation of complementary DNAs from the expressed sequence tag analysis of life cycle stages ofLaminaria digitata(Phaeophyceae)[J]. Plant Molecular Biology, 2000,43(4): 503-513.
[26]Vincent R, Jonas C, Sylvie R, etal.Identification of stress gene transcripts inLaminaria digitata(Phaeophyceae)protoplast cultures by expressed sequence tag analysis[J]. Journal of Phycology, 2005, 41(6): 1227-1235.
[27]Larsen B A, Hawkins W W. Nutritional value as protein of some of the nitrogenous constituents of two marine algae,Chondrus crispusandLaminaria digitata[J].Journal of the Science of Food and Agriculture, 1962,12(7): 523-529.
[28]Bischof K, Hanelt D, Aguilera J, et al. Seasonal variation in ecophysiological patterns in macroalgae from an Arctic fjord. I. Sensitivity of photosynthesis to ultraviolet radiation[J].Marine Biology, 2002, 140(6):1097-1106.
[29]Bukhov N G, Wiese C, Neimanis S, et al. Control of photosystem II in spinach leaves by continuous light and by light pulses given in the dark [J]. Photosynthesis Research, 1996, 50(2): 181-191.
[30]王悠. 海带对高温胁迫的生理生化响应和耐高温机理的初步研究[D]. 青岛: 中国海洋大学, 2003,76-84.
[31]Schreiber U, Bilger W, Neubauer C. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[C]// Schulze E D,Caldwell M M. Ecophysiology of Photosynthesis.Springer-Verlag, Berlin, 1995: 49-70.
[32]张守仁. 叶绿素荧光动力学参数的意义及讨论[J].植物学通报, 1999, 16: 444-448.
[33]韩博平, 韩志国, 付翔. 藻类光合作用机理与模型[M].北京: 科学出版社, 2003.
[34]梁洲瑞, 王飞久, 孙修涛, 等. 利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响[J]. 海洋科学, 2001, 35(12): 21-27.
[35]马兴宇, 梁洲瑞, 刘福利, 等. 鼠尾藻直立枝光合特性与生长的研究[J]. 水产学报, 2014, 38(9): 1447-1456.
[36]Lin A P, Wang G C, Shen S D, et al. Two specific causes of cell mortality in freeze-thaw cycle of young thalli ofPorphyra yezoensis(Bangiales, Rhodophyta)[J]. Journal of Phycology, 2010, 46(4): 773-779.
[37]Wang Z Y, Wang G C, Niu J F, et al. Optimization of conditions for tetraspore release and assessment of photosynthetic activities for different generation branches of Gracilaria lemaneiformis Bory [J]. Chinese Journal of Oceanology and Limnology, 2010, 28(4):738-748.
[38]Sies H. Strategies of antioxidant defense [J]. European Journal of Biochemistry, 1993, 215(2): 213-219.
[39]徐敏. 光温胁迫对花椰菜生长发育的影响[D]. 杭州:浙江大学, 2004, 6-41.
[40]Fridovich I. The biology of oxygen radicals [J]. Science,1978, 201(4359): 875-880.
[41]Bolton J, Luning K. Optimal growth and maximal survival temperatures of AtlanticLaminariaspecies(Phaeophyta)in culture [J]. Marine Biology, 1982,66(1): 89-94.
[42]Peter J R, Rolf G. Rapid light curves: A powerful tool to assess photosynthetic activity [J]. Aquatic Botany, 2005,82(3): 222-237.
[43]Santarius K, Exner M, Thebudlassak R. Effects of high-temperature on the photosynthetic apparatus in isolated mesophyll protoplasts ofValerianella-locusta(l)betcke [J]. Molecular Microbiology, 1991, 25(1):17-26.
[44]Havaux M. Stress Tolerance of Photosystem II in Vivo:Antagonistic Effects of Water, Heat, and Photoinhibition Stresses [J]. Plant Physiology, 1992, 100(1): 424-432.
[45]刘泳, 高温胁迫对海带生长的影响及其作用机理的初步探讨[D]. 青岛: 中国海洋大学, 2003.
[46]宰学明, 吴国荣, 陆长梅, 等. Ca2+对花生幼苗耐热性和活性氧代谢的影响[J]. 中国油料作物学报, 2001,23(1): 46-50.
[47]马德华, 庞金安, 霍振荣, 等. 高温对黄瓜幼苗膜质过氧化作用的影响[J]. 西北植物学报, 2000, 20(1):141-144.
[48]Brisson L F, Tenhaken R, et al. Function of oxidative corss-linking of cell wall structural proteins in plant disease resistance [J]. Plant Cell, 1992, 8(1): 1703-1712.
[49]Averyanov A A, Lapikova V P, et al. Active oxygen mediates heat-induced resistance of rice plant to blast disease [J]. Plant Science, 1993, 92(1): 27-34.
[50]Krishna P. Plant responses to heat stress [J]. Topics in Current Genetics, 2003, 4(1): 73-101.
[51]White A J, Critcley C. Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus [J]. Photosynth Res, 1999, 59: 63-72.
[52]Kolber Z, Zehr J, Falkowski P G. Effects of growth irradiance and nitrogen limitation on photosynthesis energy conversion in Photosystem II [J]. Plant Physiology, 1988, 88(3): 923-929.
[53]Wen X, Gong H, Lu C. Heat stress induces an inhibition of excitation energy transfer from phycobilisomesto Photosystem II but not to Photosystem I in a cyan bacterium Spirulina platensis [J]. Plant Physiology and Biochemistry, 2005, 43(4): 389-395.
[54]张玉荣, 刘峰, 单体锋, 等. 利用叶绿素荧光技术揭示人工培育的铜藻幼苗对胁迫温度、光照和盐度的反应[J]. 南方水产, 2009, 5(2): 1-9.

