水稻窄叶突变体zy17的遗传分析和候选基因鉴定
李雪倩,徐冉,段朋根,伍应保,罗越华,李云海
1.海南大学农学院,海南省热带生物资源可持续利用重点实验室,海口 570228;
2.中国科学院遗传与发育生物学研究所,植物细胞与染色体工程国家重点实验室,北京 100101
水稻窄叶突变体zy17的遗传分析和候选基因鉴定
李雪倩1,2,徐冉2,段朋根2,伍应保2,罗越华1,李云海2
1.海南大学农学院,海南省热带生物资源可持续利用重点实验室,海口 570228;
2.中国科学院遗传与发育生物学研究所,植物细胞与染色体工程国家重点实验室,北京 100101
器官大小调控是一个基本的发育生物学过程,受细胞分裂和细胞扩展的影响。然而,植物器官大小调控的遗传和分子机理仍不清楚。为了进一步了解器官大小调控的分子机制,文章分离了一系列水稻叶子宽窄改变的突变体。其中,窄叶突变体zy17叶变窄,同时伴有植株矮化、穗子变小、枝梗数和穗粒数降低的表型。遗传分析表明该窄叶性状受1个隐性基因控制;细胞学分析表明该突变体叶子的细胞数目和维管束数目显著降低,表明ZY17影响了细胞分裂。基因组重测序进一步筛选出ZY17的3个候选基因:Os02g22390基因突变发生在内含子区,编码蛋白为逆转座蛋白;Os02g28280和Os02g29530基因突变都发生在外显子区,其中Os02g28280编码一个功能未知蛋白,该基因突变后,发生碱基置换,产生非同义突变;Os02g29530编码一个含糖基转移酶相关的PFAM结构域的蛋白,该基因突变后,出现两个碱基的缺失,从而导致其蛋白翻译提前终止。对候选基因的深入研究,将揭示水稻叶子大小调控的机制。
水稻(Oryza sativa L.);窄叶突变体;细胞分裂;遗传基础
水稻(Oryza sativa L.)是人类主要的粮食作物。近半个世纪以来,通过培育高产品种,水稻产量有了成倍的增长。然而,目前世界人口已超过70亿,据估计2050年将增长至90亿,这就意味着在农业用地不能同步增长的情况下,水稻产量需要提高60%~70%[1,2]。叶片是水稻株型的重要组成部分,也是光合作用最主要的器官[3]。随着水稻突变体库的逐渐完善,相关资源愈加丰富,叶形相关基因的克隆及其功能研究逐步深入,这对水稻理想株型的塑造和高产品种培育具有重要意义[4]。
叶片形态建成是一个极其复杂的过程,与很多基因相关。叶宽是水稻叶片形态性状的重要组成部分,是多基因控制的数量性状,且易受环境影响,其形态改良总体进展不大[5]。目前,在水稻12条染色体上已检测到100多个叶宽相关QTL位点[6],且有一些窄叶相关的QTL被克隆并鉴定。因此,鉴定新的窄叶基因对解析叶片发育、培育高产品种具有重要意义。随着基因组学研究的深入,越来越多的水稻窄叶基因被克隆。位于3号染色体的COW1/NAL7基因和4号染色体的NAL1基因都已被克隆并进行了功能鉴定,其编码的蛋白都与生长素合成、降解及其极性运输密切相关[7~9]。其中,NAL1基因编码一生物学功能未知的特定蛋白,在微管组织中丰富表达,影响微管形成。研究发现,与野生型相比,nal1维管束数目明显减少,生长素的极性运输出现障碍,从而产生窄叶表型[7]。qLSCHL4和qTSN4是窄叶相关的主要QTL位点,其中LSCHL4(qLSCHL4)被克隆并鉴定为NAL1的等位基因,其近等基因系的平均产量较野生型增加18.70%[10]。SPIKE(qTSN4)同样被鉴定为NAL1的等位基因,在旱季和湿季其近等基因系的平均产量分别较野生型增加28%和24%[11]。另外1个与YUCCA基因序列同源的水稻窄叶基因NAL7编码含黄素单氧化酶,可能在生长素的生物合成过程中发挥作用[8,9]。同样位于3号染色体的NAL9基因,研究预测其突变体叶片变窄可能也与生长素相关[12]。NAL2和NAL3编码的蛋白(OsWOX3A)与拟南芥中WUSCHEL蛋白具有同源性,通过调控生长素合成与运输影响叶片发育[13]。位于12号染色体的窄叶矮杆基因NRL1/ND1/DNL1编码一种可以影响植物细胞壁形成的类纤维素合成酶D4,在种子、根尖以及茎顶端分生组织等分裂能力较强的部位集中表达,通过影响泡状细胞发育和减少细胞数目导致水稻叶片出现变卷变窄的表型[14~17]。位于4号染色体的矮杆窄叶基因TDD1编码邻氨基苯甲酸合成酶b亚基的同源蛋白,其中邻氨基苯甲酸合成酶b亚基作用于色氨酸依赖的生长素合成酶上游[18]。此外,SLL1编码KANADI家族的MYB转绿因子,从而参与叶片发育[19,20];HDA704编码组蛋白去乙酰基酶,其表达下调也将导致水稻叶片出现变窄、变卷的表型[21]。
本研究在宽叶粳(KYJ)背景下,通过甲基磺酸乙酯(Ethyl-methanesulphonate,EMS)诱变获得一系列窄叶突变体(zhaiye,zy)。其中zy17突变体表现出较窄的叶和较小的穗子。细胞学分析表明ZY17影响了细胞数目,从而影响叶子宽度。通过构建F2群体,结合重测序技术,鉴定了ZY17候选基因,为更好了解水稻叶片叶形发育的分子机制奠定理论基础。
1 材料和方法
1.1 材料
以宽叶材料KYJ为原始材料,经EMS诱变获得窄叶突变体zy17,本实验所用水稻材料都种植于北京昌平农场和浙江省富阳市中国水稻研究所实验基地。
1.2 方法
1.2.1 表型与农艺性状调查
在穗子完全抽出后选取野生型KYJ和突变体zy17各15株,选取每株主穗,对其剑叶叶宽进行测量,叶片宽度为该叶长1/2处。
在成熟期选野生型和突变体各15株测量株高,统计其主穗一次枝梗数、二次枝梗数和穗粒数,同时选取成熟期饱满种子各60粒,使用万深SC-G型自动考种分析及千粒重系统测量其长和宽。上述数据都进行t测验。
1.2.2 扫描电镜观察
在穗子完全抽出后分别取野生型KYJ和突变体的单株主穗剑叶各10片,用刀片在其1/2处两次横切,获得长约2~3 mm的局部叶片样本,将样本置于体积比为甲醛:冰醋酸:乙醇:DEPC-H2O=1:0.5: 4.75:3.75的FAA固定液中,抽真空,固定48 h以上,室温保存。将固定的材料依次转入50%(40 min)、70%(40 min)、80%(40 min)、95%(60 min)的乙醇梯度逐级脱水,再经过100%(60 min)的乙醇两次、50%乙醇+50%乙酸异戊酯(60 min以上)及100%(60 min)的乙酸异戊酯2次浸泡。将材料置于液态二氧化碳中进行临界点干燥,之后进行粘台、镀膜,在扫描电镜下观察并选取合适的角度和放大倍数进行拍照,最后统计其叶片维管数目及下表皮细胞数目,并进行t测验分析。
1.2.3 遗传分析
突变体zy17与野生型KYJ杂交获得F1群体,考察F1植株叶片形态。F1自交构建F2分离群体,在穗子完全抽出后考察F2分离群体单株叶片形态,统计野生型KYJ宽叶单株和突变体zy17窄叶单株并进行卡方适合性测验。
1.2.4 重测序筛选候选基因
对窄叶突变体zy17与野生型KYJ杂交的F2分离群体,在穗子完全抽出后选取50株zy17表型的植株,分别进行DNA提取,然后将50个样品DNA等量混合,进行全基因组重测序。具体如下:使用新型植物基因组DNA提取试剂盒(康为世纪)提取其基因组DNA,制备混池,经scandrop250超微量核酸蛋白测定仪检测DNA浓度,OD260/280都在1.8~2.0之间。利用MutMap[22~24]技术筛选目的基因。
1.2.5 候选基因鉴定
利用在线分析(网址http://helix.wustl.edu/dcaps/ dcaps.html),导入野生型与突变体序列,通过网站在线分析,找到合适的限制性内切酶,然后设计上下游引物,PCR结合酶切即可成为合适的dCAPs标记(表1)。其在两亲本间具有多态性,可用于突变位点验证以及目的基因的连锁分析。
2 结果与分析
2.1 突变体zy17的形态学分析
与野生型KYJ相比,突变体植株zy17的窄叶表型在苗期不是很明显,但在抽穗后表现出明显的窄叶(图1D)。在性状明显的抽穗期统计叶宽,突变体剑叶平均叶宽1.49 cm,野生型平均叶宽1.76 cm,突变体平均叶宽极显著低于野生型,是野生型的84.7%(图1F)。
此外,突变体与野生型在其他农艺性状上也有很大差异。株高明显矮化(图1A),突变体zy17平均株高75.10 cm,野生型KYJ平均株高95.88 cm,突变体株高极显著低于野生型,仅为野生型的78.3%(图1E)。突变体zy17的枝梗数和穗粒数显著减少(图1:B、C),一次枝梗数、二次枝梗数和穗粒数分别为7、15、60,而野生型KYJ一次枝梗数、二次枝梗数和穗粒数分别为13、47、175,突变体zy17的一次枝梗数、二次枝梗数和穗粒数分别只有野生型KYJ的53.8%、31.9%和34.3%(图1I)。然而,突变体zy17种子平均长与宽分别为7.06 mm和3.09 mm,野生型KYJ种子平均长与宽分别为7.12 mm和3.34 mm,与野生型KYJ相比,突变体zy17的种子略显短、窄,但差异不显著(图1:G、H)。
2.2 zy17降低了叶细胞数目
通过电镜扫描分析,突变体zy17叶片下表皮细胞大小与野生型KYJ叶片下表皮细胞大小没有显著性差异(图2C),但是其平均细胞数及维管束数与野生型相比有极显著性差异:突变体zy17叶片下表皮平均细胞数和维管束数分别为1246个和57个,而野生型KYJ叶片下表皮平均细胞数和维管束数分别为1563个和68个,zy17叶片下表皮平均细胞数和维管束数仅为野生型KYJ的80%和84%,单个细胞的宽度在突变体和野生型间没有显著差异(图2:A、B)。由此可见,细胞数和维管束数的减少与叶片变窄有直接关系,然而究竟是由于细胞数与维管束数减少导致zy17叶片变窄,还是由于叶片某个发育过程受阻导致叶片变窄进而引起细胞数和维管束数减少有待进一步研究。

表1 用于dCAPS分析的引物及酶

图1 突变体表型及相关性状分析A:野生型(KYJ)与突变体zy17植株形态(标尺:10 cm)。B:野生型(KYJ)与突变体zy17植株主穗(标尺:2 cm)。C:KYJ与zy17穗分枝比较(标尺:2 cm)。D:KYJ与zy17剑叶比较(标尺:1 cm)。E:株高统计数据。F:剑叶宽统计数据。G、H:粒长、粒宽统计数据。I:zy17一次、二次枝梗数以及穗粒数占KYJ的百分比(PB:一次分枝;SB:二次分枝;GN:穗粒数)。
2.3 突变体zy17的遗传分析
突变体zy17与野生型KYJ杂交获得F1群体,考察F1植株叶片形态,均表现为野生型。F1自交构建F2分离群体,在穗子完全抽出后考察F2分离群体单株叶片形态,统计野生型KYJ宽叶单株和突变体zy17窄叶单株。F2群体共计180株,其中野生型KYJ宽叶141株,突变体zy17窄叶表型39株。卡方适合性测验结果显示,F2的分离符合野生型KYJ宽叶:突变体zy17窄叶=3:1的分离规律(χ2=0.896<χ20.05,1= 3.84),表明该窄叶性状受一对隐性性状基因控制。
2.4 候选基因的筛选与验证
在重测序数据中,去除测序覆盖度低于5的SNP,共发现2096个SNP和108个InDel。其中连锁指数大于80%的SNP有219个,InDel有6个。随后对突变位点进行分析,突变发生在外显子或剪切位点的SNP有50个,InDel有1个,去除同义突变后剩余36个SNP,1个InDel,它们绝大部分位于转座子或反转座子区域。为了找到真正导致表型的突变,本文针对最有可能的SNP和InDel设计了CAPS或dCAPS引物,并利用分离群体进行检测,发现2号染色体上的1个SNP和1个InDel与表型共分离。因此,认为突变发生在2号染色体的这个区域。
对位于2号染色体上突变位点的分析显示(表2),其中3个突变位点在基因间隔区,2个突变位点在基因外显子区,1个突变位点在基因内含子区。由此得到3个候选基因:Os02g28280、Os02g29530和Os02g22390。其中Os02g22390为目的基因的可能性相对较小,其测序覆盖度极低且位点突变发生在内含子区,编码蛋白为逆转座蛋白。因此。剩余的1个SNP和1个InDel是可能性较大的候选突变位点。这两个位点突变分别发生在Os02g28280和Os02g29530的外显子区(图3:A、B)。
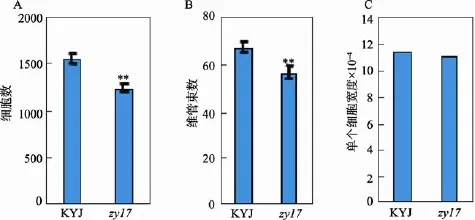
图2 细胞学观察结果及分析A:野生型(KYJ)和突变体(zy17)剑叶1/2处下表皮横向细胞数目统计,差异显著。B:KYJ和zy17剑叶1/2处下表皮横向维管束数目统计,差异显著。C:KYJ与zy17剑叶1/2处下表皮横向细胞平均宽度,两者差异不显著。
在zy17突变体中,候选基因Os02g28280在16 722 773 bp处发生碱基置换,产生非同义突变,C变为T,导致CDS翻译过程中第42个密码子GAT突变为AAT,由天冬氨酸(Asp)变为天冬酰胺(Asn)。Os02g28280编码一个含258个氨基酸残基的未知功能蛋白。在zy17突变体中,候选基因Os02g29530在17 560 608 bp处发生2个碱基TT缺失,导致蛋白翻译提前终止(图3C)。Os02g29530编码了一个包含PFAM结构域糖基转移酶相关蛋白。与拟南芥中糖基转移酶相关蛋白(AT3G02350)的相似性为65%。
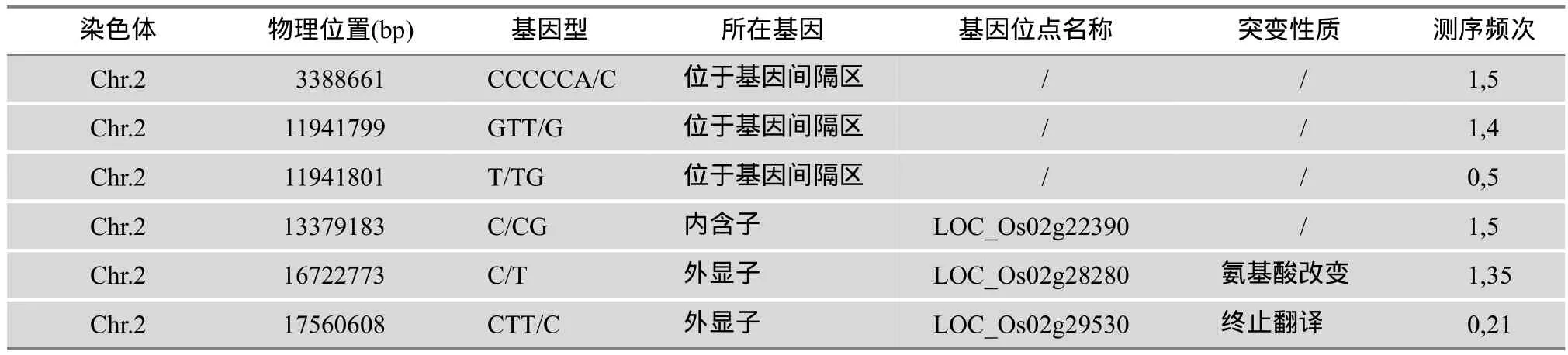
表2 突变位点分析
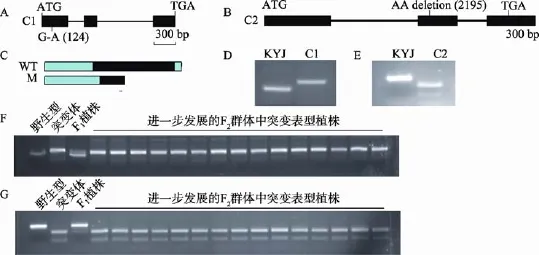
图3 候选基因鉴定及相关分析A:候选基因1(C1)、Os02g28280的基因结构图;B:候选基因2(C2)、Os02g29530的基因结构;C:Os02g29530基因在野生型KYJ(WT)和突变体zy17(M)中编码蛋白的结构比较;D、E:候选基因1和候选基因2的dCAPS验证;F、G:候选基因1和候选基因2的群体验证。
根据Os02g28280和Os02g29530基因上的突变位点,分别设计了 dCAPS1(Candi-1)和 dCAPS2 (Candi-2)两个分子标记(表1)。利用这两个标记对突变体与野生型KYJ分析的结果表明,突变体zy17中的这两个候选基因确发生了突变(图3:D、E),对F2分离群体的检测表明,这两个突变都与F2群体中突变体表型共分离(图3:F、G)。这些结果进一步证明了Os02g28280和Os02g29530为窄叶突变的候选基因。
3 讨 论
水稻是双子叶植物的模式生物。叶片整体结构看似非常简单,但其发育却是一个十分复杂的网络调控过程,涉及到基因与基因间的相互作用以及蛋白质产物与体内激素的平衡调节等。这些作用相互交织影响叶片发育进程,从而导致叶形的变化[25]。
在水稻叶形相关报道中,一系列突变体都表现出窄叶表型,其中nal1、nal7、nal9、nrl1和tdd1都被证实是由于细胞分裂减少导致叶片变窄[7,8,12,15,18]。在本研究中,扫描电镜检测显示,突变体zy17叶片细胞大小与野生型KYJ叶片细胞大小无显著性差异,但其细胞数目和维管束数目相对野生型明显减少,基因突变影响细胞分裂从而导致叶片变窄。为了进一步了解其相关机理,本研究利用基因组重测序技术和连锁分析对突变导致窄叶表型的基因进行筛查,通过连锁分析,确定位于2号染色体的Os02g28280和Os02g29530为候选基因。分析测序结果过程中,Os02g28280基因处突变随机测序36次,35次为T(突变型),1次为C(野生型)。然而我们对180的群体进行测试表明,该突变位点与表型共分离。测定一次C(野生型)可能是由于测序的误差所致。而候选基因Os02g29530处突变随机测序21次,21次皆为TT缺失(突变型),基因与表型完全连锁。我们进一步的群体分析也证实,候选基因Os02g29530中的缺失突变与表型共分离。对二者的相应蛋白结构进行生物信息学分析发现,Os02g28280编码一个功能未知的蛋白,突变导致天冬氨酸(Asp)变为天冬酰胺(Asn)。Os02g29530编码蛋白则与其在拟南芥中的同源蛋白(AT3G02350)含有一样的结构域,即与糖基转移酶相关的PFAM结构域,基因突变后,蛋白翻译提前终止,结构域功能丧失[26]。
根据以前相关报道可知,叶形变化和参与细胞壁形成的基因密切相关。木聚糖是植物次生细胞壁中半纤维素的最主要组分,近年来通过对双子叶模式植物拟南芥(Arabidopsis thaliana)中木聚糖合成缺陷的突变体分析表明:GT43家族的IRX9、IRX9-L、IRX14、IRX14-L,GT47家族的FRA8、F8H、IRX10、IRX10-L,GT8家族的IRX8、PARVUS、QUA1、GUX1、GUX2等参与了木聚糖主链、还原末端序列和侧链的合成[27]。在水稻中已有的相关窄叶基因报道中,通过QTL定位获得的DNL1、NRL1和ND1都是位于12号染色体上的同一窄叶、矮杆基因,编码属于糖基转移酶家族2(GT2)的类纤维素合成酶D4,在种子、根尖以及茎顶端分生组织等分裂能力较强的部位集中表达,最终可以通过影响植物细胞壁形成导致水稻叶片出现变窄的表型[14~17]。Os02g29530编码一个含PFAM结构域的糖基转移酶相关蛋白,是可能性最高的候选基因,可以通过调控水稻木聚糖合成影响细胞壁形成,从而导致水稻叶片变窄。
水稻叶片形态发育过程十分复杂,只有合理利用不同叶片形态资源,对相关基因进行克隆和功能研究,才能更好地揭示叶形发育的机理。2013年Jin等[28]对拟南芥中Os02g29530的同源蛋白UGT74D1进行研究,发现它是一个和生长素相关的糖基转移酶,UGT74D1基因在拟南芥中过表达会出现和本研究的水稻突变体类似的窄叶、矮杆表型,从而为本研究提供一个新思路,Os02g29530也可能通过影响生长素调控叶形。水稻窄叶基因NAL1、NAL7、NAL2和NAL3都是通过影响生长素从而对叶形进行调控,其中NAL1基因编码一生物学功能未知的蛋白,在微管组织中有丰富表达,影响微管发育,导致生长素的极性运输出现障碍,从而表现窄叶表型[7]。NAL7基因则编码属于YUCCA基因家族的黄素单氧化酶,其可能通过影响生长素的生物合成,参与叶形调控过程[9]。NAL2和NAL3编码与WUSCHEL相关的同源蛋白(OsWOX3A),通过调控生长素合成运输影响叶片发育[13]。
水稻的叶形变化与影响细胞壁形成的基因以及生长素合成降解、极性运输的基因都密切相关。本研究中突变体zy17究竟是通过哪种途径发挥作用尚不清楚,为了更好地了解其作用机理,还需对该基因及其功能进行深入探索。在以后的研究中,我们需要进一步构建基因组互补载体对zy17突变体进行遗传转化,以确定两个候选基因中哪一个是ZY17基因。
[1]Tester M, Langridge P. Breeding technologies to increase crop production in a changing world.Science, 2010,327(5967):818–822.
[2]Foley JA,Ramankutty N,Brauman KA,Cassidy ES, Gerber JS,Johnston M,Mueller ND,O'Connell C,Ray DK,West PC,Balzer C,Bennett EM,Carpenter SR,Hill J, Monfreda C,Polasky S,Rockström J,Sheehan J,Siebert S, Tilman D,Zaks DP.Solutions for a cultivated planet. Nature,2011,478(7369):337–342.
[3]朱雄涛,汪真.水稻高光效生理育种初探.福建稻麦科技,2003,21(2):14–17.
[4]陈代波,程式华,曹立勇.水稻窄叶性状的研究进展.中国稻米,2010,16(3):1–4.
[5]王兰,黄李超,代丽萍,杨窑龙,徐杰,冷语佳,张光恒,胡江,朱丽,高振宇,董国军,郭龙彪,钱前,曾大力.利用日本晴/9311重组自交系群体定位水稻成熟期叶形相关性状QTL.中国水稻科学,2014,28(6):589–597.
[6]Chen ML,Luo J,Shao GN,Wei XJ,Tang SQ,Sheng ZH, Song J,Hu PS.Fine mapping of a major QTL for flag leaf width in rice,qFLW4,which might be caused by alternative splicing of NAL1.Plant Cell Rep,2012,31(5):863–872.
[7]Qi J,Qian Q,Bu QY,Li SY,Chen Q,Sun JQ,Liang WX, ZhouYH,ChuCC,Li XG,RenFG,Palme K,ZhaoBR,ChenJF, Chen MS,Li CY.Mutation of the rice Narrow leaf1 gene,which encodes a novel protein,affects vein patterning and polar auxin transport.Plant Physiol,2008,147(4):1947–1959.
[8]Woo YM,Park HJ,Su'udi M,Yang JI,Park JJ,Back K, Park YM,An G.Constitutively wilted 1,a member of the rice YUCCA gene family,is required for maintaining water homeostasis and an appropriate root to shoot ratio. Plant Mol Biol,2007,65(1–2):125–136.
[9]Fujino K,Matsuda Y,Ozawa K,Nishimura T,Koshiba T, Fraaije MW,Sekiguchi H.NARROW LEAF 7 controls leaf shape mediated by auxin in rice.Mol Genet Genomics, 2008,279(5):499–507.
[10]Zhang GH,Li SY,Wang L,Ye WJ,Zeng DL,Rao YC, Peng YL,Hu J,Yang YL,Xu J,Ren DY,Gao ZY,Zhu L, Dong GJ,Hu XM,Yan MX,Guo LB,Li CY,Qian Q. LSCHL4 from Japonica cultivar,which is allelic to NAL1, increases yield of indica super rice 93-11.Mol Plant, 2014,7(8):1350–1364.
[11]Fujita D,Trijatmiko KR,Tagle AG,Sapasap MV,Koide Y, Sasaki K,Tsakirpaloglou N,Gannaban RB,Nishimura T, Yanagihara S,Fukuta Y,Koshiba T,Slamet-Loedin IH, Ishimaru T,Kobayashi N.NAL1 allele from a rice landrace greatly increases yield in modern indica cultivars.Proc Natl Acad Sci USA,2013,110(51):20431–20436.
[12]Li W,Wu C,Hu GC,Xing L,Qian WJ,Si H,Sun ZX, Wang XC,Fu YP,Liu WZ.Characterization and fine mapping of a novel rice narrow leaf mutant nal9.J Integr Plant Biol,2013,55(11):1016–1025.
[13]Cho SH,Yoo SC,Zhang HT,Pandeya D,Koh HJ,Hwang JY, Kim GT,Paek NC.The rice narrow leaf2 and narrow leaf3 loci encode WUSCHEL-related homeobox 3A(OsWOX3A) and function in leaf,spikelet,tiller and lateral root development.New Phytol,2013,198(4):1071–1084.
[14]Hu J,Zhu L,Zeng DL,Gao ZY,Guo LB,Fang YX,Zhang GH,Dong GJ,Yan MX,Liu J,Qian Q.Identification and characterization of NARROW AND ROLLED LEAF 1, anovelgeneregulating leafmorphology and plant architecture in rice.Plant Mol Biol,2010,73(3):283–292.
[15]Wu C,Fu YP,Hu GC,Si H,Cheng SH,Liu WZ.Isolation and characterization of a rice mutant with narrow and rolled leaves.Planta,2010,232(2):313–324.
[16]Li M,Xiong GY,Li R,Cui JJ,Tang D,Zhang BC,Pauly M,Cheng ZK,Zhou YH.Rice cellulose synthase-like D4 is essential for normal cell-wall biosynthesis and plant growth.Plant J,2009,60(6):1055–1069.
[17]Ding ZQ,Lin ZF,Li Q,Wu H,Xiang CY,Wang JF.DNL1, encodes cellulose synthase-like D4,is a major QTL for plant height and leaf width in rice(Oryza sativa L.). Biochem Biophys Res Commun,2015,457(2):133–140.
[18]Sazuka T,Kamiya N,Nishimura T,Ohmae K,Sato Y, Imamura K,Nagato Y,Koshiba T,Nagamura Y,Ashikari M,Kitano H,Matsuoka M.A rice tryptophan deficient dwarf mutant,tdd1,contains a reduced level of indole acetic acid and develops abnormal flowers and organless embryos.Plant J,2009,60(2):227–241.
[19]Yan S,Yan CJ,Zeng XH,Yang YC,Fang YW,Tian CY, Sun YW,Cheng ZK,Gu MH.ROLLED LEAF 9,encoding a GARP protein,regulates the leaf abaxial cell fate in rice. Plant Mol Biol,2008,68(3):239–250.
[20]Zhang GH,Xu Q,Zhu XD,Qian Q,Xue HW.SHALLOTLIKE1 is a KANADI transcription factor that modulates rice leaf rolling by regulating leaf abaxial cell development.Plant Cell,2009,21(3):719–735.
[21]Hu YF,Qin FJ,Huang LM,Sun QW,Li C,Zhao Y,Zhou DX.Rice histone deacetylase genes display specific expression patterns and developmental functions.Biochem Biophys Res Commun,2009,388(2):266–271.
[22]Abe A,Kosugi S,Yoshida K,Natsume S,Takagi H, Kanzaki H,Matsumura H,Yoshida K,Mitsuoka C,Tamiru M,Innan H,Cano L,Kamoun S,Terauchi P.Genome sequencing reveals agronomically important loci in rice using MutMap.Nat Biotechnol,2012,30(2):174–178.
[23]Fekih R,Takagi H,Tamiru M,Abe A,Natsume S, Yaegashi H,Sharma S,Sharma S,Kanzaki H,Matsumura H,Saitoh H,Mitsuoka C,Utsushi H,Uemura A,Kanzaki E,Kosugi S,Yoshida K,Cano L,Kamoun S,Terauchi R. MutMap+:genetic mapping and mutant identification without crossing in rice.PLoS One,2013,8(7):e68529.
[24]陈竹锋,严维,王娜,张文辉,谢刚,卢嘉威,简智华,刘东风,唐晓艳.利用改进的MutMap方法克隆水稻雄性不育基因.遗传,2014,36(1):85–93.
[25]严松,严长杰,顾铭洪.植物叶发育的分子机理.遗传, 2008,30(9):1127–1135.
[26]Lao J,Oikawa A,Bromley JR,McInerney P,Suttangkakul A, Smith-Moritz AM,Plahar H,Chiu TY,González Fernández-Niño SM,Ebert B,Yang F,Christiansen KM, Hansen SF,Stonebloom S,Adams PD,Ronald PC,Hillson NJ,Hadi MZ,Vega-Sánchez ME,Loqué D,Scheller HV, Heazlewood JL. The plant glycosyltransferase clone collection for functional genomics. Plant J,2014,79(3):517–529.
[27]秦丽霞,张德静,李龙,李学宝,许文亮.参与植物细胞壁半纤维素木聚糖合成的糖基转移酶.植物生理学报,2011,47(9):831–839.
[28]Jin SH,Ma XM,Han P,Wang B,Sun YG,Zhang GZ,Li YJ, Hou BK.UGT74D1 Is a novel auxin glycosyltransferase from Arabidopsis thaliana.PLoS One,2013,8(4):e61705.
(责任编委:邢永忠)
Genetic analysis and identification of candidate genes for a narrow leaf mutant(zy17)in rice
Xueqian Li1,2,Ran Xu2,Penggen Duan2,Yingbao Wu2,Yuehua Luo1,Yunhai Li2
1.Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresources and Agricultural College of Hainan University, Haikou 570228,China;
2.State Key Laboratory of Plant Cell and Chromosome Engineering,Institute of Genetics and Developmental Biology,Chinese Academy of Sciences,Beijing 100101,China
Control of organ size by cell proliferation and cell expansion is a fundamental process in plant development,but little is known about the genetic and molecular mechanisms that determine organ size in plants.To understand the genetic and molecular mechanisms of organ growth control,we isolate a set of mutants with altered leaf size and identify the narrow leaf mutant,zhaiye 17(zy17)(zhaiye means narrow leaf in Chinese).zy17 exhibits narrow leaves,slightly short plants,small panicles,reduced panicle branches and decreased grain numbers per panicle compared with the wild type.Our cytological analyses show that the narrow leaf phenotype of zy17 is caused by the reduced number of cells,indicating that ZY17 regulates cell proliferation.Genetic analyses show that the zy17 mutant phenotypes are controlled by a single gene.Using the whole genome resequencing approach and linkage analysis,we identify Os02g22390,Os02g28280 and Os02g29530 as candidate genes.Os02g22390 encodes a retrotransposon protein with the mutation occurring in the intronic region;Os02g28280 encodes a protein with unknown function with a base substitution resulting in non-synonymous mutation;Os02g29530 encodes a protein containing the PFAM domain related to glycosyltransferase,with a 2 bp deletion mutation causing a premature termination.Further studies on these three candidate genes will be helpful for understanding the molecular mechanism of organ size control in rice.
rice(Oryza sativa L.);narrow leaf mutant;cell proliferation;genetic basis
2015-02-02;
2015-04-03
国家重点基础研究发展计划项目(973计划)(编号:2013CBA01401),海南省科技项目(编号:ZDZX2013023),“中央财政支持中西部高校提升综合实力专项”和植物细胞与染色体工程国家重点实验室开放课题(编号:PCCE-KF-2014-05)资助
李雪倩,硕士研究生,专业方向:作物遗传育种。E-mail;825675580@qq.com
徐冉,博士,助理研究员,研究方向:植物器官大小调控。E-mail;284505584@qq.com李雪倩和徐冉为并列第一作者。
李云海,博士,研究员,研究方向:植物种子和器官大小调控。E-mail:yhli@genetics.ac.cn
罗越华,博士,研究员,研究方向:水稻光温敏雄性不育分子机制及花粉发育分子机理。E-mail;lyhhk@163.com
10.16288/j.yczz.15-056
时间:2015-4-29 10:56:55
URL:http://www.cnki.net/kcms/detail/11.1913.R.20150429.1056.003.html
·招聘启事·

