聚维酮碘作为脱钙骨基质保存剂的实验研究
赵彦涛 胡先同 韩丽伟 白玉龙 衷鸿宾
聚维酮碘作为脱钙骨基质保存剂的实验研究
赵彦涛胡先同韩丽伟白玉龙衷鸿宾
目的 探讨聚维酮碘 (PVP-I)作为脱钙骨基质 (demineralized bone matrix,DBM)长期保存剂的可行性。方法 选用 4 种标准菌种进行 PVP-I 重复 5 次的灭菌效果验证。分别采用 CCK-8 法、PNPP 法、RT-PCR 法检测 PVP-I 对成骨细胞的增殖、前交叉韧带 (anterior cruciate ligament,ACL)活力以及成骨分化标志分子 COL1α、ALP、RUNX2、OCN mRNA 表达的影响;裸小鼠肌间隙植入实验验证 PVP-I 长期保存的 DBM成骨活性是否受到影响。结果 PVP-I 对金黄色葡萄球菌、白色念珠菌、枯草杆菌黑色变种芽孢的杀灭率均为100%,对大肠杆菌的杀灭率为 88.7%;与对照组 (1±0.09)相比,高浓度 PVP-I 抑制细胞生长 (0.63±0.03)(P<0.05),低浓度 PVP-I 不促进也不抑制细胞增殖;PVP-I 显著增强成骨细胞的 ALP 活力,上调 COL1α、ALP、RUNX2 mRNA 的表达量 (1.25±0.15、1.38±0.14、1.23±0.09)(P<0.05),对 OCN mRNA 的表达影响不明显;裸鼠肌间隙植入实验表明,PVP-I 长期保存的 DBM 其成骨活性不受影响。结论 PVP-I 有望被开发成DBM 的保存剂。
聚维酮碘;移植,同种;灭菌;小鼠,裸
同种异体骨移植已成为治疗骨缺损的重要手段,脱钙骨基质 (demineralized bone matrix,DBM)的灭菌和保存在其中起到非常关键的作用。现阶段常用的灭菌方法包括:过氧乙酸联合酒精浸泡、环氧乙烷熏蒸、60Co 辐照灭菌等[1]。但这些灭菌方法都会不同程度的损伤 DBM 中的活性成分,影响其成骨活性[2-4]。所以,开发出理想的 DBM 灭菌及保存方法显得尤为迫切。
长期以来,聚维酮碘 (PVP-I)一直作为皮肤及伤口的消毒剂而被应用于临床各科室[5-6]。Zhao等[7]的研究发现,PVP-I 处理能够促进 DBM 的异位成骨能力,但其具体机制尚不清楚。用 PVP-I 长期保存 DBM 后,其成骨活性是否受到影响也不明确。为此,笔者就 PVP-I 处理的 DBM 促进异位成骨的机制以及 PVP-I 长期保存的 DBM 成骨活性是否受到影响进行了研究。
材料与方法
一、实验材料
标准菌株大肠杆菌 (ATCC 25922)、金黄色葡萄球菌 (ATCC 6538)、枯草杆菌黑色变种芽孢 (ATCC 9732)、白色念珠菌 (ATCC 10231)由美国 ATCC 公司提供,PVP-I (安捷高科 20140302)、DBM (中国人民解放军全军骨科研究所提供)、CCK-8 试剂(同仁化学所,日本 GH802)、PNPP (大连美仑生物A0122A)、Mgcl2 (北京化工厂 10012892)、二乙醇胺 (大连美仑生物 N0514AS)、RT 试剂盒 (宝生生物AK2401)、PCR 试剂盒 (宝生生物 AK3604)、PCR引物 (上海生工合成)方法。
二、灭菌效果验证
1. 菌种的选择:根据国标 GB15981-1995 要求,选择大肠杆菌、金黄色葡萄球菌、枯草杆菌黑色变种芽孢、白色念珠菌四种标准菌种进行 PVP-I灭菌效果验证。
2. 灭菌:称量无菌 DBM 共 8 份,每份 1 g,分为对照组和 PVP-I 组,每组 4 份。调整上述菌株菌悬液的浓度为 107 cfu / ml,向每个样品 DBM 中加入该菌悬液 2 ml,4 ℃ 环境下放置 12 h。用无菌生理盐水冲洗 DBM 表面,然后对照组每个样品加入 2 ml 无菌 PBS;PVP-I 组每个样品加入 2 ml 0.5% PVP-I,4 ℃ 放置 24 h。取出 DBM 后用无菌 PBS 冲洗 1 次,然后每个样品加入 10 ml DMEM 培养基,37 ℃ 培养 12 h,收集上清液,进行平板菌落计数。
3. 平板菌落计数:配制营养琼脂培养基 250 ml,高压蒸汽灭菌。取 8 个无菌试管,每个试管中加入20 ml 营养琼脂培养基。待试管中的培养基冷却至45 ℃ 时,将 1.2 中收集到的上清液稀释 1000 倍,取 100 μl 加入试管中。混匀后倒入无菌培养皿中。培养基冷却凝固后将培养皿放入 37 ℃ 培养箱,24 h后取出计数。
4. 灭菌试验重复 5 次。
三、MC3T3 细胞增殖、ALP 活性以及成骨相关蛋白基因的表达
1. 细胞培养:MC3T3-E1 细胞用含 10% FBS 的α-MEM 培养基常规培养。细胞生长达到 80% 融合时,进行传代。用 PBS 清洗细胞 1 次,然后加入0.25% 胰酶进行消化,离心后用含 10% FBS 的 α-MEM培养基重悬细胞。调整细胞密度为 2×104/ ml,接种到培养板中。96 孔板每孔接种 100 μl,12 孔板每孔接种 2 ml。
2. 细胞增殖检测:MC3T3-E1 细胞接种到 96 孔板,37 ℃ 培养 24 h。对照组加入全培,PVP-I 组加入有效碘含量为 320 ng / ml、160 ng / ml、80 ng / ml、40 ng / ml、20 ng / ml 的 PVP-I。37 ℃ 培养后 48 h 加入 10% CCK-8 溶液,其后 2 h,在 450 nm 波长下检测吸光度。
3. ALP 活力检测:MC3T3-E1 细胞接种到 96 孔板,37 ℃ 培养 24 h。对照组加入全培,PVP-I 组加入有效碘含量为 80 ng / ml 的 PVP-I。37 ℃ 培养1 周加入 PNPP 试剂。其后 2 h 加入 0.1 M 的 NaOH终止反应,405 nm 波长下检测吸光度。
4. COL1α、ALP、RUNX2、OCN mRNA 表达检测 MC3T3-E1 细胞接种到 12 孔板,对照组加入全培,PVP-I 组加入有效碘含量为 80 ng / ml的 PVP-I。37 ℃ 培养 72 h,提取细胞总 RNA。RT-PCR 反应检测 COL1α、ALP、RUNX2、OCN mRNA 表达。
四、经 PVP-I 保存后的 DBM 异位成骨实验
1. 材料灭菌:称量 24 份 DBM,每份 0.1 g。分为对照组、PVP-I 24 h 组、PVP-I 12 周组,每组 8 份(n=8)。对照组用60Co 辐照灭菌,辐照剂量 25 KGy。PVP-I 24 h 组用 PVP-I 在 4 ℃ 条件下浸泡 24 h,PVP-I 12 周组用 PVP-I 在 4 ℃ 条件下浸泡 12 周。使用前用无菌 PBS 冲洗 DBM 表面 3~5 次。
2. 裸鼠肌间隙植入实验:裸鼠 24 只,分为对照组、PVP-I 24 h 组、PVP-I 12 周组,每组 8 只。0.3% 的戊巴比妥钠麻醉,俯卧位。局部碘伏消毒。用手术刀在大腿皮肤沿长轴做一 5 mm 切口,眼科镊沿肌间隙将肌肉分开。将材料植入裸鼠肌间隙,缝合肌肉和皮肤。术后 4 周取材,将 DBM 及周围包裹的肌肉取下,进行石蜡切片,HE 染色。观察异位成骨情况。
结 果
一、PVP-I 的灭菌效果
与对照组相比,PVP-I 对金黄色葡萄球菌、白色念珠菌、枯草杆菌黑色变种芽孢的杀灭率均为100%,对大肠杆菌的杀灭率为 88.7% (表1)。
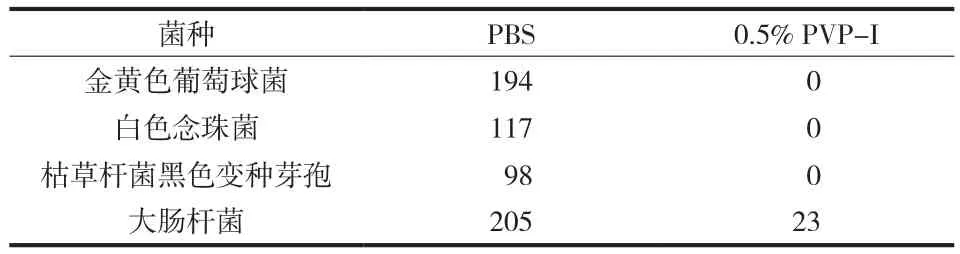
表1 0.5% PVP-I 对几种标准菌种的杀灭效果Tab.1 The sterilization effects of 0.5% PVP-I to standard strains
二、不同浓度 PVP-I 对 MC3T3 细胞增殖的影响
图1 显示:PVP-I 浓度为 320 ng / ml 和 160 ng / ml时,对 MC3T3 细胞的生长有明显抑制作用;当浓度降至 80 ng / ml 时,PVP-I 对细胞生长的抑制作用消失,出现了非常微弱的促增殖作用,但与对照组相比,其作用不明显。继续降低 PVP-I 浓度,并未出现明显促增殖的作用。
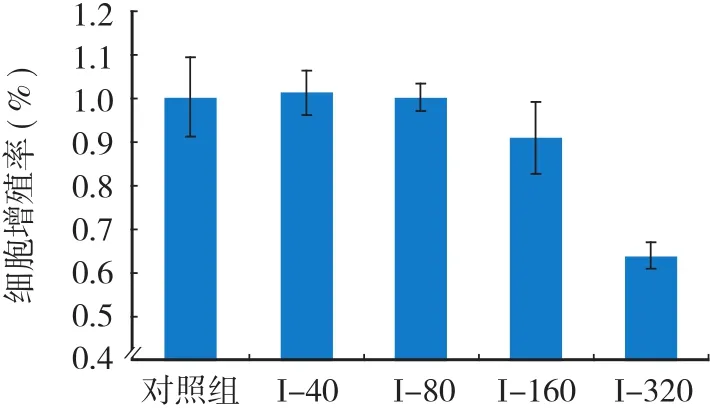
图1 PVP-I 对 MC3T3-E1 细胞增殖的影响Fig.1 The proliferation of MC3T3-E1 by the stimulation of PVP-I
三、PVP-I 对 MC3T3 细胞前交叉韧带 (anterior cruciate ligament,ACL)活力的影响
与对照组 (1±0.05)相比,PVP-I 组 (1.25± 0.04)细胞的 ALP 活力明显升高,差异有统计学意义 (P<0.05)(图2)。

图2 PVP-I 对 MC3T3-E1 细胞 ALP 活力的影响Fig.2 The ALP activity of MC3T3-E1 by the stimulation of PVP-I
四、PVP-I 对 MC3T3 细胞 ALP、COL1α、RUNX2 mRNA 表达的影响
与对照组相比,PVP-I 组细胞的 ALP (1.25± 0.15)、COL1α (1.38±0.14)及 RUNX2 (1.23±0.09)的 mRNA 表达量明显升高,差异有统计学意义 (P<0.05)。两组的 OCN mRNA 表达量差异无统计学意义(P>0.05)(图3)。
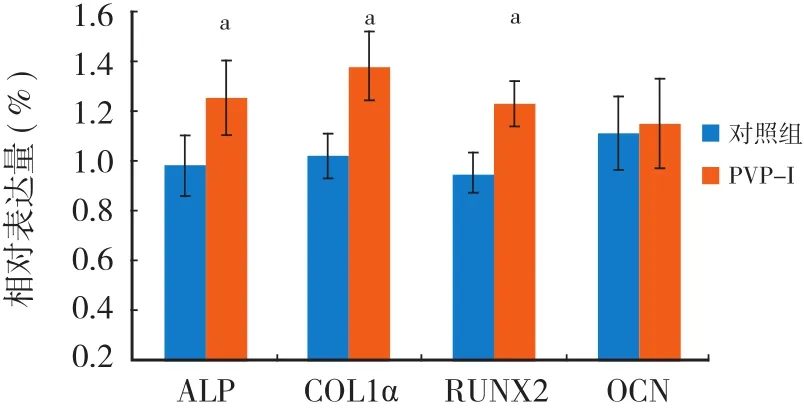
图3 PVP-I 对 MC3T3-E1 细胞几种成骨标志分子 mRNA 表达的影响Fig.3 The mRNA expressions of osteogenic molecule of MC3T3-E1 by the stimulation of PVP-I
五、PVP-I 保存时间对异位成骨能力的影响
图4 显示:经 PVP-I 保存 12 周与保存 24 h 的DBM 均有很强的异位成骨能力分别为:(2.2±0.03)、(2.3±0.05)。与对照组 (1±0.03)相比,差异有统计学意义 (P<0.05)。
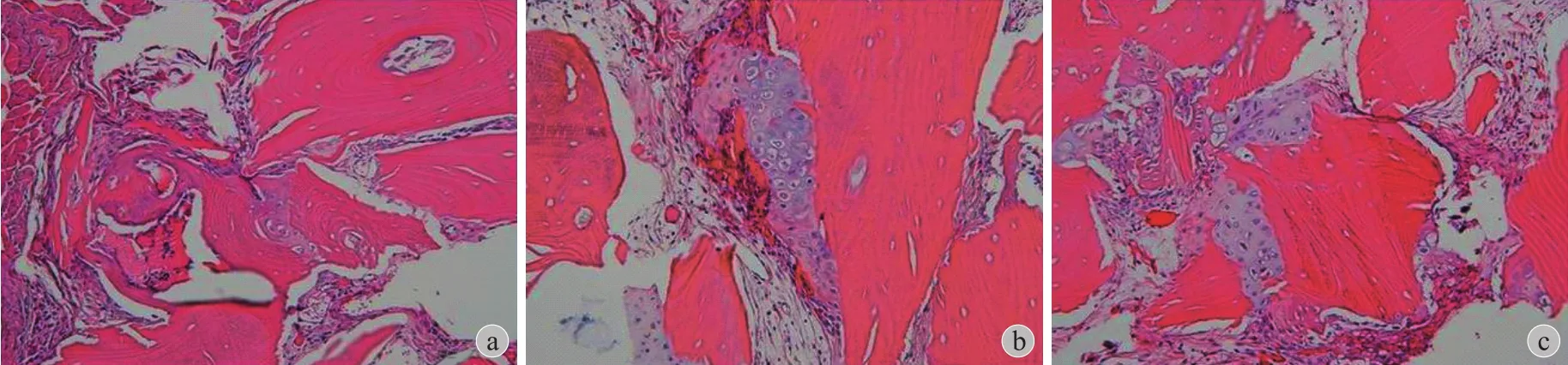
图4 PVP-I 浸泡对 DBM 异位成骨能力的影响 a:对照组;b:PVP-I 浸泡 24 h;c:PVP-I 浸泡 12 周Fig.4 The effects of PVP-I to DBM on its ectopic osteogenesis a: Control group; b: 24 hours in PVP-1; c: 12 weeks in in PVP-I
讨 论
PVP-I 是碘与表面活性剂络合而成的一种广谱抗菌消毒剂。其渗透性强,刺激性小,杀菌作用时间长,被广泛应用于临床各个科室。骨科常用 PVP-I溶液进行关节或伤口的冲洗[8-9],往往能取得良好的杀菌效果。已有学者将 PVP-I 应用到组织材料的消毒方面:汪喜顺[10]用 PVP-I 对兔半月板进行金黄色葡萄球菌染菌后的灭菌实验,结果灭菌率达到100%。本实验根据国家标准,选取了 4 种标准菌种进行灭菌验证,其中包括 1 种革兰氏阳性菌 (金黄色葡萄球菌),1 种革兰氏阴性菌 (大肠杆菌),1 种真菌 (白色念珠菌)和 1 种细菌芽孢 (枯草杆菌黑色变种芽孢)。结果显示,PVP-I 对金黄色葡萄球菌、白色念珠菌和枯草杆菌黑色变种芽孢的杀菌率均达到 100%。对大肠杆菌的杀菌率为 88.7%,未能全部杀灭,原因可能有:(1)染菌实验中,菌悬液用有机培养基 DMEM 配制,染菌后 DBM 虽经 PBS 冲洗,但 DBM 表面或内部孔隙还是会不可避免地残留部分培养基,而 PVP-I 在有机物质存在的情况下,杀菌效果会减弱[11];(2)灭菌时间短,实验中灭菌时间为24 h,延长灭菌时间可能会取得更好的灭菌效果[12]。虽然 PVP-I 对大肠杆菌的灭菌没有达到 100%,但这是在刻意染菌之后的情况。实际生产当中,如果严格控制初始污染菌,DBM 上污染的大肠杆菌数量要远远低于实验中的数据,再结合前期 DBM 处理时酒精的应用,应该会取得良好的杀菌效果。
笔者既往的研究发现,PVP-I 处理的 DBM,其异位成骨的能力有所增加,但其机制尚不明确[7]。本实验从 PVP-I 对成骨细胞增殖和分化的影响入手,对 PVP-I 增强 DBM 异位成骨能力的机制进行研究。结果显示,PVP-I 并不促进成骨细胞的增殖,而高浓度的 PVP-I 反而抑制成骨细胞的生长,这与 Jiang等[13]对于间充质干细胞的相关研究结果是一致的。
ALP 活力是反应成骨细胞分化的一个重要指标[14]。本研究采用 PNPP 法,检测了 PVP-I 对成骨细胞 ALP 活力的影响,结果表明,PVP-I 能够明显增强成骨细胞的 ALP 活力。进一步观察 PVP-I 对成骨细胞 COL1α、ALP、RUNX2、OCN mRNA 的影响,发现 PVP-I 明显上调 COL1α、ALP 及 RUNX2 mRNA 的表达,这与 Jiang 等[13]的报道一致。但 PVP-I 对 OCN mRNA 的影响不明显,这可能是由于干预时间太短。OCN 属于成骨细胞晚期分化的标志,在矿化形成的时候才开始大量表达[15]。有研究表明,PVP-I 干预成骨细胞后 4 周,与对照组相比,OCN 的基因表达有显著差异[13]。
本研究的前期研究中的异位成骨实验是用PVP-I 处理 DBM 24 h 的结果。要将 PVP-I 作为 DBM的保存剂,需要将 DBM 长期浸泡在 PVP-I 中。这是否会影响其成骨活性,本研究结果表明,DBM在 PVP-I 中浸泡 3 个月,不会影响其成骨活性。笔者还会对 PVP-I 处理更长时间的 DBM 继续进行检测,为 PVP-I 作为 DBM 保存剂的可行性提供更可靠的依据。
综上所述,PVP-I 具有很强的杀菌能力,而且其处理过的 DBM 的成骨活性不降反升,长达 3 个月的保存也不会影响 DBM 活性。这些都为 PVP-I 作为组织材料的保存剂提供了理论依据。通过一系列的实验研究,PVP-I 有望被开发成一种理想的组织材料保存剂。
[1]桑宏勋, 胡蕴玉, 李丹, 等. 生物骨移植材料的灭菌. 第四军医大学学报, 2000, (1):56-60.
[2]Munting E, Wilmart JF, Wijne A, et al. Effect of sterilization on osteoinduction Comparison of five methods in demineralized rat bone. Acta Orthop Scand, 1988, 59(1):34-38.
[3]Glowacki J. A review of osteoinductive testing methods and sterilization processes for demineralized bone. Cell Tissue Bank, 2005, 6(1):3-12.
[4]Nguyen H, Morgan DA, Forwood MR. Sterilization of allograft bone: effects of gamma irradiation on allograft biology and biomechanics. Cell Tissue Bank, 2007, 8(2):93-105.
[5]赵书理, 梁丽梅, 林巍. 聚维酮碘在围手术期的应用及研究进展. 吉林医学, 2014, 35(29):6576-6578.
[6]王俊. 聚维酮碘在手术室的应用与研究进展. 现代医学,2013, 41(1):63-66.
[7]Zhao Y, Yan J, Xia Y, et al. Enhanced osteogenesis of polyvinylpyrrolidone-iodine as a sterilizing agent for preservation of allografts. J Biomaterials Tissue Engineering,2015, 5(6):465-471.
[8]曾红俊, 杨红丽. 关节镜下清理碘伏液灌洗治疗化脓性膝关节炎. 实用骨科杂志, 2006, 12(6):554-555.
[9]李晖, 武明霞, 孙西虎. 碘伏灌注冲洗治疗骨关节化脓性感染. 中国骨伤, 2008, 21(4):303-304.
[10]汪喜顺. 不同消毒方法对同种异体半月板移植效果的研究. http://cdmd.cnki.com.cn/Article/CDMD-90115-1015504334. htm[2015-09-11]
[11]徐庆华. 含碘消毒剂及其应用技术. 中国消毒学杂志, 2012,29(4):316-318.
[12]赵显伦, 傅世忠, 陈忠荣, 等. 碘伏消毒皮肤与餐具效果影响因素的观察. 中国消毒学杂志, 1996, 13(3):146.
[13]Jiang Y, Chen L, Zhang S, et al. Incorporation of bioactive Polyvinylpyrro lidone-Iodine within bilayered collagen scaffolds enhances thedifferentiation and subchondral osteogenesis of mesenchymalstem cells. Acta Biomater, 2013,9(9):8089-8098.
[14]Kyeyune NE, Lau KH, Baylink DJ, et al. l,25-Dihydorxyvitamin D3 stimulates both alkaline phosphatase gene tarnseription and mRNA stability in human bone cells. Aerh Biochem Bio Phys,1991, 291(2):316-325.
[15]李美蓉. 吡格列酮对高糖环境下MC3T3-E1早期成骨细胞增殖、凋亡和功能蛋白OCN、ALP、BMP-2表达的影响. http://www.doc88.com/p-9307318719736.html[2015-09-11]
(本文编辑:李贵存)
A study of PVP-I as a long term preservation agent for demineralized bone matrix
ZHAO Yan-tao, HU Xian-tong,HAN Li-wei, BAI Yu-ling, ZHONG Hong-bin. Department of Orthopedics, the frst Affliated Hospital of PLA General Hospital, Beijing, 100048, PRC
ObjectiveTo discuss the feasibility of PVP-I being the preservation of demineralized bone matrix (DBM). MethodsFour standard strains were used to perform the sterilization experiment in repeated 4 times. PVP-I was added to MC3T3-E1, then cell proliferation and viability were determined by CCK-8 and differentiation status by PNPP and RT-PCR. Muscle implant experiment of nude mice was performed to verify whether the activity of DBM was damaged since it was immersed in PVP-I for a long time. ResultsThe sterilization rates of PVP-I to staphylococcus aureus, monilia albican and bacillus subtilis were all of 100%, while to Escherichia coli 88.7%. CCK-8 assay showed reduced proliferation of the MC3T3-E1 cells when the PVP-I was at a high concentration(0.63±0.03)(P<0.05). When the concentration of PVP-I was down-regulated, a negligible effect was observed on MC3T3-E1 growth. PVP-I signifcantly enhanced the activity of ALP and up-regulated the expressions of COL1α, ALP and RUNX2 (1.25±0.15, 1.38±0.14, 1.23±0.09)(P<0.05). However, PVP-I did not affect the expression of OCN. The nude mice experiment suggested that the activity of DBM was not infuenced by PVP-I. ConclusionsPVP-I may be applied as the preservation of DBM.
Povidone-iodine;Transplantation, homologous;Sterilization;Mice, nude
10.3969/j.issn.2095-252X.2015.11.005
R944.1, R318
国家自然科学基金项目 (81201380);军事医学项目 (13CXZ028),(AWS14C007);北京市自然科学基金
100048北京,解放军总医院第一附属医院骨科研究所 (赵彦涛、衷鸿宾);100048北京,北京市骨科植入医疗器械工程技术研究中心 (赵彦涛、衷鸿宾、胡先同、韩丽伟、白玉龙);100048北京,北京鑫康辰医学科技发展有限公司科研部 (胡先同、韩丽伟、白玉龙)
2015-08-04)
(7152144);北京市科技新星项目 (XXJH2015102);304 医院临床部重点扶持项目 (2014ZD001)

