β-连环素对卵巢癌细胞顺铂耐药性的影响
廖丹,刘睿,曾瀚庆
β-连环素对卵巢癌细胞顺铂耐药性的影响
廖丹,刘睿,曾瀚庆
目的:探讨信号分子β连环素(β-catenin)在多个卵巢癌耐药细胞系中的表达及其对顺铂耐药性的影响。方法:首先在2个卵巢癌耐药细胞系(C13K,SKOV-3),2个卵巢癌敏感细胞系(OV2008,A2780),A2780顺铂敏感株、A2780-cis顺铂耐药株,COC10顺铂敏感株、COC1-cis顺铂耐药株中检测β-catenin蛋白的水平。通过小干扰RNA (siRNA)介导的RNA干扰技术靶向沉默细胞中β-catenin的表达,实时荧光定量聚合酶链反应(real-time PCR)和蛋白质印迹法(Western blotting)验证β-catenin基因沉默效果。台盼蓝染色方法分析β-catenin基因沉默对细胞化疗药物顺铂敏感性的影响,流式细胞术检测顺铂处理后β-catenin基因沉默细胞的凋亡率。Western blotting筛选多个凋亡相关信号分子的改变。结果:β-catenin在2个卵巢癌耐药细胞系C13K,SKOV-3中蛋白水平较敏感细胞系明显上调。与亲本A2780和COC10细胞相比,在耐药株A2780-cis和COC1-cis中表达水平也明显增高。β-catenin siRNA能显著抑制细胞中β-catenin蛋白的水平。β-catenin基因沉默后,卵巢癌耐药细胞C13K,SKOV-3对顺铂敏感性显著增高;流式细胞术进一步分析发现β-catenin基因沉默可以促进顺铂介导的卵巢癌耐药细胞的细胞凋亡。Western blotting发现βcatenin基因沉默后,顺铂处理可以显著上调促凋亡分子p53和caspase-3蛋白水平。结论:β-catenin在卵巢癌耐药细胞系表达明显增高,β-catenin沉默可以促进卵巢癌耐药细胞对顺铂的敏感性,并同时促进了顺铂介导的细胞凋亡。
卵巢肿瘤;肿瘤细胞系;β连环素;顺铂;抗药性,肿瘤
【Abstract】Objective:To investigate the expression of β-catenin in several human ovarian cancer cell lines and its effect on cisplatin resistance.Methods:The protein level of β-catenin in two cisplatin-resistant cell lines(C13K,SKOV-3),two cisplatin-sensitive cell lines(OV2008,A2780),A2780,A2780-cis,COC10 and COC1-cis was examined by real-time PCR and western blotting analysis.Expression of β-catenin in ovarian cancer cells was knockdown by siRNA transfection.The effect of β-catenin silencing on cisplatin resistance was examined by trypan blue staining and flowcytometry.The change of apoptosisrelated proteins were examined by western blotting analysis.Results:The expression of β-catenin was upregulated in cisplatinresistant cell lines(C13K,SKOV-3)compared with cisplatin-sensitive cell lines.The expression of β-catenin in cisplatinresistant A2780 and COC1 was also higher than that in paretnal A2780 and COC1 cells.siRNA targeting β-catenin effectively knockdown expression of β-catenin in ovarian cancer cells.Silencing of β-catenin enhanced the sensitivity of cisplatin-resistant cells(C13K,SKOV-3)to cisplatin.β-catenin siRNA also resulted in more apoptosis compared with control siRNA.Cisplatin treatment in β-catenin silencing cells induced the expression of apoptosis-related protein p53 and caspase-3.Conclusions:These finding suggested that β-catenin was upregulated in cisplatin-resistant cells.Gene silencing of β-catenin enhanced sensitivity to cisplatin in cisplatin-resistant cells by inducing more cisplatin-mediated apoptosis.
【Keywords】Ovarian neoplasms;Cell line,tumor;Beta catenin;Cisplatin;Drug resistance,neoplasm
(J Int Obstet Gynecol,2015,42:108-111)
卵巢癌的发病率在女性生殖器恶性肿瘤中居第3位,但病死率却高居第1位。尽管近10年来开展了在肿瘤细胞减灭术基础上联合顺铂为主的治疗方案,但卵巢癌患者的5年生存率一直在20%~30%左右,其主要原因是卵巢癌对化疗药物产生了耐药性。耐药性的产生直接影响了化疗效果和患者生存率,因此研究卵巢癌细胞耐药发生的机制对于防止或逆转耐药产生、改善化疗效果、提高患者生存率有着很重要的意义。
卵巢癌耐药的产生是多因素、多层次、多途径共同作用的结果。目前研究发现多个信号分子或信号通路参与了卵巢癌耐药发生的机制,例如白细胞介素6(IL-6)[1]、酪氨酸蛋白激酶(Src)家族[2]、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)信号通路[3]等。β连环素(β-catenin)是Wnt信号通路中的关键分子,作为信号分子主要参与细胞分化[4]、细胞凋亡[5]、细胞增殖[6]及多种肿瘤的迁移侵袭过程[7]等。已有研究发现,β-catenin参与了多种肿瘤细胞的耐药过程,如肝癌[8]、肺癌[9]和神经母细胞瘤[10]等。本研究主要探讨β-catenin与卵巢癌顺铂耐药的关系,通过RNA干扰技术沉默β-catenin基因后,观察其对耐药卵巢癌细胞药物敏感性的影响,为卵巢癌细胞耐药发生的机制提供理论依据。
1 材料与方法
1.1材料β-catenin抗体(Abcam,英国),p53抗体和caspase-3(cell signaling technology,美国),β-actin抗体(Sigma-Aldrich,美国),辣根过氧化物酶(horseradish peroxidase,HRP)标记的驴抗兔IgG抗体(GE healthcare公司,美国),台盼蓝染色细胞存活率检测试剂盒(碧云天),凋亡检测试剂盒(Annexin V-PE Apoptosis Detection Kit,Abcam公司),小干扰RNA(siRNA)购自Invitrogen公司,转染试剂lipofectamine 2000(Invitrogen公司,美国)。
1.2细胞培养卵巢癌细胞系 C13K,A2780,OV2008,SKOV-3均培养于含有10%胎牛血清、1%青/链霉素的RPMI-1640培养基中,在含5%CO2、37℃孵箱中常规培养。
1.3蛋白质印迹法(Western blotting)分析使用RIPA裂解液裂解细胞,离心去除细胞碎片,提取各细胞总蛋白后二喹啉甲酸(BCA)法测蛋白浓度。取其等量(30 μg)细胞蛋白样品变性后上样经8%聚丙烯酰胺凝胶(SDS-PAGE)电泳后,以90 V电转膜4 h将蛋白转移至硝酸纤维素(NC)膜。转移好的NC膜5%脱脂奶粉封闭1 h,一抗4℃孵育摇床过夜(βcatenin抗体1∶3 000稀释),Tris-Hcl缓冲液溶液(TBST)洗膜3次,每次5 min,二抗室温孵育2 h(二抗为HRP标记的驴抗兔免疫球蛋白G(IgG)1∶3 000稀释),用TBST洗膜后,加入化学发光试剂(ECL)后显影。以β-actin为内参。
1.4实时荧光定量聚合酶链反应(RT-qPCR)分析提取细胞的总RNA,20 μL逆转录反应体系为:RNA 1 μg、Master mix 4 μL、酶1 μL、去RNA酶(Rnase)水。混匀,按下列条件进行反应:25℃5 min,42℃30 min,85℃5 min,4℃5 min。取1 μL互补DNA(cDNA),SYB Green 5 μL,引物(primer,10 μmol/ L)各0.2 μL,去Rnase水3.6 μL,混匀,按下列条件进行反应:94℃20 s,60℃20 s,72℃15 s,共35个循环。每个实验样本均采用3管重复,重复3次,取其平均值。
1.5台盼蓝染色方法将对照siRNA和β-catenin siRNA转染细胞24 h后,加入适量胰酶消化细胞,用培养基重悬细胞。同时以未转染组为对照细胞。以每孔4×104细胞接种6孔板,24 h孵育后加入顺铂(60 μmol/L)处理48 h后在不同的时间点收集细胞。吸取100 μL重悬的细胞到塑料离心管内,加入100 μL台盼蓝染色液,轻轻混匀,染色3 min;吸取少量经过染色的细胞,用血细胞计数板计数。具体检测方法参照试剂盒说明书。
1.6流式细胞术检测细胞凋亡将对照siRNA和β-catenin siRNA转染细胞3 d后,磷酸盐缓冲液(PBS)洗涤贴壁细胞1次,加入适量胰酶消化细胞,用培养基重悬细胞,1 000×g离心5 min,弃上清。使用PBS洗涤细胞,弃上清,并加入500 μL Annexin V-PE结合液轻轻重悬细胞,加入5 μL Annexin V-PE,轻轻混匀,室温(20~25℃)避光孵育5 min,随即进行流式细胞仪检测。
1.7siRNA转染β-catenin siRNA和control siRNA通过转染试剂(lipofectamine 2000)分别转染卵巢癌耐药细胞系C13K和SKOV-3,具体操作见转染试剂说明书。转染72 h后Western blotting检测细胞β-catenin的表达。
1.8统计学分析采用SPSS 11.5统计软件进行分析,计量资料以均数±标准差(x±s)表示,两样本均数比较用t检验,多组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1β-catenin在人卵巢癌耐药细胞系和卵巢癌敏感细胞系中的表达水平Western blotting结果显示,β-catenin在卵巢癌耐药细胞系C13K、SKOV-3的表达水平显著高于敏感细胞系OV2008、A2780,见图1。Western blotting结果进一步证实在耐药的细胞中β-catenin的蛋白水平显著高于其亲本非耐药的细胞,见图2。
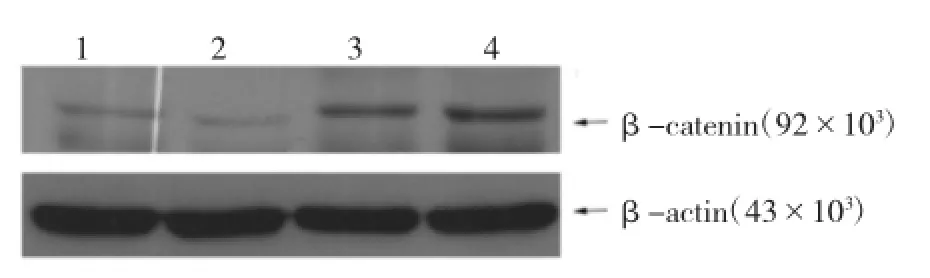
图1 Western blotting检测4个卵巢癌细胞系中β-catenin的表达

图2 Western blotting检测顺铂耐药株和亲本敏感株中β-catenin蛋白水平
2.2靶向β-catenin的siRNA的干扰效率检测RT-PCR结果显示,同对照siRNA相比β-cateninsiRNA抑制了β-catenin的mRNA水平,抑制率达90%,见图3。Western blotting结果证实同对照siRNA相比,β-catenin siRNA成功地沉默了2个卵巢癌细胞系中β-catenin的表达(>80%),见图4。

图3 RT-PCR验证靶向β-catenin的siRNA的基因沉默效率

图4 Westernblotting验证靶向β-catenin的siRNA的基因沉默效率
2.3β-catenin在卵巢癌耐药细胞对化疗药物顺铂的抵抗性台盼蓝染色方法结果显示,在C13K和SKOV-3细胞中,经顺铂处理3 d后,β-catenin基因沉默已经对细胞增殖活力产生影响,同时转染对照siRNA的细胞和未处理组细胞增殖能力差异无统计学意义(P>0.05);经顺铂处理后,β-catenin基因沉默的细胞增殖活力在不同的时间点(即3,4,5 d)均显著低于对照细胞和未处理组细胞(P<0.01),见图5。
2.4β-catenin对顺铂诱导细胞凋亡的影响流式细胞术结果显示,在β-catenin基因沉默的细胞中,顺铂处理诱导更多细胞处于凋亡状态。在C13K细胞中,对照组细胞凋亡率为(19.4±0.9)%,β-catenin基因沉默的细胞凋亡率为(34.2±2.1)%,差异有统计学意义(t=8.59,P<0.05);在SKOV-3细胞中,对照组细胞凋亡率为(9.6±1.1)%,β-catenin基因沉默细胞的凋亡率为(19.8±1.8)%,差异有统计学意义(t= 15.38,P<0.05),见图6(见后插一)。
2.5β-catenin对顺铂诱导的凋亡相关信号分子表达的影响为了进一步分析顺铂诱导细胞凋亡的分子机制,本研究筛选了一系列与凋亡相关的信号分子,包括p53,p73,caspase-3,caspase-7,B淋巴细胞瘤2(Bcl-2),Bcl-2相关X蛋白(Bax)等。本研究发现,在β-catenin表达沉默的细胞中,顺铂显著增加了p53和caspase-3蛋白的表达,见图7。
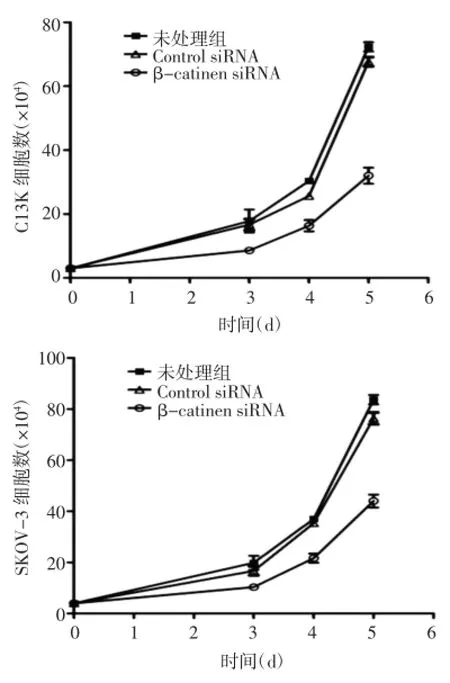
图5 不同时间点顺铂处理后卵巢癌细胞活性
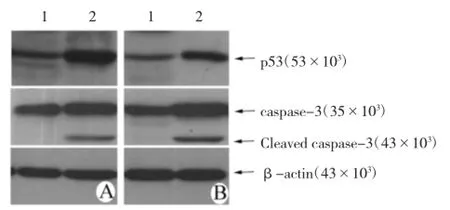
图7 Western blotting检测顺铂诱导凋亡相关蛋白的表达
3 讨论
卵巢癌早期诊断困难,70%患者初诊时已处于晚期,在肿瘤细胞减灭术的基础上开展顺铂为主的联合方案目前已成为卵巢癌的常规治疗方案,然而卵巢癌细胞对顺铂存在耐药导致患者5年生存率仍偏低。目前导致卵巢癌细胞对顺铂产生耐药的具体分子机制并不十分清楚,近年广泛关注细胞信号通路和转录因子的功能。有研究发现抗凋亡蛋白Bcl-2 和Bcl-XL在卵巢癌耐药细胞中表达水平较敏感细胞明显上调,并通过下调细胞凋亡过程中最主要的终末剪切酶caspase-3的表达而参与卵巢癌细胞的顺铂耐药过程[11]。George等[2]报道Src激酶活性的抑制可以增加细胞对化疗药物顺铂或紫杉醇的敏感性,并可扭转耐药细胞对紫杉醇的抗药性。Lee等[3]也证实PI3K/AKT信号通路参与卵巢癌细胞的耐药过程。在卵巢癌耐顺铂细胞株OVCAR-3/CDDP的AKT磷酸化水平明显高于其亲代细胞株OVCAR-3,同时顺铂处理可抑制亲代细胞株中AKT磷酸化水平,而在耐药的卵巢癌细胞中却无此作用。另外,PI3K活性抑制剂可以明显提高顺铂对耐药细胞株诱导的细胞凋亡。
人类β-catenin基因又名β-catenin1,定位于染色体3q21。一方面β-catenin与钙依赖性跨膜糖蛋白E钙黏蛋白(E-cadherin)的胞内段结合介导细胞间黏附、迁移等功能,对上皮极性和完整性的维持起重要作用;另一方面β-catenin参与Wnt通路的信号传导,在调控细胞生长和肿瘤发生中发挥着重要作用。本研究发现β-catenin卵巢癌耐药细胞系中蛋白水平较敏感细胞系明显上调。β-catenin基因沉默后,卵巢癌耐药细胞C13K、SKOV-3对顺铂敏感性显著增高,并同时伴随着凋亡细胞数的增加。以上结果提示抑制β-catenin的表达可能通过促进细胞凋亡实现,从而增加了耐药卵巢癌细胞对顺铂的敏感性。
p53是重要的肿瘤抑制基因,该基因的突变或缺失是导致许多肿瘤发生的原因,同时p53可参与细胞凋亡过程而介导耐药,而顺铂诱导肿瘤细胞凋亡是发挥其抗肿瘤作用的重要机制。目前已有研究发现顺铂可以通过诱导p53/Bax途径,启动线粒体凋亡途径而杀伤卵巢癌细胞[12]。笔者前期的机制研究发现,在β-catenin表达沉默的细胞中,顺铂处理可以促进细胞凋亡的相关分子p53和caspase-3的表达的增高,提示p53/caspase-3信号通路可能参与了卵巢癌细胞的耐药机制。
[1]Guo Y,Xu F,Lu T,et al.Interleukin-6 signaling pathway in targeted therapy for cancer[J].Cancer Treat Rev,2012,38(7):904-910.
[2]George JA,Chen T,Taylor CC.SRC tyrosine kinase and multidrug resistance protein-1 inhibitions act independently but cooperatively to restore paclitaxel sensitivity to paclitaxel-resistant ovarian cancer cells[J].Cancer Res,2005,65(22):10381-10388.
[3]Lee S,Choi EJ,Jin C,et al.Activation of PI3K/Akt pathway by PTEN reduction and PIK3CA mRNA amplification contributes to cisplatin resistance in an ovarian cancer cell line[J].Gynecol Oncol,2005,97 (1):26-34.
[4]Kielman MF,Rindapää M,Gaspar C,et al.Apc modulates embryonic stem-cell differentiation by controlling the dosage of β-catenin signaling[J].Nat Genet,2002,32(4):594-605.
[5]Xu MX,Zhao L,Deng C,et al.Curcumin suppresses proliferation and induces apoptosis of human hepatocellular carcinoma cells via the wnt signaling pathway[J].Int J Oncol,2013,43(6):1951-1959.
[6]Bilir B,Kucuk O,Moreno CS.Wnt signaling blockage inhibits cell proliferation and migration,and induces apoptosis in triple-negative breast cancer cells[J].J Transl Med,2013,11:280-292.
[7]Zhao L,Li W,Zang W,et al.JMJD2B promotes epithelialmesenchymal transition by cooperating with β-catenin and enhances gastric cancer metastasis[J].Clin Cancer Res,2013,19(23):6419-6429.
[8]Xu N,Shen C,Luo Y,et al.Upregulated miR-130a increases drug resistance by regulating RUNX3 and Wnt signaling in cisplatintreated HCC cell[J].Biochem Biophys Res Commun,2012,425(2):468-472.
[9]Teng Y,Wang X,Wang Y,et al.Wnt/beta-catenin signaling regulates cancer stem cells in lung cancer A549 cells[J].Biochem Biophys Res Commun,2010,392(3):373-379.
[10]Flahaut M,Meier R,Coulon A,et al.The Wnt receptor FZD1 mediates chemoresistance in neuroblastoma through activation of the Wnt/beta-catenin pathway[J].Oncogene,2009,28(23):2245-2256.
[11]Yang X,Zheng F,Xing H,et al.Resistance to chemotherapy-induced apoptosis via decreased caspase-3 activity and overexpression of antiapoptotic proteins in ovarian cancer[J].J Cancer Res Clin Oncol,2004,130(7):423-428.
[12]Cheng JQ,Jiang X,Fraser M,et al.Role of X-linked inhibitor of apoptosis protein in chemoresistance in ovarian cancer:possible involvement of the phosphoinositide-3 kinase/Akt pathway[J].Drug Resist Updat,2002,5(3/4):131-146.
The Effect of β-catenin on Cisplatin Resistance in Human Ovarian Cancer Cells
LIAO Dan,LIU Rui,ZENG Han-qing.
Department of Obstetrics and Gynecology(LIAO Dan),Department of General Surgery(LIU Rui),Nada Hospital of Hainan State Farms,Danzhou 571700,Hainan Province,China;Department of Hematology,The Second Affiliated Hospital of Chongqing Medical University,Chongqing400016,China(ZENGHan-qing)
LIAO Dan,E-mail:liaodancq1981@163.com
2014-02-24)
[本文编辑秦娟]
571700海南省儋州市农垦那大医院妇产科(廖丹),普外科(刘睿);重庆医科大学附属第二医院血液内科(曾瀚庆)
廖丹,E-mail:liaodancq1981@163.com

