血管内皮生长因子基因与子宫内膜异位症
金志兴,朱芝玲,王莉
·综述·
血管内皮生长因子基因与子宫内膜异位症
金志兴,朱芝玲△,王莉△
子宫内膜异位症(EMs)是一种病因未明,严重影响妇女生活的疾病。血管内皮生长因子(VEGF)可影响子宫内膜异位症的发生、发展,而VEGF基因中至少有30个单核苷酸具有多态性,目前学者们对-460 C/T、+405 G/C(也称为-634 G/C)、+936 C/T、-1154 G/A和-2578 A/C等的研究较多,这些位点可能通过影响VEGF的表达从而影响EMs。VEGF基因调控主要在转录及转录后水平,受药物、体内环境、体外环境等诸多因素的影响,其具体调控机制目前大多尚未明了。研究VEGF基因多态性及其调控途径以及对EMs的影响,将有助于学者们对EMs的发病机制作进一步了解,为探索治疗EMs的新方法提供思路。
子宫内膜异位症;血管内皮生长因子类;基因表达;基因
【Abstract】Endometriosis seriously impacts on women′s life,whose etiology is still unknown.Vascular endothelial growth factor(VEGF)may affect the occurrence and development of endometriosis.VEGF gene has at least 30 single nucleotide polymorphisms,of which-460 C/T,+405 G/C(also known as-634 G/C),+936 C/T,-1154 G/A and-2578 A/C are more studied.These sites may impact on the development of endometriosis by influencing production of VEGF.The main gene regulation level of VEGF is in transcription and post-transcription,whose specific regulatory mechanism is not clear,and it can be affected by many factors,such as drugs,in vivo environment and in vitro environment.Research on the influence of VEGF gene polymorphisms and its regulation pathways on endometriosis will help scholars understanding the pathogenesis of endometriosis more so as to provide ideas of new ways to treat endometriosis.
【Keywords】Endometriosis;Vascular endothelial growth factors;Gene expression;Genes
(J Int Obstet Gynecol,2015,42:29-32)
子宫内膜异位症(EMs)是一种多因素(环境、基因、免疫等)共同作用所致的性激素依赖的妇科疾病,表现为具有生长能力及一定功能的子宫内膜组织(腺体或间质)出现在子宫腔被覆内膜和宫体肌层以外的其他部位。EMs影响10%的育龄妇女,其主要临床表现为慢性盆腔疼痛、痛经、不孕等。这些症状给患病妇女带来了严重的生理和心理的痛苦。尽管有关EMs的研究很多,但迄今为止,其发病机制仍未明确。目前公认的机制有经血逆流学说、内膜种植学说和机体免疫应答系统异常学说。郎景和教授提出经血逆流的“3A”模式,即逆流进入腹腔的子宫内膜组织在腹腔内种植、生长和转移必须通过黏附、侵袭、血管生成才能完成。现已有许多研究证明,血管生成在EMs的发生发展中起着重要的作用。血管内皮生长因子(VEGF)是血管形成中最重要的细胞因子之一,其能诱导内皮细胞的增殖、迁移、分化以及毛细血管的形成,为异位病灶的存活提供血液支持。因此研究VEGF基因多态性及其调控有助于学者们对EMs发病机制作进一步了解,也有利于探索治疗EMs的新方法。现就近些年来对VEGF基因多态性及其调控与EMs的研究作一综述。
1 VEGF
VEGF是由2条分子质量各为24 ku的单链以二硫键组成的高度保守的同源二聚体糖蛋白。VEGF 有6个亚型,即VEGF-A,-B,-C,-D,-E及胎盘生长因子(PIGF),其分子质量从35 ku至44 ku不等。其中,VEGF-A最常见,其产生受细胞因子、激素、生长因子和缺氧等因素的调控。VEGF能结合于酪氨酸激酶受体家族,且结合于不同的受体有不同的活性。其最常结合于VEGF受体1和VEGF受体2(又称受体Flt-1和KDR),导致二聚体的形成,从而引发受体磷酸化和活化下游的蛋白激酶级联反应。
VEGF的主要功能是刺激血管内皮细胞的增殖、迁移;通过诱导纤溶酶原激活物、纤溶酶原激活物受体及抑制因子的合成与释放,改变血管内皮细胞外基质,促使外周基质和血管基底膜降解,从而增加血管的通透性。由此可以看出,VEGF在血管的形成中具有关键作用。
2 VEGF基因多态性与EMs
Bellelis等[1]的研究表明约5.3%的EMs患者的一级亲属有EMs病史,这种家族聚集性与此病在同卵双生患者中的发病情况具有高度一致性,这提示基因因素在EMs的发病过程中起到了重要作用。VEGF基因定位在6p21.3染色体,由8个外显子组成,通过选择性剪切过程从而转录翻译成几种不同的蛋白质。具有生物效应的VEGF调控主要在转录及转录后水平。人VEGF基因启动子的长段已被克隆出来,几个重要的顺式调控元件也已经绘出,见图1。
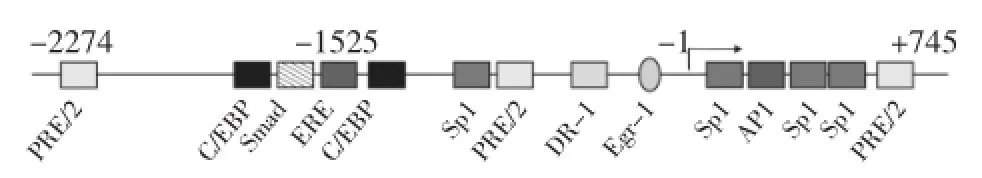
图1 人VEGF基因主要的顺式调控元件示意图
VEGF基因至少涉及30个单核苷酸多态性。为探究VEGF基因多态性与EMs患病风险的关系,许多学者利用聚合酶链反应(PCR)测序及限制性内切酶片段长度多态性(RFLP)方法,分别对不同国家的EMs患者进行了研究,这些研究主要集中在VEGF基因位点-460 C/T(rs833061)、+405 G/C(又称为-634 G/C,rs2010963)、+936 C/T(rs3025039)、-1154 G/A (rs1570360)和-2578 A/C(rs699947)上的单核苷酸多态性上。
2.1-460 C/T目前对EMs患者-460 C/T位点的多态性研究较多见,但结论并不统一,大多数学者认为-460 C/T的多态性与EMs患病风险无明显相关性,而Goralczyk等[2]对中国台湾人和波兰人-460 C/ T位点的研究显示,该基因位点多态性与EMs患病风险相关,而且其进一步研究认为TT纯合子和T等位基因与EMs的高患病风险相关,杂合子和C等位基因与EMs的低患病风险相关。
2.2+405 G/C对于+405 G/C的多态性与EMs患病风险是否相关的研究,目前也尚未有统一意见。在认为+405 G/C的多态性与EMs患病风险相关的研究中,Attar等[3]对112例土耳其妇女的研究认为,基因型为+405 CC的患者要比正常人多2~3倍的患病风险,而基因型为+405GC与+405GG者的患病风险要比正常人低,说明基因型+405 CC与EMs高患病风险相关,而+405GC与+405GG可能是作为一种使机体患病风险降低的保护性基因型。Emamifer等[4]对1 080例北伊朗妇女的研究证实了上述结论。但Altinkaya等[5]对192例土耳其EMs患者进行了研究,认为+405GC和+405GG与EMs的高患病风险相关,与上述结论不一致。此外,该研究还发现,相对于正常人,基因型+405GG在异位病灶>3 cm的妇女中更为常见。
2.3+936 C/T对于+936 C/T的多态性与EMs患病风险的研究,不同的调查者得出的结论不同。如Xu等[6]对11项相关研究的2 690例患者和2 803例正常对照进行Meta分析认为:EMs患病风险与+936 C/T的多态性相关,且两者的关联强度在Ⅲ~Ⅳ期患者中表现得更为明显。而Cosín等[7]对186例患EMs白种人和180例健康白种人的+936 C/T位点进行比较后,认为两者并不相关。
2.4-1154 G/A对-1154 G/A基因多态性与EMs患病风险的研究较上述3个基因位点少,且结论存在差异。Li等[8]对2012—2013年40项相关研究的3 313例患病妇女和3 393例健康对照者进行Meta分析发现,-1154 G/A的多态性与妇女EMs患病风险相关,且-1154 G/A基因多态性作为一种保护因素,能降低EMs的患病风险。但Rotman等[9]对42例美国妇女的研究则认为-1154 G/A的多态性与妇女EMs患病风险无相关性。
2.5-2578 A/C多数研究认为-2578 A/C基因多态性与EMs低患病风险相关,但是等位基因-2578 A还是-2578 C在EMs发病过程中起保护作用,目前尚不明确。而Liang等[10]对11项相关研究进行Meta分析则认为-2578 A/C基因多态性与EMs的患病风险不相关。
2.6单倍型除上述这些对VEGF各个基因位点多态性的研究分析之外,还有研究对VEGF的不同单倍型进行了研究。较为明确的结论是:VEGF的-2578/-460/+405与-2578/-1154/+405单倍型与EMs患病风险无关;-460C/-1154A/-2578A、-460T/ -1154A/-2578A、-460T/-1154A/-2578C、-460T/-1154G/ -2578C单倍型会降低EMs的患病风险,而-460C/ -1154A/-2578C单倍型则会使EMs的患病风险升高。
从上述对VEGF各个基因位点及单倍型多态性的研究中可以发现,不同的研究者得出的结论并不完全相同,甚至完全相反。究其原因,调查对象的地域或种群不同、研究样本大小不同、EMs患病者的个体差异等因素可能造成调查结果的差异,但这并不否认VEGF基因多态性与EMs发病之间的密切联系,故在今后的研究中应尽可能消除样本量大小和个体差异对调查结果造成的影响。
3 VEGF基因调控与EMs
VEGF基因调控主要在转录及转录后水平。在EMs中,VEGF基因的表达可受药物、体内环境、体外环境等诸多因素的调控,但这些因素具体如何调控VEGF基因表达目前大多尚未明确。部分学者对此进行探索性研究,取得了一些进展。如Huang等[11]通过体外培养人子宫内膜干细胞研究白细胞介素1β(IL-1β)刺激VEGF表达的机制,发现IL-1β能诱导环氧合酶2(COX-2)的表达,该过程可以被丝裂原活化蛋白激酶(MAPK)途径抑制剂p38所抑制,说明IL-1β诱导COX-2的表达是通过MAPK途径起作用的;而IL-1β诱导的VEGF增加可被COX-2的特异性抑制剂NS938所抑制,说明IL-1β诱导VEGF的增加可通过COX-2信号途径被阻断。由此可以看出,IL-1β对VEGF或COX-2的作用都与MAPK信号途径相关。说明不仅VEGF与VEGF受体结合可激活下游的MAPK信号途径,在EMs中,VEGF基因调控也与MAPK信号途径有关。
3.1药物对VEGF基因的调控Mueller等[12]在将人子宫内膜细胞进行体外培养发现,雌激素能够诱导VEGF mRNA的产生,使其增加3~5倍,这与VEGF基因转录起始位点上游-1 525 bp雌激素反应元件的多态性有关。在大鼠中,雌激素在不同位点的共同作用下同样能诱导VEGF的产生。这些研究都证实了雌激素在EMs的发生、发展中起重要作用,故临床上常使用促性腺激素释放激素类似物(GnRH-a)降低雌激素的分泌,从而减小EMs异位病灶的体积并减少其血液供应。Huang等[13]用不同浓度的GnRH-II(GnRH两种亚型之一)培养EMs患者异位、在位内膜细胞和正常人的内膜细胞时发现,3种细胞分泌VEGF水平呈剂量依赖性下降,且患者异位内膜细胞的VEGF分泌水平比患者在位内膜细胞和正常人的内膜细胞下降更明显,证明雌激素对异位内膜细胞的影响更大。
还有研究发现,Activin A能调节正常在位内膜分泌IL-8和VEGF,破坏正常在位内膜中Activin A的表达使EMs的患病风险增加[14]。罗咪酯肽能作用于VEGF基因的转录水平从而降低VEGF的表达,同时其还能降低在加入氯化钴模拟的缺氧环境下产生的缺氧诱导因子1α(HIF-1α)的表达水平,而HIF-1α能够影响VEGF基因转录[15]。Sevket等[16]还发现,生长抑素类似物(奥曲肽、兰瑞肽)能够通过降低基质金属蛋白酶9(MMP-9)和VEGF的表达水平使子宫内膜异位灶萎缩减小。上述物质均能通过调控VEGF基因的表达而对EMs起作用,但具体的调控机制尚不明了。
3.2外界环境对VEGF基因的调控早期研究发现灵长类动物在暴露于外源性内分泌干扰物二恶英的环境下,EMs患病率增加,这说明接触二恶英与EMs的形成有关。二恶英结合并激活芳香烃受体(AHR),从而导致下游基因的转录。尽管结合了配体的AHR对VEGF基因启动子的直接作用少见报道,但有间接证据表明,结合了配体的AHR可激活子宫内膜上皮细胞上的胎盘蛋白,而胎盘蛋白能刺激子宫内膜上皮细胞上VEGF的表达[17]。Xu等[18]研究绿茶提取物中主要成分——表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)在体外对EMs的作用时发现,EGCG能抑制EMs异位灶植入过程中微血管的形成,该作用是通过c-Jun、γ干扰素(IFN-γ)、MMP-9和趋化因子配体信号介导从而选择性抑制VEGF-C和VEGF受体2的表达来实现的。
3.3腹腔内环境对VEGF基因的调控VEGF的表达与EMs患者的腹腔内环境(例如缺氧、酸中毒、前列腺素E2及炎症细胞因子IL-1β)有密切的联系。Braza-Boïls等[19]将人异位子宫内膜细胞分别放在EMs患者腹水和正常人腹水中进行培养,通过逆转录聚合酶链反应(RT-PCR)技术观察6种miRNA (miR-16、-17-5p、-20a、-125a、-221和-222)的表达,然后分别应用RT-PCR和酶联免疫吸附试验(ELISA)检测VEGF mRNA和VEGF的表达,发现子宫内膜细胞的3种miRNA在EMs腹水中培养的表达量均低于正常腹水,而VEGF mRNA和VEGF的表达量则高于正常腹水,说明EMs患者腹腔内环境的改变可能通过调节miRNA的表达来影响EMs中血管的形成。
3.4内皮抑素基因对VEGF基因的调控Zhang等[20]向异位病灶注射转染了内皮抑素基因的质粒脂质体,与未处理组相比,其能增加内皮抑素的mRNA和蛋白质的表达水平,显著降低血清VEGF的表达水平以及缩小病灶,而且该研究进一步证实了血清VEGF与血清内皮抑素显著呈负相关。因此,恢复体内内皮抑素基因的表达可以为EMs的治疗提供一条新途径。
4 总结与展望
综上所述,VEGF基因的多态性和基因调控与EMs的发病密切相关。由于受调查对象的地域或种群、研究样本大小、EMs患病者的个体差异等因素的影响,目前研究较多的VEGF基因位点(-460 C/T、+405 G/C、+936 C/T、-1154 G/A和-2578 A/C)多态性与EMs患病风险之间是否紧密相关尚有争议,因此尚待大量针对不同种族的大样本研究,以便为EMs的基因治疗提供靶点。在EMs中,VEGF基因调控主要受药物、体内及体外环境等因素的影响,对这方面的研究有助于进一步阐明VEGF的基因调控途径,以便更清楚地了解EMs的发病过程,从而为临床治疗提供新思路。
[1]Bellelis P,Dias JA Jr,Podgaec S,et al.Epidemiological and clinical aspects of pelvic endometriosis—a case series[J].Rev Assoc Med Bras,2010,56(4):467-471.
[2]Goralczyk B,Smolarz B,Romanowicz H,et al.Single nucleotide polymorphisms of VEGF gene in endometriosis[J].Pol Merkur Lekarski,2012,32(189):151-153.
[3]Attar R,Agachan B,Kuran SB,et al.Genetic variants of vascular endothelialgrowthfactorandriskforthedevelopmentof endometriosis[J].In Vivo,2010,24(3):297-301.
[4]Emamifar B,Salehi Z,Mehrafza M,et al.The vascular endothelial growth factor(VEGF)polymorphisms and the risk of endometriosis in northern Iran[J].Gynecol Endocrinol,2012,28(6):447-450.
[5]Altinkaya SO,Ugur M,Ceylaner G,et al.Vascular endothelial growth factor+405 C/G polymorphism is highly associated with an increased risk of endometriosis in Turkish women[J].Arch Gynecol Obstet,2011,283(2):267-272.
[6]Xu S,Wu W,Sun H,et al.Association of the vascular endothelial growth factor gene polymorphisms(-460C/T,+405G/C and+936T/ C)with endometriosis:a meta-analysis[J].Ann Hum Genet,2012,76(6):464-471.
[7]Cosín R,Gilabert-Estellés J,Ramón LA,et al.Vascular endothelial growth factor polymorphisms(-460C/T,+405G/C,and 936C/T)and endometriosis:their influence on vascular endothelial growth factor expression[J].Fertil Steril,2009,92(4):1214-1220.
[8]Li YZ,Wang LJ,Li X,et al.Vascular endothelial growth factor gene polymorphisms contribute to the risk of endometriosis:an updated systematic review and meta-analysis of 14 case-control studies[J].Genet Mol Res,2013,12(2):1035-1044.
[9]Rotman C,Fischel L,Cortez G,et al.A search to identify genetic risk factors for endometriosis[J].Am J Reprod Immunol,2013,69(1):92-95.
[10]Liang S,Huang Y,Fan Y.Vascular endothelial growth factor gene polymorphisms and endometriosis risk:a meta-analysis[J].Arch Gynecol Obstet,2012,286(1):139-146.
[11]Huang F,Cao J,Liu Q,et al.MAPK/ERK signal pathway involved expression of COX-2 and VEGF by IL-1β induced in human endometriosis stromal cells in vitro[J].Int J Clin Exp Pathol,2013,6 (10):2129-2136.
[12]Mueller MD,Vigne JL,Minchenko A,et al.Regulation of vascular endothelial growth factor(VEGF)gene transcription by estrogen receptors alpha and beta[J].Proc Natl Acad Sci U S A,2000,97 (20):10972-10977.
[13]Huang F,Wang H,Zou Y,et al.Effect of GnRH-II on the ESC proliferation,apoptosisandVEGFsecretioninpatientswith endometriosis in vitro[J].Int J Clin Exp Pathol,2013,6(11):2487-2496.
[14]Rocha AL,Carrarelli P,Novembri R,et al.Activin A stimulates interleukin 8 and vascular endothelial growth factor release from cultured human endometrial stromal cells:possible implications for the pathogenesis of endometriosis[J].Reprod Sci,2012,19(8):832-838.
[15]Imesch P,Samartzis EP,Schneider M,et al.Inhibition of transcription,expression,and secretion of the vascular epithelial growth factor in human epithelial endometriotic cells by romidepsin[J].Fertil Steril,2011,95(5):1579-1583.
[16]Sevket O,Sevket A,Molla T,et al.Somatostatin analogs regress endometriotic implants in rats by decreasing implant levels of vascular endothelial growth factor and matrix metaloproteinase 9[J].Reprod Sci,2013,20(6):639-645.
[17]Mueller MD,Vigne JL,Streich M,et al.2,3,7,8-Tetrachlorodibenzo-p-dioxin increases glycodelin gene and protein expression in human endometrium[J].J Clin Endocrinol Metab,2005,90(8):4809-4815.
[18]Xu H,Becker CM,Lui WT,et al.Green tea epigallocatechin-3-gallate inhibits angiogenesis and suppresses vascular endothelial growth factor C/vascular endothelial growth factor receptor 2 expression and signaling in experimental endometriosis in vivo[J].Fertil Steril,2011,96(4):1021-1028.
[19]Braza-Boïls A,Gilabert-Estellés J,Ramón LA,et al.Peritoneal fluid reduces angiogenesis-related microRNA expression in cell cultures ofendometrialandendometriotictissuesfromwomenwith endometriosis[J].PLoS One,2013,8(4):e62370.
[20]Zhang TT,Fang XL,Gang J.Endostatin gene therapy for endometriosis in rats[J].J Int Med Res,2012,40(5):1840-1849.
Vascular Endothelial Growth Factor Gene and Endometriosis
JIN Zhi-xing,ZHU Zhi-ling,WANG Li.
Obstetrics and Gynecology Hospital of Fudan University,Shanghai 200011,China
ZHU Zhi-ling,E-mail:zhilingzhu888@126.com;WANG Li,E-mail:wanglisa1101@163.com
2014-08-14)
[本文编辑王昕]
国家自然科学基金(30901942)
200011上海,复旦大学附属妇产科医院
朱芝玲,E-mail:zhilingzhu888@126.com;王莉,E-mail:wanglisa1101@163.com
△审校者

