响应面分析法优化火棘果中原花青素提取工艺
吴 伟,曾倩兰,向 福*
(1.大别山特色资源开发湖北省协同创新中心,湖北黄州438000;2.湖北理工学院医学院,湖北黄石435003;3.黄冈师范学院生命科学学院,湖北黄州438000)
响应面分析法优化火棘果中原花青素提取工艺
吴伟1,2,曾倩兰2,向福1,3*
(1.大别山特色资源开发湖北省协同创新中心,湖北黄州438000;2.湖北理工学院医学院,湖北黄石435003;3.黄冈师范学院生命科学学院,湖北黄州438000)
为了优化火棘果中原花青素的提取工艺,基于单因素试验的结果,采用响应面分析法探讨提取温度、乙醇体积分数、料液比、提取时间和提取次数对原花青素提取率的影响,确定火棘果中原花青素最佳提取工艺。结果表明,最佳提取条件为提取温度70℃、乙醇体积分数70%、提取料液比1∶20(g∶mL)、提取时间4.0 h、提取3次,在此提取工艺条件下,所得原花青素的提取率为5.74%,与理论提取率接近。
响应面分析法;火棘果;原花青素;提取
火棘(Pyracantha fortuneana)又称火把果、救军粮,为蔷薇科火棘属植物,属于常绿灌木[1]。火棘资源丰富,具有较高的观赏价值,其果实具有很高的食用价值和药用价值[2-3]。火棘果为原料的保健果酒、饮料等已经在市面上有售。火棘的药用在《滇南本草》、《本草纲目》等都有记载[4]。根主治虚劳骨蒸、湿热痹痛、月经不调、跌打损伤等症状;果实主治脾胃虚弱、消化不良、泄泻、痢疾、疳积、崩漏、白带、产后腹痛等病症;叶主治血崩及贫血、闭经和爆发性火眼、外敷治疗疮殇肿毒[5]。
原花青素(proanthocyanidins,PC)是含双黄酮衍生物的天然多酚化合物的总称,是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂之一[6-7]。一般为红棕色粉末,气微、苦涩,溶于水和大多数有机溶剂。原花青素分布广泛,主要存在于植物的根、茎、叶、皮、壳等,低聚原花青素广泛存在于各种水果的皮、核、梗中[8]。原花青素是一种新型高效抗氧化剂,是目前为止所发现的最有效的自由基清除剂,具有非常强的体内活性[9]。
响应面分析法是目前最常用的工程类优化方法,它是基于统计学的综合实验技术,来解决复杂系统变量与相应之间关系的一种方法,通过对所需分析的相应受多个变量影响的问题进行建模和分析,从而优化该响应[10]。所以,响应面优化法广泛应用于生物工程、食品工程以及其他工程领域的过程优化[11-12]。目前对火棘果的研究主要集中在营养成分、功效方面,对其有效成分如原花青素的的有效提取鲜有报道。本研究在单因素的基础上,利用响应面优化试验对火棘果中原花青素提取工艺条件进行优化,确定最佳的提取工艺条件,为充分利用火棘果资源提供理论依据。
1 材料与方法
1.1材料与试剂
火棘果:采自湖北理工学院植物园,粉碎后保存备用。
无水乙醇(分析纯):武汉市洪山中南化工试剂有限责任公司;儿茶素标准品(色谱纯):上海金穗生物科技有限公司;香草醛(分析纯):湖南湘中地质实验研究所;石油醚(分析纯):天津市凯通化学试剂有限公司;甲醇(分析纯):武汉市洪山中南化工试剂有限责任公司;盐酸(分析纯):中平能化集团开封东大化工有限公司试剂厂。
1.2仪器与设备
YP6002电子天平:上海佑科仪器仪表有限公司;SCQ-450超声波清洗器:上海盛普机械制造有限公司;DHG-9140A电热恒温鼓风干燥箱:上海姚氏仪器设备厂;RE-3000旋转蒸发器、SHZ-Ⅲ循环水真空泵:上海亚荣生化仪器厂;SF-130C万能粉碎机:吉首市中诚制药机械厂;752SP紫外-可见分光光度计:上海元析仪器有限公司;HWS26水浴锅:上海一恒科学有限公司;AL204电子天平:梅特勒-托利多仪器(上海)有限公司。
1.3实验方法
1.3.1儿茶素标准曲线的制备[13]
分别吸取质量浓度1.0 mg/mL的儿茶素标准液各0.125 mL、0.250mL、0.375mL、0.500mL、0.625mL、0.750mL、0.875 mL、1.000 mL至25 mL容量瓶中,用甲醇溶液稀释成质量浓度分别为0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20mg/mL、0.25mg/mL、0.30mg/mL、0.35mg/mL、0.40mg/mL,摇匀,再分别加入15 mL 4 g/100 mL香草醛-甲醇溶液和7.5 mL浓盐酸,定容,混匀。在30℃水浴避光反应30 min后,用甲醇代替标准品作空白对照,于波长500 nm处测定吸光度值,以儿茶素质量浓度(x)为横坐标,对吸光度值(y)为纵坐标,绘制儿茶素标准曲线。
1.3.2样品溶液的制备与含量测定
将火棘果磨粉过筛后,称取1 g火棘果粉末,置于圆底烧瓶中,加入适量的乙醇,在一定温度和时间下提取,将滤渣再次在相同的条件下提取。合并滤液,减压浓缩,得到样品溶液。
根据儿茶素标准曲线回归方程计算出原花青素含量,并计算原花青素的提取率。原花青素的提取率计算公式如下:

1.3.3单因素试验
分别考察乙醇体积分数(65%、70%、75%、80%、85%、90%)、提取温度(60℃、65℃、70℃、75℃、80℃)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL))、提取时间(2.0 h、2.5 h、3.0 h、3.5 h、4.0 h、4.5 h、5.0 h)和提取次数(1、2、3、4、5)对火棘果中原花青素提取率的影响。
1.3.4响应面分析试验
在单因素试验的基础上,根据Box-Behnken的中心组合试验设计原理,采用响应面分析法对火棘果中原花青素提取工艺进行优化,选取提取温度(X1)、乙醇体积分数(X2)、料液比(X3)3个因素为自变量,以原花青素提取率(Y)为响应面值,并以1、0、-1分别代表自变量的高中低水平,响应面试验设计因素与水平如表1所示。

表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiments design
2 结果与分析
2.1儿茶素标准曲线的绘制
以儿茶素质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制儿茶素标准曲线,结果如图1所示。
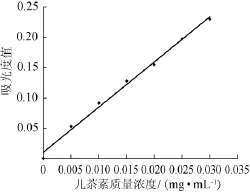
图1 儿茶素标准曲线Fig.1 Standard curve of catechin
由图1可知,儿茶素标准曲线回归方程为y=7.45x+ 0.010 5,决定系数R2=0.993 4,表明儿茶素质量浓度与吸光度值呈良好的线性关系。
2.2单因素试验结果
2.2.1乙醇体积分数对火棘果中原花青素提取率的影响
乙醇体积分数对火棘果中原花青素提取率的影响结果见图2。
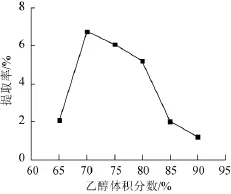
图2 乙醇体积分数对原花青素提取率的影响Fig.2 Effect of ethanol concentration on the procyanidins extraction rate
由图2可得,当乙醇体积分数为65%~70%时,随着乙醇体积分数的变大,原花青素的提取率增大;在乙醇体积分数为70%时,原花青素的提取率最大,为6.762 1%;当乙醇体积分数>70%后,随着乙醇体积分数的增大,提取率变小。这可能是由于“相似相溶”原理,当溶剂的极性与原花青素的极性相近时,原花青素的提取率达到最大。因此,选取最佳提取乙醇体积分数为70%。
2.2.2提取温度对原花青素提取率的影响
提取温度对原花青素提取率的影响结果见图3。
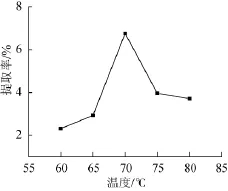
图3 提取温度对原花青素提取率的影响Fig.3 Effect of extraction temperature on the procyanidins extraction rate
由图3可得,当提取温度从60℃升至70℃时,随着提取温度的升高,原花青素的提取率变大;当温度达到70℃时,提取率达到最大,为6.721 4%;当提取温度>70℃后,提取率随着提取温度的升高而减小,但提取率比提取温度在60℃时高,可能是因为随着提取温度的升高,原花青素中热不稳定的成分分解[14]。故选最佳提取温度在70℃。
2.2.3料液比对原花青素提取率的影响
料液比对原花青素提取率的影响结果见图4。

图4 料液比对原花青素提取率的影响Fig.4 Effect of ratio of solid to liquid on the procyanidins extraction rate
由图4可得,当料液比为1∶15~1∶20(g∶mL)时,随着料液比的增大,原花青素的提取率变大,溶剂增加后,随着细胞破裂加剧,原花青素迅速进入溶剂;当料液比达到1∶20(g∶mL)时,提取率达到最大,为6.744 2%,原花青素浓度达到饱和;当料液比超过1∶20(g∶mL)后,随着料液比的增大,提取率变小,原花青素达到饱和后反而抑制其从细胞的渗出。故取最佳选料液比在1∶20(g∶mL)。
2.2.4提取时间对原花青素提取率的影响
提取时间对原花青素提取率的影响结果见图5。

图5 提取时间对原花青素提取率的影响Fig.5 Effect of extraction time on the procyanidins extraction rate
由图5可得,当提取时间为2.0~4.0 h时,随着提取时间的延长,原花青素的提取率增大;当提取时间达到4.0 h时,提取率达到最大,为6.751 3%;当提取时间超过4.0 h后,随着提取时间的延长,提取率减小,可能是随着提取时间的延长,原花青素热不稳定的成分分解[15]。综合考虑选取提取时间4.0 h进行下一步的响应面优化试验。
2.2.5提取次数对原花青素提取率的影响

图6 提取次数对原花青素提取率的影响Fig.6 Effect of extraction times on the procyanidins extraction rate
由图6可得,随着提取次数的增多,提取率增大;当提取次数达到3次时,提取率达到最大,为6.712 8%,之后提取率变化不大。为了节约成本故取3次作为响应面试验提取条件。
2.3响应面试验结果
2.3.1响应面试验设计和结果
响应面试验设计及结果见表2。

表2 响应面试验设计及结果Table 2 Design and results of response surface experiments
利用Design Expert 8.0.6.1软件对表2数据进行二次多元回归拟合,得到原花青素提取率与提取温度(X1)、乙醇体积分数(X2)和料液比(X3)的二次多项回归方程:

2.3.2响应面回归模型方差分析
为了检验回归方程的有效性,对该数学模型进行回归方差分析显著性检验,结果见表3。
由表3可知,F值反映了各因子对响应值的重要性,F值越大(P值越小),表明该因素对响应值的影响越大。F(X2)>F(X1)>F(X3),说明3个影响因子对于原花青素提取率的影响强弱顺序为:乙醇体积分数>提取温度>料液比。而对于显著性,X12和X22对响应值极显著(P<0.000 1);而X1、X2和X32对响应值有显著影响(P<0.05)。虽然3因素的交互作用对于响应值的影响没有显著性,但它们与响应值之间的关系并不是简单的线性,响应值同时也受各因素的二次项的影响。模型的F值为45.49,P<0.000 1表明该模型具有高度的显著性,失拟项P值为0.648 2>0.05,说明该模型失拟项不显著,即该模型对于实验数据的拟合度较好。模型的校正决定系数R2Adj=0.961 6,说明该模型能解释96.16%响应值的变化,未计入回归方程的变量对火棘果中原花青素的提取效果影响比较小。相关系数R2=0.983 2,表示该模型拟合程度良好,实验的误差小,可以用该模型来分析和预测火棘果原花青素的提取率[16]。

表3 回归模型方差分析Table 3 Variance analysis of regression model
2.3.3响应面分析与优化
根据上述回归方程绘制出响应面分析图,以确认提取温度、乙醇体积分数和料液比3因素对火棘果中原花青素提取率的影响,响应面曲面和等高线见图7。

图7 提取温度、乙醇体积分数和料液比交互作用对原花青素提取率影响的响应曲面及等高线Fig.7 Response surface plots and contour line of effects of interaction between extraction temperature,alcohol concentration and solid-liquid ratio on procyanidins extraction rate on extraction efficiency
由图7可知,提取温度和乙醇体积分数对原花青素的提取率影响显著,因为提取温度和乙醇体积分数对应的曲面较陡,料液比对原花青素提取率影响作用较弱。等高线可以反映出交互作用的强弱,提取温度和乙醇浓度交互作用较强,因为它们交互作用的等高线图为椭圆形,相反,其相互作用的等高线图为圆形,故提取温度与料液比的交互作用以及乙醇体积分数与料液比的交互作用较弱。此外,响应面均为开口向下的凸面,乙醇体积分数、提取温度和料液比等3个因素与原花青素提取率基本呈抛物线关系,表面在试验区域内可以找出最优值。多元回归模型预测的最佳提取工艺条件为:乙醇体积分数70.60%,提取温度70.40℃,提取料液比1∶19.24(g∶mL),该条件下绿原酸提取率预测值为5.771 7%。
2.3.4验证试验结果
为了检验响应面模型的有效性,考虑到实际操作的方便性将各因素修正为提取温度70℃,乙醇体积分数70%,提取料液比1∶20(g∶mL),提取时间4.0 h,提取次数3次,在此修正条件下进行5次平行试验,得出实际提取率为5.74%。验证值与预测值相接近,说明该模型可以很好地反映出火棘果中原花青素提取条件,响应面优化回归模型对实际工艺操作具有一定的指导意义。
3 结论
本研究在单因素试验的基础上,利用Box-Behnken中心试验设计原理及响应面分析法确定了火棘果中原花青素最佳提取工艺条件:提取温度70℃,乙醇体积分数70%,提取料液比1∶20(g∶mL),提取时间4.0 h,提取次数3次,在此工艺条件下,测得原花青素的提取率为5.74%,与理论值相近,说明响应面法对火棘果中原花青素提取条件参数的优化是可行的,适合于提取火棘果中原花青素工业化生产。
[1]刘明华,王大红.火棘乳酸菌饮料的研制[J].中国酿造,2011,30(6):192-196.
[2]罗宝芳,王金妮,黄银妹,等.野生火棘研究进展[J].中国酿造,2014,33(2):1-4.
[3]蒋春兰,庄洋,朱定国,等.火棘果酒在酿制过程中化学成分及其抗氧化特性的变化[J].中国酿造,2013,32(8):80-83.
[4]翁文江,高雪.火棘果不同极性部位提取物体外抗氧化研究[J].食品工业科技,2015,36(1):77-80.
[5]黄荣,傅小红.火棘植物功能性成分研究进展[J].中国野生植物资源,2014,33(5):37-41.
[6]ARIGA T,HAMANO M.Radical scavenging action and its mode in procyanidins B-1 and B-3 from azuki beans to peroxyl radicals[J].Agr Biol Chem,1990,54(10):2499-2504.
[7]ARIGA T,KOSHIYAMA I,FUKUSHIMA D.Antioxidative properties of procyanidins B-1 and B-3 from azuki beans in aqueous systems[J]. Agr Biol Chem,1988,52(11):2717-2722.
[8]吕丽爽.天然抗氧化剂低聚原花青素的研究进展[J].食品科学,2002,23(2):147-149.
[9]孙传范.原花青素的研究进展[J].食品与机械,2010,26(4):146-148.
[10]SCHOTANUS M I J,FRANCHIN P,LUPOI A,et al.Seismic fragility analysis of 3D structures[J].Struct Saf,2004,26(4):421-441.
[11]赵志永,蒲彬,贺玉凤,等.响应面法优化新疆红枣总黄酮乙醇提取工艺[J].中国酿造,2012,31(1):88-90.
[12]马荣山,王艳平,穆晶.响应面法优化树莓酒流加发酵工艺[J].中国酿造,2011,11(11):86-89.
[13]魏玮,程秀玮.响应面法优化微波辅助提取茄子皮中原花青素工艺[J].中国酿造,2014,33(3):91-96.
[14]孙兰萍,许晖.天然火棘色素的提取及稳定性的研究[J].冷饮与速冻食品工业,2005,11(3):5-8.
[15]卫亚丽,杨江.野生火棘果红色素提取工艺优化[J].中国野生植物资源,2010,29(4):50-53.
[16]汪志慧,孙智达,谢笔钧.响应曲面法优化双酶法提取莲房原花青素[J].食品科学,2011,32(4):64-68.
Optimization of extraction process of procyanidins inPyracantha fortuneanafruit by response surface methodology
WU Wei1,2,ZENG Qianlan2,XIANG Fu1,3*
(1.Hubei Collaborative Innovation Center for the Characteristic Resources Exploitation of Dabie Mountains,Huangzhou 438000,China;2.Medical College,Hubei Polytechnic University,Huangshi 435003,China;3.College of Life Sciences,Huanggang Normal University,Huangzhou 438000,China)
To optimize the extraction process of procyanidins inPyracantha fortuneanafruit,on the base of single factor experiments,the effect of extraction temperature,alcohol concentration,solid-liquid ratio,extraction time and extraction times on procyanidins extraction rate was investigated by response surface methodology.The optimum extraction process of procyanidins inP.fortuneanafruit was determined.The results showed that the optimum extraction conditions were extraction temperature 70℃,ethanol concentration 70%,solid-liquid ratio 1∶20(g∶ml),extraction time 4.0 h,and extraction times 3.Under this conditions,the procyanidins extraction rate was 5.74%,which was approached to the theoretical value.
response surface methodology;Pyracantha fortuneanafruit;procyanidins;extraction
R284.2
A
0254-5071(2015)10-0116-05
10.11882/j.issn.0254-5071.2015.10.026
2015-09-11
大别山特色资源开发湖北省协同创新中心创新团队项目(2015TD07)
吴伟(1979-),男,副教授,博士,研究方向为生物技术药物。
向福(1977-),男,副教授,博士,研究方向为天然植物资源利用。

