制备氢氧化亚铁实验方案再探究
徐建飞+张平+杜淑贤
摘要:按教材实验,通过溶液反应得到的氢氧化亚铁沉淀往往由白色逐步变为灰绿色,最后变为红褐色。为能合理解释该实验现象,设计实验方案进行了探究及改进。结果表明:用硫酸亚铁溶液和氢氧化钠溶液反应制取氢氧化亚铁,新生成的氢氧化亚铁沉淀具有吸附性,可以吸附溶液中亚铁离子而显示灰绿色。采用在氢氧化钠溶液中加入硫酸亚铁(使溶液中没有过量Fe2+)和水浴加热(促使过量Fe2+水解)的方法,使得到的氢氧化亚铁是白色絮状沉淀。
关键词:氢氧化亚铁;制备;沉淀颜色;实验改进
文章编号:1005–6629(2015)7–0054–04 中图分类号:G633.8 文献标识码:B
1 课题的由来
1.1 化学教材对氢氧化亚铁实验的描述
通过资料检索和文献调查发现,制取氢氧化亚铁实验是中学化学和大学无机化学教学中一个非常重要的演示实验。在现行经教育部审定使用的中学化学教材和大学无机化学教材上都有制备氢氧化亚铁的演示实验。
中学化学教材上的描述:在试管中加入5mL氢氧化钠溶液,然后把吸有硫酸亚铁溶液的长滴管插入试管中氢氧化钠溶液的液面下,再慢慢挤出长滴管中硫酸亚铁溶液。
观察到的实验现象是:先产生白色沉淀,后变灰绿色,最后变红褐色。
原因是:生成的氢氧化亚铁不稳定,易被空气中的氧气氧化成氢氧化铁。所以,看到有灰绿色、红褐色等一系列的颜色变化。
在大学无机化学教材上对本实验的现象描述是:氢氧化钠与硫酸亚铁反应先生成白色沉淀,后很快变为灰绿色,最后变为红褐色。原因是生成的氢氧化亚铁不稳定,易被空气中的氧气氧化成氢氧化铁。
1.2 做制取氢氧化亚铁演示实验结果与教材上描述不一致
按教材上的顺序做硫酸亚铁溶液和氢氧化钠溶液反应制取氢氧化亚铁的实验时,通常只看到有大量浅绿色沉淀生成。在很长一段时间后看到试管中浅绿色悬浊液上方液面交界处有一圈红褐色。
2 课题的探究过程
2.1 对“白色沉淀、灰绿色沉淀、红褐色沉淀”组成的探究
查阅了很多资料后可知,对氢氧化亚铁是白色沉淀,氢氧化铁是红褐色沉淀没有歧义。但对灰绿色沉淀的组成有多种说法。
化学类学术期刊对浅绿色沉淀组成的描述主要有以下三种观点:
(1)张英锋老师发表在《化学教育》杂志上的“也谈灰绿色物质——绿锈的组成”一文中指出:“灰绿色物质是由氢氧化铁和氢氧化亚铁按一定比例组成的物质。[1]”
(2)李俊生老师发表在《化学教学》杂志上的“对灰绿色物质的组成及形成规律的再分析”一文中指出:“灰绿色物质是由氢氧化亚铁在大量硫酸根离子存在的情况下形成的Fe6(SO4)2(OH)4O2,这是一种氧基碱式复盐,是一种沉淀,也是一种配合物。[2]”
(3)李俊生老师发表在《中小学实验与装备》杂志上的“对一典型化学实验题的再分析”一文中又指出:“灰绿色物质是氢氧化亚铁的水合物。[3]”
第一种说法占主要地位,中学化学教材和大学无机化学教材中也认定“灰绿色沉淀是由氢氧化铁和氢氧化亚铁组成的混合物”(即氢氧化亚铁不稳定,易被空气中的氧气氧化为氢氧化铁)。
2.2 对“灰绿色沉淀”组成的实验验证与探究
2.2.1 对“灰绿色是由氢氧化亚铁在大量硫酸根离子存在的情况下形成的一种氧基碱式复盐”的实验验证与探究
为了验证“灰绿色是由氢氧化亚铁在大量硫酸根离子存在的情况下形成的一种氧基碱式复盐”的结论,根据控制变量法的原理,设计了下列对照实验:取三支试管分别滴入5mL氢氧化钠溶液,再用滴管按教材上演示实验方法分别滴入硫酸亚铁溶液、氯化亚铁溶液和硝酸亚铁溶液。实验结果如下表1所示。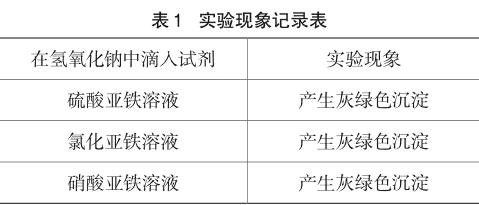
从上述对照实验现象可知,这种对灰绿色沉淀组成的解释是不正确的。因为后两组实验中没有硫酸根离子存在,但也是产生灰绿色沉淀,所以灰绿色沉淀不可能是“由氢氧化亚铁在大量硫酸根离子存在的情况下形成的一种氧基碱式复盐”。
2.2.2 对“灰绿色是由氢氧化铁和氢氧化亚铁组成的物质”的实验验证与探究
通过查阅资料发现[4],对“灰绿色沉淀是由氢氧化铁和氢氧化亚铁组成的物质”的说法是中学化学教材、大学无机化学教材和化学类期刊中的主要观点。它们得出这个结论的主要依据是氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁。所以显示的颜色是白色和红褐色的中间色——浅绿色、灰绿色等。
根据调色原理可知,白色和红褐色的调和色不可能是浅绿色、灰绿色,即灰绿色沉淀不可能是氢氧化亚铁和氢氧化铁的混合物。
所以,取一定量的灰绿色沉淀,先加入足量盐酸,看到灰绿色沉淀全部溶解,再加入硫氰化钾溶液,结果没有看到溶液变血红色,说明原来灰绿色沉淀中不含氢氧化铁。
由此得出,灰绿色沉淀不可能是由氢氧化亚铁被空气中氧气氧化后生成的氢氧化铁和氢氧化亚铁组成的混合物。即灰绿色沉淀与氢氧化铁无关。
2.2.3 对“灰绿色是氢氧化亚铁的水合物”的实验验证与探究
对“灰绿色是氢氧化亚铁的水合物”的结论,2012年,张旭旻老师在“氢氧化亚铁制备实验的研究”一文中认为氢氧化亚铁低温下会增加结晶水,并使颜色变绿,经水浴加热后会由绿变白,是失结晶水之故(该文获全国化学实验改进方案一等奖)。
2014年,刘彩红老师在《化学教学》杂志上的“氢氧化亚铁制备实验的设计”一文中也提及到氢氧化亚铁沉淀加热后会由绿变白[5]。
张旭旻老师和刘彩红老师的实验证明氢氧化亚铁沉淀在常温呈绿色,水浴加热后会变白色。他们对这个现象的解释是氢氧化亚铁低温下会增加结晶水,使颜色变绿,经水浴加热后会由绿变白,并有白色沉淀产生,其原因是失去了结晶水。
笔者认为她们的实验现象无误,但不能进一步证明她们的解释是否正确。因为氢氧化亚铁在水溶液中是否带有结晶水,没有经过定量分析和分子结构检测,无法证实或证伪。
2.3 对浅绿色的新猜想和实践探究
笔者的观点是:氢氧化亚铁是白色胶状沉淀,因吸附了溶液中浅绿色的亚铁离子,而使白色沉淀变成浅绿色。
如果笔者假设成立,教材上提供的制取氢氧化亚铁的步骤中把“氢氧化钠溶液加入硫酸亚铁溶液中”则不正确,应改为“把硫酸亚铁溶液加入氢氧化钠溶液中”。其原因有两点:(1)在氢氧化钠溶液加入硫酸亚铁溶液中,生成的氢氧化亚铁马上会吸附溶液中没有反应的大量亚铁离子,而使沉淀显浅绿色;(2)在氢氧化钠溶液中加入硫酸亚铁溶液反应生成氢氧化亚铁后,溶液中只有过量的氢氧根离子,不会有过量的亚铁离子存在,所以沉淀不会显绿色。
如果以上假设成立,那么所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。
笔者设计了下列三个实验方案以证明自己的假设。实验过程中观察到的实验现象如表2、表3所示: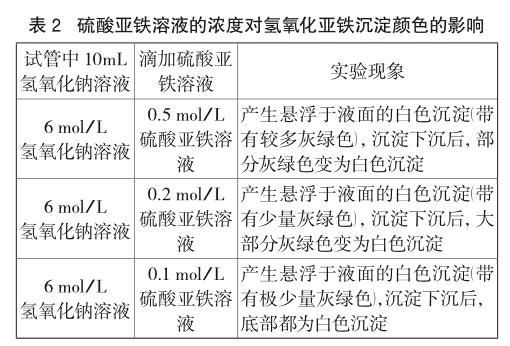
上述实验现象证实笔者的设想,即在氢氧化钠溶液浓度一定的条件下,硫酸亚铁溶液的浓度越小,溶液中游离的亚铁离子越少,产生的氢氧化亚铁沉淀吸附亚铁离子的量越少,所以产生白色沉淀的现象越明显。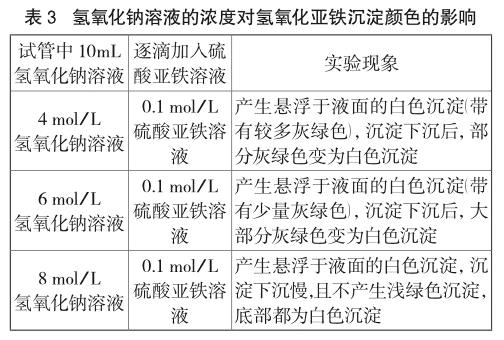
上述实验现象证实笔者的设想,即在硫酸亚铁溶液浓度一定(且取很小值)的条件下,氢氧化钠溶液的浓度越大,溶液中游离的亚铁离子越少,产生的氢氧化铁沉淀吸附亚铁离子的量越少,所以产生白色沉淀的现象越明显。
上述两组实验结果证明笔者的猜想是正确的。根据猜想,设计了第三组实验,即在硫酸亚铁溶液和氢氧化钠溶液浓度不变的条件下,改变滴加硫酸亚铁的方式,实验操作和现象如下表4所示。
毛细滴管口径小,挤出的硫酸亚铁的量比普通滴管的量更少,不断移动位置是防止亚铁离子局部过量。由上表中实验现象进一步证明笔者的设想正确。
3 结果与讨论
3.1 产生浅绿色沉淀的原因
制取氢氧化亚铁实验时产生颜色不同的实验现象与氢氧化钠溶液和硫酸亚铁溶液滴加顺序不同和所配溶液浓度不同有关,观察到浅绿色沉淀的原因是氢氧化亚铁沉淀具有吸附性,吸附了溶液中过量的呈浅绿色的亚铁离子造成的。
3.2 制备氢氧化亚铁的最佳方法
由上述猜想和定量实验验证,得出制备氢氧化亚铁的最佳方法是:
试剂:8 mol/L氢氧化钠溶液;0.1 mol/L硫酸亚铁溶液。
滴加顺序:在试管中加入5mL 8 mol/L氢氧化钠溶液,用毛细滴管吸取0.1 mol/L硫酸亚铁溶液,滴管尖端插入液面下,慢慢挤一点;移动位置后再挤一点……
现象:观察到有白色的氢氧化亚铁沉淀生成。
加入硫酸亚铁溶液量多后,白色沉淀慢慢变成浅绿色。
原因:硫酸亚铁量多后,氢氧化亚铁沉淀吸附了过量的亚铁离子而显示绿色。
3.3 温度对氢氧化铁制备实验的影响及原因分析
笔者做上述实验时用的都是常温下的试剂,整个实验过程都没有进行过加热,氢氧化钠溶液也是用实验室现有的蒸馏水配制(没有煮沸过),更没有采用液封等措施。
上述实验现象证明笔者的观点是正确的。氢氧化亚铁沉淀的颜色与是否带结晶水无关,而与吸附亚铁离子有关。
笔者也做了带浅绿色的氢氧化亚铁沉淀在水浴中加热的实验,得到的实验现象与张旭旻老师的实验现象相似。
笔者对氢氧化亚铁沉淀水浴加热后由绿变白,并有片状白色沉淀下沉的原因分析是硫酸亚铁是由强酸弱碱组成的盐,由于盐的水解是吸热反应,加热后会促进亚铁离子水解,而使氢氧化亚铁沉淀表面吸附的亚铁离子转化为氢氧化亚铁沉淀,而使沉淀颜色由绿变白,同时由于沉淀量的增多,而产生有片状白色沉淀下沉的现象。
综上所述,建议教材上应把氢氧化钠与硫酸亚铁反应产生的现象和原因的分析改为:有白色沉淀或绿色沉淀生成,原因是氢氧化亚铁是白色沉淀,因吸附溶液中亚铁离子而显绿色。
参考文献:
[1]张英锋.也谈灰绿色物质——绿锈的组成[J].化学教育,2009,(1):71~72.
[2]李俊生.对灰绿色物质的组成及形成规律的再分析[J].化学教学,2005,(9):59~61.
[3]李俊生.对一典型化学实验题的再分析[J].中小学实验与装备,2009,(6):55~56.
[4]刘炎昭等.灰绿色氢氧化亚铁成因的实验探析[J].中学化学教学参考,2014,(5):51~52.
[5]刘彩红.氢氧化亚铁制备实验的设计[J].化学教学2014,(9):52~53.

