基于教材中数据处理与应用的实践探索
丁浩
摘要:化学教材中涉及大量的定量数据,教学中教师要帮助学生厘清数据修约规则、挖掘数据隐含信息、拓展数据运用价值,以发挥数据的最大功效,使其更好地服务于教学。
关键词:化学教材;数据处理;教材分析
文章编号:1005–6629(2015)7–0014–03 中图分类号:G633.8 文献标识码:B
数据是精辟、适度概括的语言,具有精确和蕴意丰富等特点。在实际教学中,教师会用到各种数据。这些数据产生的条件和背景不同,来源也不同,可能源于教材或是其他文献,也可能是源于科研论文或实际生产。对这些数据,不能只进行简单的呈现,而要帮助学生厘清数据的含义,并进行适当的加工处理和意义拓展,使学生更容易理解其内涵,以期获得更好的教学效果。本文以化学教材中的相关数据为例,谈谈数据的处理和应用。
1 厘清数据修约规则,明确相应实现途径
数据一般由数值和单位组成,而数值又是用具体数字表示的。在不同的场合需要用到不同的数据,同时对数值精确程度的要求也不尽相同。化学教学在涉及具体的数据时,要引导学生厘清相关数据的修约规则,知道具体数据的可能来源,以及实现或获取这些数据的实验途径,从而使学生具备相应的实验技能。
例如,苏教版《化学1》[1]在“溶液的配制及分析”的“活动与探究”部分,设置了配制100mL 0.100 mol·L-1 Na2CO3溶液的实验,要求学生计算所需碳酸钠固体的质量并完成相关实验操作。这其中涉及到了有效数字的问题。有效数字是指在实验中实际能够测量到的数字,而能够测量到的是包括最后一位估计的,即不确定的数字。因此有效数字在一定程度上依赖于测量仪器的精确度,数值的有效数字位数越多,对应的称量仪器的精确度也越高。对于100mL 0.100 mol·L-1的碳酸钠溶液,所需碳酸钠固体质量为1.06g。配制溶液的浓度有三位有效数字,为了保证实验的精确度,应该使用分析天平(或电子天平)准确称取碳酸钠固体1.06g。由于对数据的内涵不够清晰,有些教师往往让学生直接采用托盘天平称取1.1g碳酸钠固体,这样得到的溶液的浓度与0.100 mol·L-1之间存在误差,使得实验的精确度有所下降,达不到精确配制溶液的目的。
由于数据的大小和有效数字位数的多少,不仅代表了某物质具体量的不同,同时也体现了实验操作的准确度不同,或对实验器材的要求不同。所以,教学中要结合具体情况做出说明,让学生明白有效数字与实验仪器及其准确度的关系。如称量1.8g的样品用托盘天平即可,而称取0.7865g的样品必须用分辨值为0.1mg的分析天平;量取5.0mL和5.00mL溶液时,则应分别选用10mL量筒和10mL移液管;量取21.05mL 0.1000 mol·L-1盐酸,则要采用酸式滴定管。这样,学生不仅能体验到这些数据的来历,而且能懂得正确记录测量值对结果准确度的保证作用。对于上述碳酸钠溶液配制等问题,人为地增加或减少有效数字的位数会导致概念理解的偏差,在教学中要为学生发展预留空间,为学生形成较为完整的科学概念奠定基础。由于高中生比较熟悉的称量仪器是托盘天平,而且有些学校没有分析天平(或电子天平),或分析天平的数量不能满足学生分组实验的需要,这时要与学生说清楚,使用精确度不同的天平,得到数据的有效数字会有所差异,如果使用托盘天平称量碳酸钠固体,质量是1.1g,这样得到溶液的浓度精确度达不到0.100 mol·L-1。
2 挖掘数据隐含信息,深入理解其中奥秘
教材所呈现的一些数据,有时没有“来龙去脉”,这时需要对数据进行有效加工,引导学生挖掘数据隐含的信息和真相。这不仅可以增强学生的数据意识,重视数据的收集、整理和分析,更重要的是能引导学生从数据中获取信息,促进学生的主动探究,形成有效的解决问题的能力,而且加工和处理数据的实践过程,还有利于学生创新思维能力的培养。
例如,在《物质结构与性质》模块的“共价键的类型”教学中,为了使学生理解有关键能的数据,可以设问:“碳碳单键和双键的键能分别为348 kJ·mol-1和615 kJ·mol-1,从共用电子对数量看,两者是1:2,但碳碳双键的键能小于碳碳单键键能的两倍(615 kJ·mol-1<2×348 kJ·mol-1)。其中的原因是什么呢?”然后引导学生从轨道重叠的方式来解释。学生意识到碳碳单键是碳原子之间通过sp3杂化轨道“头碰头”重叠形成的σ键,而碳碳双键是碳原子之间通过sp2杂化轨道“头碰头”重叠形成一个σ键的同时,未杂化的p轨道“肩并肩”形成一个π键,两对共用电子对对应原子轨道的重叠方式是不一样的;而且由于原子轨道“头碰头”比“肩并肩”重叠程度大,形成的σ键比π键牢固。最后,再抛出问题:“碳碳双键中σ键和π键的键能分别大约是多少?乙烯发生加成反应时哪个化学键发生断裂?”这样,学生在定性感知原子轨道重叠程度与共价键强度关系的基础上,又从定量的角度比较了σ键和π键的强度,深化了对键能概念和碳碳之间单、双键性质的认识。
又如,苏教版《化学反应原理》教材[2]的“沉淀溶解平衡原理的应用”中指出,“CuSO4溶液中含有Fe3+,可向溶液中加入氢氧化铜或碱式碳酸铜,调节溶液pH至3~4,铁离子就会全部转化为氢氧化铁除去”。氢氧化铁在酸性条件下能够稳定存在(沉淀完全)!这与常规的“酸碱反应”产生认知冲突,学生难以理解。对此,教学中可以告诉学生,在分析化学上,当溶液中离子的浓度小于或等于1.0×10-5 mol·L-1时,就能认为沉淀完全了。然后让学生根据Fe(OH)3和Cu(OH)2的溶度积分别计算Fe(OH)3完全沉淀时的pH,以及此时产生Cu(OH)2沉淀所需要c(Cu2+)的最小值。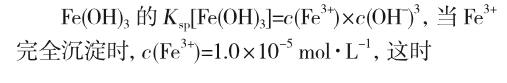

通过理论分析,学生认识到由于Fe(OH)3的溶度积很小,所以OH-只需要很小的浓度就能够使Fe3+完全沉淀,所以采用调节溶液pH至3~4的方法可以使Fe3+完全沉淀而Cu2+没有开始沉淀,可以除去溶液中的Fe3+。通过以上运算,学生进一步熟练了溶度积的相关计算,同时,这些具体的数据也增加了信息的可信度,更容易理解和接受相关除杂知识。
3 拓展数据运用价值,优化课堂教学设计
教材中所列的某些定量数据,可能蕴藏着非常丰富的含义,它不仅能说明教材编写者想说明的问题,而且还能用于其他知识或原理的教学。教学中对这些数据含义进行适当的拓展,并融入相关内容的教学设计之中,能够充分发挥数据真实性和直观性等特点的作用,促进学生对相关知识或原理的理解,使教学更加贴近学生的思维水平,达到优化的教学境界。
教材给出这些数据的意图是判断同一可逆反应在相同温度、不同起始浓度的情况下,达到平衡时的平衡常数相同。学生在分析中很容易发现,生成物浓度幂之积与反应物浓度幂之积的比值基本相同,得到平均值171即为平衡常数。进一步推知,对于任一可逆反应,只要温度相同,达到平衡状态时生成物浓度幂之积与反应物浓度幂之积的比值为一定值,该比值为相应温度下该反应的平衡常数,从而建立起平衡常数的概念。由于这些数据源自科学实验,具有真实、可信等特点,在“化学平衡的移动”的教学时,还有其独到的教学价值。教学中,可以先让学生利用平衡常数进行简单计算的知识,计算出每组实验中反应物的平衡转化率(见表2)。
表2中的数据,还可以用来探究反应进行限度的定量表示,进一步判断某反应是否达到平衡状态以及平衡移动的方向。对于教材中类似的数据,我们要注意挖掘和拓展它们的教育价值,帮助学生揭示、理解和掌握相应的化学知识和原理。
数据是一种理性的定量表达,真实有效的数据有极大的权威性和很强的说服力,深度提取其中量化信息,充分利用数据蕴含的信息,使之更符合学生的认知特征,有利于学生在定性判断的基础上增加一些定量感知,同时发挥数据对于教学的最大功效。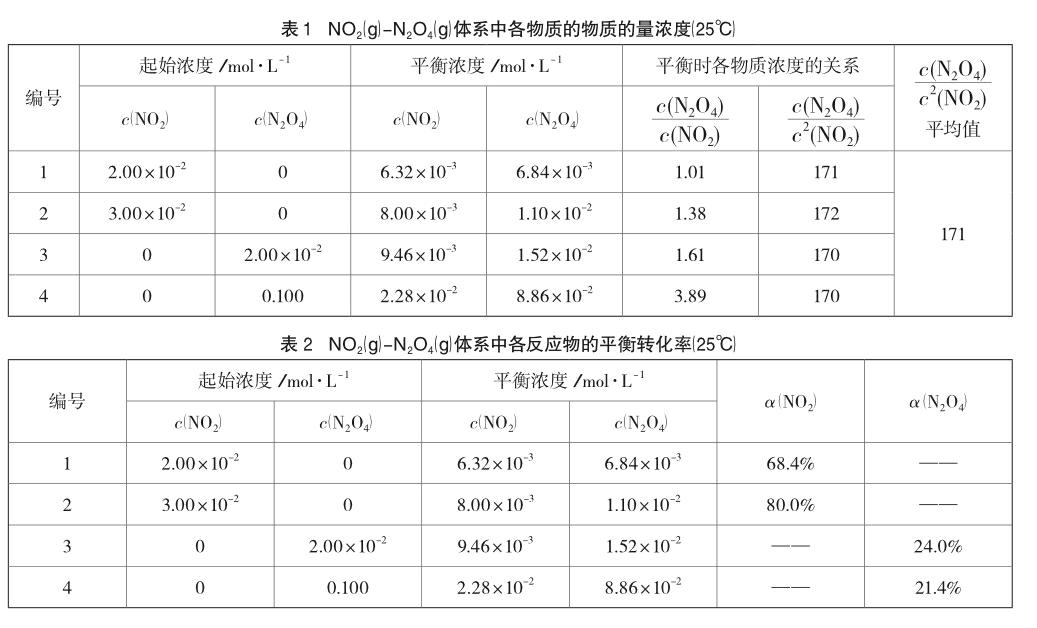
参考文献:
[1]王祖浩主编.普通高中课程标准实验教科书·化学1[M].南京:江苏教育出版社,2011:24.
[2]王祖浩主编.普通高中课程标准实验教科书·物质结构与性质[M].南京:江苏教育出版社,2012:49.
[3]王祖浩主编.普通高中课程标准实验教科书·化学反应原理[M].南京:江苏教育出版社,2012:48.

