广金钱草总黄酮胶囊Ⅰ期临床耐受性和安全性研究
李文淑,孙斌,赵攀,魏振满,刘树红
(1.中国人民解放军第三O二医院 临床药理研究室,北京 100039; 2.中国人们解放军第三O二医院 病理诊断与研究中心,北京 100039)
·基础研究·
广金钱草总黄酮胶囊Ⅰ期临床耐受性和安全性研究
李文淑1,孙斌1,赵攀1,魏振满1,刘树红2*
(1.中国人民解放军第三O二医院 临床药理研究室,北京 100039; 2.中国人们解放军第三O二医院 病理诊断与研究中心,北京 100039)
目的:评价健康受试者单次和多次口服广金钱草总黄酮胶囊的临床安全性和耐受性。方法:本研究共选取64例健康受试者,男女各半,其中54例受试者随机双盲法分配到单次给药试验组,共分7个剂量组(剂量分别为133、399、798、1197、1596、1995、2394 mg),每剂量组人数(试验药+安慰剂)分别为4(4+0)、4(4+0)、6(6+0)、10(8+2)、10(8+2)、10(8+2)和10(8+2)例;10例(8+2)受试者进入连续多次给药试验组,给药剂量为一次665 mg,3次/日,连续10 d。给药前后对全部入组受试者的血常规、尿常规、血生化、ECG、凝血功能进行定时检测,并记录生命体征。结果:64例受试者全部完成研究且无严重不良反应。单次给药试验组46例受试者中有9例(19.6%)和安慰剂组8例受试者中有2例(25.0%)均出现了轻度不良反应;连续给药试验组8例受试者中有6例(75%)和安慰剂组2例中有1例(50%)出现轻度不良反应;上述出现的不良反应,受试者均转归,且研究者判断为与试验药物可能无关。结论:健康人体单日单次口服广金钱草总黄酮胶囊不超过2394 mg或连续服药665 mg/次,3次/日,具有较好的安全性和耐受性。建议Ⅱ期临床试验使用剂量不高于665 mg/次,3次/日。
广金钱草总黄酮胶囊;单次给药;多次给药;耐受性;安全性
广金钱草为豆科植物广金钱草Desmodiumstyracifolium(Osb.)Merr.的干燥地上部分。全草入药,具有清热利尿、祛风止痛、止血生肌、消炎解毒之功能,可用于治疗尿路感染、尿结石、胆囊炎等病症[1-3]。广金钱草总黄酮胶囊为北京海泰联合医药科技发展有限公司自主研发的治疗尿石症的中药新药,为通过药理跟踪,采用大孔树脂等分离技术从广金钱草中提取分离出的广金钱草总黄酮。
临床前主要药效学试验显示,广金钱草总黄酮胶囊对大鼠实验性尿路结石具有良好的治疗和预防作用;小鼠和犬的一般药理学研究表明,广金钱草总黄酮胶囊对动物的呼吸、心血管及中枢神经系统均无显著影响;急毒试验表明,给予小鼠和大鼠灌胃口服广金钱草胶囊,未表现出严重急中毒现象;大鼠和比格犬长期毒性研究表明,大鼠灌胃广金钱草总黄酮1800 MKD以下剂量,连续26周,未见组织或器官发生实质性变化;比格犬口服广金钱草总黄酮300 MKD,连续6个月,各项观测指标未见明显变化[900 MKD,连续6个月为其最大耐受剂量(MTD)]。临床前结果表明,广金钱草胶囊是一种有前景的治疗尿石症的中药新药。本研究观察健康受试者单次和连续多次口服广金钱草总黄酮胶囊的Ⅰ期临床安全性和耐受性,为Ⅱ期临床研究推荐可能的应用剂量。
1 受试者选择
1.1 入选标准
健康志愿者,男女各半,年龄18~45岁且年龄相差10岁以内;体重指数在19~24 kg/m2且男性≥50 kg,女性≥45 kg;无药物过敏史和神经系统疾病;一般体检、血、尿常规化验、心、肝、肺、肾功能检查均为正常者;育龄期妇女必须采取有效的避孕措施;按照GCP要求,受试者自愿理解并签署知情同意书。
1.2 排除标准
既往有药物、食物或其他物质过敏史者;3个月内参加过其他临床医学试验者;2个月内献血或作为受试者被采样者;近2周内曾应用各种药物者(包括中药);哺乳期、妊娠期及计划近期怀孕女性;烟酒嗜好、药物滥用及残疾者;患有重要脏器原发疾病(心、肝、肾、肺、脑等)、传染性疾病、精神障碍者;既往有胃肠肝胆手术史可能影响口服药物吸收者;对药物的依从性差者;根据研究者判断,受试者不符合要求者;实验室指标异常,尤其血肌酐>150 μmol·L-1,谷丙转氨酶(ALT)、谷草转氨酶(AST)超过正常值上限一倍以上及有临床意义的心律失常者。
1.3 剔除标准
经复核不符合入选标准而入选者;已入选但未用药者;已入选但无任何记录者。
1.4 终止标准
在试验中发现临床研究方案有重大失误,给药过程中出现严重不良反应(影响正常工作、学习、生活等);超过1/3的使用研究药物的受试者发生DLT不良反应;在达到最大剂量时,虽未出现不良反应,亦应终止试验;申办者要求中止(如经费原因、管理原因等);国家食品药物监督管理局因某种原因勒令中止试验。
2 试验药品与给药剂量依据
广金钱草总黄酮胶囊,规格:133 mg/粒,批号:20100818,由北京海泰联合医药科技发展有限公司提供。
单次给药试验剂量设计根据广金钱草总黄酮胶囊小鼠和大鼠急性毒性剂量实验,动物的安全低剂量为28.47 mg·kg-1,换算成人的剂量为30×0.16(大鼠系数)=4.8 mg·kg-1,按60 kg/人体重计算应为288 mg,因此决定用133 mg作为广金钱草总黄酮胶囊单次给药耐受性的最小给药剂量;按照犬长毒实验中的最大给药剂量(900 mg·kg-1,换算成人的剂量为477.9 mg·kg-1)的1/10作为最低有毒剂量计算,则人的最大剂量为477.9 mg·kg-1×1/10×60 kg=2800 mg,故拟定2394 mg为单次给药耐受性的最大给药剂量。
连续多次给药剂量设计依据54例健康受试者完成的7个剂量递增的单次给药临床耐受试验,单日单次服用133~2394 mg的广金钱草总黄酮胶囊可安全耐受,即单日服用总剂量为2394 mg的广金钱草总黄酮胶囊是安全耐受的,若分为一日三次服用,则每次服用剂量为798 mg。综上,选择665 mg(5粒)剂量,进行一日三次,连续10 d给药的考察剂量。
3 试验设计与流程
3.1 单次给药临床试验设计
采用随机双盲安慰剂对照(试验组∶>安慰剂组为4∶>1)、单剂量递增的整体设计。广金钱草总黄酮胶囊初始给药剂量为133 mg(1粒),最大剂量为2394 mg(18粒),共设133 mg(1粒)、399 mg(3粒)、798 mg(6粒)、1197 mg(9粒)、1596 mg(12粒)、1995 mg(15粒)、2394 mg(18粒)7个剂量组,口服给药。健康受试者男女各半,随机、平行、双盲法分配入组。每个剂量组试验结束后,独立安全委员会负责评价试验用药剂量的安全性。只有前一个剂量组评价为安全剂量后,方可进入下一个剂量组继续试验。所有入组受试者服药前一天入住Ⅰ期临床试验病房,吃清淡晚餐后禁食过夜,第二天早晨7:30左右给予试验药物,给药2 h内禁饮食,2 h后受试者可自由活动和饮水,但需避免剧烈运动,禁烟酒、咖啡及任何其他药物。
3.2 连续多次给药临床试验设计
在7个剂量组单次给药临床试验的全部受试者完成研究后,进行后续的连续多次给药的临床研究。试验采用随机双盲安慰剂对照(试验组∶>对照组为4∶>1)整体设计。符合要求的10名健康受试者,男女各半,按照随机双盲法平行入组到试验组或安慰剂对照组。服药前1 d,受试者入住Ⅰ期临床试验病房,吃清淡晚餐后禁食过夜。给药日分别口服给药(7:00、15:00、23:00时),连续10 d,每次665 mg,一日3次。受试者给药2 h内禁饮食,2 h后可自由活动和饮水,但需避免剧烈运动,禁烟酒、咖啡及任何其他药物。试验结束后,独立安全委员会负责评价该剂量试验用药的安全性。
4 观察时间和观察指标
单次给药临床研究观察时间:筛选期和给药后1、2、4、8、12、24 h及停药后1周。
连续多次给药临床研究观察时间:筛选期和给药后1、2、4 h及第4、7、11天及停药后1周。
观察指标:血常规、尿常规、血生化检查、ECG检查、凝血功能检测,并记录生命体征。
5 药物不良反应记录
严密观察整个试验过程中可能发生的不良反应,并详细地做好记录,尤其体格指标、实验室检查指标等异常情况,并做好妥善处理。研究医师会对发生的不良反应与药物的关系进行判定并进行安全性评价,一旦发生严重不良事件(SAE),应及时处理并上报有关部门。
6 统计学分析
所有的统计分析将采用SAS 9.1.3软件完成,其中计量资料采用均数(Mean)、标准差(SD)、中位数(Median)、最小值(Min)和最大值(Max)描述;计数资料采用例数(百分比)描述。不良事件和实验室指标,根据世界卫生组织(WHO)毒性分级标准进行分析,描述各指标异常的严重程度。
7 结果
7.1 受试者一般情况分析
单次给药研究共入组54例受试者。试验组46例,其中133 mg组4例(7.4%)、399 mg 组4例(7.4%)、798 mg组6例(11.1%)、1197 mg组8例(14.8%)、1596 mg组8例(14.8%)、1995 mg组8例(14.8%)、2394 mg组8例(14.8%),安慰剂组8例(14.8%),全部受试者均完成研究。
连续多次给药研究共设1个剂量组,665 mg/次,3次/日。本次研究共纳入健康受试者10例,其中试验组8例(80.0%)、安慰剂对照组2例(20.0%),所有受试者均完成研究。见表1~2。
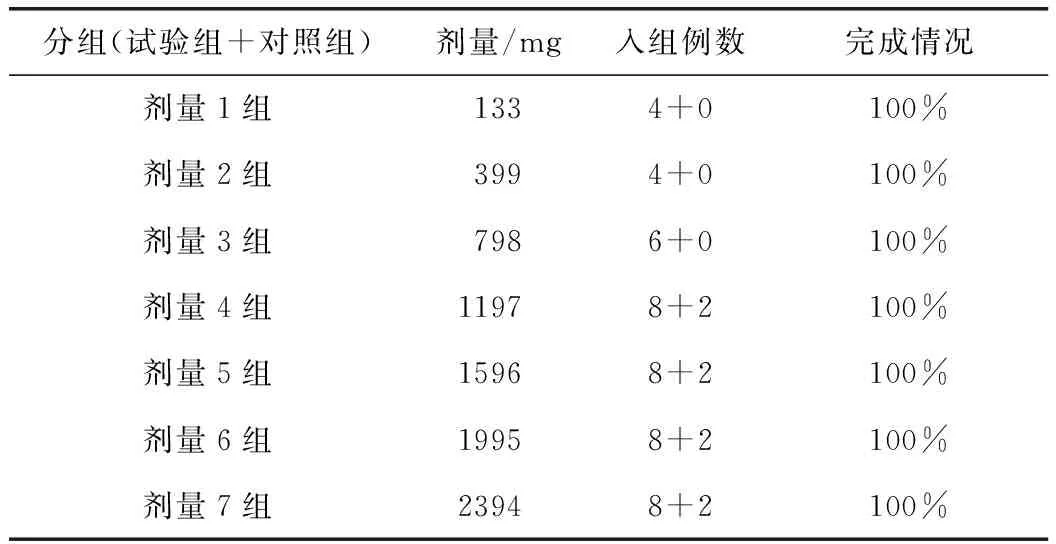
表1 单次给药组受试者入组情况
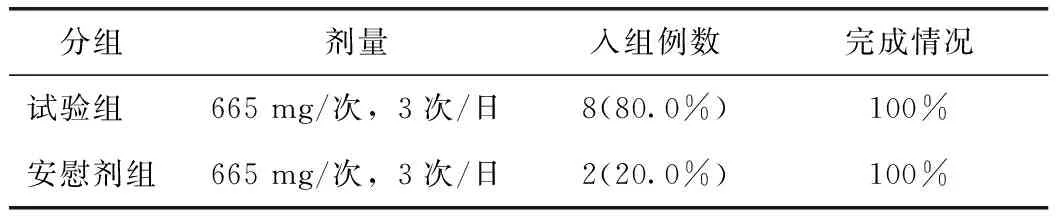
表2 连续给药组受试者入组情况
单次给药研究入组的54例受试者中男性27例(50.0%),女性27例(50.0%),中位年龄24岁,平均身高为(164 ± 8)cm,平均体重为(57.22±6.51)kg,平均体重指数为(21.2 ± 1.83)Kg/m2。连续多次给药研究入组的10例受试者中男性5例(50.0%),女性5例(50.0%),中位年龄29.0岁,平均身高为(165±8.00)cm,平均体重为(58.70±9.39)kg,平均体重指数为(21.41±1.61)Kg/m2。
64例受试者中,HBsAg、抗-HCV、抗-HIV均为阴性,胸部X线摄片及心电图均无异常,符合入选标准。经统计分析,全部入组受试者给药前在上述指标方面,试验组和安慰剂对照组相比,差异无统计学意义(P>0.05)。
7.2 安全性评价
7.2.1 临床情况 单次给药研究:入组的54例受试者全部完成临床研究,其中不同剂量试验组46例受试者中9例发生轻度不良反应(19.6%),安慰剂组的8例受试者中2例发生轻度不良反应(25%),研究者判断上述出现的全部不良反应均可能与药物无关。试验组不良事件发生均为实验室指标异常,包括白细胞和中性粒细胞异常各1例、谷丙转氨酶异常1例、纤维蛋白原异常4例、活化部分凝血活酶时间异常1例、尿红细胞异常1例、尿白细胞异常1例、尿蛋白质异常1例。安慰剂组不良事件发生均为实验室指标异常,包括甘油三酯和尿蛋白质异常各1例。
连续给药研究:入组的10例受试者均完成研究,其中试验组8例受试者中有6例(75.0%),安慰剂对照组2例受试者中有1例(50.0%)出现了轻度不良反应,研究者判断上述出现的全部不良反应均可能与药物无关。试验组不良反应发生均为实验室指标异常,包括ALT、 直接胆红素(DBIL)、总胆红素(TBIL)、尿素(UREA)及肌肝(CRE)异常各1例,血浆纤维蛋白原(FIB)异常6例,APTT(S)异常3例,PT(a)与PT(s)异常各2例;安慰剂对照组不良反应亦均为实验室指标异常,包括FIB异常与尿红细胞异常。
7.2.2 生命体征与心电图 试验前后入组64例受试者的生命体征和ECG均正常,且无显著变化。
7.2.3 实验室检查
7.2.3.1 血液学检查 单次给药研究:所有54例受试者给药前血常规检查结果均显示正常。46例试验组受试者中,出现给药后异常的包括白细胞计数(WBC)和中粒细胞百分比(NE)异常各1例,均为异常无临床意义。8例安慰剂组受试者中未出现异常。连续多次给药研究:所有10例受试者给药前与给药后血常规检查结果均显示正常,且无显著变化(p>0.05)。
7.2.3.2 血生化检查 单次给药研究:46例试验组受试者中,出现给药后异常的包括ALT 1例,为异常无临床意义。8例安慰剂组受试者中出现甘油三醋(TG)异常1例。各剂量组详情见表3。
注:意义判定1=正常;2=异常无临床意义;3=异常有临床意义;4=未查。下同
连续多次给药研究:8例试验组受试者中,出现给药前正常、给药后异常的包括ALT、DBIL、TBIL及CRE异常各1例,研究者判断为异常无临床意义;出现给药前异常、给药后异常的有UREA异常1例,研究者判断均为异常无临床意义;2例安慰剂对照组受试者未出现异常。各剂量组详情见表4。
7.2.3.3 凝血常规检查 单次给药研究:46例试验组受试者中,出现给药后异常的包括FIB异常4例,APTT(S)异常1例,均为异常无临床意义。8例安慰剂组受试者中未出现异常。各剂量组详情见表5。
连续多次给药研究:8例试验组受试者中,出现给药前正常、给药后异常的包括FIB异常5例,APTT(S)异常3例,PT(a)与PT(s)异常各2例,研究者判断均为异常无临床意义;出现给药前异常、给药后异常的为FIB异常1例,研究者判断均为异常无临床意义。2例安慰剂对照组受试者中有1例出现了异常,包括FIB异常,研究者判断均为异常无临床意。各剂量组详情见表6。
7.2.3.4 尿常规检查 单次给药研究:46例试验组受试者中,出现给药后异常的,包括尿红细胞及尿白细胞异常各1例,均为异常无临床意义。8例安慰剂组受试者中出现给药后异常的为尿蛋白质1例。
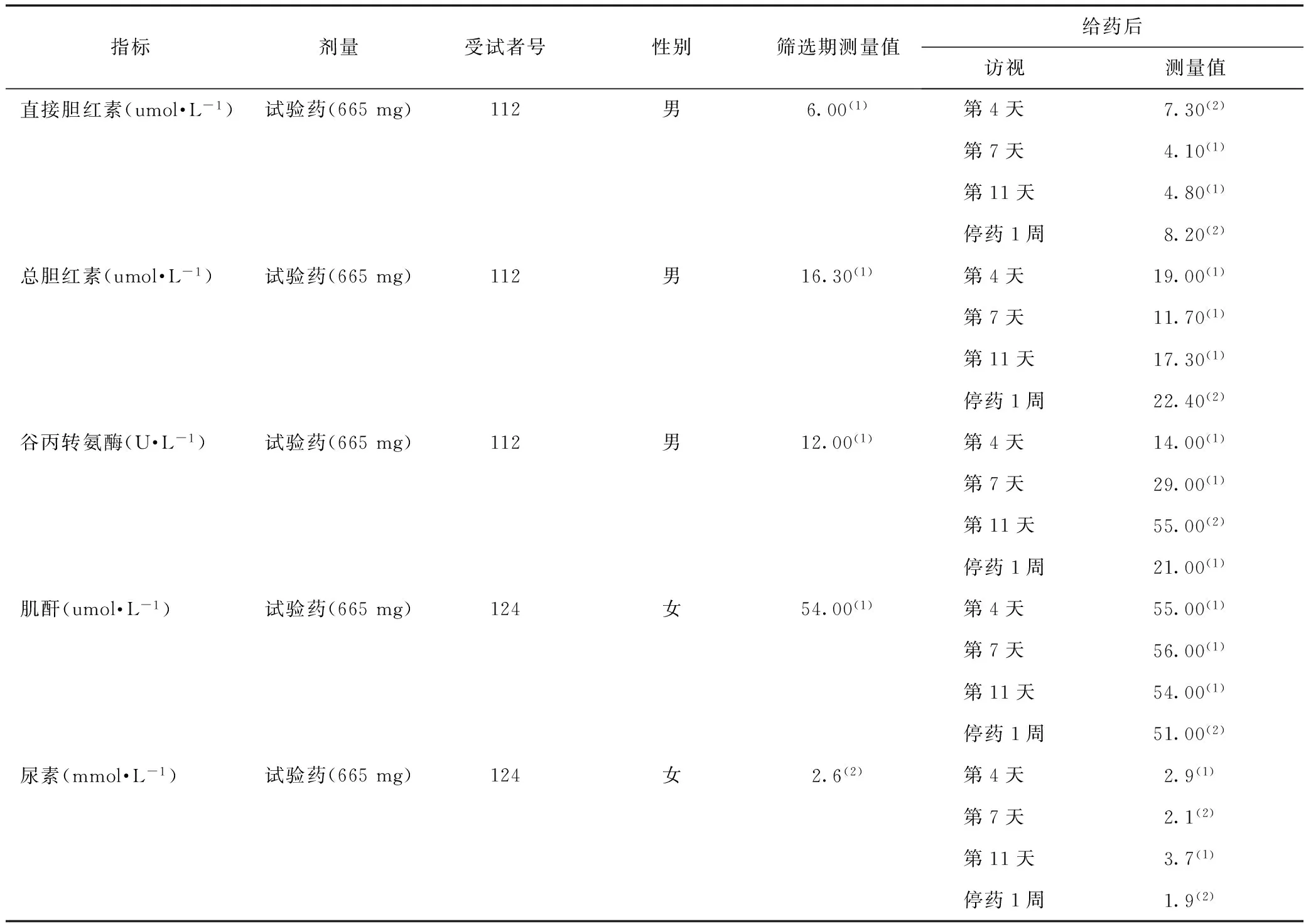
表4 多次给药血生化指标给药前正常、给药后异常的受试者情况
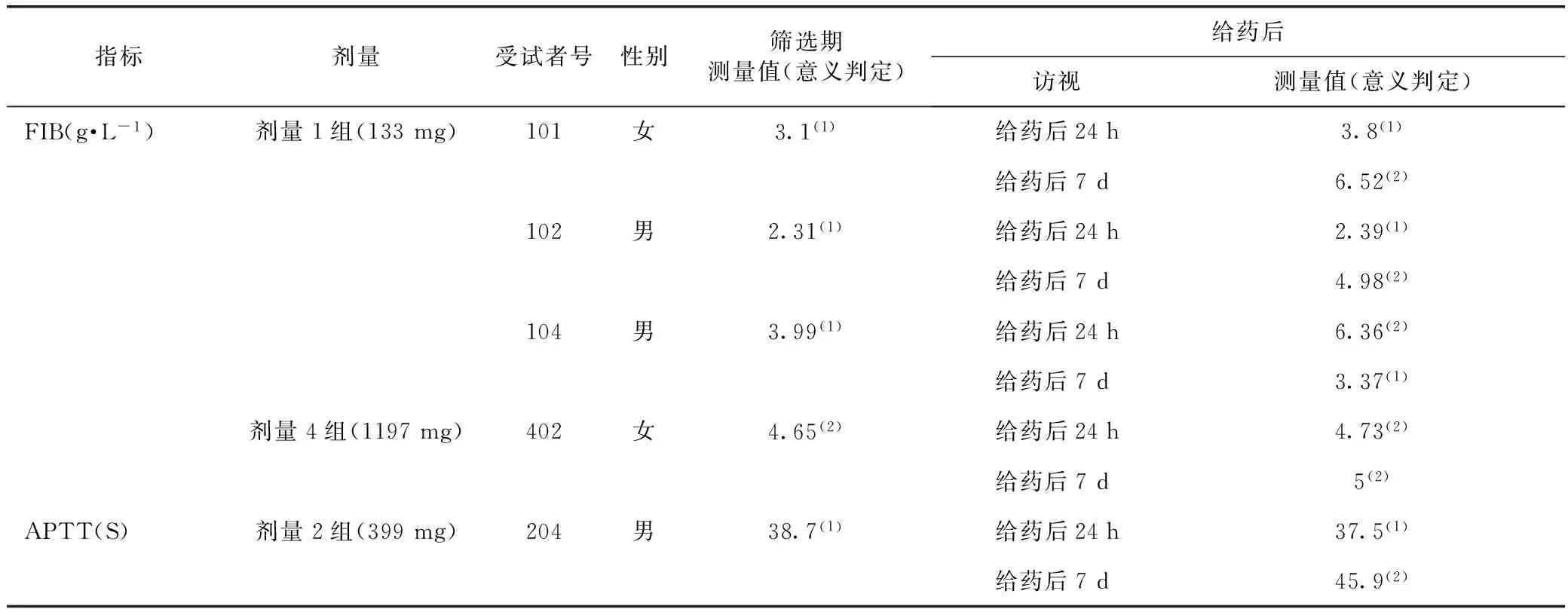
表5 单次给药凝血常规指标给药前正常、给药后异常的受试者情况

表6 连续多次给药凝血常规指标给药前正常、给药后异常的受试者情况
8 讨论
尿路结石是一种常见疾病,在世界各国发病率日趋增高[4]。近年来,国内外开展了体外震波碎石治疗,代替了部分外科手术取石,但仍有适应症的选择,损伤内脏,大结石震成小块结石后的损伤,阻塞尿路等许多问题[5-7]。实施体外碎石后,运用中药消炎、排石亦属必要。因此,在整个非手术治疗泌尿系统结石时,西医临床上常用枸橼酸钾、噻嗪类利尿剂、镁剂、乙酰半胱酸等促排剂,其疗效不甚理想,且毒副反应明显[8-11]。然而中成药如“泌石通”“排石冲剂”“石淋通”片都是常用的疗效确切的药物,中医药治疗占据很重要的地位[12-14],但这些传统的中成药仍存在制药工艺原始、质量控制难、没有准确的定量检测方法、服用量大、与国际接轨有较大距离等不足。广金钱草总黄酮胶囊的研发应运而生,其是广金钱草中药材经分离、提取、纯化精制的中药新药,目前国内还没有该药的人体应用资料。故本研究结合临床前的研究资料,进行广金钱草总黄酮胶囊的单次给药人体耐受性研究。
单次给药研究结果表明,入组的54例受试者全部完成研究,无SAE事件发生。广金钱草总黄酮胶囊单次给药在133~2394 mg剂量范围内仅发生了与实验室异常相关的不良事件,这些不良事件经研究者判定均为与试验药物可能无关的轻度不良事件。
连续多次给药研究结果显示,入组的10例受试者全部完成研究,无SAE事件发生。试验组受试者口服广金钱草总黄酮胶囊665 mg/次,3次/日,连续给药10 d,与安慰剂对照组一样均有部分受试者(75%&50%)发生了与实验室异常相关的轻度不良反应,这些不良反应均被研究医生判定为与试验药物可能无关的轻度不良事件。
综上所述,健康人体单日单次口服广金钱草总黄酮胶囊不超过2394 mg或连续服药665 mg/次,3次/日,具有较好的安全性和耐受性。建议II期临床试验使用剂量不高于665 mg/次,3次/日。但凝血指标异常显示广金钱草总黄酮胶囊可能会影响人体的凝血功能,建议II期临床试验实施时着重观察凝血指标。
[1] 蔡华芳.金钱草治疗尿结石的作用和机理研究[J].中国医疗前沿,2010,12(5):7-8,48.
[2] 程波.金钱草治疗尿结石的机制作用研究[J].中国医药指南,2013,20(11):662-663.
[3] 赵建一.金钱草治疗尿结石的机理作用研究[J].中医临床研究,2013,16(5):37-38.
[4] 周向文,黄冬梅,吕建新.中医药治疗泌尿系结石临床研究进展[J].亚太传统医药,2011,3(33):151-152.
[5] 夏飞,钱书武.尿结石临床治疗方法探讨[J].中外医疗,2011,15:8-9.
[6] 张明,陈继兵,郭海锋.体外震波碎石术后石街57例的处理和预防[J].南通大学学报(医学版),2011,31(05):398-399.
[7] 杨胜辉.238例膀胱结石成分及相关危险因素分析[J].中国当代医药,2013,16(20):59-60.
[8] 王强,王细生.485例尿结石成分分析与预防指导[J].国际检验医学杂志,2013,11(34):1460-1462.
[9] 班莉,黎行山,李天.复方金钱草联合多沙唑嗪治疗尿结石临床观察[J].亚太传统医药,2013,08(9):163-164.
[10] 夏飞,钱书武.尿结石临床治疗方法探讨[J].中外医疗,2011,15:8-9.
[11] 谭文,张碧容.中西医结合治疗尿结石肾绞痛134例[J].国际医药卫生导报,2004,22(10):33-34.
[12] 赵素容,卢兖伟,吴文雅.广金钱草总黄酮胶囊对照品的研究(英文)[J].中成药,2007,06(29):845-849.
[13] 王晓林,周媛媛,阴艳华.超声波辅助提取广金钱草总黄酮的工艺研究[J].广东化工,2010,09(37):35-37.
[14] 许实波,丘晨波,钟如芸,等.广金钱草总黄酮对心脑血管的效应[J].中山大学学报自然科学版,1980,04:98-102.
StudyonPhaseIClinicalToleranceandSafetyofTotalFlavonoidsofHerbaDesmodiiStyracifoliiCapsules
LIWenshu1,SUNBin1,ZHAOPan1,WEIZhenman1,LIUShuhong2*
(1.CenterofNewDrugandClinicalResearch,302HospitalofPLA,100039,Beijing,China; 2.DepartmentofPathologyandHepatology,100039,Beijing,China)
Objective:To evaluate the safety and tolerance of single dose and multiple dose total flavonoids of Herba Desmodii Styracifolii capsules by oral administration in healthy subjects.Methods:A randomized,double-blind,placebo-controlled study was conducted in 64 eligible subjects(female:male=1∶1).The proportion of experiment group and placebo group was 80%.54 eligible subjects were divided to 7 dosages in single dose group,the number of subjects(experiment group+placebo group) were 4(4+0),4(4+0),6(6+0),10(8+2),10(8+2),10(8+2) and 10(8+2),respectively.10 eligible subjects were distributed to multiple dose group,the number of subjects(experiment group+placebo group) were 10(8+2).Safety and tolerability were evaluated by monitoring adverse events and laboratory parameters containing blood routine,urine routines,blood biochemistry,ECG examination,blood clotting function.Result:64 people all completed the study and no serious adverse events occurred.In the single dose group,9 cases of experiment group occurred mild adverse events(19.6%,9/46),2 cases of placebo group occurred mild adverse events(25.0%,2/8);In the multiple dose group,6 people of experiment group occurred mild adverse events(75.0%,6/8),1 people of placebo group occurred mild adverse events(50.0%,1/2);All adverse events were judged as no-drug-related by the investigators.Conclusion:Total flavonoids of Herba Desmodii Styracifolii capsule was safe and well tolerated with single dose of less than 2394 mg per single day or multiple dose of 665 mg(1/8 h) in Chinese subjects.The suggested dosage of II-phase clinical trial was no higher than 665 mg per time,3 times a day.
Total flavonoids of Herba Desmodii Styracifolii capsule;single dose;multiple dose; tolerance;safety
10.13313/j.issn.1673-4890.2015.3.007
2014-10-14)
*
刘树红,主治医师,病理学;E-mail:18511862409@163.com

