铁沉积对大鼠肝纤维化影响的机制研究*
江 远,张 玲,钟肖英,吴文如,何金洋
铁沉积与肝纤维化(Liver fibrosis,LF)关系密切。含铁血黄素(Hemosiderosis)可沉积在各种类型的肝硬化[1,2]、慢性病毒性肝炎[3]患者肝组织中,而铁过载又会进一步促进肝硬化和肝癌的发生[4~6]。临床资料显示,去铁治疗能显著改善血清LF指标[7]。我们前期实验表明,炎症反应是铁沉积于巨噬细胞并促进LF发生的机制之一[8],且不同铁负载水平能够诱导肝星状细胞(Hepatic stellate cell,HSC)活化或发生细胞凋亡,提示铁螯合剂治疗LF的潜在作用[9]。本研究在本课题组成功建立实验性LF大鼠模型的基础上[10],以去铁铵腹腔注射SD大鼠作为对照,探讨铁沉积影响LF的发生机制。
1 材料与方法
1.1 动物、试剂与仪器 SD大鼠39只,体质量110~140 g,雌雄各半,购于广东省医学实验动物中心(合格证号:0029666)。鼠抗α-平滑肌肌动蛋白(Anti-αsmooth muscle actin,α-SMA,批号:BM0002)、山羊抗小鼠 IgG(SA1020)、二氨基联苯胺(DAB)显色试剂盒(AR1022)由武汉博士德生物工程公司提供。新鲜配制普鲁士蓝染色所需染液:2%亚铁氰化钾50 ml+浓盐酸1 ml。铁标准溶液1000μg/mL由国家标准物质中心提供。ASCENT型酶标仪为芬兰雷勃公司产品。AU400型奥林巴斯全自动生化分析仪由日本奥林巴斯公司提供。JENA AA400型原子吸收分光光度计由德国JENA仪器公司提供。TGF-β1引物由加拿大Fermentas公司合成。Master mix荧光定量聚合酶链反应(PCR)试剂盒购自日本TOYOBO公司。TRIzol RNA提取试剂购于美国MRC公司。
1.2 肝纤维化大鼠模型制备 取SD大鼠39只,随机分为模型组和空白对照组。模型组(n=27)以二甲基亚硝胺(DMN,天津化学试剂研究所)10μL.kg-1腹腔注射,每周连续3日,共4 w;空白对照组(n=12)予以等体积生理盐水腹腔注射。在造模成功后,再将模型大鼠随机分为模型组(n=15)和去铁铵组(n=12)。分别给予两组模型大鼠生理盐水或去铁铵(诺华制药厂)100 mg·kg-1腹腔注射,3次/w,共2 w。实验结束时,按要求收集血清,摘取左前叶肝脏,分别待检。
1.3 血生化指标和血清铁检测 使用AU400型奥林巴斯全自动生化分析仪检测。
1.4 血清铁蛋白和转铁蛋白检测 采用ELISA法检测(美国ADL公司)。
1.5 大鼠肝组织铁浓度(Hepatic iron concentration,HIC)检测 按照有关文献[11]报道的方法,采用火焰原子吸收光谱法测定。
1.6 肝组织病理学检查 取肝组织,在Bouin's固定液中固定24 h~36 h,石蜡包埋,切片,分别行HE染色、Masson染色和普鲁士蓝染色。按照参考文献[12,13]报道的方法进行肝组织胶原半定量分析。
1.7 肝组织α-SMA表达检测 按照试剂盒说明书提供的方法操作。
1.8 肝组织TGF-β1 mRNA水平检测 按TRIzol提取试剂盒操作说明进行总RNA提取,立即行逆转录。将目的基因与内参照三磷酸甘油醛脱氢酶(GAPDH)的比值作为该目的基因的相对水平。
1.9 统计学处理 应用SPSS 11.5统计软件进行统计分析,计量资料以()表示,多个样本均数的两两比较采用LSD-t检验,多样本有序分类资料的两两比较采用Ridit分析,P<0.05为差异有统计学意义。
2 结果
2.1 肝组织病理学表现 对照组肝组织肝小叶排列整齐,无病理学改变;模型组肝组织可见大量纤维沉积,肝小叶结构破坏,部分肝组织出现脂肪堆积,汇管区大片炎细胞浸润,肝组织大片出血灶,伴随着纤维组织增生,甚至有假小叶形成。肝组织内有棕褐色颗粒样物质(铁)沉积,且主要沉积在库弗细胞(KC)中;去铁铵组肝细胞变性坏死有所减轻,纤维结缔组织和假小叶形成均有所减少(图1~3)。
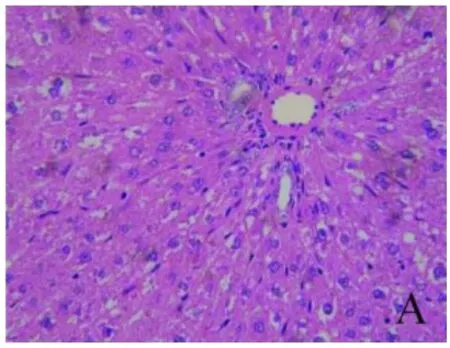
图1 肝组织病理学表现 对照组肝组织肝小叶排列整齐,无病理学改变(HE,400×)
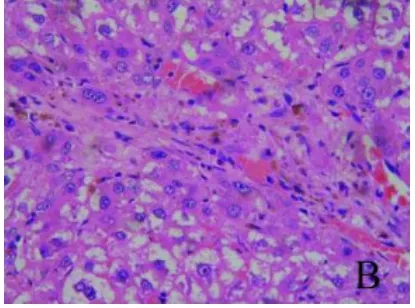
图2 肝组织病理学表现 模型组大鼠肝组织可见纤维组织增生,假小叶形成。肝组织内有棕褐色颗粒样物质(铁)沉积,且主要沉积在 KC 中(HE,400×)
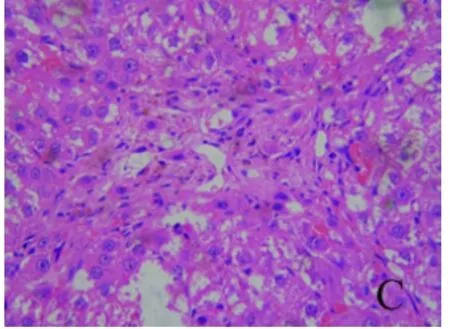
图3 肝组织病理学表现 去铁铵腹腔注射后,肝组织肝细胞变性坏死有所减轻,纤维结缔组织和假小叶形成均有所减少(HE,400×)
2.2 肝组织胶原情况 对照组肝组织仅有少量胶原纤维沉积在汇管区和中央静脉壁;模型组胶原纤维染色显著增强,可见纤维间隔,甚至有假小叶形成;去铁铵组胶原纤维增生明显减轻,纤维间隔变窄,较少有假小叶形成(图4~6)。半定量分析胶原结果表明,模型组胶原沉积较对照组和去铁铵组明显增加(P<0.05,表1)。
2.3 铁负载水平比较 经普鲁士蓝染色,结果显示各组肝组织铁负载水平不同,即呈模型组>去铁铵组>对照组趋势。深蓝色铁颗粒主要沿纤维间隔分布,铁主要沉积在KC,或为被KC吞噬(图7~9)。
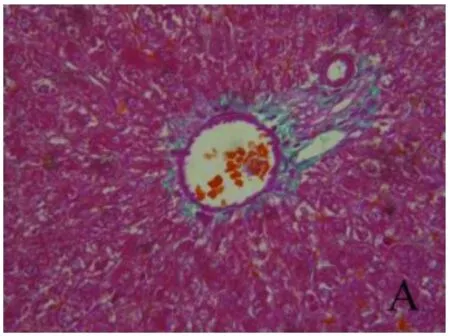
图4 肝组织胶原情况 对照组肝组织仅有少量胶原纤维沉积在汇管区和中央静脉壁(Masson,400×)
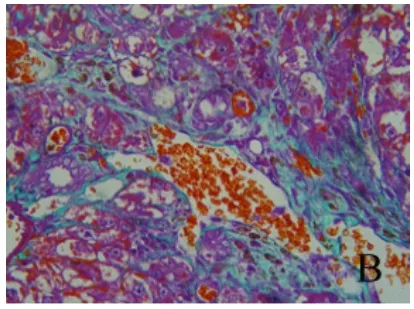
图5 肝组织胶原情况 模型组肝组织胶原纤维染色显著增强,可见纤维间隔(Masson,400×)
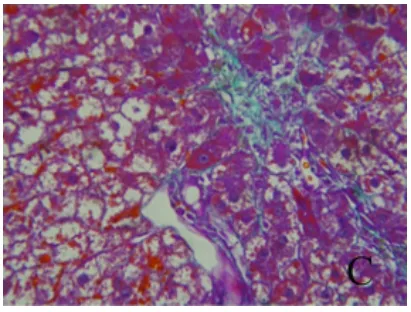
图6 肝组织胶原情况 去铁铵腹腔注射后,肝组织胶原纤维增生明显减轻,纤维间隔变窄,少有假小叶形成(Masson,400×)
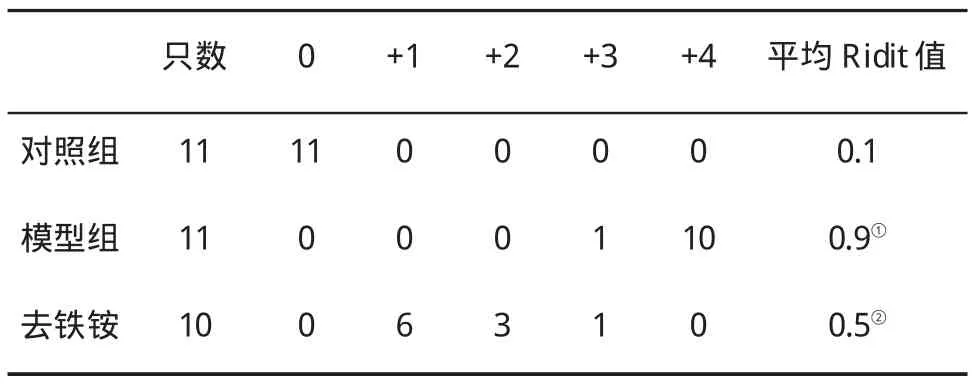
表1 各组大鼠肝组织胶原半定量结果比较
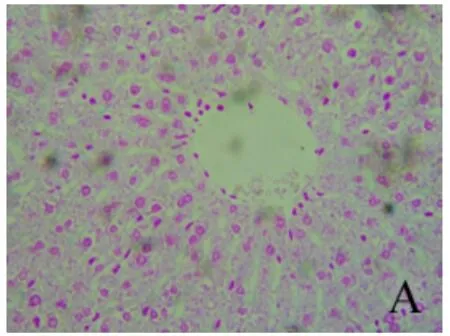
图7 肝组织铁染色结果 对照组肝组织无铁沉积(普鲁士蓝,400×)
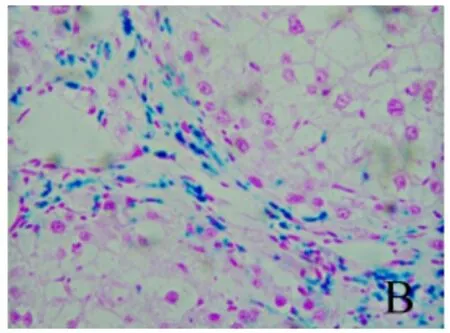
图8 肝组织铁染色结果 模型组肝组织有大量棕褐色物质(铁)沉积,主要沿纤维间隔分布,铁主要沉积在KC(普鲁士蓝,400×)
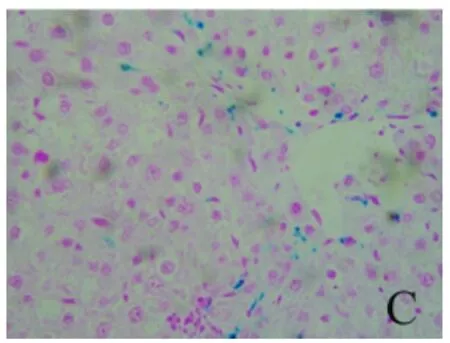
图9 肝组织铁染色结果 去铁铵腹腔注射后,肝组织铁负载明显减少(普鲁士蓝,400×)
2.4 肝组织α-SMA表达情况 在模型组肝组织坏死区周围,沿着铁颗粒分布区域,有大量α-SMA表达阳性的HSC(即活化的HSC)和吞噬铁的KC同时出现在新形成的纤维间隔中,并且在活化的HSC中也出现铁颗粒沉积,提示在DMN诱导的LF大鼠,肝组织伴随着大量HSC活化,铁主要沉积于KC和HSC(图10~11)。
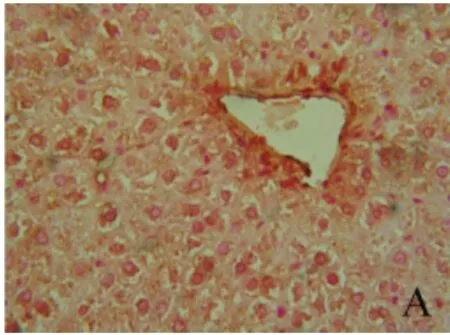
图10 肝组织α-SMA表达情况 对照组肝组织未见α-SMA表达(免疫组化,400×)
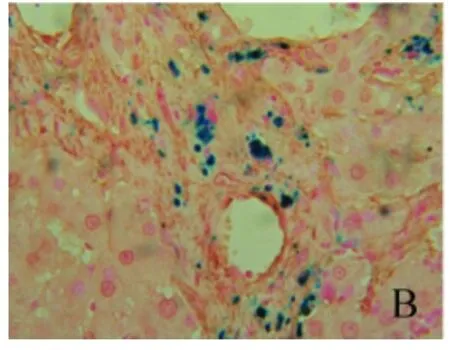
图11 肝组织α-SMA表达情况 模型组大鼠肝组织见大量α-SMA表达阳性的HSC(即活化的HSC)和吞噬铁的KC同时出现在新形成的纤维间隔中,在活化的HSC中也出现铁颗粒沉积(免疫组化,400×)
2.5 大鼠肝组织铁浓度的变化 根据实验步骤制作标准曲线(图12),结果表明,铁质量浓度在0.0~5.0 μg/mL范围内,线性良好。用标准溶液进行精密度实验,测得平均值为1.006μg/mL,相对标准偏差(RSD)为0.494%。加样回收率实验结果表明,回收率在98.86%~99.993%之间,平均回收率为99.61%。最后进行肝组织HIC测定(表2)。结果表明,模型组HIC为对照组的 1.78倍(LSD-t=5.15,P<0.01),而去铁铵组HIC较模型组则减少了23.5%(LSD-t=-2.76,P<0.05),提示正常大鼠肝组织含有一定量的铁,但随着LF的形成,铁沉积更加明显,而去铁铵处理则能减轻铁的沉积。
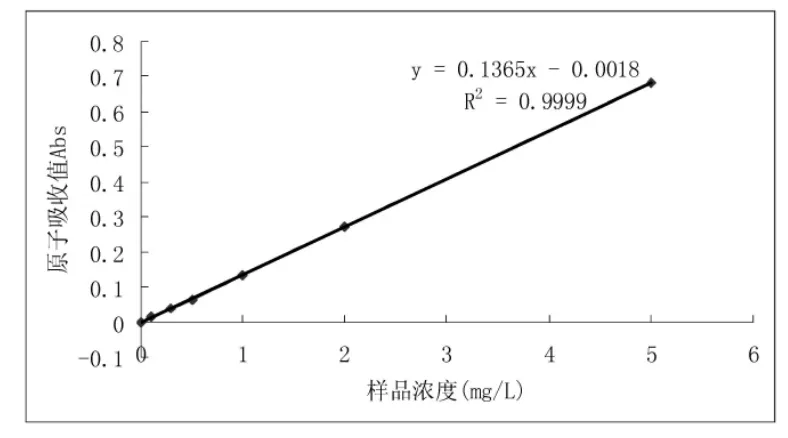
图12 铁原子吸收标准曲线和回归方程
表2 各组大鼠肝组织铁浓度(mg/g干重,)的变化
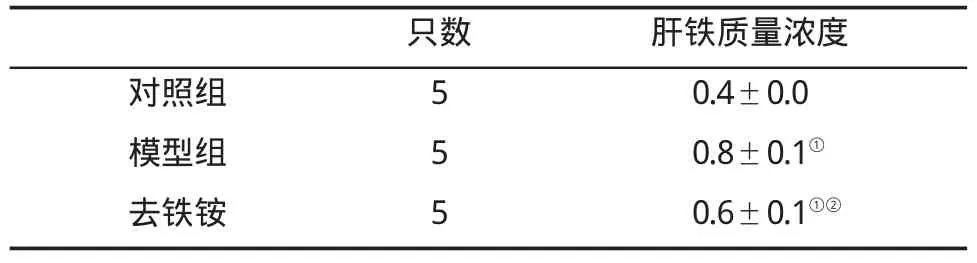
表2 各组大鼠肝组织铁浓度(mg/g干重,)的变化
与对照组比,①P<0.01或P<0.05;与模型组比,②P<0.05
只数 肝铁质量浓度对照组 5 0.4±0.0模型组 5 0.8±0.1①去铁铵 5 0.6±0.1①②
2.6 大鼠血清铁蛋白、转铁蛋白和血清铁水平变化 模型组血清铁蛋白水平是对照组的1.97倍(LSD-t=2.21,P<0.05);去铁铵能使模型组血清铁蛋白水平降低 78.5%(LSD-t=-3.52,P<0.01)。模型组血清转铁蛋白仅为对照组的 49.3%(LSD-t=-4.78,P<0.01);而经去铁铵治疗,血清转铁蛋白则增加81.4%(LSD-t=3.77,P=0.01)。模型组血清铁水平显著减少(LSD-t=-2.50,P<0.05),但去铁铵能进一步降低其血清铁水平(LSD-t=-2.43,P<0.05,表 3)。
表3 各组大鼠血清铁蛋白、转铁蛋白和血清铁水平()比较
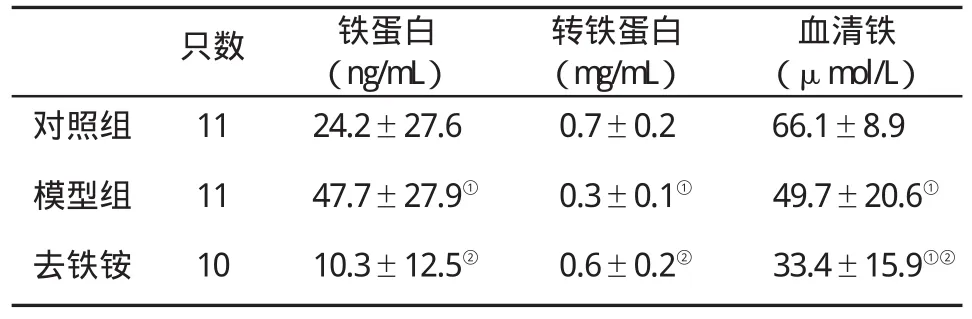
表3 各组大鼠血清铁蛋白、转铁蛋白和血清铁水平()比较
与对照组比,①P<0.05;与模型组比,②P<0.01
血清铁(μmol/L)对照组 11 24.2±27.6 0.7±0.2 66.1±8.9模型组 11 47.7±27.9① 0.3±0.1① 49.7±20.6①去铁铵 10 10.3±12.5② 0.6±0.2② 33.4±15.9①②只数 铁蛋白(ng/mL)转铁蛋白(mg/mL)
2.7 铁沉积对DMN诱导的LF大鼠肝组织TGF-β1 mRNA水平的影响 模型组肝组织TGF-β1 mRNA水平为对照组的 5.2倍[(11.896±0.639)对(2.292±0.222),LSD-t=25.95,P<0.01],而经去铁铵治疗,其TGF-β1 mRNA水平下调了 37.1%[(7.481±0.745),LSD-t=-11.95,P<0.01]。结果表明,LF大鼠肝组织TGF-β1 mRNA水平明显上调,而去铁铵能降低其水平,提示肝内铁沉积通过调控TGF-β1基因水平可能促进了LF的发生和发展。
3 讨论
Arezzini et al[4]研究显示添加羰基铁能促进亚剂量CCL4诱导的大鼠肝硬化发生。Mackinnon et al[14]报道亚毒性剂量CCL4蒸汽吸入的大鼠在添加铁和酒精后能促进LF的发展。给予酒精性肝病模型动物添加羰基铁导致了大鼠LF的组织病理学变化[15]。本课题组曾以DMN腹腔注射建立大鼠LF模型,发现铁负载和脂肪堆积是其显著的组织病理学特点[10]。
在本实验中,模型组大鼠肝损伤严重,肝组织有胶原纤维沉积、肝细胞变性坏死和大片出血灶,肝组织铁负载明显增加,铁主要沿纤维间隔分布。而用去铁铵治疗后,肝组织铁负载明显减少,胶原纤维沉积和肝细胞变性坏死明显减轻,提示铁沉积是促进大鼠LF形成的因素之一。
进一步研究发现,铁沉积于KC和 HSC并促进其活化是铁沉积影响大鼠LF发生的关键机制。首先,在DMN诱导的大鼠LF中,我们观察到铁负载的存在。用去铁铵治疗后,肝组织铁沉积和血清铁离子水平均明显下降;其次,通过普鲁士蓝染色及普鲁士蓝和α-SMA双染色发现,在LF大鼠肝组织中伴随着HSC大量活化,铁主要沉积于KC和HSC;再次,作为最重要的促纤维化细胞因子之一,肝组织TGF-β1 mRNA水平在LF大鼠明显上调,TGF-β1可通过自分泌和旁分泌途径使静止的HSC活化,从而促进LF的发生和发展。在DMN大鼠LF模型发现铁负载的KC和HSC TGFβ1蛋白表达均呈强阳性,提示铁沉积可能使KC表达TGFβ1蛋白增加从而影响HSC活化,促进了LF的进展[16]。
铁元素是细胞生长的基本物质,肝脏是铁储存的主要部位。肝脏出血是本次实验性LF大鼠的显著特征。伴随着出血性坏死及纤维化进展,红细胞中的铁主要被KC吞噬。运铁素(Ferroportin)能将储存在KC中的铁转出细胞外[17],再被HSC摄取。由于HSC存在转铁蛋白受体[18],转铁蛋白受体1(TfR1)作为一种2型跨膜蛋白,能够高亲和性地连接含三价铁的转铁蛋白,经细胞内吞途径转运到细胞内,在HSC内与铁蛋白结合,变成可储存的铁[19,20]。我们认为,在肝纤维化发生时,大量的铁沉积于肝组织并形成HSC活化的外环境,进一步促进了LF的进展,甚至导致肝硬化的发生。因此,有效地控制肝铁过载,对肝病的预防和治疗有着重要的临床意义。
[1]Batts KP.Iron overload syndromes and the liver.Mod Pathol,2007,20(Suppl 1):S31-39.
[2]Ludwig J,Hashimoto E,Porayko MK,et al.Hemosiderosis in cirrhosis:a study of 447 native livers.Gastroenterology,1997,112(3):882-888.
[3]Guyader D,Thirouard AS,Erdtmann L,et al.Liver iron is a surrogate marker of severe fibrosis in chronic hepatitis C.J Hepatol,2007,46(4):587-595.
[4]Arezzini B,Lunghi B,Lungarella G,et al.Iron overload enhances the development of experimental liver cirrhosis in mice.Int J Biochem Cell Biol,2003,35(4):486-495.
[5]Troadec MB,Courselaud B,Détivaud L,et al.Iron overload promotes cyclin D1 expression and alters cell cycle in mouse hepatocytes.J Hepatol,2006,44(2):391-399.
[6]Mueller S,Afdhal NH,Schuppan D.Iron,HCV,and liver cancer:hard metal setting the pace Gastroenterology,2006,130(7):2229-2234.
[7]Alexander J,Tung BY,Croghan A,et al.Effect of iron depletion on serum markers of fibrogenesis,oxidative stress and serum liver enzymes in chronic hepatitis C:results of a pilot study.Liver Int,2007,27(2):268-273.
[8]江远,张玲,何金洋,等.铁沉积于巨噬细胞对转化生长因子及炎症介质基因表达的影响.中国中西医结合急救杂志,2011,18(2):103-106.
[9]江远,张玲,邓远绮,等.不同铁负载水平影响肝星状细胞活化和凋亡的抗肝纤维化机制研究.中国中西医结合急救杂志,2013,20(6):369-373.
[10]江远,张玲,何金洋,等.在二甲基亚硝胺诱导大鼠肝纤维化时铁超载和脂肪堆积的作用.中西医结合肝病杂志,2009,19(2):100-102.
[11]刘明家,周志强,祖元刚,等.湿法消解-火焰原子吸收法测定动物样品中六种金属元素.光谱学与光谱分析,2012,32(7):1961-1964.
[12]何金洋,符路娣,邓文娣,等.扶正利湿解毒法体内外逆转肝纤维化. 世界华人消化杂志,2007,15(16):1781-1787.
[13]He JY,Ge WH,Chen Y.Iron deposition and fat accumulation in dimethylnitrosamine-induced liver fibrosis in rat.World J Gastroenterol,2007,13(14):2061-2065.
[14]Mackinnon M,Clayton C,Plummer J,et al.Iron overload facilitates hepatic fibrosis in the rat alcohol/low-dose carbon tetrachloride model.Hepatology,1995,21(4):1083-1088.
[15]徐光福,葛桂玲,李澎涛,等.铁剂诱发大鼠肝纤维化的组织学变化. 世界华人消化杂志,2004,12(3):714-718.
[16]Guo L,Enzan H,Hayashi Y,et al.Increased iron deposition in rat liver fibrosis induced by a high -dose injection of dimethylnitrosamine.Experiment Mol Pathol,2006,81(3):255-261.
[17]Wessling-Resnick M.Iron imports III.Transfer of iron from the mucosa into circulation.Am J Physiol Gastrointest Liver Physiol,2006,290(1):G1-G6.
[18]Bridle KR,Crawford DH,Ramm GA.Identification and characterization of the hepatic stellate cell transferrin receptor.Am J Pathol,2003,162(5):1661-1667.
[19]Umbreit JN,Conrad ME,Hainsworth LN,et a l.The ferrireductase paraferritin contains divalentmetal transporter as well as mobilferrin.Am J Physiol Gastrointest Liver Physiol,2002,282(3):534-539.
[20]Graham RM,Chua AC,Herbison CE,et a l.Liver iron transport.World J Gastroenterol,2007,13(35):4725-4736.

