138例药物性肝损伤患者影响预后的因素分析*
刘丽娜,赵建学,陆玮婷,陈广梅,陈 婉
药物性肝损伤(Drug-induced liver injury,DILI)是指药物和/或化学物质经呼吸道、消化道或静脉等途径进入人体而导致的肝脏损害[1~3]。本研究通过观察引发DILI的药物种类,评估各个专科用药风险,并通过患者人群特点和实验室指标来评估和预测影响DILI预后的可能因素,为建立我国DILI诊治指南提供一定的临床资料。
1 资料与方法
1.1 病例来源 2008年7月至2014年7月在我院住院期间被诊断为DILI的138例患者,女性94例,男性 44例;平均年龄(51.34±14.96)岁。
1.2 临床分型 采用医学科学国际组织委员会药物性肝损伤的分型标准[4,5]:(1)肝细胞型:ALT>2倍正常上限或 ALT/ALP(R)≥5;(2)胆汁淤积型:ALP>2倍正常上限或 R≤2;(3)混合型:ALT和 ALP均>2倍正常上限,R介于 2~5之间。
1.3 预后判断[6]①治愈:临床症状及体征完全消失,血清学各项指标恢复正常;②好转:临床症状及体征减轻,血清学各项指标较治疗前均好转,并低于正常上限 2倍以下;③未愈:临床症状及体征无改善,血清生化学指标改善不明显或病情加重;④死亡。
1.4 检测方法 使用普朗医疗PUZS-300全自动生化分析仪进行血生化学检测。
1.5 统计学方法 采用回顾性研究方法,记录患者性别、年龄、原发疾病、用药史、过敏史、临床表现、肝功能检查、住院时间、伴发疾病等资料,并对可能引发DILI的药物种类、临床特点、临床类型等进行统计分析。应用SPSS22.0软件,计量资料以()表示,采用t检验,计数资料采用x2检验;影响因素分析采用Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 DILI患者的一般资料 在各个年龄段患者中DILI临床类型无显著性差异(P>0.05,表1)。
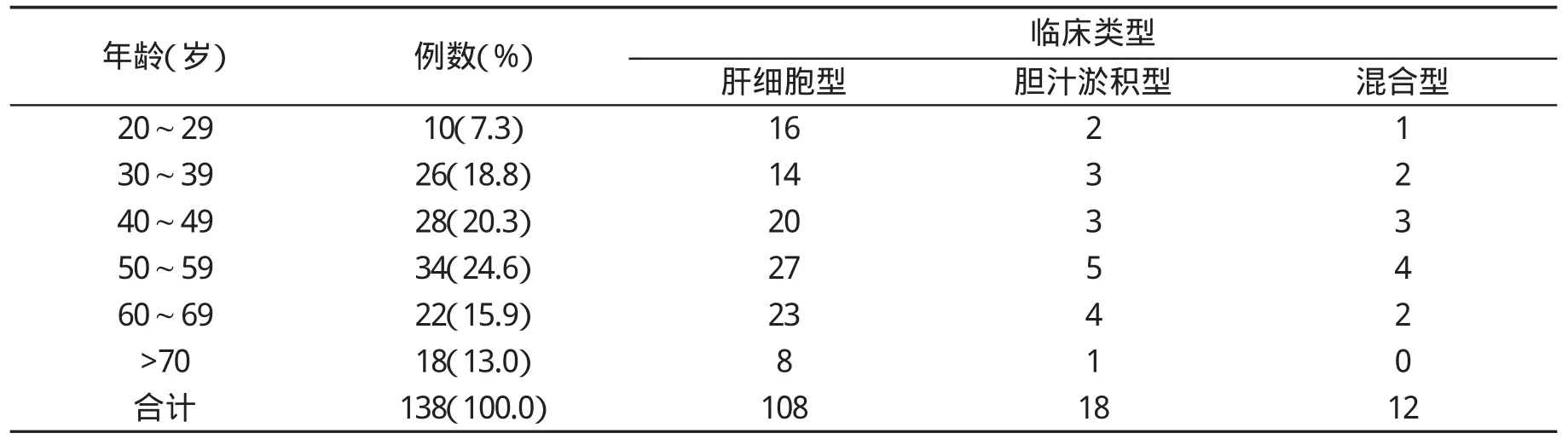
表1 138例DILI患者一般资料(%)
2.2 影响DILI患者预后的相关因素分析 在138例DILI患者中,发病者女性多于男性,临床预后为有效的为105例(76.1%),未愈33例(23.9%)。不同可疑药物引起DILI不同预后的病例数存在显著性差异(P<0.05)。中成药及中草药在所有引起DILI的药物中比例最高,预后较其他类型药物更差,其中有应用治疗脱发、银屑病的首乌藤、制首乌,治疗类风湿性关节炎的雷公藤,保健品中的蜂胶及治疗妇科疾病和肿瘤的黄药子等为甚。在2例肝衰竭患者中有1例为中药引起。其次是抗肿瘤和免疫抑制剂以及抗生素和抗真菌药,三者累计占68.11%。其它如解热镇痛剂、心血管药物和保健品引起的DILI在5.8%左右,而降糖药、抗结核药和激素类药物引起者各占4.35%,见表2。临床治疗有效和未愈患者的性别、年龄、用药至发病时间和合并慢性基础疾病等因素无显著性差异(P>0.05)。未愈患者主要为胆汁淤积型和混合型,且未愈患者中33.3%有过敏史,50%发病时有发热、皮疹或嗜酸细胞增多>6%的临床表现,见表3。

表2 临床预后与用药种类差异比较
2.3 初始发病时肝功能变化对DILI患者临床预后的预测作用 与临床治疗有效患者比,临床未愈患者在初始发病血清胆红素高、蛋白低(P<0.05,表4)。
2.4 影响DILI患者临床预后因素的Logistic回归分析 根据以上统计结果,剔除在有效与未愈患者间无统计学差异的指标变量,采用向后删除法作二项分类Logistic回归分析。结果筛选出血清TBIL、TBA和ALP等为对DILI预后有独立预测性的指标,见表5。
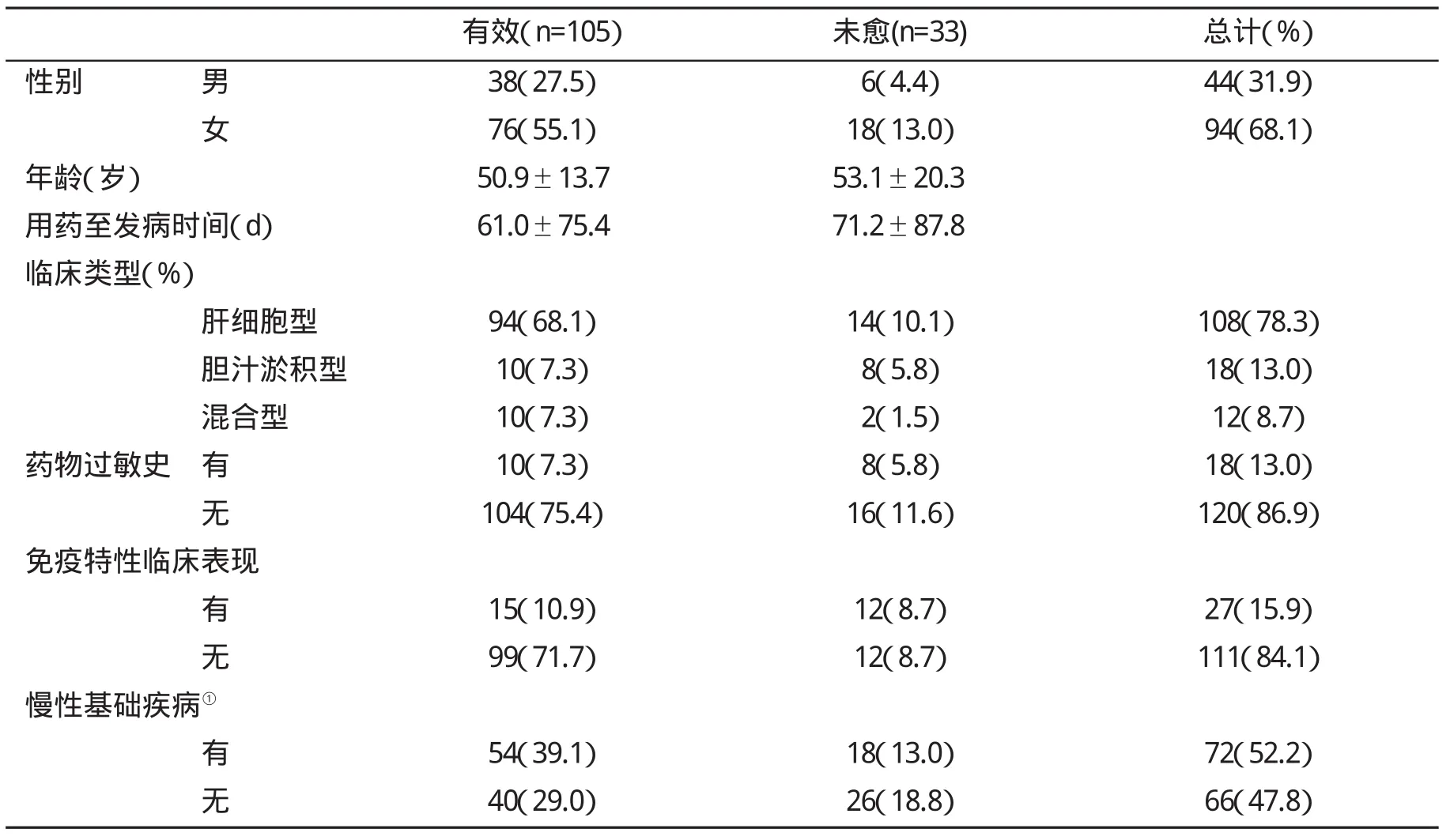
表3 影响预后的相关因素
表4 不同预后患者初始发病时肝功能()比较
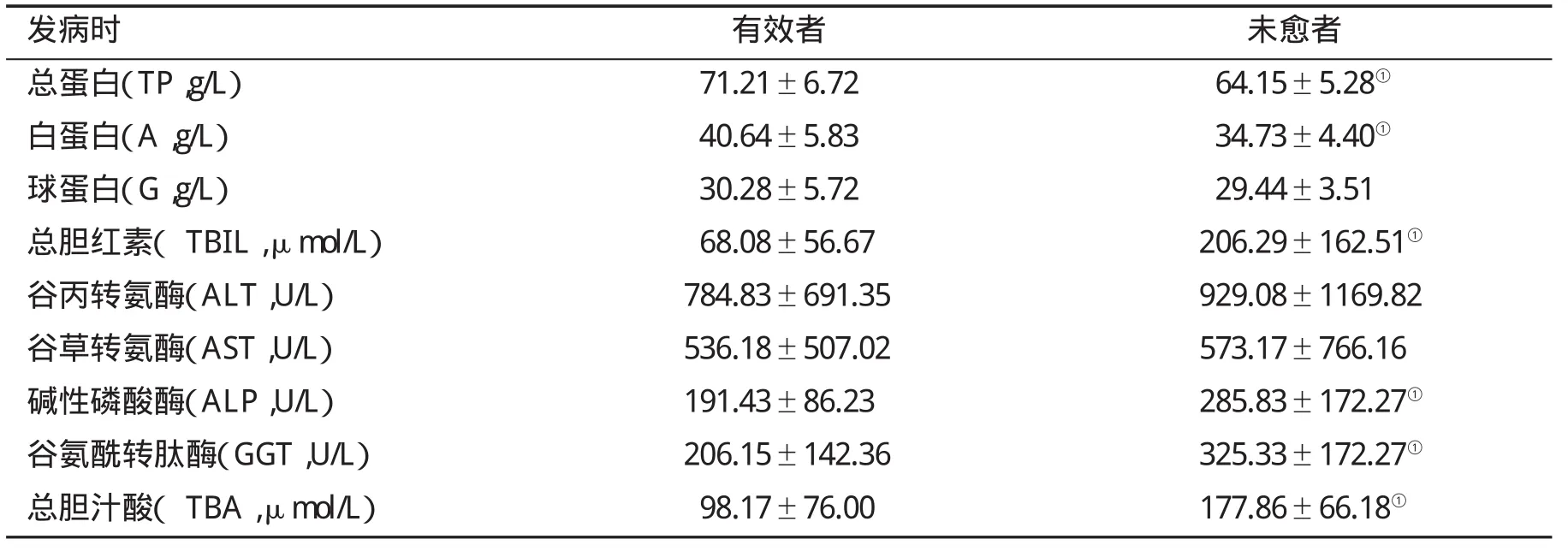
表4 不同预后患者初始发病时肝功能()比较
①P<0.05
发病时 有效者 未愈者总蛋白(TP,g/L) 71.21±6.72 64.15±5.28①白蛋白(A,g/L) 40.64±5.83 34.73±4.40①球蛋白(G,g/L) 30.28±5.72 29.44±3.51总胆红素( TBIL,μmol/L) 68.08±56.67 206.29±162.51①谷丙转氨酶(ALT,U/L) 784.83±691.35 929.08±1169.82谷草转氨酶(AST,U/L) 536.18±507.02 573.17±766.16碱性磷酸酶(ALP,U/L) 191.43±86.23 285.83±172.27①谷氨酰转肽酶(GGT,U/L) 206.15±142.36 325.33±172.27①总胆汁酸( TBA,μmol/L) 98.17±76.00 177.86±66.18①
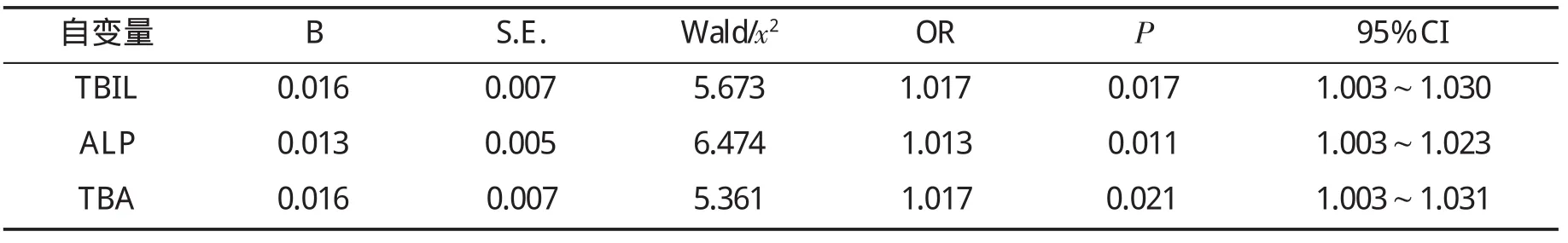
表5 影响DILI患者预后的Logistic回归分析
3 讨论
本研究发现DILI发病人群主要在40~60岁,此年龄段患者常常并存多种慢性病,长期服用多种中、西药物,而这个过程可能存在药物之间相互影响,加速诱导肝酶的代谢异常,而可疑药物再进入机体,更容易在此类人群中诱发DILI。以往国内文献中报道中草药引起的DILI多居第2或第3位[7]。本研究表明,中药引发的DILI居于首位,可能一方面中医医院的病患使用中药治疗机会较之西医医院多,另一方面中药是天然药品,很多人把中药当作保健品长期服用,加上中药本身种植、筛选、炮制和煎煮等过程中存在不当因素,增加了中药致肝毒性的风险[8]。尤其应该注意,本研究发现中药中的首乌藤、制首乌、雷公藤、蜂胶、黄药子等是引发DILI的主要药物,有些药物既往已有报道[9~12]。与其他类型的西药引起的DILI比,中药引起的DILI预后较差,有显著性差异。本研究还发现DILI主要以肝细胞型多见,其次是胆汁淤积型,混合型最少,这与以往的文献报道基本一致[13]。DILI的临床类型与预后之间没有明显的相关性。
进一步研究发现,DILI患者的临床预后与患者性别、年龄、用药至发病时间均无明显关系,而多与患者的个体差异有关。因DILI的临床表现主要是乏力、纳差、黄疸等非特异性症状,本研究发现临床未能治愈的50%患者出现了发热、皮疹、嗜酸细胞增多的药物免疫过敏反应表现[14],且患者多为过敏体质。DILI的发生易感性与至少四种基因型差异相关,即药物代谢酶基因、药物和胆汁酸跨膜转运蛋白基因、细胞应激反应基因和先天免疫或适应性免疫反应基因,包括主要组织相容性复合体(Major histocompatibility complex,MHC)区基因[15],还与线粒体损伤机制导致的细胞凋亡或坏死有关[16]。本研究存在回顾性研究的缺陷,未能对患者行基因多态性研究,但从研究结果看,确实存在个体差异对DILI预后的影响,所以临床医师针对特异性体质的人群使用有肝毒性药物时,更要注重检测血药浓度,进行个体化治疗。
Lee亦发现年龄和血清胆红素水平是药物引发肝毒性损伤患者预后的相关因素[17],且TBIL水平增高的病例预后较差。亦有研究发现TBIL>300μmol/L时,药物性肝损伤患者的病死率高达91.3%。Luo[18]在啮齿类动物实验中发现,相对于经典肝损伤指标ALT、AST、LDH,肝细胞坏死并存在胆管增生病理改变的只有TBA水平增加,特别是其中的结合胆酸牛磺胆酸(Taurocholic acid,TCA)和甘氨胆酸(Glycocholic acid,GCA),并认为血清胆汁酸水平是肝脏损伤后特定病理改变中更有价值的诊断指标。所以,本实验通过单因素方差分析发现初始发病患者肝功能中除转氨酶和球蛋白外,其他指标在治疗有效与未愈组均有显著性差异,但通过多因素的Logistic回顾分析,筛选出TBIL、TBA和ALP能独立地对预后进行预测。当然,也有研究发现传统的ALT、AST、TBIL和ALP单独或组合使用,无法侦测早期肝损伤或者提供预后的指导[19]。科学家们也正在尝试研究miRNAs作为新的具有预测作用的生物学标记物[20]。未来希望有更好的指标能够筛选容易发生DILI的人群,并有更理想的指标进行预后的预测。
[1]Navarro VJ,Senior JR.Drug-related hepatotoxicity.N Engl J Med,2006,354(7):731-739.
[2]茅益民,曾民德.药物性肝损伤的诊断.药物评价,2007,4(6):389.
[3]王凡,刘宾,李莉,等.急性药物性肝损害的临床分析和治疗探讨.中国医院用药评价与分析,2007,79(3):193-195.
[4]许彪,何卫平,张爱民,等.两种国际诊断标准对 230例药物性肝损害诊断的分析比较.中华肝脏病杂志,2007,15(12):926-929.
[5]Benichou C.Criteria of drug-induced liver disorders.Report of an international consensus meeting.J Hepatol,1990,11(2):272-276.
[6]朱斌,章福彬,刘卫,等.药物性肝损害 88例临床分析.实用肝脏病杂志,2008,11(6):396-397.
[7]张涛,贾继东.107例药物性肝损害的病因和临床特点.肝脏,2005,10:174-176.
[8]刘冬梅.中药及其制剂临床应用安全问题的分析.中国现代药物应用.2010,4(13):115-116.
[9]鄢良春,赵军宁,邱雄.何首乌安全性问题研究进展.中药药理与临床,2009,25(3):77-80,449.
[10]徐英,陈崇崇,杨莉,等.基于胆汁酸代谢网络分析中药黄药子的肝毒性.药学学报,2011,46(1):39-44.
[11]柴智,周文静,高丽.雷公藤肝毒性及其作用机制的研究进展.中国实验方剂学杂志,2011,17(7):243-246.
[12]李玥,徐立,刘若囡,等.生、制首乌醇提物对小鼠肝脏的影响.海南医学院学报,2011,17(4):452-455.
[13]戴维佳,赖荣陶,王晖.113例药物性肝损害临床特征及影响因素分析.临床肝胆病杂志,2011,27(10):1058-1065.
[14]Wysowski DK,Fourcroy JL.Flutamide hepatotoxicity.J Urol,1996,155(1):209-212.
[15]Andrade RJ,Robles M,Ulzurrun E,et al.Drug-induced liver injury:insights from genetic studies.Pharmacogenomics,2009,10(9):1467-1487.
[16]Han D,Dara L,Win S,et al.Regulation of drug-induced liver injury by signal transduction pathways:critical role of mitochondria.Trends Pharmacol Sci,2013,34(4):243-253.
[17]Lee WM.Drug-induced hepatotoxicity.N Engl J Med,1995,333(17):1118-1127.
[18]Luo L,Schomaker S,Houle C,et al.Evaluation of serum bile acid profiles as biomarkers of liver injury in rodents.Toxicol Sci,2014,137(1):12-25.
[19]Shi Q,Hong H,Senior J,et al.Biomarkers for drug-induced liver injury.Expert Rev Gastroenterol Hepatol,2010,4(2):225-234.
[20]Shi Q,Yang X,Mendrick DL.Hopes and challenges in using miRNAs as translational biomarkers for drug-induced liver injury.Biomark Med,2013,7(2):307-315.

