应用扩散张量成像研究儿童偏瘫型脑瘫皮质脊髓束损伤与临床预后的关系
贠国俊 曹建国 刘 青 曾洪武 杨 雪 王玉娟
广东深圳市儿童医院康复科 深圳 518026
白质纤维束成像(diffusion tensor tractography,DTT)是目前唯一有效观察和追踪脑白质纤维束的非侵入检查方法,能够充分显示白质纤维束的分布、走形及受损情况[1]。目前已广泛应用于成人中枢神经系统,随着技术成熟,在儿童中枢系统的应用受到重视。一些研究已经证明,是评价脑瘫患儿白质纤维束损伤很好的工具[2-3],应用DTT 技术可以分析偏瘫型脑瘫患儿皮质脊髓束(cortical spinal tract,CST)损伤程度,评价患侧肢体功能障碍程度和预后[4]。
1 资料与方法
1.1 一般资料选取2013-03—2015-03在我院康复医学科就诊且符合纳入标准的偏瘫型脑瘫患儿24例,男16例,女8例;年龄2~4岁,平均(3.2±1.1)岁。纳入标准:(1)符合2006-08 全国(长沙)小儿脑瘫学术研讨会制定的分型及诊断标准;(2)符合偏瘫型脑瘫诊断标准;(3)软化灶位于侧脑室后角、内囊、放射冠仅累及白质;(4)临床表现为患侧肢体不同程度运动障碍,研究对象均具有自主站立、走、跑、跳两大功能区运动功能;(5)患者均签署知情同意书。排除标准:(1)合并智力或认知能力低下;(2)病灶为多发病灶。
1.2 研究方法
1.2.1 影像学检查:采用MRI及DTI检查。采用GE Signa Excite 1.5T 成像系统,扫描参数:平扫采集横断位T1WI、T2WI、FLAIR,矢状位T1WI,层厚/间距均5/0.5mm,平扫T1WI采用T1flair序列,T2WI采用FRFSE-XL,DTI序列单次激发EPI,翻转角90°,21个方向,TR 9 000ms,TE 87.5 ms,回波键长度1,层厚/间隙3/0 mm。横断扫描,与结构像方向平行(平行于前后联合)。测量各兴趣区部位(ROI)FA 和ADC值和观察CST 损伤程度变化,ROI大小为4.6 mm2,为6个像素,每个区域包括3个同部位的ROI,取其平均值,然后结合患儿运动功能障碍进行综合评估。
1.2.2 数据处理:将采集到的DTI数据传输到工作站,使用GE公司提供的专用纤维束成像软件包进行DTI图像分析处理,重建CST,由同一名医学影像医师重建各向异性分数(fract-ional,FA)和 表 观 弥 散 系 数(ADC)及 方 向 编 码 彩 色(directionally encoded color,DEC)图;DEC 图中红色、绿色、蓝色分别代表左右、前后、上下走行的纤维束[5]。
1.3 评定标准(1)在DEC图中分别测量患侧及健侧CST的FA 和ADC。每个区域测量3次取平均值作为最后结果;在DEC图中观察CST 形态及亮度改变情况;在DTT 图中根据CST 与软化灶的空间位置,将两者的关系分成3级,1级:纤维束走形自然、形态完整(即接近);2级:纤维束受压、推移、稀疏(部分穿行);3 级:纤维束中断(完全穿行)。(2)患儿运动功能评估采用粗大运动功能评分(Gross Motor Function Measure,GMFM)88项[7],评估患儿D 区和E 区运动功能。
1.4 统计学分析采用SPSS 16.0 统计软件进行数据处理。所有计量资料用±s表示,患侧与健侧CST 的FA 和ADC值的比较采用配对t检验;CST 损伤与GMFM 值的相关性采用Pearson分析,P<0.05为差异有统计学意义
2 结果
2.1 患儿健侧和患侧FA 值比较24例偏瘫型脑瘫患儿患侧和健侧CST 的FA 值比较结果显示:CST 接近脑软化灶者,FA 值轻度降低,与健侧比较差异无统计学意义;CST 部分穿行及完全穿行脑软化灶者,FA 值均低于健侧,差异有统计学意义(P<0.05)。见表1。
表1 患儿健侧与患侧CST 的FA 值比较 ±s)

表1 患儿健侧与患侧CST 的FA 值比较 ±s)
?
2.2 患儿健侧和患侧ADC值比较24例偏瘫型脑瘫患儿患侧和健侧CST 的ADC值比较结果显示:CST 接近脑软化灶者ADC值轻度增高,与健侧比较差异无统计学意义;CST部分穿行及完全穿行脑软化灶者,ADC 值均明显高于健侧,差异有统计学意义(P<0.05)。见表2。
表2 患儿健侧与患侧CSTADC值比较 ±s)
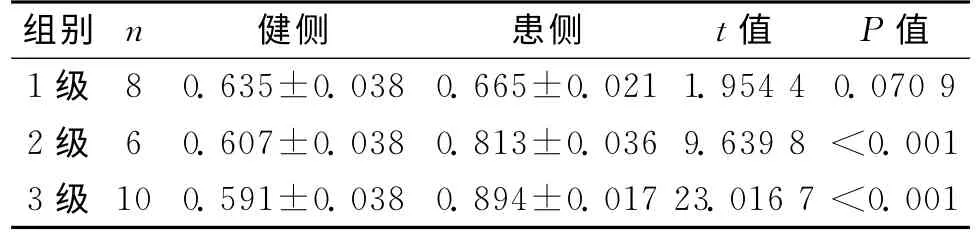
表2 患儿健侧与患侧CSTADC值比较 ±s)
?
2.3 GMFM 的D 区和E区分值比较CST 接近脑软化灶者D 区和E区的分值较部分穿行和完全穿行脑软化灶分值明显增高,差异有统计学意义(P<0.05);部分穿行较完全穿行脑软化灶患儿D 区和E区分值明显增高,差异有统计学意义(P<0.05)。见表3。
表3 患儿D 区和E区分值比较 ±s)

表3 患儿D 区和E区分值比较 ±s)
?
3 讨论
偏瘫型脑瘫是脑瘫常见的类型之一,占全部脑瘫患儿20%~33%[6-7],临床表现为患儿一侧上下肢不同程度瘫痪,运动、感觉、协调功能障碍。早期评价偏瘫型脑瘫患儿脑损伤程度和准确预测患儿预后是一大难题。虽然常规的头颅CT 和MRI可以显示部分脑瘫患儿脑内的病变,但很难准确显示病灶与神经纤维束的空间位置以及白质受损的范围[8]。
磁共振弥散张量成像是以水分子布朗运动为理论基础,在磁共振弥散加权成像(diffusion weighted imaging,DWI)基础上发展起来的成像方法,基本原理是水分子在不同组织中具有各项异性的特征,在脑组织和髓鞘白质纤维等不均值组织中表现出来弥散各项异性特征,使水分子在各方向上的扩散程度不一致,平行于白质纤维束方向的扩散能力强于垂直方向,这种具有方向依赖性的扩散即为扩散的各向异性,FA值的大小与髓鞘、微管、微丝的完整性及神经纤维排列的紧密程度、走行方向密切相关。DTI最常用的参数是FA 和ADC值,FA 是指水分子弥散的各项成分在整个弥散张量中所占比例,FA 值的变化于0~1之间,FA 值的大小与髓鞘的完整性、纤维致密性有密切关系,FA 值越大,神经传导能力越强[9-10]。ADC 值 反 映 体 内 水 分 子 弥 散 的 速 度 和 范 围,ADC和FA 值是2 个不同参数,水分子弥散受限越小,则ADC值越高,FA 值越低。Lee等[11]研究报道,部分外伤性脑损伤和脑瘫患儿的运动能力受到限制,在普通的头颅MRI不能发现任何细微的结构异常,通过DTI则发现患侧的FA值明显低于健侧。
CST 是椎体束中最大的下行纤维束,主要功能为控制肢体的随意运动,对CST 受损程度的了解有助于早期对病情及预后准确评价。本研究分别测量24例偏瘫型脑瘫患儿患侧和健侧的CST 区域的FA 值和ADC值。CST 为1级的患儿,患侧和健侧FA 值和ADC差别无明显差异,这与CST 接近病灶,但无中断和破坏相符,因此患侧的FA 值和ADC 值与健侧比较变化不大,患者GMFM 的D 区和E 区分值明显高于CST 为2级和3级的患儿,因此,患侧的肢体运动功能障碍症状较轻,CST 为2级的6例患儿,CST 部分通过软化灶,FA 值较健侧明显降低,ADC值较健侧明显增高,因CST受到不同程度破坏,所以患侧肢体的运动功能障碍较1级的患儿明显严重;患儿GMFM 的D 区和E 区分值较CST 为1级的患儿低,CST 为3级的10例患儿,CST 全部或大部分通过软化灶,DTT 显示不连续,FA 值明显降低,ADC 明显增高,由于CST 发生变性坏死,使组织结构的完整性受到破坏。通过对CST 的重建,可以观察到白质纤维束的形态和完整性,偏瘫患儿运动通路障碍可导致病灶远端CST 发生Wallerian变性,可表现为FA 值降低,为髓鞘溶解和轴突崩解使得结构完整性受损,受损区神经胶质细胞所致,受损越严重,患儿的肢体功能障碍也越严重,预后也较差。本研究发现,患儿脑损伤后CST 受损伤的程度和GMFM 评分有显著相关性,评分越低的患儿,软化灶位于皮质脊髓束的中心,即CST 为3 级:纤维束中断(完全穿行);评分越高的患儿,软化灶位于皮质脊髓束的侧方,即CST 为1 级:纤维束走形自然、形态完整。
综上所述,DTT 分级可准确、直观显示皮质脊髓束的损伤程度,通过分析DTT 分级和患儿GMFM 评分的关系,可以判断患儿的预后,并为患儿的早期康复提供影像依据。
[1] Klose U,Mader I,Unrath A,et al.Directional correlation in white matter tracks of the human brain[J].J Magn Reson Imaging,2004,20(1):25-30.
[2] Trivedi R,Agarwal S,Shah V,et al.Correlation of quantitative sensorimotor tractography with clinical grade of cerebral palsy[J]Neuroradiology,2010,52(8):759-765.
[3] Yoshida S,Hayakawa K,Yamamoto A,et al.Quantitative diffusion tensor tractography of the motor and sensory tract in children with cerebral palsy[J].Dev Med Child Neurol,2010,52(10):935-940.
[4] 贠国俊,曹建国,曾洪武,等.磁共振弥散张量在35例偏瘫型脑瘫患儿的康复评价[J].中华临床医师杂志:电子版,2013,7(11):5 101-5 103.
[5] Jellison BJ,Field AS,Medow J,et al.Diffusion tensor imaging of cerebral white matter:apictorial review of physics,fiber tract anatomy,and tumor imaging patterns[J].A Am J Neuroradiol,2004,25(3):356-369.
[6] Kontis DB,Catani MA,Cuddy MB,et al.Diffusion tensor MRI of the corpus callosum and cognitive function in adults born preterm[J].Neuroreport,2009,20(4):424-428.
[7] Inoue T,Ogasawara K,Beppu T,et al.Diffusion tensor imaging for preoperative evaluation of tumor gradein gliomas[J].Clin Neurol Neurosurg,2005,107(3):174-180.
[8] Nakayama N,Okumura A,Shinoda J,et al.Evidence for white matter disruption in traumatic brain injury without macroscopic lesions[J].J Neurol Neurosurg Psychiatry,2006,77(7):850-855.
[9] 李贻卓,黄子林,魏一飞,等.MR 弥散张量三维脑白质纤维束成像[J].南方医科大学学报,2007,27(8):1 244-1 250.
[10] 白卓杰,卢光明,张志强,等.磁共振弥散张量成像在原发全面性癫痫中的初步应用[J].医学研究生学报,2010,23(4):387-390.
[11] Lee ZI,Byun WM,Jang SH,et al.Diffusion tensor magnetic resonance imaging of microstructural abnormalities in children with brain injury[J].Am J Phys Med Rehabil,2003,82(7):556-559.

