熊果酸诱导慢性粒细胞白血病细胞凋亡过程中活性氧的生物学功能探讨
费选文 张苏伟 孟令英


[摘要] 目的 研究熊果酸对慢性粒细胞白血病细胞株K562的凋亡及其过程中活性氧自由基的作用。 方法 不同浓度UA处理后用显微镜观察K562细胞的形态学变化;用Annexin V/PI双染色法检测凋亡;用DCFH-DA法检测活性氧自由基的水平。 结果 20μmol/L浓度组可见细胞变形、坏死,40μmol/L浓度组可见细胞变形、核固缩、核碎裂和胞膜突起等现象。10、20、40μmol/L作用48h后K562细胞凋亡呈剂量依赖关系,凋亡率分别为21.66%、40.55%、70.21%,随着UA浓度的增高细胞凋亡率也增高,差异具有统计学意义(P<0.01)。熊果酸能显著增高K562细胞内的活性氧水平,且活性氧水平随着熊果酸的浓度增加而升高。平均荧光强度由48.96升至78.23,差异具有统计学意义(P<0.01)。 结论 熊果酸可诱导慢性粒细胞白血病凋亡,且活性氧自由基的水平在凋亡诱导过程中起了重要作用。
[关键词] 熊果酸;慢性粒细胞白血病;凋亡;活性氧自由基
[中图分类号] R733.72 [文献标识码] A [文章编号] 2095-0616(2015)15-27-04
[Abstract] Objective To study the effect of UA on apoptosis of ROS cell line K562 and its process. Methods Different concentrations of UA treatment after microscope was used to observe the morphological changes of K562 cells; annexin V/PI double staining method for the detection of apoptosis; variations method was used to detect the reactive oxygen species (ROS) level. Results In the 20μmol/L concentration group, the deformation and necrosis of the cells were found, and the deformation of the cells was 40μmol/L. 10, 20, 40μmol/L for 48h after apoptosis of K562 cells was dose dependent, the apoptosis rate was 21.66%, 40.55%, 70.21%, with UA concentration increased cell apoptosis rate increased. The difference is statistically significant (P<0.01). UA can significantly increase the level of reactive oxygen species in K562 cells, and the level of reactive oxygen species increases with the increase of UA concentration. The average fluorescence intensity was 48.96 to 78.23, and the difference was statistically significant (P<0.01). Conclusion UA can induce the apoptosis of chronic myeloid leukemia, and the level of reactive oxygen species plays an important role in the process of apoptosis induction.
[Key words] UA; Chronic myeloid leukemia; Apoptosis; Reactive oxygen species
熊果酸(UA)属于五环三萜类化合物,广泛分布于自然界中[1-5]。UA对多种致癌和促癌物质均有不同程度的抵抗作用,并且能够抑制多种实体肿瘤细胞的生长[1-5]。Ning等[6](2012年)探讨了来源于髓系的人白血病细胞U937中由UA诱导的细胞凋亡过程,结果表明,PKB失活和JNK活化在UA引起的细胞凋亡中发挥着重要的作用。活性氧自由基(ROS),包括H2O2和超氧化物自由基,引起细胞的氧化应激,这正是内源性凋亡途径的启动因素,如Azhar等[7](2011年)发现,在人白血病细胞株THP-1中,化合物诱导的凋亡与ROS的生成及JNK激活有关,用NAC抑制ROS的产生可以抑制JNK信号激活及凋亡,这说明正是ROS水平的增高引起上述过程。
本文通过UA诱导K562细胞凋亡,针对性检测ROS这一关键分子靶点,探讨ROS在UA诱导K562细胞凋亡过程中的作用,为UA临床应用积累有价值的参考资料。
1 材料与方法
1.1 材料
慢性粒细胞白血病细胞株K562以及熊果酸由汕头大学医学院中心实验室惠赠;RPMI-1640购自GIBCO;Annexin V/PI、DCFH-DA荧光染料购自Sigma公司。
1.2 细胞培养与分组
K562细胞在含10%胎牛血清和100U/L青霉素以及100U/L链霉素的RPMI-1640培养基里悬浮培养。取1×106个/mL浓度的细胞分四组,分别以0、10、20、40μmol/L UA作用48h。endprint
1.3 细胞形态观察
取对数生长期各组K562细胞,接种于培养瓶,48h后分别加入10、20、40μmol/L浓度的UA,处理48h后在倒置显微镜下观察细胞形态变化并拍摄记录细胞形态。
1.4 细胞凋亡检测
收集四组处理后的细胞,1500rpm离心5min,弃上清,用PBS重悬细胞并计数。取1×106个重悬的细胞,1500rpm离心5min后弃上清,加入195μL Annexin V-FITC结合液轻轻重悬细胞。再加入5μL Annexin V-FITC,轻轻混匀。室温(20~25℃)避光孵育10min。1500rpm离心5min,弃上清,加入190μL Annexin V-FITC结合液轻轻重悬细胞。加入10μL碘化丙啶染色液,轻轻混匀,冰浴避光放置。流式细胞仪检测。
1.5 细胞内ROS水平检测
DCFH-DA自由扩散进入细胞后被酯酶催化变成DCFH,在活性氧存在的情况下被氧化成DCF,后者的荧光强度与细胞内活性氧水平成正比。收集处理后1×106个/mL细胞悬液,PBS洗涤后,加入1mL Hanks液重悬,加入2.5mmol/L的CDFH-DA液40μL,使终浓度为100μmol/L,在37℃下避光孵育1h,PBS洗涤后上流式细胞仪检测。
1.6 统计学处理
使用统计学软件SPSS19.0软件进行数据分析,熊果酸诱导凋亡及ROS水平试验检测数据用()表示,两两比较使用t检验,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态变化
10μmol/L浓度组整个时间段细胞形态变化不明显;20μmol/L浓度组可见少许细胞变形、坏死,随着时间的延长变形、坏死的细胞有增多趋势;40μmol/L浓度组可见细胞变形、核固缩、核碎裂和胞膜突起等现象。见图1。
2.2 UA诱导K562细胞凋亡
不同浓度组的UA作用K562细胞后,应用流式细胞仪检测各组的细胞凋亡率。结果表明,UA作用K562细胞48h后,随着UA浓度的增高细胞凋亡率也增高,差异有统计学意义(P<0.01)。见表1。
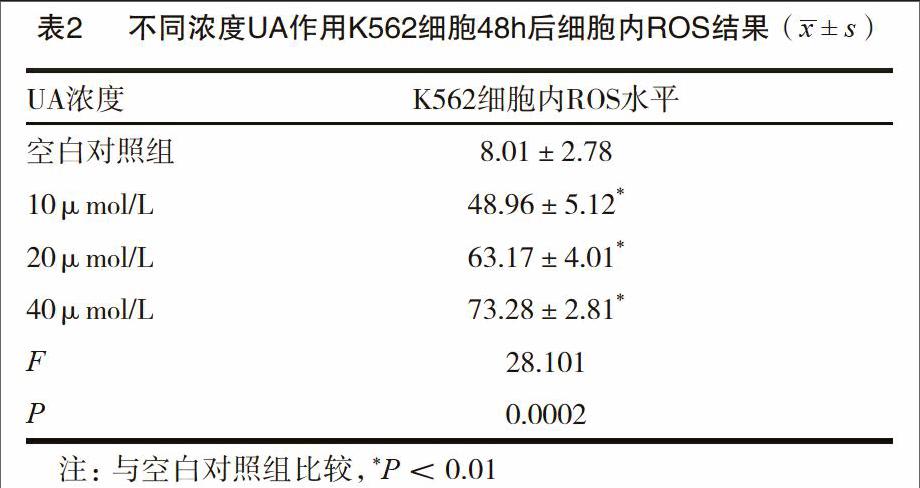
2.3 UA降低K562细胞内ROS水平
不同浓度组的UA作用K562细胞后,应用流式细胞仪检测各组的细胞内ROS水平。结果表明,UA作用K562细胞48h后,随着UA浓度的增高细胞内ROS水平呈升高趋势,差异有统计学意义(P<0.01)。见表2。
3 讨论
慢性粒细胞白血病是一种侵袭血液及骨髓的血液系统恶性肿瘤,它以产生大量的不成熟白细胞为主要特点,这些不成熟的白细胞在骨髓内聚集,抑制正常的骨髓造血功能,并且通过血液循环在全身扩散,导致机体出现贫血、出血倾向、感染及器官浸润等症状[8-16]。
细胞凋亡是维持机体细胞数量动态平衡的主要方式,凋亡机制的紊乱是肿瘤发生的重要原因,诱导肿瘤细胞凋亡是抑制肿瘤的重要手段,同时也是临床上肿瘤治疗研究的热点之一。
本研究结果显示,UA 10μmol/L浓度组整个时间段细胞形态变化不明显;20μmol/L浓度组可见少许细胞变形、坏死,随着时间的延长变形、坏死的细胞有增多趋势;40μmol/L浓度组可见细胞变形、核固缩、核碎裂和胞膜突起等现象。UA作用K562细胞48h后,随着UA浓度的增高细胞凋亡率也增高,差别具有统计学意义(P<0.01)。
UA是一种新近发现的治疗白血病中药,是五环三萜类化合物中的一个代表性药物。有研究表明UA可以通过诱导白血病细胞凋亡来实现杀伤白血病细胞的目的,在诱导凋亡的过程中需要细胞内的氧自由基的参与[17]。五环三萜类化合物的抗肿瘤作用机理非常复杂,研究者们试图从不同的方向解析其机制,很难对此类各种不同的化合物效应归纳出一个通用的作用模式,但是近年来的发现逐渐形成一个统一的主题:它们启动了细胞内源和外源的两种凋亡途径,诱导细胞凋亡。
外源性凋亡途径是由细胞表面的死亡受体的激活所启动的,在多种癌细胞中五环三萜类化合物celastrol南蛇藤素增加肿瘤坏死因子(TNF)死亡受体家族的死亡受体4(DR4)的表达[18]。内源性凋亡途径又称作线粒体凋亡途径,研究表明,在伊马替尼耐药细胞株KBM5中CDDO-Me主要是通过线粒体凋亡途径诱导细胞调亡,低浓度的CDDO-Me抑制线粒体ROS的消耗,而细胞毒性效应则是伴随迅速有选择性地使GSH下降,ROS升高。
ROS是真核生物有氧呼吸的产物包括H2O2和超氧化物自由基等,可以引起细胞的氧化应激。ROS具有反应活性高、能快速与胞内大分子物质起反应的特点,可以引起细胞内结构的病理性损伤。然而,细胞内存在抗氧化酶类,拮抗这类物质的氧化损伤,清除细胞正常代谢过程中产生的ROS物质,使得细胞内的ROS的产生和清除处于一个动态平衡。研究表明ROS可以介导细胞内的信号转导,激活相关的转录因子,从而引起相关的生物基因表达,起到调节细胞生长、增殖和凋亡的生物学功能。当细胞内ROS的动态平衡被破坏时,细胞就会受到氧化损伤,甚至死亡[19]。大量的研究证实ROS是细胞凋亡的重要信号通路之一[20]。本研究结果显示,10μmol/L的UA就可使K562细胞内的ROS水平显著升高,并且随着ROS浓度的增高ROS水平也增高,与对照组相比具有统计学意义,并可能由此激活相对应的效应机制从而引发细胞凋亡。因此,刺激细胞内产生ROS从而诱导细胞凋亡可能是UA诱导K562细胞凋亡的重要机制。
综上所述,ROS可以诱导K562细胞产生凋亡。其可能的凋亡信号通路为:UA作用于K562细胞引起细胞内的ROS水平升高,继而产生细胞的氧化损伤,激活相关的凋亡机制从而诱导细胞产生凋亡。
[参考文献]endprint
[1] Yuliang W Zejian W,Hanlin S,et al.The hypolipidemic effect of artesunate and ursolic acid in rats[J].Pak J Pharm Sci,2015,28(3):871-874.
[2] Gurovic MS,Lanza AM,Adánez MC,et al.Cytotoxic effects induced by combination of heliantriol B2 and dequalinium against human leukemic cell lines[J].Phytother Res,2011,25(4):603-610.
[3] Sung B,Park B,Yadav VR,et al.Celastrol,a triterpene,enhances TRAIL-induced apoptosis through the down-regulation of cell survival proteins and up-regulation of death receptors[J].J Biol Chem,2010,285(15):11498-11507.
[4] Samudio I,Kurinna S,Ruvolo P,et al.Inhibition of mitochondrial metabolism by methyl-2-cyano-3,12-dioxooleana-1,9-diene-28-oate induces apoptotic or autophagic cell death in chronic myeloid leukemia cells[J].Mol Cancer Ther,2008,7(5):1130-1139.
[5] Mun-OK,Dong-OM,Jin MJ,et al.Agaricus blazei extract induces apoptosis through ROS-dependent JNK activation involving the mitochondrial pathway and suppression of constitutive NF-κB in THP-1 Cells[J].Evid Based Complement Alternat Med,2011,20:176-187.
[6] Ning G,Senping C,Amit B,et al.Ursolic acid induces apoptosis in human leukaemia cells and exhibits anti-leukaemic activity in nude mice through the PKB pathway[J].BJP,2012,165:1813-1826.
[7] Azhar RH,Shahab U,Rong B,et al.Resveratrol suppresses constitutive activation of AKT via generation of ROS and induces apoptosis in diffuse large B cell lymphoma cell lines[J].PLoS One,2011,6(9):24703.
[8] Gao N,Rahmani M,Dent P,et al.2-Methoxyestradiol-induced apoptosis in human leukemia cells proceeds through a reactive oxygen species and Akt-dependent process[J]Oncogene,2005,24(23):3797-3809.
[9] Bang HS,Seo DY,Chung YM,et al.Corrigendum to:Ursolic Acid-Induced Elevation of Serum Irisin Augments Muscle Strength During Resistance Training in Men[J].Res Pharm Sci,2014,9(1):11-22.
[10] Li R,Wang X,Zhang XH,et al.Ursolic acid promotes apoptosis of SGC-7901 gastric cancer cells through ROCK/PTEN mediated mitochondrial translocation of cofilin-1[J].Asian Pac J Cancer Prev,2014,15(22):9593-9597.
[11] Swamy SM,Huat BT.Intracellular glutathione depletion and reactive oxygen species generation are important in alpha-hederin-induced apoptosis of P388 cells[J].Mol Cell Biochem,2003,245(1):127-139.
[12] Zhang T,Su J,Guo B,et al.Ursolic acid alleviates early brain injury after experimental subarachnoid hemorrhage by suppressing TLR4-mediated inflammatory pathway[J].Int Immunopharmacol,2014,23(2):585-591.endprint
[13] Bang HS,Seo DY,Chung YM,et al.Ursolic Acid-induced elevation of serum irisin augments muscle strength during resistance training in men.[J].Korean J Physiol Pharmacol,2014,18(5):441-446.
[14] Sandjo LP,Fru CG,Kuete V,et al.Elatumic acid:a new ursolic acid congener from Omphalocarpum elatum Miers (Sapotaceae)[J].Z Naturforsch C,2014,69(8):276-282.
[15] Mahmoudi M,Rabe SZ,Balali MM,et al.Ursolic acid induced apoptotic cell death following activation of caspases in isolated human melanoma cells[J].Cell Biol Int,2015,39(2):230-236.
[16] Chen HX,Xu XG,Han YY,et al.Plasma concentration and pharmacokinetics of ursolic acid carried in self-microemulsifying drug delivery system in rats studied by UPLC-MS/MS[J].Acta Pharmaceutica Sinica,2014,49(6):938-941.
[17] Liu B,Liu Y,Yang G,et al.Ursolic acid induces neural regeneration after sciatic nerve injury[J].Neural Regen Res,2013,8(27):2510-2519.
[18] Peng H,Cao F,Wang J,et al.Regulation of ursolic acid on TNF-alpha and collagen in silicotic rats[J]. Journal of Hygiene Research,2014,43(4):594-607
[19] Chen J,Fu H,Wang Z,et al.A new synthetic ursolic acid derivative IUA with anti-tumor efficacy against osteosarcoma cells via inhibition of JNK signaling pathway[J].Cell Physiol Biochem,2014,34(3):724-733.
[20] Yang Y,Zhao Z,Liu Y,et al.Suppression of oxidative stress and improvement of liver functions in mice by ursolic acid via LKB1-AMP-activated protein kinase signaling.[J].J Gastroenterol Hepatol,2015,30(3):609-618.
(收稿日期:2015-05-25)endprint

