β3肾上腺素能受体通过降低钙敏感性介导正常和心衰大鼠心脏的负性肌力作用
杨岚 李海清 李晓鹏 赵倩倩 吴博威 崔香丽
基础研究
β3肾上腺素能受体通过降低钙敏感性介导正常和心衰大鼠心脏的负性肌力作用
杨岚 李海清 李晓鹏 赵倩倩 吴博威 崔香丽
目的 探讨β3肾上腺素能受体在正常和心衰大鼠心脏中的作用机制。方法 100只(SD)大鼠(体重180~220 g)随机分成假手术组(30只)和心脏衰竭组(70只),结扎冠状动脉制成心衰模型,4周后假手术组和心衰组再随机分为β3受体激动剂BRL37344组和β3受体拮抗剂SR59230A组进行实验。结果 与假手术组相比:①4周、8周、12周后心衰组大鼠心质量指数HW/BW(心重/体重)和LVW/BW(左心重/体重)均明显升高(P<0.05),左室舒张末期内径(LVEDD)和左室收缩末期内径(LVESD)均明显增大(P<0.05),左室射血分数(LVEF)和短轴缩短率(LVFS)均明显减小(P<0.05)。②阻断 β1、β2受体给予 β3受体激动剂BRL37344后,心衰组的心率(HR)、左心室收缩压(LVSP)、左室等容收缩期室内压最大上升速率(+dp/dtmax)及左室等容舒张期室内压最大下降速率(-dp/dtmax)均下降(P<0.05),左心室舒张压(LVEDP)升高(P<0.05);阻断β3受体后以上心功能检测指标明显改善。③心衰大鼠的左心室壁β3受体表达增加。④急性分离的单个心衰大鼠心肌细胞,给予BRL37344后肌小节收缩幅度(bl%peak h)、钙瞬变(F340/380)幅度均明显下降(从0.33±0.09到0.25±0.07,P=0.074),钙敏感性降低(P<0.05)。结论 心衰大鼠心脏β3受体表达显著增加。阻断β1和β2肾上腺素能受体的情况下给予BRL37344,大鼠离体心脏功能受到抑制;心衰大鼠给予BRL37344后负性肌力作用更明显。激动β3受体使心肌细胞收缩幅度和钙瞬变幅度下降,钙敏感性降低。
心力衰竭; β3肾上腺素能受体; 钙敏感性
慢性心力衰竭是冠心病、高血压、心肌瓣膜病等各种类型心血管疾病的终末阶段,现在已逐渐成为威胁人类健康的重大公共健康问题[1,2]。由不同病因引起的缺血性心力衰竭损害心室充盈和(或)射血功能,表现为心脏舒缩功能障碍、冠状动脉储备下降、心脏泵血功能下降等等[3]。主要的生理改变有神经内分泌儿茶酚胺类等的过度释放或抑制,主要病理变化包括心肌梗死和胶原纤维增生及心室重构、]一些炎症因子的释放等变化。神经内分泌系统以交感神经和肾素-血管紧张素系统过度兴奋为主要改变,通过β肾上腺素能受体改变交感神经的张力效应来介导心衰的发生发展。传统观念认为,肾上腺素能受体中的β1和β2亚型介导儿茶酚胺对心脏的变力性和血管的舒张作用,其拮抗剂和激动剂已广泛用于心血管疾病的治疗,但长期使用有副作用和脱敏现象。1989年克隆出β3亚型[4],当时认为它主要分布在脂肪组织,对代谢起作用。近些年的研究发现,β3受体在心血管系统也有表达并具有功能,并推测其不同于β1和β2受体的机理和作用。但其机制研究的报道较少,激动β3受体对于心衰是代偿性保护作用还是致心力衰竭恶化还有争议。其变力性作用的机制也有待进一步研究。本研究用大鼠心脏左前降支结扎手术造成大鼠心衰模型,利用β3受体激动剂BRL37344和拮抗剂SR59230A研究β3受体在大鼠正常和衰竭心脏中的作用,利用单细胞钙成像技术观察激动正常和心衰大鼠心脏β3受体引起负性变力性效应的机制。
1 材料与方法
1.1 实验动物 SD大鼠,雄性,180~220 g,100只,购于中国人民解放军军事医学科学院实验动物中心[SCXK(京)2009-0019]。随机分成假手术组(30只)和心脏衰竭组(70只),采用冠状动脉结扎的方法制作大鼠心衰模型。相同条件下喂养,4周后假手术组存活27只,心衰组存活41只。假手术组随机分为BRL37344组(12只)和SR59230A组(15只);心衰组随机分为BRL37344组(21只)和SR59230A组(20只),对照均为前后对照。
1.2 试剂 BRL37344、SR59230A、P型胶原酶、Fura-2 AM均购买于美国Sigma公司。其他试剂购自上海生工生物工程有限公司。抗β3受体的抗体购自上海博研生物科技有限公司。
1.3 超声心动检测 4周后,用超高分辨率小动物超声实时影像系统(型号vivid6/dimension,美国)分别对假手术组和心衰组大鼠进行检测。测量指标包括左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室射血分数(LVEF)、左室短轴缩短率(LVFS),选择5个心动周期测量,取平均值。
1.4 心质量指数HW/BW和左心室质量指数LVW/BW测量 用10%水合氯醛麻醉大鼠,打开胸腔迅速摘取心脏,称取全心重量(heart weight,HW),然后减去左右心房及残余的右心室壁,保留室间隔和左心室,称取左心室重量(left heart weight,LVW),最后计算全心质量指数和左心室质量指数HW/BW和LVW/BW。
1.5 心脏功能检测 离体心脏连接于Langendorff灌流装置(型号ML870,上海艾德仪器国际贸易公司),用台式液按7 ml/min的速度进行灌流,待心脏收缩稳定后,记录一段正常收缩数据即为对照,然后依次给予BRL37344和SR59230A,下次给药之前不清洗。其中灌流台式液(Tyrode′s solution)(单 位 :mmol/L) 成 分 :KCl 5.4,NaH2PO40.33,HEPES 5.0,Glucose 10.0,MgCl21.0,NaCl 140,CaCl21.80灌流液以95%O2和5%CO2充分饱和,灌注压 60 mm Hg(1 mm Hg=0.133 kPa)左右,温度39℃,用1 mmol/L的NaOH调pH至7.38。用LabChart分析软件测量分析左室收缩压(LVSP)、左室舒张压(LVEDP)、左室等容收缩期室内压最大上升速率(+dp/dtmax)、左室等容舒张期室内压最大下降速率(-dp/dtmax)。
1.6 免疫组织化学法 分别剪取假手术组和手术组左心室前壁坏死区域边缘部分和非坏死部分,迅速将组织放入甲醛中。蜡块包埋,切片厚度5μm,再经过脱蜡、抗原修复,加兔抗鼠anti-β3受体一抗、二抗试剂盒,加SABC封闭及DAB显色剂显色后,镜下观察β3受体的表达。
1.7 单细胞收缩和钙瞬变同步检测 分离单个心衰大鼠心肌细胞后,使用200目的滤网将多余的组织纤维过滤得到单个心肌细胞悬液,加入标准KB液清洗2次后4℃保存。KB液(单位:mmol/L)成分如下:L-Glutamine 50.0,KCl 30.0,Taurine 20.0,KH2PO430.0,HEPES 10.0,Glucose 10.0,MgCl21.0,EGTA 0.5,KOH 85.0。温度39℃,用1 mmol/L的KOH调pH至7.38。实验前,避光条件下在细胞悬液中加入荧光染料Fura-2 AM,使细胞负载荧光探针30 min后,洗去多余荧光染料。将一滴细胞悬液滴于灌流槽内,使其贴壁10 min后,给予有钙台式液(1.5 mmol/L)灌流20 min后用药,灌流速度为1.2 ml/min。 然后用IonOptix离子影像系统(美国IonOptix公司)同步测量单个细胞收缩和钙瞬变。细胞收缩用肌小节缩短幅度表示为bl%peak h(bl%peak h为肌小节相对缩短幅度,dep v:最大收缩速率,ret v:最大舒张速率)。钙瞬变以△Ca表示[△Ca:钙瞬变 F340/380 比值的变化幅度。+d(Ca)/dtmax:收缩期钙最大上升速率。-d(Ca)/dtmax:舒张期钙最大下降速率]。钙敏感性表示为CaS,为钙瞬变幅度和收缩幅度的比值。实验中用铂丝电极给予持续场刺激,电压15 V,频率1.0 Hz。待心肌细胞收缩稳定后记录一段数据即为对照,然后依次给予BRL37344和SR59230A,下次给药之前不清洗,均为前后对照。
1.8 统计学方法 用SPSS 13.0统计软件进行数据分析。实验数据以±s表示,采用完全随机单因素方差分析(ANOVA)。P<0.05认为差异有统计学意义。
2 结果
2.1 心动超声检测结果 假手术组和心衰组两组心动超声图像显示,假手术组大鼠左室心腔未见扩大,心室前壁后壁均正常收缩(图1A)。与假手术组相比,手术4周、8周、12周的大鼠心腔有扩张,心室后壁收缩基本完好,但前壁几乎无收缩。数据显示,LVEDD和 LVESD均有明显增大(P<0.05),LVEF和 LVFS均有明显减小(P<0.05)(图 1B、C、D,表1),证明心衰模型造模成功。
2.2 心质量指数HW/BW和左心室质量指数LVW/BW 从表2可以看到,与假手术组相比,12周后的心衰组大鼠心质量指数HW/BW和LVW/BW 均有明显升高(P<0.05)。
表2 两组大鼠存活率、HW/BW和LVW/BW 比较(±s)

表2 两组大鼠存活率、HW/BW和LVW/BW 比较(±s)
注:HW/BW:全心质量指数;LVW/BW:左心室质量指数。与假手术组相比,aP<0.05
组别 例数 存活率(%)HW/BW(mg/g)LVW/BW(mg/g)假手术组 6 90 3.21±0.36 2.25±0.24手术组 7 60 3.81±0.18a 3.05±0.25a
2.3 左心室功能测定 左心室Langendorff离体心脏灌流的结果表明,选择造模12周后的大鼠心脏,在β1和β2肾上腺素能受体阻断剂普萘洛尔(Propranolol)干预的情况下,待收缩稳定后观察记录一段,即为对照组;再给予BRL37344约10 min,收缩稳定后在不清洗情况下最后给与SR59230A,观察记录结果。与假手术对照组和心衰对照组相比,假手术BRL组和心衰BRL组的心率(HR)、LVSP、+dp/dtma及-dp/dtmax的绝对值均有明显降低(P<0.05),LVEDP 明显升高(P<0.05);和对照组相比,假手术SR组和心衰SR组均无明显变化,未见统计学差异(P>0.05)。见表3和图 2。
表1 假手术组和手术组大鼠心动超声结果比较(±s)

表1 假手术组和手术组大鼠心动超声结果比较(±s)
注:LVESD:左室收缩末期内径;LVEDD:左室舒张末期内径;LVEF:左室射血分数;LVSF:短轴缩短率。与假手术组相比,aP<0.05
组别 例数LVESD(mm)LVEDD(mm)0 4 8 12 0 4 8 12假手术组 9 3.41±0.22 3.51±0.15 3.69±0.15 3.52±0.15 5.54±0.32 5.62±0.17 5.75±0.15 5.59±0.32手术组 16 3.45±0.22 3.78±0.11a 4.03±0.15a 5.74±0.64a 5.52±0.37 5.84±0.13a 6.00±0.22a 6.84±0.46a组别LVEF(%)LVSF(%)0 4 8 12 0 4 8 12假手术组 74.90±1.07 73.00±1.41 73.00±2.28 71.80±2.64 38.00±1.00 37.00±1.79 35.30±1.63 35.20±2.14手术组 77.30±0.97 68.20±1.17a 64.20±3.87a 48.30±4.84a 36.30±2.42 34.70±1.03a 31.30±2.58a 24.50±3.21a
2.4 心衰大鼠心脏β3受体的表达增加 记录完手术12周大鼠的HW/BW和LVW/BW后,剪取实验鼠心脏左心室手术结扎部位的边缘部分,H&E染色可观察到假手术组大鼠左心室前壁心肌细胞基本排列整齐,心肌纤维完整,几乎无细胞间隙扩张及细胞肥大现象(图3A)。手术组左心室前壁结扎处有一部分心肌细胞坏死,细胞间隙扩张,细胞有轻到中度肥大,有胶原纤维增生变粗,且有心肌细胞排列紊乱现象(图3B),细胞有轻到中度肥大。
免疫组织化学法检测,镜下可看到靠近细胞膜表面附近有较多β3受体的表达,有些细胞的胞浆中也可见到其广泛表达。按照人工定性或半定量评分判定方法:着色范围,估算阳性细胞百分比,即视野内阳性细胞数所占细胞总数的百分比。0分:0%阳性细胞;1分:阳性细胞百分比<10%;2分:11%~50%;3分:51%~80%;4分:>80%。着色强度,即阳性细胞着色程度。0分,阴性;1分:弱阳性;2分:中等阳性;3分:强阳性。最后,将着色范围分数和着色强度分数相乘,然后用统计方法计算总分数,即为最终免疫组织化学染色结果。每张切片随机取至少 6个 100×视野(图 3C、D、E、F,表 4)。
表4 左心室组织β3受体表达分数比较(±s)
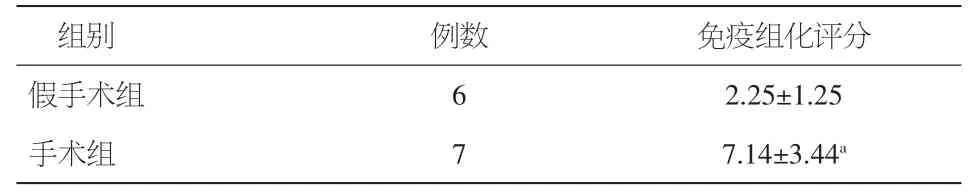
表4 左心室组织β3受体表达分数比较(±s)
注:与假手术组相比,aP<0.05
组别 例数 免疫组化评分假手术组 6 2.25±1.25手术组 7 7.14±3.44a
2.6 激动β3受体使心衰心脏的单个心肌细胞钙敏感性下降 与sham组相比,心衰心肌细胞给予BRL37344后,肌小节收缩幅度bl%peak h明显减小(P<0.05)(见图 4A),钙瞬变幅度(△Ca)也有下降(见图4B);肌小节最大收缩速率和最大舒张速率均下降(P<0.05)(见表5);收缩期细胞内钙上升速率和舒张期细胞内钙下降速率均降低(P<0.05)(见图 4B、C,表 5)。SR59230A 阻断 β3受体后,肌小节收缩幅度、收缩速率和舒张速率无明显变化,钙瞬变幅度(△Ca)却明显下降(P<0.05)(见图 4D),说明收缩同样的幅度需要较少的细胞内钙,即阻断β3受体可以增加钙敏感性(见表 5)。BRL37344激动β3受体后,心肌细胞的钙敏感性下降(P<0.05)(n为细胞个数)。见图4E、表 5。
3 讨论
激动哺乳动物β1和β2肾上腺素能受体引起心率加快、心肌收缩力加强和心肌舒张速度加快[5,6]。而激动心肌的β3肾上腺素能受体则可以拮抗β1和β2受体起到负性肌力作用[7,8],这种作用在交感神经过度激活时对心脏可能有保护作用[9]。因此许多研究者利用β3受体激动剂观察其心肌保护作用[10]。近年来的研究结果显示,β3受体激动剂如BRL-37344、nebivolol等对家兔急性心肌缺血/再灌注(I/R)损伤的左室心功能有显著的保护作用[11,12]。外科移植手术在心脏保存液中加入β3受体激动剂如Nebivolol、CL 316243和BRL 37344等可改善心脏的功能[13]。β3受体激动剂介导的家兔心脏负性肌力作用与肌膜L-型钙电流的抑制有关[14]。激动家兔心肌细胞β3受体可以导致Na+/K+泵活性增加[15]。Na+/K+泵活性增加使细胞内Na+浓度下降,减少了由Na+/Ca2+交换途径进入细胞内的Ca2+,使肌浆网(SR)Ca2+储备减少,下次收缩时释放的游离钙浓度降低,因而发挥负性肌力作用。在心衰的心肌,β3受体表达增加,其活性上调对心脏可能是一种有益的补偿作用[16-18],可以对抗交感神经过度激活的作用。但是心衰时β3受体上调随着疾病的进程对心脏是有害的[19,20]。
表3 大鼠心脏左心室功能检测结果比较(±s)

表3 大鼠心脏左心室功能检测结果比较(±s)
注:HR:心率;LVSP:左心室收缩压;LVEDP:左心室舒张压;+dp/dtmax:左室等容收缩期室内压最大上升速率;-dp/dtmax:左室等容舒张期室内压最大下降速率。与假手术对照组相比,aP<0.05;与手术对照组相比,bP<0.05
组别例数LVEDP(mm Hg)LVSP(mm Hg)HR(BPM)-dp/dtmax(mm Hg/s)+dp/dtmax(mm Hg/s)假手术组 15对照 7.46±3.74 80.66±20.79 205.30±30.27 -1036.33±256.46 1912.03±296.61 BRL 25.54±22.79a 75.58±24.91a 163.90±21.24a -868.61±232.02a 1344.624±221.32aSR 16.10±8.27 91.68±16.07 171.04±20.47 -1080.39±134.13 1779.40±346.10手术组 17对照 5.89±17.25 47.63±27.72 177.63±31.08 -600.55±222.60 766.05±257.18 BRL 35.47±18.53b 63.37±18.29b 141.75±18.50b -444.50±115.90b 612.60±191.36bSR 8.90±24.83 44.54±24.94 188.09±26.05 -576.07±150.39 805.40±200.04
表5 单个心肌细胞肌小节收缩、钙瞬变和钙敏感性比较(±s)

表5 单个心肌细胞肌小节收缩、钙瞬变和钙敏感性比较(±s)
注:bl%peak h:肌小节相对缩短幅度;dep v:最大收缩速率;ret v:最大舒张速率;△Ca:钙瞬变F340/380比值的变化幅度;+d[Ca]/dtmax:收缩期钙最大上升速率;-d[Ca]/dtmax:舒张期钙最大下降速率;CaS:钙敏感性。与对照组相比,aP<0.05
组别 例数 Cell Shortening Calcium Transient CaS bl%peak h(μm) dep v(μm/ms) ret v(μm/ms) △Ca +d[Ca]/dtmax -d[Ca]/dtmax对照组 14 9.88±2.73 -3.88±1.32 2.52±0.88 0.33±0.09 28.85±6.24 -2.80±1.70 0.09±0.04 BRL 组 6 4.91±1.73a -1.58±1.80a 0.98±0.45a 0.25±0.07 17.70±0.67a -1.20±0.36a 0.15±0.03aSR 组 7 9.98±1.89 -3.65±1.20 2.39±0.99 0.21±0.11a 21.13±5.65a -1.44±1.50a 0.07±0.01a
本研究免疫组化的结果显示,心衰大鼠心脏β3受体的表达增加,心功能下降(图3D、F和图1B、C、D)。正常心脏肾上腺素能受体主要是β1和β2受体,而随着心脏疾病的迁延,β3受体的表达增加,受体表达的分布发生变化,因此其对心脏的作用也较为复杂。在手术12周后HF组大鼠心室前壁收缩明显消失,心脏射血分数减少,阻断β1、β2受体后,给予β3受体激动剂BRL37344表现出负性肌力作用,可以推测在心衰的发展过程中激动β3受体起到了一定的作用。研究中给予β3受体拮抗SR59230A,对正常大鼠心脏功能没有太大影响,一方面可能是由于正常心脏β3受体表达量极少,另一方面由于β1和β2受体在心脏中正性变力的主导地位。
β3受体对心脏的负性肌力作用包括抑制L-型Ca2+电流、激活Na+/K+泵、影响钠钙交换而降低细胞内钙释放和舒张期钙摄取、降低细胞内游离钙浓度。但是其机制还有待进一步研究。我们应用大鼠心衰模型观察了激动和抑制β3受体对单细胞收缩和钙瞬变的作用,结果显示,激动β3受体可以使大鼠心肌细胞钙瞬变和收缩幅度均减小,而且会降低心肌细胞的钙敏感性。抑制β3受体后心肌细胞钙敏感性增加。
综上所述,我们的结果表明心衰大鼠心脏β3受体表达显著增加。用BRL37344激动β3受体,大鼠左心室收缩功能受到抑制,对心衰大鼠负性肌力作用更强。激动β3受体使心肌细胞收缩和钙瞬变幅度下降,其作用机制是降低了心肌细胞的钙敏感性。阻断β3受体后不改变心肌细胞收缩幅度,但是钙瞬变幅度下降,钙敏感性升高。
致谢:实验过程中得到山西医科大学生理系张宇、赵录英、张炜芳、王瑾、白晓洁等老师的大力帮助。在此表示诚挚的感谢!

图1 大鼠心脏心动超声检测结果
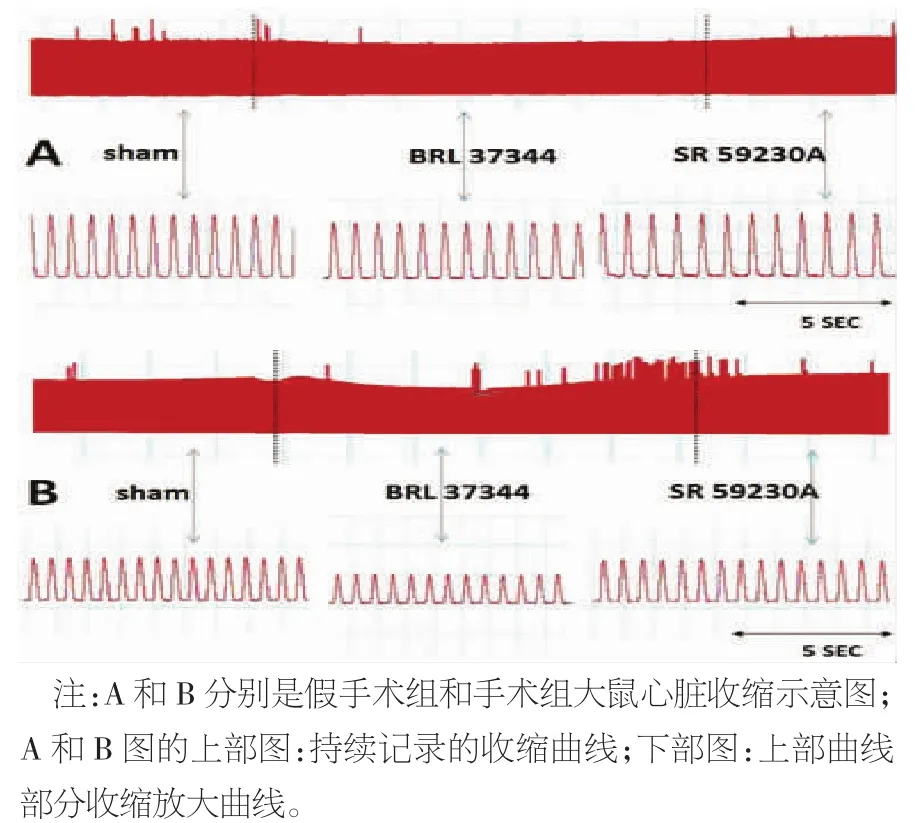
图2 心脏收缩曲线示意图
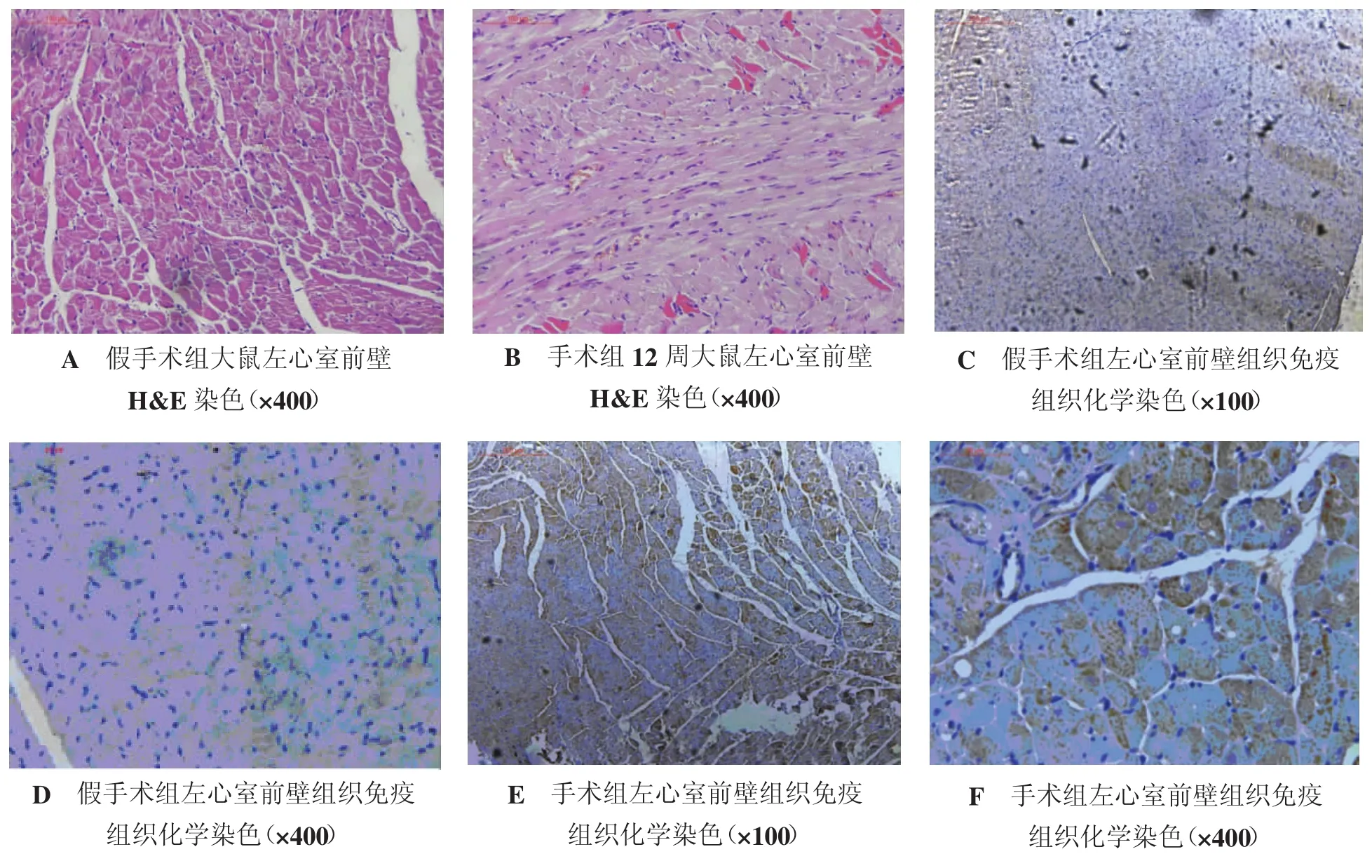
图3 假手术组和手术组大鼠心脏中β3受体的表达
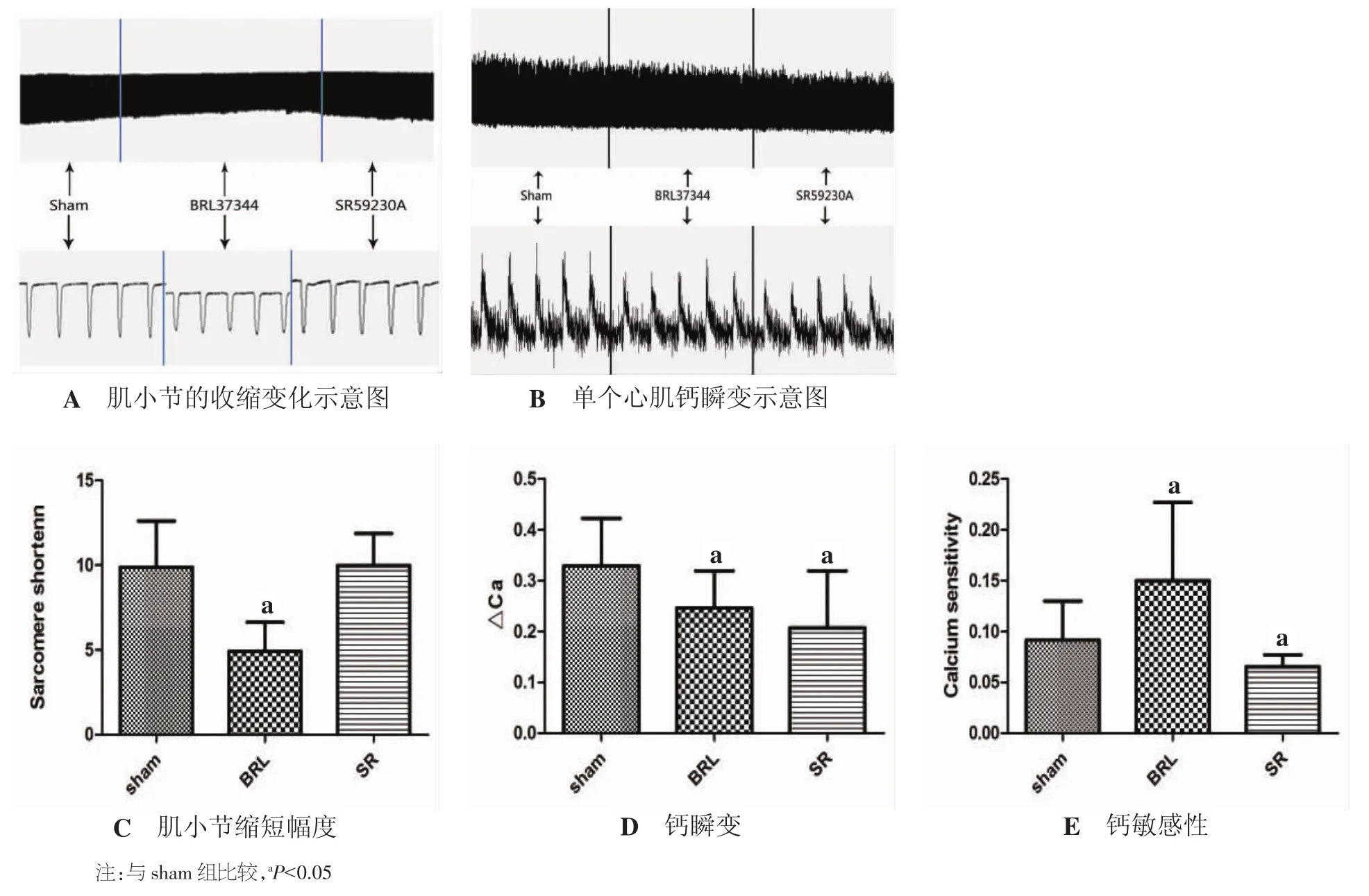
图4 激活β3受体单个心肌细胞钙敏感性降低
[1]杨水祥,胡大一.心力衰竭的新机制和新策略研究进展.中国心血管病研究,2005,3:403-405.
[2]鲍国萍,徐达华,高潮,等.白细胞介素-18与心力衰竭关系的探讨.中国心血管病研究,2007,5:836-837.
[3] Wang Y,Yuan J,Qian Z,et al. β2 adrenergic receptor activation governs cardiac repolarization and arrhythmogenesis in a guinea pig model of heart failure.Sci Rep,2015,8:7681.
[4]Emorine LJ,Marullo S,Briend-Sutren MM,et al.Molecular characterization ofthe human beta 3-adrenergic receptor.Science,1989,245:1118-1121.
[5]Chen Z,Miao G,Liu M,et al.Age-related up-regulation of beta3 adrenergic receptor in heart failure rats.J Recept Signal Transduct Res,2010,30:227-233.
[6]Brodde OE,Bruck H,Leineweber K.Cardiac adrenoceptors:physiological and pathophysiological relevance.J Pharmacol Sci,2006,100:323-337.
[7]Napp A,Rixius K,Pott C,et al.Effects of the β3-Adrenergic AgonistBRL 37344 on EndothelialNitric Oxide Synthase Phosphorylation and Force of Contraction in Human Failing Myocardium.Journal of Cardiac Failure,2009,15:57-67.
[8]Gauthier C,Sèze-Goismier C,Rozec B.Beta 3-adrenoceptors in the cardiovascular system.Clin Hemorheol Microcirc,2007,37:193-204.
[9]Nantel F,Bonin H,Emorine LJ,et al.The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization.Mol Pharmacol,1993,43:548-555.
[10]Gauthier C,Rozec B,Manoury B,et al.Beta-3 Adrenoceptors as New Therapeutic Targets for Cardiovascular Pathologies.Curr Heart Fail Rep,2011,8:184-192.
[11]Sorrentino SA,Doerries C,Manes C,et al.Nebivolol exerts beneficial effects on endothelial function,earlyendothelial progenitor cells, myocardial neovascularization, and left ventricular dysfunction early after myocardial infarction beyond conventional beta1-blockade.J Am Coll Cardiol,2011,57:601-611.
[12]García-Prieto J,García-Ruiz JM,Sanz-Rosa D ,et al. β3adrenergic receptor selective stimulation during ischemia/reperfusion improves cardiac function in translational models through inhibition of mPTP opening in cardiomyocytes.Basic Res Cardiol,2014,109:422.
[13]Aragón JP,Condit ME,Bhushan S,et al.Beta 3-Adrenoreceptor Stimulation Ameliorates Myocardial Ischemia-Reperfusion Injury Via Endothelial Nitric Oxide Synthase and Neuronal Nitric Oxide Synthase Activation.J Am Coll Cardiol,2011,58:2683-2691.
[14]Treinys R,Zablockait D,Gendvilien V,et al.Βeta 3-Adrenergic regulation of L-type Ca2+current and force of contraction in human ventricle.J Membr Biol,2014,247:309-318.
[15]Bundgaard H,Liu CC,Garcia A,et al.β(3)adrenergic stimulation of the cardiac Na+-K+pump by reversal of an inhibitory oxidative modification.Circulation,2010,122:2699-2708.
[16]Li B,Zhao Q,Wang LX,et al.Effect of β3-Adrenergic Receptor on Atrial L-type Ca2+Current in Rats with Chronic Heart Failure.Heart,Lung and Circulation,2014,23:369-377.
[17]Ovize M,Baxter GF,Di Lisa F,et al.Postconditioning and protection from reperfusion injury:where do we stand?Cardiovasc Res,2010,87:406-423.
[18]Reiken S,Wehrens XH,Vest JA,et al.Beta-blockers restore calcium release channel function and improve cardiac muscle performance in human heart failure.Circulation,2003,107:2459-2466.
[19]Ignarro LJ.Different pharmacological properties of two enantiomers in a unique beta-blocker,nebivolol.Cardiovasc Ther,2008,26:115-134.
[20]Flather MD,Shibata MC,Coats AJ,et al.Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure.Eur Heart J,2005,26:215-225.
Activation of β3-adrenergic receptor mediated negative inotropic action through decreasing calcium sensitivity of rat ventricular myocytes
YANG Lan,LI Hai-qing,LI Xiao-peng,et al.Department of Physiology at Shanxi Medical University,Taiyuan 030001,China
CUI Xiang-li,E-mail:cuixlcxl@sina.com
Objective To observe the mechanism underlying the activation of β3-adrenoceptor(β3AR)in normal and heart failure(HF)rats.Methods 100 SD rats (weighting 180-220 g)were randomly divided into sham group(n=30) and HF group(n=70).Rat models were established by coronary artery ligation.After 4 weeks of surgery,Sham group and HF group were randomly divided into BRL37344 treated and SR59230A treated groups.Results Compared with the sham group.⑴After 4,8 and 12 weeks the index of ventricular HW/BW and LVW/BW were significantly decreased(P<0.05).Left ventricular end-diastolic diameter (LVEDD)and left ventricular end-systolic diameter(LVESD)were significantly increased(P<0.05),left ventricular ejection fraction(LVEF)and fractional shortening(LVFS)were significantly decreased(P<0.05).⑵After blockade of β1and β2receptors as well as activing β3receptors,the heart rate(HR),left ventricular systolic pressure (LVSP),left ven-tricular systolic isovolumic ventricular pressure maximal rate of rise(+dp/dtmax)and left ventricular isovolumic relaxation pressure and maximal rate of decrease(-dp/dtmax)were significantly lowered(P<0.05),while left ventricular diastolic pressure(LVEDP)was increased(P<0.05).After blockade of β3receptor,hemodynamic parameters were reversed.⑶The expression of β3receptors in the left ventricular wall increased in the HF rats after 4,8 and 12 weeks of the ligation surgery.⑷In the isolated single cardiomyocytes,the amplitude of sarcomere contraction(expressed as bl%peak h)and calcium transient(expressed as △Ca)decreased in presence of BRL 37344 in HF rats(from 0.33±0.09 of control to 0.25±0.07,P=0.074).The calcium sensitivity decreased after β3adrenoceptor activation.Conclusion While had very low expression in normal rat heart,β3-adrenoceptor had much higher expression in HF hearts of rat.When blocking of β1and β2-adrenoceptors,the cardiac function of normal and HF rats were inhibited with administration of BRL37344.In the failure heart,activation of β3-adrenoceptor led to decreased bl%peak h and calcium transients.The results showed that β3-adrenoceptor played more significant negative inotropic effect in the HF heart of rats.Activation of β3-adrenoceptor led to decrease of calcium sensitivity.
Heart failure; β3-adrenoceptor; Calcium
山西省自然科学基金(项目编号:2012011040-8);2011山西医科大学科技创新基金(项目编号:057514);2013中央财政支持地方项目基金
作者单位:030001 山西省太原市,山西医科大学生理学系
崔香丽,E-mail:cuixlcxl@sina.com
10.3969/j.issn.1672-5301.2015.07.022
Q95-33;R541.6
A
1672-5301(2015)07-0659-06
2015-04-17)

