原发性高血压患者颈动脉内膜中层厚度与脂蛋白相关磷脂酶A2水平相关性研究
郑冠群 盛晓东 周建龙 范韬 金骁琦
原发性高血压患者颈动脉内膜中层厚度与脂蛋白相关磷脂酶A2水平相关性研究
郑冠群 盛晓东 周建龙 范韬 金骁琦
目的探讨原发性高血压(EH)患者血浆脂蛋白相关磷脂酶A2(Lp-PLA2)水平与原发性高血压患者颈动脉内膜中层厚度(IMT)的相关性。方法 选择90例EH患者,其中单纯EH患者46例(单纯EH组)、EH合并颈动脉硬化(CAS)患者44例(EH伴发CAS组);另选取同期在我院体检的40名健康者作为正常对照组。应用颈动脉彩色多普勒超声检查IMT,检测三组血浆Lp-PLA2水平及其他生化指标并进行比较。结果 单纯EH组和EH伴发AS组与正常对照组相比,其收缩压(SBP)[(150.87±10.62)mm Hg比(162.38±16.13)mm Hg 比 (123.31±9.23)mm Hg]、舒张压(DBP)[(89.44±9.71)mm Hg 比 (94.32±11.86)mm Hg 比(76.31±7.48)mm Hg]、同型半胱氨酸(Hcy)[(9.25±4.13)μmol/L 比(13.64±5.48)μmol/L 比(6.03±3.01)μmol/L]、白介素(IL)-2[(145.12±16.14)pg/ml比(168.77±21.24)pg/ml比(124.00±5.25)pg/ml]及 Lp-PLA2水平[(113.0±32.73)ng/ml比(292.1±69.87)ng/ml比(65.32±20.01)ng/ml]均显著升高,且 EH 伴发 CAS 组 SBP、Hcy、IL-2及Lp-PLA2水平又明显高于单纯EH组,颈动脉IMT[(1.10±0.17)mm]、超敏C-反应蛋白(hs-CRP)[(5.72±2.51)mg/L]及载脂蛋白(APO)-B/APO-A1 比值(0.79±0.22)明显高于正常对照组及单纯 EH组,差异均有统计学意义(均P<0.05)。EH患者血浆Lp-PLA2水平与IMT、Hcy、hs-CRP以及IL-2呈正相关(r=0.402、0.335、0.226、0.214,P<0.05)。多元逐步回归分析显示,IMT、Hcy为影响血浆 Lp-PLA2水平的相关因素。结论 EH患者血浆Lp-PLA2水平与颈动脉IMT密切相关。Lp-PLA2检测对EH患者伴发CAS有预测意义,为CAS早期诊断和干预治疗提供积极的参考价值。
原发性高血压; 颈动脉粥样硬化; 脂蛋白相关磷脂酶A2; 颈动脉内膜中层厚度
动脉粥样硬化(atherosclerosis,AS)是心脑血管并发症的病理基础。原发性高血压(essential hypertension,EH)患者是促进AS发生的高危人群。心脑血管疾病的致残、致死率极高。如何早期识别AS,并进一步早期干预成为目前研究的热点。目前认为AS是一种慢性炎症状态,并且炎症反应贯穿了从脂纹形成到斑块破裂的全过程,炎性细胞因子在AS的发生发展中起重要作用[1]。最近的研究表明,脂蛋白相关性磷脂酶A2(lipoprotein phosphalipase A2,Lp-PLA2)是一种与AS疾病有关的新的炎症标志物,其可能直接参与AS过程[2]。目前有关原发性高血压与Lp-PLA2的相关性研究很少。本研究通过检测90例原发性高血压患者及40名健康体检者血浆Lp-PLA2水平及颈动脉内膜中层厚度(IMT),探讨原发性高血压患者Lp-PLA2与IMT的相关性。
1 对象与方法
1.1 研究对象 收集2014年1月至2015年3月在本院心内科确诊为EH的患者90例,其中男性48例、女性42例。所有患者均符合2010年修订版的《中国高血压防治指南》的诊断标准。排除:①继发性高血压、冠心病、糖尿病、恶性肿瘤、恶性贫血、肝肾功能或凝血功能异常、严重心功能不全患者;②近期有感染、发热等疾病患者,以及妊娠期妇女;③发病前曾服用影响Lp-PLA2活性的药物(如降脂药、β受体阻断药、洋地黄等)。所有EH患者做颈动脉彩超,颈动脉内膜中层厚度(IMT)>0.9 mm或有颈动脉粥样斑块考虑伴发颈动脉硬化(CAS)。共确诊44例EH合并CAS患者(EH伴发CAS组),此外46例为单纯EH患者(单纯EH组)。同时选取健康体检者40名作为正常对照组。本研究经本院伦理委员会批准,入选者均签署知情同意书。
1.2 研究方法
1.2.1 血生化指标测定 所有研究对象禁食8~14 h后采集清晨空腹静脉血,采用全自动生化分析仪酶法测定甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDLC)、载脂蛋白 A1(APO-A1)、载脂蛋白 B(APO-B)、同型半胱氨酸(Hcy);采用散射免疫比浊法测定超敏C反应蛋白(hs-CRP);采用酶联免疫吸附法测定白介素(IL)-2;采用酶联免疫吸附法测定血浆脂蛋白相关磷脂酶A(2Lp-PLA2)。
1.2.2 颈部血管彩色超声测定颈动脉内中膜厚度(IMT) 由专人应用多功能彩色多普勒超声诊断仪测量,探头频率7.5~11.0 MHz。检查前受试者休息至少15 min,诊室温度恒定、安静。检查时受试者取仰卧位,头颈部尽量仰伸,头转向对侧。探头置于胸锁乳突肌前缘或后缘,由双锁骨上窝颈动脉起始处沿血管走行,逐渐上移。测量颈动脉分叉部或壶腹部距颈动脉分叉部1 cm内的颈总动脉主干段2个点的IMT(从内膜内表面至中膜外表面),左右两侧共4个点,然后取平均值作为IMT值。IMT≤0.9 mm为正常IMT,IMT>0.9 mm为内膜增厚。同时检测有无斑块形成。
1.3 统计学方法 采用SPSS 17.0统计软件进行分析。计量资料以±s表示,各组间比较采用方差分析,两因素相关性分析采用Pearson相关,多因素线性关系采用多元逐步回归分析。P<0.05表示差异有统计学意义。
2 结果
2.1 三组临床资料比较 三组性别、年龄、BMI、TG、TC、LDL-C、HDL-C、APO-A1 及 APO-B 比较未见统计学差异(均P>0.05)。单纯EH组和EH伴发 AS 组 SBP、DBP、Hcy、IL-2 及 Lp-PLA2水平均高于正常对照组;EH伴发AS组SBP、Hcy、IL-2及Lp-PLA2水平显著高于单纯EH组,颈动脉IMT、hs-CRP及APO-B/APO-A1比值显著高于正常对照组及单纯EH组,差异均有统计学意义(均P<0.05)。见表 1。
2.2 Lp-PLA2水平与临床资料的Pearson相关分析 EH患者(包括单纯EH组及EH伴发AS组)血浆Lp-PLA2水平与IMT、Hcy、hs-CRP及 IL-2呈正相关(r=0.402、0.335、0.226、0.214,P<0.05)。
2.3 多元逐步回归分析 以血浆Lp-PLA2水平为因变量(Y),以性别、年龄、病程、BMI、SBP、DBP、IMT、Hcy、hs-CRP、IL-2、TG、TC、HDL-C、LDL-C、APO-A1、APO-B、APO-B/APO-A1 比值为自变量进行多元逐步回归分析,结果显示,IMT、Hcy为影响血浆Lp-PLA2水平的相关因素。回归方程Y=3.142+0.812X1+0.201X(2X1:IMT,X2:Hcy)。
3 讨论
AS是心血管疾病的主要发病基础,在冠心病、糖尿病、高血压等及其靶器官损害中,动脉粥样硬化起关键作用。颈动脉是粥样硬化最易累积的血管之一。检测颈动脉粥样硬化是目前比较常用的无创性检测方法,主要是超声测量颈动脉IMT和粥样斑块。一旦颈动脉的某个部位增厚,出现斑块的危险性明显增加,且颈动脉粥样硬化时IMT的改变早于斑块的发生,故颈动脉IMT增加是颈动脉粥样硬化的早期标志。欧洲高血压指南认为颈动脉IMT>0.9 mm是AS靶器官损害的标志[3]。在本研究中我们也取0.9 mm作为颈动脉增厚的界点。
有研究发现[4],EH是一种慢性、炎症反应性疾病,从EH的发生发展到对靶器官的损伤,内皮功能紊乱引发的血管炎症是主要的病理特征。炎症也是AS发展过程中的核心因素。陈明[5]的研究也发现,高血压患者收缩压与颈动脉IMT增厚呈正相关。Lp-PLA2是新近发现的与AS密切相关的一个炎症标志物[6,7]。国外研究也认为Lp-PLA2具有促进AS的作用,可作为评估早期心脑血管疾病的预测及治疗预后的重要指标[2]。Lp-PLA2又称血小板活性因子乙酰水解酶(platelet activating factor-AH,PFA-AH),属于磷脂酶家族,由巨噬细胞和活化血小板分泌,以HDL-C和LDL-C作为载体在血液中循环,并沉积于动脉粥样硬化斑块中[8]。Lp-PLA2分为在循环中的分泌型Lp-PLA2和存在于动脉粥样斑块中的Lp-PLA2两类。产自动脉粥样硬化斑块的分泌型Lp-PLA2,具有高度特异性和低生物变异性[9]。因此,检测血浆中Lp-PLA2可以定性定量地反映动脉粥样硬化斑块中炎症反应的程度。大量研究也报道Lp-PLA2的活性、质量与动脉粥样硬化的严重程度和心血管危险呈正相关[10]。另外,血浆Lp-PLA2活性的增高与主要心血管事件的发生率呈正相关[11]。
国内研究表明,H型高血压患者较健康对照组血浆Lp-PLA2水平明显升高,且患者的IMT与Lp-PLA2水平有明显正相关关系[12]。本试验结果显示原发性高血压患者血清中 SBP、DBP、Hcy、IL-2及Lp-PLA2水平明显高于健康人群的对照组,且EH伴发AS组SBP、Hcy、IL-2及Lp-PLA2水平又显著高于单纯EH组,颈动脉IMT、hs-CRP及APO-B/APO-A1比值显著高于正常对照组及单纯EH组。Hcy是一种含硫分子的氨基酸,高浓度的Hcy会损伤血管内皮细胞,活化促血栓因子,促进血小板聚集,从而引致血管性疾病的发生[13]。高Hcy血症可导致心血管疾病发病率和死亡率增高,是动脉粥样硬化发生、发展的一个独立危险因素[14]。IL-2是一种多功能的促进炎症细胞因子。Hs-CRP是敏感的炎症指示器,有研究显示,高浓度hs-CRP可促进血管内皮细胞增生、迁移,动脉内膜增厚,促进AS的形成发展。而APO-B/APO-A1的比值则反映了人体内致动脉粥样硬化和抗动脉粥样的脂蛋白的颗粒数量,该比例能更好地反映动脉粥样硬化的风险。本研究结果均表明,炎症反应不仅参与了高血压的发生发展,同时在高血压所致的外周AS中起着重要作用。
表1 三组临床资料比较(±s)
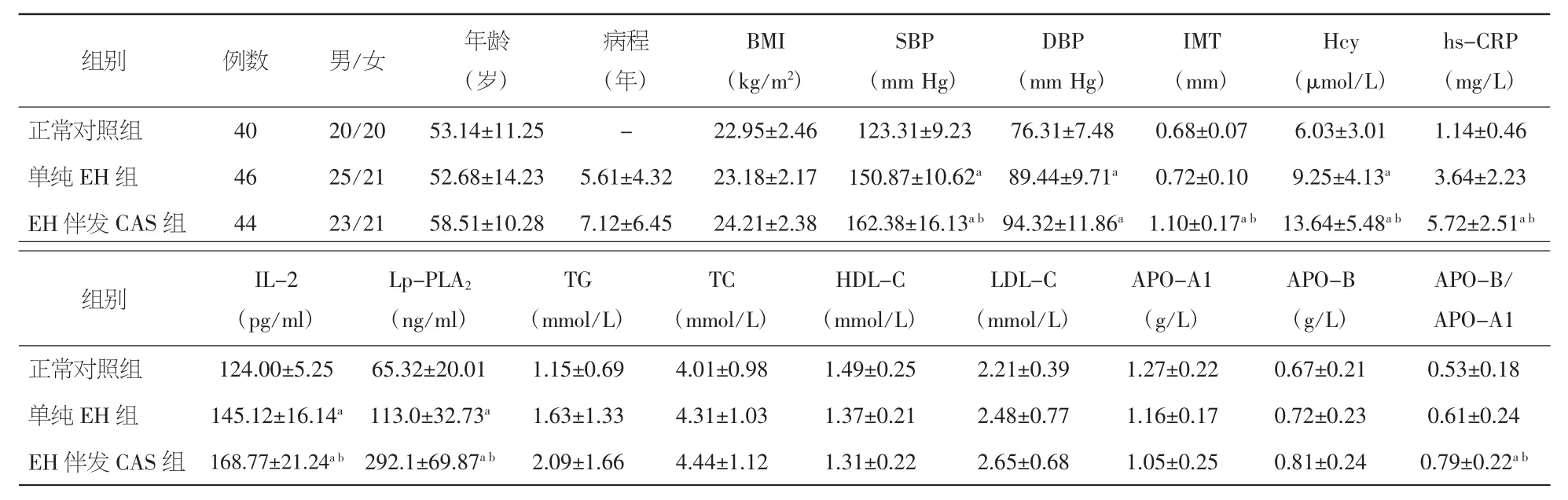
表1 三组临床资料比较(±s)
注:BMI:体重指数;SBP:收缩压;DBP:舒张压;IMT:劲动脉内中膜厚度;Hcy:同型半胱氨酸;hs-CRP:超敏 C 反应蛋白;IL-2:白介素-2;Lp-PLA2:血浆脂蛋白相关磷脂酶A2;TG:甘油三酯;TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;APO-A1:载脂蛋白A1;APO-B:载脂蛋白B。与正常对照组比较,aP<0.05;与单纯EH组比较,bP<0.05
h s-C R P(m g/L)正常对照组 4 0 2 0/2 0 5 3.1 4±1 1.2 5 - 2 2.9 5±2.4 6 1 2 3.3 1±9.2 3 7 6.3 1±7.4 8 0.6 8±0.0 7 6.0 3±3.0 1 1.1 4±0.4 6单纯 E H 组 4 6 2 5/2 1 5 2.6 8±1 4.2 3 5.6 1±4.3 2 2 3.1 8±2.1 7 1 5 0.8 7±1 0.6 2a 8 9.4 4±9.7 1a 0.7 2±0.1 0 9.2 5±4.1 3a 3.6 4±2.2 3 E H 伴发 C A S 组 4 4 2 3/2 1 5 8.5 1±1 0.2 8 7.1 2±6.4 5 2 4.2 1±2.3 8 1 6 2.3 8±1 6.1 3ab9 4.3 2±1 1.8 6a 1.1 0±0.1 7ab 1 3.6 4±5.4 8ab 5.7 2±2.5 1ab组别 I L-2(p g/m l)组别 例数 男/女 年龄(岁)病程(年)B M I(k g/m2)S B P(m m H g)D B P(m m H g)I M T(m m)H c y(μ m o l/L)A P O-B/A P O-A 1正常对照组 1 2 4.0 0±5.2 5 6 5.3 2±2 0.0 1 1.1 5±0.6 9 4.0 1±0.9 8 1.4 9±0.2 5 2.2 1±0.3 9 1.2 7±0.2 2 0.6 7±0.2 1 0.5 3±0.1 8单纯 E H 组 1 4 5.1 2±1 6.1 4a 1 1 3.0±3 2.7 3a 1.6 3±1.3 3 4.3 1±1.0 3 1.3 7±0.2 1 2.4 8±0.7 7 1.1 6±0.1 7 0.7 2±0.2 3 0.6 1±0.2 4 E H 伴发 C A S 组 1 6 8.7 7±2 1.2 4ab2 9 2.1±6 9.8 7ab 2.0 9±1.6 6 4.4 4±1.1 2 1.3 1±0.2 2 2.6 5±0.6 8 1.0 5±0.2 5 0.8 1±0.2 4 0.7 9±0.2 2abL p-P L A2(n g/m l)T G(m m o l/L)T C(m m o l/L)H D L-C(m m o l/L)L D L-C(m m o l/L)A P O-A 1(g/L)A P O-B(g/L)
本研究结果显示,血浆Lp-PLA2水平与IMT、Hcy、hs-CRP及IL-2呈正相关,说明血浆Lp-PLA2水平能很好地反映原发性高血压患者颈动脉硬化严重程度及炎症反应程度。另外多元逐步回归分析显示,血浆Lp-PLA2水平与颈动脉IMT及Hcy密切相关,这证明血浆Lp-PLA2水平与原发性高血压患者颈动脉硬化密切相关。分析Lp-PLA2参与EH颈动脉粥样硬化的原因可能为:①炎症反应。Lp-PLA2作为一种炎症因子,主要由巨噬细胞等炎症细胞合成分泌,同时也受到炎性物质的调节[15],在血液中与脂蛋白颗粒结合,产生氧化性游离脂肪酸(oxidize fattyacids,oxFA) 和 溶 血 磷 脂 酰 胆 碱(LysoPC),这两者均有促进炎症发生和促进细胞凋亡的作用[16],进一步促进血管平滑肌细胞的增殖、迁移和凋亡,从而影响血管舒缩功能,损伤血管内皮。②炎症反应与高血压相互影响。炎症反应会对血管内皮细胞的自我调节能力产生破坏,同时内皮功能紊乱也会导致EH的发生、发展[17]。高血压本身也具有促进炎症的效应,随着血管压力的增高血流亦加速,导致血管内膜及血管壁受到损害的概率增加,局部炎性反应也会随之增强,加速斑块的形成。同时高血压还能诱发内皮功能紊乱,加快动脉硬化的发展[18]。
总之,EH伴发颈动脉硬化患者血浆Lp-PLA2水平明显升高,EH患者血浆Lp-PLA2水平与颈动脉IMT密切相关,因此检测Lp-PLA2水平对EH患者伴发CAS有预测意义。目前已有研究表明,Lp-PLA2抑制剂可以减少动脉硬化斑块的形成,可能是EH防治的一个新靶点,值得研究。
[1]刘伟利,王桂芳.同型半胱氨酸与冠脉病变程度及斑块的关系.中国心血管病研究,2011,9:37-39.
[2]Macphee Colin H,Jeanenne N,Andrew Z.Role of lipoproteinassociated phospholipase A2in atherosclerosis and its potential as a therapeutic target.Current opinion in pharmacology,2006,6:154-161.
[3]Giuseppe M,De Backer G,Anna D,et al.2007 Guidelines for the Management of Arterial Hypertension:The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension(ESH)and of the European Society of Cardiology(ESC).Journal of hypertension,2007,25:1105-1187.
[4]VMarjut V,Kari P,Sari K,et al.Predictive value of N-terminal pro-brain natriuretic peptide in severe sepsis and septic shock.Critical care medicine,2007,35:1277-1283.
[5]陈明.高血压患者颈动脉内膜中层厚度与心血管危险因素的临床相关性研究.中国心血管病研究,2010,8:41-43.
[6]曹乾,任丽,李晓东.胰岛素抵抗下脂蛋白相关磷脂酶A2介导的炎症因子的表达与动脉硬化关系.山西医药杂志,2011,7:225-229.
[7]顾菲菲.易损斑块研究进展.中国心血管病研究,2012,10:63-65.
[8]Kinney GL,Snell-bergeon JK,Maahs DM,et al.Lipoproteinassociated phospholipase A2activity predicts progression of subclinical coronary atheroselerosis. Diabetes Technol Ther,2011,13:381-387.
[9] Natalie K,Sonja G,Regina R,et al.Variability of serial lipoprotein-associated phospholipase A2measurements in post myocardial infarction patients:results from the AIRGENE Study Center Augsburg.Clinical Chemistry,2008,54:124-130.
[10] Anderson JL.Lipoprotein-associated phospholipase A2: an independentpredictorofcoronary artery disease eventsin primary and secondary prevention.Am J Cardiol,2008,101:F23-33.
[11]Ikonomidis I,Michalakeas CA,Lekakis J,et al.The role of lipoprotein -associated phospholipase A2(Lp -PLA2)in cardiovascular disease.Rev Recent Clin Trials,2011,6:108-113.
[12]廖忠,梁叶表,麦丽萍,等.血浆Lp-PLA2水平与H型高血压患者颈动脉内膜中层厚度相关性的研究.中国医药指南,2014,35:32-34.
[13]Ramakrishnan S,Sulochana KN,Lakshmi S,et al.Biochemistry of homocysteine in health and diseases.Indian J Biochem Biophys,2006,43:275-283.
[14]林桂花,李日行.高半胱氨酸与慢性充血性心力衰竭关系的临床研究.中国心血管病研究,2010,8:668-670.
[15] Krishnankutty S.Lipoprotein-associated phospholipase A2,vascular inflammation and cardiovascular risk prediction.Vascular Health and Risk Management,2006,2:153-156.
[16]Paolo P,Maria PG,Eleonora C,et al.The molecular sources of reactive oxygen species in hypertension. Blood Pressure,2008,17:70-77.
[17]Timothy W,Goon Patrick KY,Lip Gregory YH.Endothelial progenitor cells, endothelial dysfunction, inflammation, and oxidative stress in hypertension. Antioxidants & Redox Signaling,2008,10:1079-1088.
[18]Escobar E.Hypertension and coronary heart disease.Journal of human hypertension,2002,16:S61-S63.
Correlation between carotid artery intima-media thickness(IMT) and lipoprotein-associated phospholipase A2level in patients with essential hypertension
ZHENG Guan-qun,SHENG Xiao-dong,ZHOU Jian-long,et al.Department of Cardiology,the Changshu Hospital Affiliated to Medical College of Yangzhou University,Changshu 215500,China
ZHENG Guan-qun,E-mail:anzgq2006@126.com
ObjectiveTo investigate the correlation between the level of plasma lipoprotein associated phospholipase A(2Lp-PLA2)and carotid artery intima-media thickness(IMT)in patients with essential hypertension(EH).Methods90 patients with EH were divided into EH group(46 cases)and EH with carotid atherosclerosis(CAS)group(44 cases).Meanwhile,40 healthy people who
physical examination were selected as control group.Carotid color Doppler ultrasonography was used to measure IMT of internal carotid artery.The level of plasma Lp-PLA2and some biochemical in three groups were detected for study.ResultsCompared with the control group,the level of systolic pressure(SBP)[(150.87±10.62)mm Hg vs(162.38±16.13)mm Hg vs(123.31±9.23)mm Hg],diastolic pressure(DBP)[(89.44±9.71)mm Hg vs(94.32±11.86)mm Hg vs(76.31±7.48)mm Hg],homocysteine(Hcy)[(9.25±4.13)μmol/L vs(13.64±5.48)μmol/L vs(6.03±3.01)μmol/L],interleukin(IL)-2[(145.12±16.14)pg/ml vs(168.77±21.24)pg/ml vs(124.00±5.25)pg/ml]and Lp-PLA2[(113.0±32.73)ng/mlvs(292.1±69.87)ng/ml vs(65.32±20.01)ng/ml]in EH group and EH with CAS group were significantly higher,and the level of SBP,Hcy,IL-2 and Lp-PLA2in EH with CAS group were significantly higher than EH group,IMT [(1.10±0.17)mm],hypersensitive C-reactive protein (hs-CRP)[(5.72±2.51)mg/L] and apolipoprotein(APO)-B/APO-A1(0.79±0.22)were higher than control group and EH group.The level of Lp-PLA2was positively correlated with IMT,Hcy,hs-CRP and IL-2 in EH patients(r=0.402,0.335,0.226,0.214,P<0.05).Multiple stepwise regression analysis showed that IMT and Hcy were the related factors of Lp-PLA2.ConclusionThe level of Lp-PLA2is significantly related to the IMT in EH patients.Lp-PLA2detection has significance for prediction of CAS in patients with EH,and can provide a positive reference value for early diagnosis and intervention of CAS.
Essential hypertension; Carotid atherosclerosis; Lipoprotein associated phospholipase A2;Carotid artery intima-media thickness
215500 江苏省常熟市,扬州大学医学院附属常熟医院心血管内科
郑冠群,E-mail:anzgq2006@126.com
10.3969/j.issn.1672-5301.2015.10.012
R544.1
A
1672-5301(2015)10-0909-04
2015-06-24)

