紫色叶用莴苣遗传多样性及亲缘关系的TRAP分析
王亚楠 韩莹琰 范双喜卜 斌
(北京农学院植物科学技术学院,北京 102206)
紫色叶用莴苣遗传多样性及亲缘关系的TRAP分析
王亚楠 韩莹琰 范双喜*卜 斌
(北京农学院植物科学技术学院,北京 102206)
利用TRAP标记对47份紫色叶用莴苣种质进行亲缘关系及遗传多样性分析。20对引物组合共扩增出多态性条带430条,多态性比率(PPB)为67.08%。47份紫色叶用莴苣材料的遗传相似系数在0.706 3~0.982 8之间,Nei’s基因多样性指数(He)和Shannon’s信息指数(I)分别为0.255 3和0.397 6,遗传多样性水平较低。聚类分析结果表明,47份紫色叶用莴苣材料分为2大类群,第Ⅱ类群又分为5个亚类,叶片形态相似的种质基本上聚在一起,亲缘关系较近。
紫色叶用莴苣;TRAP标记;遗传多样性
叶用莴苣(Lactuca sativaL.)是菊科莴苣属一年或二年生草本植物,在世界范围内广泛种植(Kristkova et al.,2008),也是菊科植物基因组计划(Compositae Genome Project,http://compgenomics.ucdavis.edu/)研究的一个重要物种(Truco et al.,2007)。叶用莴苣原产于地中海沿岸,5世纪传入中国,近年来大规模栽培,按叶色可分为绿色和紫色两类,其中紫色叶用莴苣色泽艳丽,营养成分含量较高,富含花青素,具有抗氧化、抗癌、抗心血管病、美容等保健功能(蒋先明,1999),受到育种者和消费者的青睐。
对莴苣属种质资源遗传多样性的研究欧美国家报道较多,多种标记方法都有应用(Hill et al.,1996;Dilpreet et al.,2011)。Kesseli 等(1991)利用RFLP标记对67份莴苣属种质资源进行多样性分析,否定了栽培莴苣起源于柳叶莴苣(L.saligna)与刺毛莴苣(L. virosa)杂交的假说。van de Wiel等(1999)利用SSR标记推断出栽培莴苣与野莴苣(L.serriola)的亲缘关系较近。Simko(2009)利用EST-SSR标记成功区分了96份栽培莴苣的不同亚种,并且能区分开绿色莴苣和紫色莴苣。Uwimana等(2012)利用SSR标记分析了欧洲莴苣属种质资源的居群结构,根据杂交基因流向判断出野莴苣在欧洲蔓延迅速的原因。
我国对叶用莴苣的研究主要集中在生理生化方面(范双喜和伊东正,2002;闻婧 等,2011),关于叶用莴苣遗传多样性的研究较少,尤其是紫色叶用莴苣更加少见。李悦(2010)采用系统学和形态解剖学方法研究了中国莴苣属及其近缘属的亲缘关系。刘丽娟(2008)利用SRAP标记和形态标记对50份莴苣材料进行了遗传多样性分析,两种聚类结果具有较好的相关性和符合度。
目标区域扩增多态性(target region amplified polymorphism,TRAP) 是 Hu和 Vick在 SRAP技术基础上,利用EST序列设计定向引物,扩增出与目标基因序列相关的多态性片段的一项技术,具有操作简单、重复性好、效率高等优点,在种质资源鉴定评价、构建遗传图谱、重要性状基因标记、辅助选择育种与指纹分析等方面都有应用(Hu & Vick,2003;杜晓华 等,2004;Hu et al., 2005)。
生产上紫色叶用莴苣的栽培和研究水平远落后于绿色叶用莴苣,而且品种类型和数量有限,品种更新缓慢。部分种质缺乏系谱背景,来源不明,给育种工作带来不便。同时,各地频繁引种导致品种混杂、退化现象严重。紫色叶用莴苣种质资源创新和新基因发掘亟待解决。本试验首次对我国紫色叶用莴苣的遗传多样性进行研究,利用TRAP标记对47份紫色叶用莴苣种质进行亲缘关系鉴定和种质评价,了解其遗传背景,为深入挖掘利用种质资源、指导亲本选配、提高育种效率提供理论 参考。
1 材料与方法
1.1 试验材料
供试47份紫色叶用莴苣材料由中国农业科学院蔬菜花卉研究所国家种质资源中期库、北京京研益农科技发展中心、中蔬种业科技(北京)有限公司、河北青县青丰种业有限公司提供,品种名称及叶片形态特征见表1,来源地主要集中在北京和河北,有38份;其余的福建3份、山东2份、美国3份、日本1份。
1.2 试验方法
2012年2月25日温室播种,3月28日定植于大棚,每个品种定植1个小区,25株,株距40 cm,两侧设置保护行,各小区管理水平一致。依据莴苣种质资源描述规范和数据标准(李锡香和王海平,2006)观测、记录叶片性状。
在幼苗长至5~6片真叶时分别取嫩叶,液氮速冻后于-80 ℃冰箱保存。利用植物基因组提取试剂盒(北京鼎国生物技术有限公司生产)提取DNA。采用1%琼脂糖凝胶电泳及紫外分光光度计检测DNA质量和浓度,并稀释至30~50 ng·μL-1,-20 ℃冰箱保存待用。
引 物 序 列 参 照 Li和 Quiros(2001)、Hu等 (2005)的方法进行设计,用叶片形态(叶形、叶面褶皱、叶尖、叶缘)差异较大的罗生1号、红生1号、立生3号、大橡生1号4个品种进行引物筛选,从60对引物中筛选出多态性明显、条带清晰、重复性好的20对引物组合,对47份紫色叶用莴苣种质进行遗传分析。表2为试验所用引物序列,表3为TRAP分析所用引物组合。TRAPPCR 反应体系(20 μL):DNA 模板 2 μL(60~100 ng·μL-1),10×PCR Buffer(Mg2+free)2 μL,Mg2+1.6 μL(2.0 mmol·L-1),dNTP 0.8 μL(0.2 mmol·L-1), 引 物 1.5 μL(0.75 μmol·L-1),Taq酶 0.2 μL(1.0 U),ddH2O 11.9 μL。PCR 扩增程序:94 ℃预变性 5 min;94 ℃变性 45 s,35 ℃退火 45 s,72 ℃延伸 1 min,5 个循环;94 ℃变性 45 s,51 ℃退火 45 s,72 ℃延伸 1 min,35 个循环;72 ℃延伸10 min。PCR产物用6.0%变性聚丙烯酰胺电泳分离,银染显带。
1.3 数据处理
采用人工读带在胶片观察灯上观测结果,根据引物迁移率和扩增条带的有、无分别记为1和0,构建二元矩阵。采用POPGEN Version 1.31软件计算遗传多态性数据,包括多态性比率(PPB)、Nei’s基因多样性指数(He)、Shannon’s信息指数(I)。 根 据 Nei和 Li(1979) 的 方 法, 采 用NTSYS-pc 2.1软件中的DICE法计算相似系数;采用UPGMA法进行聚类分析,生成聚类图。
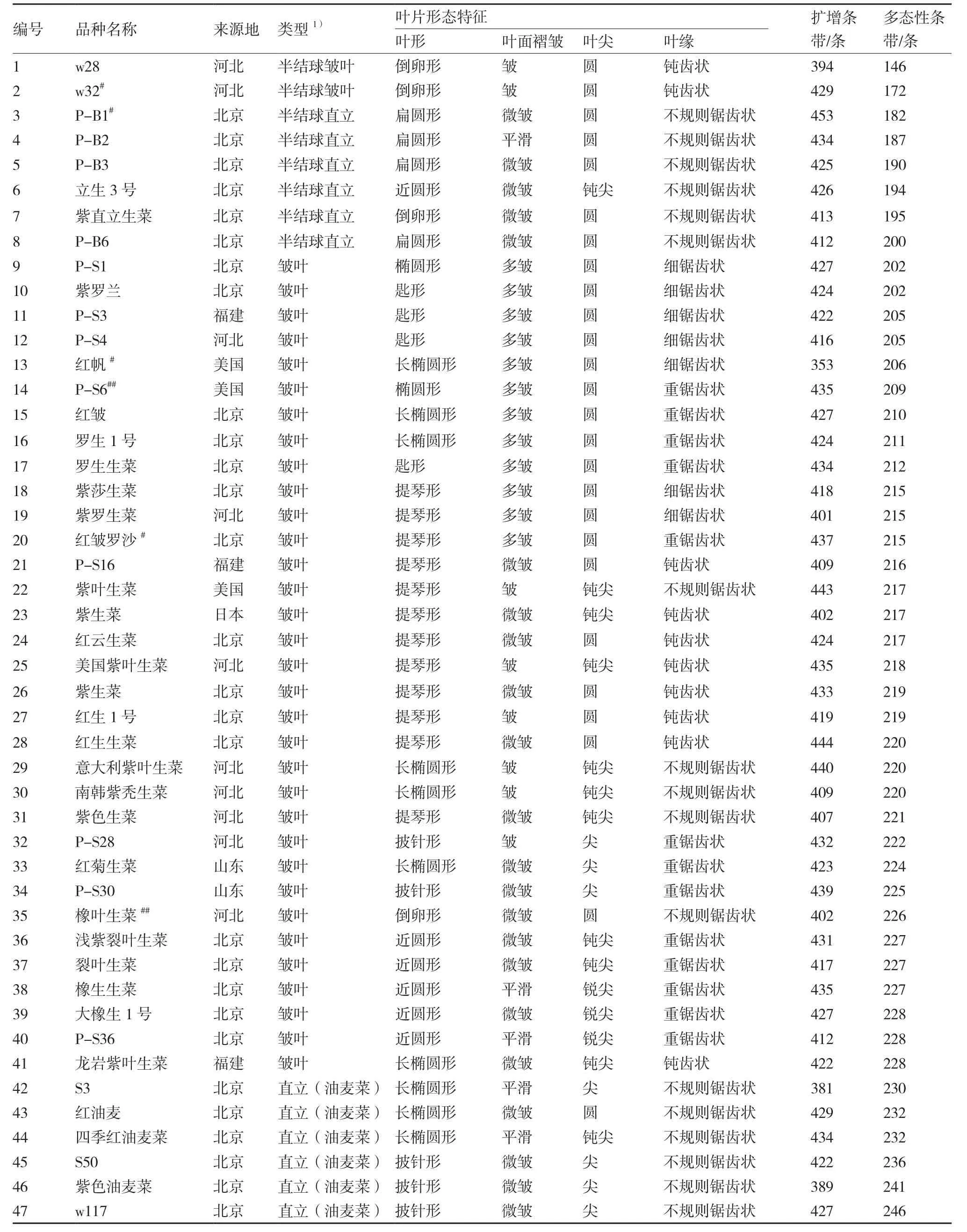
表1 供试种质名称、来源地、叶片形态特征及TRAP扩增结果

表2 试验所用TRAP引物序列
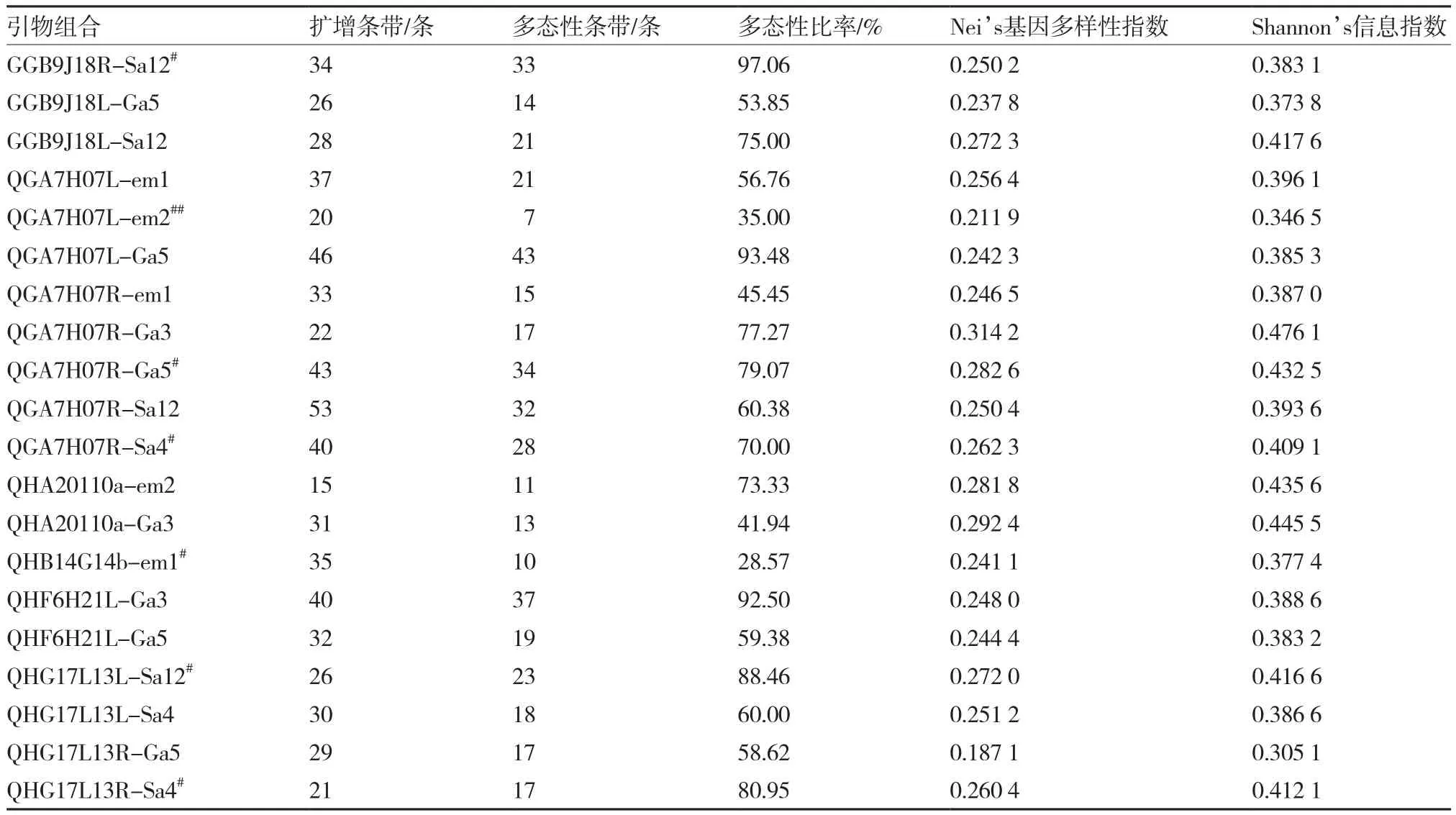
表3 20对TRAP引物组合对47份紫色叶用莴苣材料的扩增结果
2 结果与分析
2.1 TRAP-PCR扩增结果
利用20对引物组合对47份紫色叶用莴苣材料进行TRAP-PCR扩增,扩增片段长度200~1 000 bp;共扩增出641条条带,其中多态性条带430条,平均每对引物获得21.50条多态性条带,多态性比率为67.08%;引物组合QGA7H07R-Sa12扩增出的条带数最多,达53条;引物组合GGB9J18R-Sa12扩增条带的多态性最高,多态性比率为97.06%(表3、图1)。TRAP-PCR扩增能检测到特异扩增位点的引物有7对,占引物对总数的35.00%。丰富的多态性条带及对品种间稀有遗传变异的检测能力表明,TRAP技术对供试紫色叶用莴苣种质具有较高的鉴别能力,适合分析该物种的遗传多样性。
2.2 遗传变异性分析
由表1可知,供试47份紫色叶用莴苣材料扩增出的条带数在353~453条之间,平均为421条;多态性条带数在146~246条之间,平均为214条。引物扩增结果表明(表3),47份紫色叶用莴苣材料的 Nei’s基因多样性指数在 0.187 1~0.314 2 之间,平均为 0.255 3;Shannon’s信息指数在 0.305 1~ 0.476 1之间,平均为 0.397 6;遗传相似系数在 0.706 3~0.982 8 之间,平均为 0.837 0。20 号红皱罗沙与46号紫色油麦菜、27号红生1号与46号紫色油麦菜间的遗传相似系数最小,均为0.706 3;25号美国紫叶生菜与29号意大利紫叶生菜间的遗传相似系数最大,为0.982 8。47份紫色叶用莴苣种质的Nei’s基因多样性指数和Shannon’s信息指数较低,品种间相似系数较高,说明供试紫色叶用莴苣材料的多样性水平较低,遗传背景狭窄。

图1 引物组合GGB9J18R-Sa12对47份紫色叶用莴苣材料的扩增结果
从表1还可以看出,2号w32、3号P-B1、13号红帆、14号P-S6、20号红皱罗沙、35号橡叶生菜等6份材料检测到特异性位点,占总数的12.77%。这表明供试紫色叶用莴苣种质虽然多样性水平较低,但种质间依然存在较高的遗传分化。
2.3 聚类分析
根据DICE相似系数,采用UPGMA法构建聚类图(图2),在相似系数0.813处将供试47份紫色叶用莴苣材料划分为2个类群。
第Ⅰ类群共6份种质,为42号、43号、44号、45号、46号、47号,全部为油麦菜类型,叶形偏 长、披针形或长椭圆形,叶面褶皱少,边缘为不规则锯齿状;其余41份种质划分为第Ⅱ类群,在相似系数0.828处进一步细分为5个亚类。
第1亚类共17份种质,1号和2号为半结球皱叶类型;5号为半结球直立类型;21号、22号、23号、24号、25号、29号、30号、31号的亲缘关系较近,形态上表现为:叶片提琴形或长椭圆形,叶面皱或微皱,叶尖圆或钝尖,叶缘为不规则锯齿状或钝齿状;33号、38号、39号、40号的亲缘关系较近,形态上表现为:叶片深裂宛如橡叶、近圆形、叶面褶皱较少、叶尖为锐尖、叶缘重锯齿状,此亚类中的36号、37号也具有相似形态,但是与这4份种质的亲缘关系较远。
第2亚类共18份种质,全部为皱叶类型。9 号、10号、11号、12号、14号、16号、17号、18 号、19号、20号、26号的亲缘关系较近,形态上表现为:叶面褶皱多、叶尖较圆、叶缘为重锯齿状或细锯齿状,此亚类中的13号、15号也具有相似形态,但与这11份种质的亲缘关系较远,其中13号红帆的亲缘关系最远,是美国引进品种,表现出与国内品种的差异;27号、28号与第1亚类中的21号、22号等种质形态相似,32号、34号、41号与第1亚类中的33号、38号等种质形态相似,但是这5份种质却归为第2亚类,TRAP聚类结果与形态分类不完全相同可能是因为这几份种质的遗传背景比较复杂,或者是TRAP所用引物扩增区域的局限性造成的。
第3亚类包含3号和4号2份种质,都是半结球直立类型,亦都是由北京市农林科学院蔬菜研究中心选育而成。
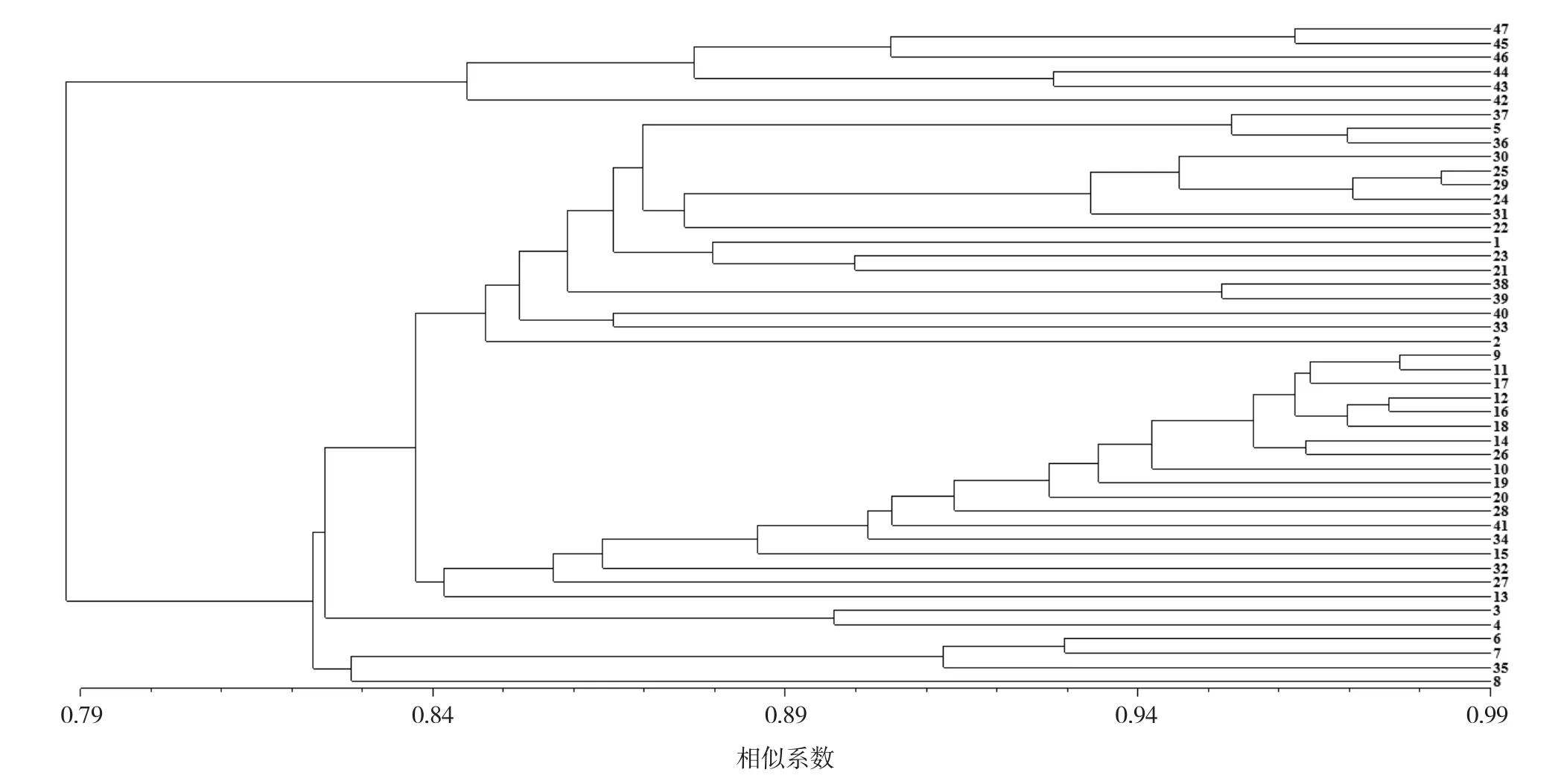
图2 47份紫色叶用莴苣种质TRAP聚类分析树状图(UPGMA法)
第4亚类共3份种质,6号、7号是半结球直立类型,由北京市农林科学院蔬菜研究中心育成;35号为皱叶类型,来自河北,其形态与7号相似,叶片倒卵形、叶面微皱、叶尖圆、叶缘呈不规则锯齿状。
第5亚类只有1份种质8号,为半结球直立 类型。
聚类结果显示(图2),13号、14号、22号、23号等4份国外引进品种与国内品种不存在明显的遗传差异,表明其有共同的遗传基础;供试材料在地理来源聚类上混杂,没有明显的规律性,这与供试种质的来源地主要集中在河北及北京地区有关,也可能是频繁引种使紫色叶用莴苣种质间某些基因相互渗入,打破了种质的地域限制。
3 结论与讨论
本试验采用的20对TRAP引物组合在47份紫色叶用莴苣种质间均能扩增出条带,平均每对引物扩增出多态性条带21.50条,多态性比率为67.08%,可见采用TRAP标记检测紫色叶用莴苣种质能产生较多谱带,多态性位点丰富,这与Hu等(2005)在莴苣属种质上的扩增结果相似,证明TRAP标记具有稳定的重复性。刘丽娟(2008)采用SRAP标记对莴苣属植物扩增得到的引物多态性条带平均为25.58条,表明TRAP标记对紫色叶用莴苣的遗传分析与SRAP具有可比拟的扩增效率和图谱。
本试验采用TRAP标记对47份紫色叶用莴苣材料的亲缘关系进行分类,将其划分为2大类群,第Ⅱ类群又划分为5个亚类。依据Lebeda等 (2007)的分类方法可以将紫色叶用莴苣分为脆叶结球莴苣、绵叶结球莴苣、直立莴苣、皱叶莴苣和拉丁莴苣。采用 EST-SSR(Simko,2009)、AFLP(Hill et al.,1996) 和 SAMPL(Witsenboer et al.,1997)等分子标记方法对莴苣属种质资源进行多样性分析,聚类结果与Lebeda等(2007)的划分结果一致。本试验也得到了相似的聚类结果:供试47份紫色叶用莴苣种质含有直立莴苣和皱叶莴苣2个类型,TRAP聚类结果基本上将2个类型区分开了,第1、2亚类主要为皱叶莴苣,第3、4、5亚类主要为直立莴苣。
紫色叶用莴苣的主要食用部位是叶片,叶片性状是其重要的形态特征。其中皱叶莴苣类型叶形、叶褶皱、叶尖、叶缘等叶片表型性状存在较大差异(陈青君 等,2011)。卜斌(2013)对皱叶莴苣23个形态指标的调查结果表明,叶尖、叶形、叶缘、叶褶皱等4个指标相似的品种亲缘关系较近。本试验在分子水平上验证了这一结果,33份皱叶莴苣种质中在这4个指标上相似的种质基本聚在一起,表明可以依据这4个叶片性状对皱叶莴苣进行 分类。
按照植物学分类紫色叶用莴苣可划分为3个变种:皱叶莴苣(L. sativavar.crispaL.)、结球莴苣(L. sativavar.capitataL.)、直立莴苣(L. sativavar.romanaGars)(蒋先明,1999)。油麦菜近年来栽培较为普遍,它的植物学分类一直有争议,林辰壹等(2005)通过比较油麦菜、莴苣、菊苣的形态特征和生长特性认为其是莴苣的一个变种;金波等(2002)则认为油麦菜是菊苣的一个变种。本试验中,TRAP聚类结果显示紫色油麦菜(42号、43 号、44号、45号、46号、47号)被划为第Ⅰ类群,与直立莴苣亲缘关系较近,与散叶莴苣亲缘关系较远。由于供试材料覆盖莴苣变种类型不全面,油麦菜及直立莴苣品种较少,不能确定油麦菜属于莴苣的哪个变种,需要进一步探讨。
本试验结果表明,供试紫色叶用莴苣种质间差异较小,遗传基础狭窄,种质间的遗传相似系数总体偏高,变异范围在 0.706 3~0.982 8 之间,Nei’s基因多样性指数平均为0.255 3,Shannon’s信息指数平均只有0.397 6。Kesseli等(1991)认为由于多系起源及复杂的驯化过程使莴苣具有丰富的形态和较高的遗传多样性;董洁等(2009)的研究表明紫色散叶莴苣主要数量性状变异范围大,蕴藏着很大的选择潜力。本试验结果与这两者有所不同,可能是因为供试紫色叶用莴苣种质类型单一,多为散叶类型,而叶用莴苣的变异主要发生在不同类型间,同一类型种质间亲缘关系较近,遗传多样性低。造成这种现象的原因一方面是紫色叶用莴苣是自花授粉植物,长期自交繁育使群体内基因逐渐纯和,遗传变异减少;另一方面可能是优良品种的循环利用,在商业化育种中优良种质资源或相关基因被反复循环利用是常见的,在相近的种质基因库范围内育种,导致遗传多样性的降低,反映在形态特征上为表型相近。棉花、六倍体大麦等作物由于优良种质的循环利用也表现出遗传多样性降低(Bowman et al.,1996;van Esbroeck et al.,1998;Mikel,2013)。
遗传多样性低这一结果也反映了我国紫色叶用莴苣的育种现状,目前在国内生产中占较大份额的是绿色结球莴苣,紫色叶用莴苣虽然逐渐受到重视,但育种基础薄弱。此外,中国不是叶用莴苣的起源中心,品种多为国外引进,后来选育的品种也多为进口品种的衍生后代,自主育成的紫色叶用莴苣品种很少。同时,由于频繁引种,紫色叶用莴苣存在同物异名或同名异物现象,如25号美国紫叶生菜与29号意大利紫叶生菜两个品种来自不同的种子公司,但遗传相似系数为0.982 8,很可能是同物异名。在今后的育种工作中应充分挖掘、利用含有特异等位基因的品种,选择遗传差异大、亲缘关系远的品种为杂交亲本,逐渐丰富、扩宽紫色叶用莴苣的遗传基础,提高育种效率。
卜斌.2013.叶用莴苣种质资源形态标记聚类分析〔硕士论文〕.北京:北京农学院.
陈青君,韩莹琰,谷建田,范双喜.2011.叶用莴苣种质资源的主要农艺性状鉴定与耐热性评价.中国蔬菜,(20):20-27.
董洁,范双喜,陈青君,韩莹琰,秦勇.2009.叶用莴苣遗传多样性的初步研究.北京农学院学报,24(4):7-11.
杜晓华,王得元,巩振辉.2004.目标区域扩增多态性(TRAP):一种新的植物基因型标记技术.分子植物育种,2(5):747-750.
范双喜,伊东正.2002.钙素对叶用莴苣营养吸收和生长发育的影响.园艺学报,29(2):149-152.
蒋先明.1999.蔬菜栽培学各论(北方本).北京:中国农业出版 社:129-130.
金波,程贤禄,杨铭华.2002.新型特菜图谱.北京:中国农业出版社.
李锡香,王海平.2006.莴苣种质资源描述规范和数据标准.北 京:中国农业科技出版社:4-30.
李悦.2010.中国莴苣属及其近缘属植物系统学关系的初步研究 〔硕士论文〕.郑州:郑州大学.
林辰壹,耿文娟,谢军,苟小军.2006.油麦菜与莴苣、菊苣的生物学特性比较.中国园艺学会第七届青年学术讨论会.泰安.
刘丽娟.2008.SRAP标记在DUS测试中的应用与高分辨率双向电泳体系的建立〔硕士论文〕.武汉:华中农业大学.
闻婧,杨其长,魏灵玲,程瑞锋,刘文科,鲍顺淑,周晚来.2011. 不同红蓝LED组合光源对叶用莴苣光合特性和品质的影响及节能评价.园艺学报,38(4):761-769.
中国农业科学院蔬菜花卉研究所.2010.中国蔬菜栽培学.北京:中国农业出版社:547.
Bowman D T,May O L,Calhoun D S.1996.Genetic base of upland cotton cultivars released between 1970 and 1990.Crop Sci,36:577-581.
Dilpreet S R,Sachin R,Ian C B,Kulvinder S G,Joseph P Y.2011.EST-SSR development from 5Lactucaspecies and their use in studying genetic diversity amongL. serriolabiotypes.Jounal of Heredity,102(1):17-28.
Hill M,Witsenboer H,Zabeau M,Vos P,Kesseli P,Michelmore I R.1996.PCR-based fingerprinting using AFLPs as a tool for studying genetic relationships inLactucaspp.Theoretical and Applied Genetics,93:1202-1210.
Hu J,Vick B A.2003.Target region amplification polymorphism:anovel marker technique for plant genotyping.Plant Molecular Biology Reporter,21:289-294.
Hu J,Ochoa O E,Truco M J,Vick B A.2005.Application of the TRAP technique to lettuce (Lactuca sativaL.)genotyping.Euphytica,144:225-235.
Kesseli R,Ochoa O,Michelmore R.1991.Variation at RFLP loci inLactucaspp. and origin of cultivated lettuce(L. sativa).Genome,34:430-436.
Kristkova E,Dolezalova I,Lebeda A,Vinter V,Novotna A.2008.Description of morphological characters of lettuce(Lactuca sativaL.)genetic resources.Hort Sci(Prague),35(3):113-129.
Lebeda A,Ryder E J,Grube R,Dolezalova I,Kristkova E.2007. Lettuce(Asteraceae;Lactucaspp.)//Singh R.Genetic resources,chromosome engineering,and crop improvement series.Vegetable Crops,3:377-472.
Li G,Quiros C F.2001.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging inBrassica.Theor Appl Genet,103:445-461.
Mikel M A.2013.Genetic composition of contemporary proprietary U. S. lettuce(Lactuca sativaL.)cultivars.Genet Resour Crop Evol,60:89-96.
Nei M,Li W H.1979.Mathematical model for studying genetic variation in terms of restriction endonucleases.Proceedings of the National Academy of Sciences,76:5269-5273.
Simko I.2009.Development of EST-SSR markers for the study of population structure in lettuce(Lactuca sativaL.).Journal of Heredity,100(2):256-262.
Truco M J,Antonise R,Lavelle D,Ochoa O,Kozik A,Witsenboer H,Fort S B,Jeuken M J W,Kesseli R V,Lindhout P,Michelmore R W,Peleman J.2007.A high-density,integrated genetic linkage map of lettuce(Lactucaspp.).Theor Appl Genet,115:735-746.
Uwimana B,d’Andrea L,Felber F,Hooftman D A P,den Nijs H C M,Smulders M J M,Visser R G F,van de Wiel C C M.2012.A Bayesian analysis of gene flow from crops to their wild relatives:cultivated(Lactuca sativaL.)and prickly lettuce(L. serriolaL.)and the recent expansion ofL. serriolain Europe.Molecular Ecology,21(11):2640-2654.
van de Wiel C,Arens P,Vosman B.1999.Microsatellite retrieval in lettuce(Lactuca sativaL.).Genome,42:139-149.
van Esbroeck G A,Bowman D T,Calhoun D S,May O L.1998.Changes in the genetic diversity of cotton in the USA from 1970 to 1995.Crop Sci,38:33-37.
Witsenboer H,Vogel J,Michelmore R W.1997.Identification,genetic localization,and allelic diversity of selectively amplified microsatellite polymorphic loci in lettuce and wild relatives(Lactucaspp.).Genome,40:923-936.
Analysis of Genetic Diversity and Relationship in Purple Lettuce by TRAP Technique
WANG Ya-nan,HAN Ying-yan,FAN Shuang-xi*,BU Bin
(DepartmentofPlantScienceandTechnology,BeijingAgriculturalCollege,Beijing102206,China)
TRAP technique was used to analyze the genetic diversity and relationship of 47 purple lettuce(Lactuca sativaL. ) species.20 pairs of TRAP primers amplified polymorphic bands were 430,and the polymorphic rate was 67.08%.The genetic similarity coefficient was 0.706 3-0.982 8.The average Nei’s gene diversity index and Shannon’s information index were 0.255 3 and 0.397 6,respectively,indicating that the low degree of genetic diversity in purple lettuce.The cluster analysis divided these 47 species into 2 major groups,and the Ⅱ group could be devided into 5 subgroups.The species with similar leaf morphology were clustered together,they had closer genetic relationship.
Purple lettuce;TRAP marker;Genetic diversity
王亚楠,女,硕士研究生,专业方向:叶用莴苣种质资源与分子标记应用,E-mail:wynxueshu369@163.com
*通讯作者(Corresponding author):范双喜,男,教授,博士生导师,专业方向:蔬菜生理与分子机理,E-mail:fsx20@163.com
2014-02-25;接受日期:2014-04-21
国家自然科学基金项目(31372057),现代农业产业技术体系北京市叶类蔬菜创新团队建设专项(blvt-02),北京市科技新星计划项目(2010B020)

